 ,1,2, 苗利娟1,2, 黄冰艳1,2, 高伟3, 张忠信1,2, 齐飞艳1,2, 刘娟3, 董文召1,2, 张新友
,1,2, 苗利娟1,2, 黄冰艳1,2, 高伟3, 张忠信1,2, 齐飞艳1,2, 刘娟3, 董文召1,2, 张新友 ,1,2,*
,1,2,*Characterization of the promoter and 5'-UTR intron in AhFAD2-1 genes from peanut and their responses to cold stress
SHI Lei ,1,2, MIAO Li-Juan1,2, HUANG Bing-Yan1,2, GAO Wei3, ZHANG Zong-Xin1,2, QI Fei-Yan1,2, LIU Juan3, DONG Wen-Zhao1,2, ZHANG Xin-You
,1,2, MIAO Li-Juan1,2, HUANG Bing-Yan1,2, GAO Wei3, ZHANG Zong-Xin1,2, QI Fei-Yan1,2, LIU Juan3, DONG Wen-Zhao1,2, ZHANG Xin-You ,1,2,*
,1,2,*通讯作者: * 张新友, E-mail:haasz@126.com
收稿日期:2020-11-17接受日期:2021-03-19网络出版日期:2021-03-31
| 基金资助: |
Corresponding authors: * E-mail:haasz@126.com
Received:2020-11-17Accepted:2021-03-19Published online:2021-03-31
| Fund supported: |
作者简介 About authors
E-mail:leis100@163.com

摘要
Δ12-脂肪酸脱氢酶基因(FAD2)催化油酸生成亚油酸, 是决定油酸亚油酸比值的关键基因。高油酸花生对低温更加敏感, 暗示FAD2在低温响应中发挥作用。为探索花生FAD2的低温胁迫应答, 本研究分析了花生FAD2-1A/B的基因结构, 从普通油酸花生品种豫花9326中克隆了FAD2-1A/B启动子和内含子, 并通过转化拟南芥验证了功能及其对冷胁迫的应答。结果表明, AhFAD2-1A/B包含2个外显子和1个位于5'-UTR的内含子; AhFAD2-1A/B基因启动子功能较弱, 仅AhFAD2-1B启动子在子叶期幼苗的子叶叶尖中观察到蓝色; AhFAD2-1假基因5'侧翼序列具有启动子活性, 可调控基因在子叶、下胚轴、种子中表达。AhFAD2-1内含子序列具有启动子的功能, 驱动基因在幼苗下胚轴及子叶中表达, 同时还有提高基因表达效率和扩大表达范围的功能, 是AhFAD2-1基因表达调控必需元件; 包含5'-UTR内含子的AhFAD2-1A/B启动子的调控序列功能受低温胁迫抑制。
关键词:
Abstract
Delta-12 fatty acid desaturase 2 (FAD2) catalyzes the conversion of oleic acid to linoleic acid and is the determination of the level of oleic to linoleic acid ratio (O/L) in peanut oil. Peanuts with high oleic acid content are more susceptible to cold stress than those with normal oleic acid content, suggesting that FAD2 plays important roles in response to cold stress. To explore the role ofFAD2s during the process of cold stress acclimation in peanut, the genomic structures of AhFAD2-1A/Bwere determined; the function of promoters, intron of AhFAD2-1A/Band their response to cold stress were characterized by using β-glucuronidase (GUS) gene reporter system in transgenic Arabidopsis. The results were as follows: AhFAD2-1A/B genes consisted of two exons and one intron within their 5'-UTR; promoter ofAhFAD2-1A was too weak to be detected and the promoter of AhFAD2-1B poorly activated the expression level of GUS in cotyledon tip of seedlings; the promoter of AhFAD2-1pseudogene activated GUS expression limited to cotyledon, hypocotyl, and seed. The intron of AhFAD2-1B demonstrated promoter-like activity which was restricted in cotyledon and hypocotyl, and not only enhanced the gene expression efficiency but also expanded gene expression range. Intron-mediated enhancement was an essential aspect of AhFAD2-1expression. Activities of 5'-flanking region of AhFAD2-1A/B were repressed by the cold stress.
Keywords:
PDF (3674KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
石磊, 苗利娟, 黄冰艳, 高伟, 张忠信, 齐飞艳, 刘娟, 董文召, 张新友. 花生AhFAD2-1基因启动子及5'-UTR内含子功能验证及其低温胁迫应答. 作物学报[J], 2021, 47(9): 1703-1711 DOI:10.3724/SP.J.1006.2021.04247
SHI Lei, MIAO Li-Juan, HUANG Bing-Yan, GAO Wei, ZHANG Zong-Xin, QI Fei-Yan, LIU Juan, DONG Wen-Zhao, ZHANG Xin-You.
花生(Arachis hypogaea L.)广泛种植于热带、亚热带和温带地区, 其种子脂肪含量在50%左右, 是重要的油料作物之一。我国花生年种植面积约460万公顷, 产量约1700万吨(http://zzys.agri.gov.cn/ nongqing.aspx), 占世界总产量的40%左右, 是世界上最大的花生生产国。我国也是世界上最主要的花生消费国, 总产量的一半用来榨油, 花生油营养丰富, 气味醇香, 深受消费者喜爱。花生油中不饱和脂肪酸油酸(C18:1)和亚油酸(C18:2)含量约占脂肪酸总量的80%, 高油酸花生中油酸含量大于75%, 普通花生中油酸含量在35%~60%之间[1]。油酸比亚油酸更有益于健康, 并且有更好的风味[2,3]和更稳定的化学性质, 按照不同检测方法计算, 油酸的氧化稳定性比亚油酸高3.4~14.5倍[3], 导致高油酸花生及其制品不易酸败, 有更长的货架期。因此油酸含量很大程度上决定了花生油及其他花生制品的品质, 是评价花生品质的重要指标, 受到了育种家的高度关注, 培育和推广高油酸花生品种成为当前热点。
Δ12-脂肪酸脱氢酶基因(delta-12 fatty acid desaturase 2, FAD2)通过催化油酸脱C12上的2个氢而引入双键生成亚油酸[4], 是决定油酸含量的关键基因。FAD2的自然突变或化学诱变[5,6,7,8,9]以及通过基因工程方法沉默该基因[10,11,12,13]都可以产生高油酸性状。研究表明, 通过提高细胞膜的流动性, 多不饱和脂肪酸(polyunsaturated fatty acid, PUFAs)在动植物适应冷胁迫过程中发挥重要作用[14], PUFAs中的亚油酸含量在拟南芥[15]、大豆[16]中会随着温度的降低显著升高。FAD2基因直接参与细胞膜冷胁迫适应过程[17], 橄榄中FAD2参与低温响应[18,19], 棉花、花生、生菜FAD2冷胁迫后表达量显著升高[17,20-22], 拟南芥fad2突变体低温条件下不发芽[23]。FAD2还参与其他非生物胁迫, 如拟南芥fad2突变体耐盐能力显著下降[24], 部分FAD2受光调控[17], 植物特有防卫相关化合物聚乙炔(polyacetylene)在生物合成前期受FAD2催化[25]。与普通花生相比, 高油酸花生在种子发芽期对低温敏感, 出苗率低[26]。研究花生FAD2调控区功能及其对低温胁迫的响应, 对解析高油酸花生的耐低温性具有重要的意义。
本研究从普通油酸花生品种豫花9326中克隆了FAD2的调控序列, 并对序列及其顺式作用元件进行了分析, 通过转化拟南芥验证了功能及其对冷胁迫的应答, 旨在为解析和提高高油酸花生的耐寒性提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 花生(Arachis hypogaea L.)品种豫花9326由本实验室选育, 为普通油酸花生, 种植于河南省农业科学院试验基地。Columbia生态型拟南芥, 由本实验室保存, 种植于22℃ 16 h光照/ 20℃ 8 h黑暗的植物生长培养箱。1.1.2 菌株及质粒 农杆菌菌株GV3101、植物表达载体pBI121由本实验室保存。大肠杆菌JM109感受态、pMD18-T克隆载体购自宝日医生物技术(北京)有限公司。
1.1.3 试剂 植物DNA提取试剂盒、质粒提取试剂盒、DNA纯化试剂盒、琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司; 限制性内切酶、连接酶、PrimeSTAR GXL DNA聚合酶、Prime-Script RT Reagent Kit等购自宝日医生物技术(北京)有限公司; PCR引物合成及DNA测序由北京六合华大基因科技有限公司完成; 其他试剂均为进口或国产分析纯。
1.2 AhFAD2-1 5'端侧翼序列、内含子的克隆
利用花生AhFAD2-1基因(EF192432.1)序列, 在花生基因组信息网(https://www.peanutbase.org/home)中进行BLAST比对, 获得花生AhFAD2-1基因5°端侧翼序列及内含子序列, 根据核苷酸序列设计引物(表1), 以花生叶片gDNA为模板进行PCR扩增, 扩增体系10 μL, 包括模板0.2 μL、5× PrimeSTAR GXL缓冲液2 μL、2.5 mmol L -1 dNTPs混合物0.8 μL、10 μmol L -1上游及下游引物各0.5 μL、PrimeSTAR GXL DNA 聚合酶 (1.25 U μL -1) 0.2 μL, ddH 2O补齐至10 μL。反应条件为98℃变性10 s, 55℃退火15 s, 68℃延伸5 min, 35个循环; 68℃延伸10 min。1%琼脂糖电泳检测PCR扩增产物, 切胶回收, 克隆至pMD18-T载体并测序。Table 1
表1
表1本研究所用引物及其序列
Table 1
| 目的片段 Target fragment | 上游引物 Forward primer (5°-3°) | 下游引物 Reverse primer (5°-3°) |
|---|---|---|
| PAhFAD2-1A+intron | ACGCGTCGA (Sal I) CTTCCGCCAGAATGAGGAACTAAA TCACAG | GACATCTAGA (Xba I) GTTGTGTTGTTAAAGCT CCTGTTACCAATG |
| PAhFAD2-1B+intron | CGGGGTACC (Kpn I) ATGTTTCATAGAATTTAAGCTCAGA CACG | |
| PAhFAD2-1B(pseudo) | ACGCGTCGA (Sal I) CACCAAGTAGCTTCTCAATGGCTCA GATTCG | |
| AhFAD2-1B-intron | ACGCGTCGA (Sal I) CATAGGAGAAGCACTCACTTCTCTT CTCTC | |
| AhFAD2-1B-intron681 | ACGCGTCGA (Sal I) CATAATGGCTTCTGGGCCCTCAC | |
| AhFAD2-1B-intron363 | ACGCGTCGA (Sal I) CATAATGGCTTCTGGGCCCTCAC | GACATCTAGA (Xba I) TATCATGCCAAGTGACT AGTATGA |
| PAhFAD2-1A | ACGCGTCGA (Sal I) CTTCCGCCAGAATGAGGAACTAAA TCACAG | GACATCTAGA (Xba I) GATGAATCTCGCAGCCA CGTTT |
| PAhFAD2-1B | CGGGGTACC (Kpn I) ATGTTTCATAGAATTTAAGCTCAGA CACG |
新窗口打开|下载CSV
1.3 AhFAD2-1启动子序列分析
利用植物启动子在线分析网站PLACE (1.4 AhFAD2-1启动子及内含子缺失表达载体构建
根据引入的酶切位点, 分别选择对应的Sal I和Xba I或Kpn I和Xba I对PCR扩增产物进行双酶切, 用T4 DNA连接酶分别连接到经对应双酶切后的pBI121质粒上, 替换其CaMV35S元件, 构建重组植物表达载体pBI-PAhFAD2-1A+intron、pBI- PAhFAD2-1B+intron、pBI-PAhFAD2-1B(pseudo)、pBI-PAhFAD2-1A、pBI-PAhFAD2-1B、pBI-AhFAD2-1B intron、pBI-AhFAD2- 1B intron681、pBI-AhFAD2-1B intron363。转化大肠杆菌感受态, 利用PCR扩增、双酶切及测序(5°-GGAA TTGTGAGCGGATAAC-3°; 5°-GCCCGGCTTTCTTG TAAC-3°)鉴定阳性克隆。提取质粒, 冻融法转化上述7个载体及pBI121至农杆菌中, 鉴定阳性克隆, 保存于-80℃备用。1.5 拟南芥转化及GUS组织化学染色
花序浸染法转化拟南芥。收集成熟种子, 在含50 mg L-1卡那霉素MS固体培养基上筛选抗性植株。CTAB法提取绿色健壮抗性苗DNA, 用转化载体中对应的特异引物PCR扩增鉴定阳性植株, 反应条件为: 94℃ 5 min; 95℃ 45 s, 55℃ 45 s, 72℃ 3 min, 35个循环; 72℃ 10 min。对T2代种子进行Kan抗性追踪, 后代中绿苗和黄化苗比例接近3∶1的为单拷贝株系。取单拷贝株系的幼苗、根、茎、叶、花、角果、种子等组织置于GUS染色液(X-gluc 0.5 g L-1, 50 mmol L-1 pH 7.0磷酸缓冲液, 10 mmol L-1 EDTA, 0.5 mmol L-1铁氰化钾, 0.5 mmol L-1亚铁氰化钾, 0.01% Triton X-100, 20%甲醇)中, 抽真空10 min, 37℃温浴过夜。用乙醇乙酸混合液(体积比为1∶1)将染色组织脱至无色, 分别用75%、50%、25%的乙醇洗涤3次, 显微镜下观察, 并采集图像。每个转化载体随机至少选取4个单拷贝独立转化株系进行GUS染色分析, 保证其中3个株系染色结果一致。
1.6 胁迫试验
转基因拟南芥种子播种于含50 mg L-1卡那霉素MS固体培养基上, 待出现第1片真叶后, 分别放置于10℃ 16 h光照/ 8℃ 8 h黑暗、15℃ 16 h光照/ 13℃ 8 h黑暗、22℃ 16 h光照/ 20℃ 8 h黑暗、30℃ 16 h光照/ 28℃ 8 h黑暗的植物生长培养箱中进行温度胁迫试验, 于1、2、4 d分别取样染色。2 结果与分析
2.1 AhFAD2-1基因分析及启动子、内含子的克隆
通过BLAST比对, 获得了3个AhFAD2-1同源序列, 1个位于Arahy 9 (A09)染色体114194542~ 114195863 (Identity=98.49%)之间, 命名为AhFAD2-1A; 另2个分别位于Arahy 19 (B09)染色体154049703~ 154048379 (Identity=100%)和152798019~152796774 (Identity=97.04%) (pseudogene)之间, 后者序列中的开放阅读框(open reading frame, ORF)对应区第451位碱基由G突变为T (G451T), 形成终止密码子TAA, 同时在673位碱基后存在1个GACTCAG的7 bp序列插入(图1), 导致该基因只能编码150 aa, 不能翻译成完整379 aa的FAD2-1编码蛋白, 因此为假基因, 这2个基因位点分别命名为AhFAD2-1B和AhFAD2-1B(pseudo)。通过cDNA与DNA的序列比对, AhFAD2-1包含2个外显子和1个内含子, 其中1个外显子包含了整个ORF区, 另1个外显子和内含子位于起始密码子ATG上游的非翻译区(图1)。图1
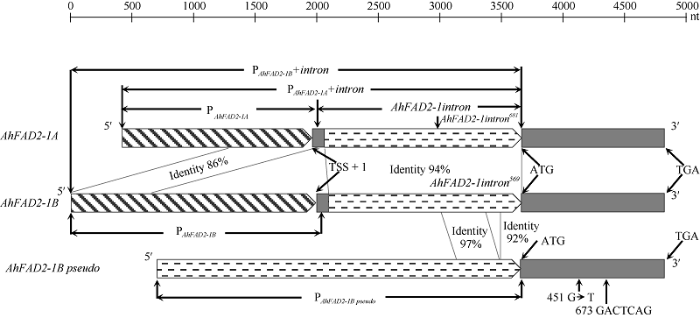 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1FAD2-1A/B/pseudo基因结构及启动子比较
TSS: 转录起始位点。
Fig. 1Comparison of FAD2-1A/B/pseudo promoters and genomic structures in peanut
TSS: the transcription start site.
以豫花9326基因组DNA为模板, 克隆了AhFAD2-1A、AhFAD2-1B转录起始位点5°上游1575 bp和2027 bp启动子序列, 分别命名为PAhFAD2-1A和PAhFAD2-1B (图1); 克隆了AhFAD2-1A、AhFAD2-1B和AhFAD2-1B(pseudo)起始密码子ATG 5°上游包含启动子和内含子的3247、3684和2967 bp序列, 分别命名为PAhFAD2-1A+intron、PAhFAD2-1B+intron和PAhFAD2-1B(pseudo) (图1); 克隆了AhFAD2-1B的1567 bp内含子序列, 命名为AhFAD2-1B-intron; 克隆了内含子缺失片段, 命名为AhFAD2-1-intron681、AhFAD2- 1B-intron363。将上述目的片段连接到pBI121载体中, 对重组质粒进行测序鉴定, 获得了阳性重组质粒。
2.2 AhFAD2-1启动子生物信息学分析
应用在线分析网站PLACE和plantCARE对花生PAhFAD2-1A、PAhFAD2-1B及内含子序列进行生物信息学分析。PAhFAD2-1A起始转录位点上游-24 bp (TAT AAA)或-45 bp (TATA)存在可能的真核生物RNA聚合酶II结合位点TATA-box, 在-90 (CAAT)、-97 (CAAT)或-115 bp (CCAAT)存在可能的增强转录作用的CAAT-box; PAhFAD2-1B的TATA-box可能位于-25 bp (ATTATATAA), CAAT-box可能位于-61 bp (CAAT)或-113 bp (CAAAT)。AhFAD2-1A和AhFAD2-1B起始密码子ATG 5°上游序列具有同源性, 其中内含子序列同源性为94%, PAhFAD2-1A序列的-33~ -679 bp与PAhFAD2-1B序列的-1345~ -1982 bp同源性为86% (图1)。PAhFAD2-1A特异性序列中发现有多种种子表达相关元件, 如DPBFCOREDCDC3 (ACACNNG)、PYRIMIDINEB OXOSRAMY1A (CCTTTT)、SEF4MOTIFGM7S (RTTTTTR)、ACGTABOX (TACGTA)等。PAhFAD2-1B特异性序列中发现有叶肉细胞或叶片表达相关作用元件, 如MYBCORE (CNGTTR)、CACTFTPPCA1 (YACT)、RAV1AAT (CAACA)、MYBCORE (leaf)、DOFCOREZM (AAAG)、GATABOX (GATA)等。两者同源序列中发现了多种种子表达相关顺式作用元件, 如RY-element (CATGCATG)、SEF1MOTIF (ATATTTAWW)、DPBFCOREDCDC3 (ACACNNG)、SEF4MOTIFGM7S (RTTTTTR)、SEF3MOTIFGM (AACCCA)和EBOXBNNAPA (CANNTG)等; 根表达相关作用元件, 如ROOTMOTIFTAPOX1 (ATATT)、OSE2ROOTNODULE (CTCTT)、AUXREPSIAA4 (KGTCCCAT)、RAV1AAT (CAACA)。除此之外还有多种生物胁迫和非生物胁迫响应顺式作用元件: 低温响应作用元件或热激元件LTR (CCGAAA)、CCAATBOX1 (Heat shock element) (CCAAT)、MYCCONSENSUSAT (CANNTG); 盐诱导响应作用元件GT1CONSENSUS (GAAAAA); 光响应作用元件G-Box (CACGTT、TAAACGTG、TACGTG)、Box 4 (ATTAAT)、GT1-motif (GGTTAA); 茉莉酸甲酯响应元件CGTCA-motif (CGTCA)和TGACG-motif (TGACG); 脱落酸响应元件ABRE (ACGTG); 赤霉素响应元件GARE-motif (TCTGTTG)和TC-rich repeats (GTTTTCTTAC)等。
2.3 AhFAD2-1启动子、内含子及假基因5'侧翼序列功能分析
GUS染色结果如图2所示, PAhFAD2-1A经过染色后未发现任何组织具有显示GUS活性的蓝色; PAhFAD2-1B仅在子叶期幼苗的子叶叶尖处观察到蓝色, 随着苗龄增加蓝色消失, 其他组织未发现蓝色。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2AhFAD2A/B/pseudo启动子和内含子转基因拟南芥的GUS组织化学染色
Fig. 2Histochemical analyses of AhFAD2A/B/pseudo promoters and introns in transgenic Arabidopsis plants
AhFAD2-1B-intron序列具有启动子活性, 可以驱动GUS基因的表达, 在幼苗期的下胚轴及子叶中观察到蓝色, 当内含子缺失掉大部分序列, 仅保留与假基因同源的片段时(AhFAD2-1B-intron363和AhFAD2-1B-intron681), 没有观察到染色后呈蓝色的组织, 说明该同源序列不能发挥启动子的功能; PAhFAD2-1A+intron在苗期的子叶和下胚轴中显示蓝色, 进入生殖生长期后, 拟南芥种子中的胚被染成蓝色; PAhFAD2-1B+intron子叶期幼苗子叶、下胚轴和根尖显示蓝色, 随着苗龄增加, 莲座叶及茎生叶染为蓝色, 下胚轴蓝色消失, 进入生殖生长期后, 花萼、柱头、角果皮、种皮及胚都显示蓝色。综合以上结果, PAhFAD2-1A/B序列融合了AhFAD2-1内含子后, 其启动效率及表达范围都有明显变化, 内含子增强了启动子的启动效率并扩大了启动范围。
PAhFAD2-1B(pseudo)也具有启动子活性, 在幼苗子叶和下胚轴处观察到了蓝色, 进入生殖生长期后, 拟南芥种子中的胚被染成蓝色。
2.4 低温胁迫对PAhFAD2-1A+intron和PAhFAD2-1B+ intron的影响
高油酸花生种子在发芽期对低温较为敏感, 为探讨AhFAD2-1基因是否参与花生对低温胁迫的响应, 观察了转PAhFAD2-1A+intron和PAhFAD2-1B+intron拟南芥幼苗在不同温度处理下的染色情况。30℃环境中, PAhFAD2-1A+intron驱动GUS在拟南芥根尖中表达, 而正常生长的22℃环境中在根尖中不表达, 其他组织中的表达模式没有变化, 随着温度的降低和时间的延长, 10℃环境中第4天没有观察到蓝色(图3-A), 对照CaMV35S启动子在相同条件下染色模式没有变化(图3-B); PAhFAD2-1B+intron在30℃环境中, 第1天莲座叶和根中没有观察到蓝色, 子叶的蓝色变淡, 第2天和第4天GUS染色模式恢复正常, 与22℃环境中拟南芥的GUS表达模式一致, 随着温度的降低和时间的延长, 在10℃环境中第4天根中的蓝色消失, 叶子的蓝色变淡(图4)。说明PAhFAD2-1A+intron和PAhFAD2-1B+intron驱动GUS基因表达的能力受到了低温抑制。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3转PAhFAD2-1A+intron拟南芥低温胁迫条件下的GUS组织化学染色
A: 转PAhFAD2-1A+intron拟南芥; B: 转CaMV35S拟南芥。1-day: 处理1 d; 2-day: 处理2 d; 4-day: 处理4 d。
Fig. 3GUS histochemical staining of transgenic Arabidopsis with PAhFAD2-1A+intron under cold stress
A: PAhFAD2-1A+intron transgenic Arabidopsis plants; B: CaMV35S transgenic Arabidopsis plants. 1-day: one day after treating; 2-day: two days after treating; 4-day: four days after treating.
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4转PAhFAD2-1B+intron拟南芥低温胁迫条件下的GUS组织化学染色
1-day: 处理1 d; 2-day: 处理2 d; 4-day: 处理4 d。
Fig. 4GUS histochemical staining of transgenic Arabidopsis with PAhFAD2-1B +intron under cold stress
1-day: one day after treating; 2-day: two days after treating; 4-day: four days after treating.
3 讨论
3.1 花生FAD2-1基因调控序列活性受低温抑制
在发芽出苗期, 珍珠豆或多粒型花生品种温度低于12℃, 普通型和龙生型花生品种温度低于15℃时不能正常萌动发芽[27]。我国北方春播花生在种子萌发期会遭遇“倒春寒”等低温伤害, 造成种子腐烂、发芽率降低, 这限制了花生在我国北方高纬度地区的推广。尽管花生中含有多对FAD2基因[21], 遗传分析表明花生高油酸性状仅由1对AhFAD2-1A/B控制, 当AhFAD2-1A基因在448 bp处发生G-A突变, 导致AhFAD2-1A脱氢酶功能降低, 同时AhFAD2-1B在441 bp后插入A导致AhFAD2-1B提前终止或在656和998 bp处插入微型反向重复转座元件(miniature inverted-repeat transposable element, MITE)导致AhFAD2-1B翻译不完全, 就引起花生的高油酸[5,6]。本研究分别克隆了AhFAD2-1A/B的调控区域并验证了功能以及其对低温的胁迫应答。环境胁迫过程中植物受到伤害的主要部位是流动双层细胞膜, 较高含量的PUFAs有助于细胞膜的流动, 有助于植物在受到低温胁迫后维持正常功能及低温伤害后的功能恢复[28]。FAD2基因决定了PUFAs中亚油酸的含量, 在多种植物中受低温诱导表达[17,18,19,20,21,22], 同时拟南芥fad2突变体的耐冷性较野生型明显降低[23], 说明亚油酸在植物对抗低温胁迫过程中具有重要作用。目前, 高油酸花生品种选育是花生育种的重要方向, 我国各花生育种单位通过连续回交育种结合FAD2-1A/B基因标记辅助选择技术实现了对现有推广品种的高油酸化改良[1,29-30], 高油酸花生后代与轮回亲本的细胞质遗传物质完全一致, 细胞核遗传物质有96%以上的相似度, 两者主要在油酸和亚油酸含量方面存在差异, 高油酸花生中AhFAD2-1A/B双突变导致亚油酸含量大幅降低, 推测这是生产上部分高油酸花生不耐低温的原因。本研究发现在低温胁迫下AhFAD2-1A/B基因调控序列的启动活性明显受到抑制, 导致下游基因表达受限, 与薛晓梦等[21]分析的高油酸花生品种ZH413中AhFAD2-1A/B在低温胁迫下的表达模式一致, 这可能是花生对冷胁迫敏感的原因之一, 高油酸花生中亚油酸含量较普通花生亚油酸含量更低, 导致高油酸花生对冷胁迫更为敏感。花生中含有多个FAD2基因, 表达模式各不相同[21,31], 部分FAD2与AhFAD2-1A/B表达部位重叠, 这可能在一定程度上补偿了AhFAD2-1A/B功能的缺失, 降低了高油酸花生对冷胁迫的敏感性, 薛晓梦等[21]的研究结果也认为FAD2-1基因表达量降低不是低温敏感的直接原因。因此, 不同遗传背景的高油酸品种耐寒性是否与普通花生存在差异, 还需要进一步探讨, 同时在选育耐寒高油酸花生品种时, 应选用耐寒轮回亲本作为改良对象, 保证后代对高纬度、寒冷地区的适应性。
3.2 FAD2-1内含子正调控启动子活性
不同物种的FAD2基因结构保守, 都有2个外显子和1个位于5'-UTR的内含子[11,32-33]。内含子长度变化较大, 大豆为406 bp, 油菜为1077 bp, 拟南芥为1113 bp, 水稻为3148 bp, 且序列间没有相似性。本研究中的AhFAD2-1A/B基因结构与其他物种相同, 内含子长度分别为1603 bp和1567 bp, 序列与其他物种不具相似性。研究发现, FAD2内含子有类似启动子的功能且对基因的表达有正调控作用。拟南芥FAD2内含子具备组成型表达活性, 与该基因5'端上游包含启动子的2411 bp序列功能相似[24], 且受植物激素的调控[34]; 芝麻FAD2内含子不仅具备类似启动子的功能, 其介导的调控机制还参与FAD2的种子特异性表达及其他FAD2的表达,可使转基因拟南芥中启动子的表达效率提高100倍[35]; 油菜BnFAD2A5-1、BnFAD2C5内含子序列中包含TATA-box和CAAT-box, 具备启动子活性, 同时增强上游启动子活性[36,37]。本研究中获得的AhFAD2-1内含子和启动子活性较弱, 内含子对启动子具有正调控作用, 增强了启动子活性, 使AhFAD2-1A/B在叶片或子叶和种子中得以表达, 这与薛晓梦等[22]分析的花生AhFAD2-1A/B表达模式一致, 相比荧光定量PCR方法分析表达模式, 通过分析启动子功能鉴定的表达模式在组织上可更加细化。3.3 AhFAD2-1B假基因可能具有可执行功能
假基因是指由于个别碱基的突变或序列插入导致不能翻译为有功能和全长蛋白的缺陷拷贝, 被认为是“基因组化石”, 主要有2种类型: 一类为“加工”型, 指mRNA转录本经反转录后重新整合到基因组中, 随后发生提前终止、移码突变或截断而导致失活形成的假基因; 另一类为“非加工型”, 指基因组序列经过复制后插入到基因组, 复制基因由于功能冗余而发生失活形成的假基因, 假基因广泛存在于生物体中[38,39]。尽管假基因是编码蛋白的无效拷贝, 部分假基因仍可通过产生的调控RNAs (regulatory RNAs)在基本加工过程中起作用[39]。本研究中获得的假基因AhFAD2-1B(pseudo)具有可执行功能的启动子, 其起始密码子5'上游序列含有FAD2-1B的同源序列, 推测该假基因为“非加工型”, 是在进化过程中发生了复制, 并在长期选择过程中发生随机突变后形成的。AhFAD2-1B在第665碱基上的MITE插入可导致AhFAD2-1B丧失油酸脱氢酶活性[6], 肖钢等[40] 通过转化酿酒酵母证明了甘蓝型油菜基因组中FAD2的6个假基因没有功能, 推测AhFAD2-1B (pseudo)编码的150 aa的蛋白序列不具备油酸脱氢酶功能, 但作为可转录的假基因, AhFAD2-1B(pseudo)是否在转录水平上具有调控功能还需要进一步的验证。4 结论
克隆了花生AhFAD2-1A/B基因及5°上游调控序列, 通过转基因证明了内含子具有启动子活性并可增强转录水平,AhFAD2-1A基因ATG 5'上游序列驱动下游基因在种子中优势表达, AhFAD2-1B基因ATG 5°上游序列驱动下游基因在子叶、根尖、莲座叶、茎生叶、柱头及胚等组织中表达, 同时AhFAD2-1A/B调控序列的表达能力受低温抑制。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 5]
[本文引用: 5]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
