 ,, 林云, 陈景斌, 薛晨晨, 袁星星, 闫强, 高营, 李灵慧, 张勤雪, 陈新
,, 林云, 陈景斌, 薛晨晨, 袁星星, 闫强, 高营, 李灵慧, 张勤雪, 陈新 ,*江苏省农业科学院经济作物研究所, 江苏南京 210014
,*江苏省农业科学院经济作物研究所, 江苏南京 210014Genetic and cytological analysis of male sterile mutant msm2015-1 in mungbean
WU Ran-Ran ,, LIN Yun, CHEN Jing-Bin, XUE Chen-Chen, YUAN Xing-Xing, YAN Qiang, GAO Ying, LI Ling-Hui, ZHANG Qin-Xue, CHEN Xin
,, LIN Yun, CHEN Jing-Bin, XUE Chen-Chen, YUAN Xing-Xing, YAN Qiang, GAO Ying, LI Ling-Hui, ZHANG Qin-Xue, CHEN Xin ,*Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China
,*Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China通讯作者:
收稿日期:2020-07-11接受日期:2020-10-14网络出版日期:2021-05-12
| 基金资助: |
Received:2020-07-11Accepted:2020-10-14Online:2021-05-12
| Fund supported: |
作者简介 About authors
E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (6873KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
吴然然, 林云, 陈景斌, 薛晨晨, 袁星星, 闫强, 高营, 李灵慧, 张勤雪, 陈新. 绿豆雄性不育突变体msm2015-1的遗传学与细胞学分析[J]. 作物学报, 2021, 47(5): 860-868. doi:10.3724/SP.J.1006.2021.04153
WU Ran-Ran, LIN Yun, CHEN Jing-Bin, XUE Chen-Chen, YUAN Xing-Xing, YAN Qiang, GAO Ying, LI Ling-Hui, ZHANG Qin-Xue, CHEN Xin.
绿豆[Vigna radiate (L.) Wilczek]属于豆科(Leguminosae)、蝶形花亚科(Papilionaceae)、豇豆属(Vigna), 是严格的闭花授粉双子叶作物。作为全球(尤其是亚洲)农业系统中的重要杂粮作物[1,2], 绿豆是优质膳食蛋白质、维生素、矿物质和碳水化合物的来源[3,4]。近些年随着我国种植结构调整和农业供给侧结构改革的进行, 绿豆的需求量持续攀升, 但其产量一直相对较低[5]。杂交是提高作物产量的有效手段, 且杂交种具有适应性强、均匀性好、非生物和生物耐受性高等优良性状, 为农业增产做出了巨大贡献[6,7,8]。玉米是世界上首个利用杂种优势实现商业化杂交种的作物[9,10], 随后在水稻[6]、小麦[11]、大麦[12]、油菜[13]、棉花[14]等多个作物中逐渐建立了杂交育种体系。研究显示, 绿豆杂种优势突出, 利用绿豆品种‘KPS1’与‘Korea 7’等不同组合配制的杂交种在产量上最高可得到40%以上的超亲优势[15]。但由于绿豆是严格的闭花授粉作物, 严重阻碍了其杂种优势利用。
在雌雄同花作物中, 雄性不育材料是杂种利用中的宝贵资源。广义上讲, 雄性不育是指植物不能产生开裂的花药、有功能的花粉或有活力的雄配子[16], 可分为3种类型: (1) 细胞质不育(cytoplasmic male sterility, CMS), 由核基因偶联的线粒体基因引起, 又叫核质互作不育[17], 可应用于“三系法”杂交体系, 但需要可靠的恢复系[18]。(2) 细胞核不育(genetic male sterility, GMS), 仅由核基因引起[19], 先前由于较难获得大规模雄性不育母本而在杂交制种中难以应用, 但随着生物技术的发展以及不断的科学探索, 科学家已在玉米等异花传粉作物中开发出基于隐性核雄性不育的高效制种系统[20,21]; (3) 环境敏感型核不育(environment-sensitive genic male sterility, EGMS), 指育性受到光周期、温度等环境因素影响[7], 可应用于“两系法”杂交体系。在拟南芥、水稻、玉米等植物中雄性不育材料的研究报道很多且类型多样, 花粉的细胞学分析及其败育的分子机理也研究得较为透彻[21,22,23,24]。
然而, 目前绿豆的雄性不育研究尚属空白。本研究通过对‘苏绿1号’进行60Co-γ诱变获得绿豆稳定遗传雄性不育突变体, 分析了其表型, 对育性分离群体进行了遗传分析, 以及对其花粉发育进行了细胞学分析, 解析了花粉败育发生的时期和可能的原因, 以期为深入研究绿豆雄性不育机理及杂种优势利用奠定基础。
1 材料与方法
1.1 试验时间与地点
田间试验于2014—2019年在江苏省农业科学院试验基地进行, 室内试验在江苏省农业科学院经济作物研究所内实验平台完成。1.2 ‘苏绿1号’辐射诱变
2014年初对3 kg ‘苏绿1号’ (约5万粒)进行60Co-γ辐射诱变, 使用剂量200 Gray。诱变后的绿豆种子播种, M1代混收。从M2代诱变群体中选择1000个单株种成株行。从其后代(M3)中筛选育性相关突变体。1.3 绿豆雄性不育突变体的表型分析
‘苏绿1号’和msm2015-1突变体于谷雨时节盆栽种植于江苏南京市江苏省农业科学院院内, 分析观察了连续2年的表型, 包括营养生长期的株型和株高、花期的花蕾和盛开花朵的结构, 以及成熟期结荚情况, 2年表现型一致。成熟花粉的花药和柱头表型于体视镜下观察。扫描电镜方法参考文献[25], 花组织用2.5%戊二醛固定液固定, 观察前用0.1 mol L-1磷酸缓冲液冲洗3遍, 之后使用梯度酒精溶液脱水, 酒精-异戊基醋酸(v:v = 1:3)溶液中处理1 h, CO2临界点干燥, 真空镀膜, 使用江苏省农业科学院中心实验室平台蔡司扫描电子显微镜(EVO-LS10)进行观察。1.4 绿豆雄性不育突变体群体的遗传学分析
单株收获与不育株同一个株系的可育植株, 按株系种植M4代。去除表型不分离的株系(全部可育)后, 将可分离的株系组成遗传群体进行遗传学分析。统计了分离群体中可育株系和不育株系的数目, 利用卡方进行符合性检测。1.5 绿豆雄性不育突变体的细胞学观察
绿豆盛花期, 于上午8:00左右, 收集‘苏绿1号’和msm2015-1突变体不同发育时期的花苞及盛开的花朵, 置于卡诺固定液(无水乙醇:冰醋酸 = 3:1)或者FAA固定液(50%乙醇:冰醋酸︰甲醛 = 89:6:5)中固定备用。1.5.1 成熟花粉粒生活力检测 此部分试验方法主要参考文献[25,26]。(1) 花粉柱头萌发: 盛开的绿豆花朵置于卡诺固定液中固定24 h后, 雌蕊经酒精系列复水, 再用蒸馏水漂洗3次。置于2 mol L-1 NaOH中软化柱头12 h, 蒸馏水漂洗3次, 最后用0.05%苯胺蓝避光染色12 h, 置于荧光倒置显微镜(蔡司Axio Vert A1)下观察并照相, ‘苏绿1号’和msm2015-1各观察3个柱头。(2) 花粉体外萌发: 采用液体培养法, 即在载玻片上滴入适量花粉液体培养基, 在绿豆花朵刚开放时用镊子剖出花粉置于培养基中, 盖上盖玻片, 放入湿润的培养皿中, 30℃培养箱中遮光培养2 h, 光学显微镜下观察, 分别取3个‘苏绿1号’和msm2015-1的花粉样本进行试验, 各观察3个不同的视野。(3) Alexander和I2-KI染色: 固定好的成熟花粉用镊子剖出置于载玻片上, 滴1~2滴Alexander染液或者1% I2-KI染液, 盖玻片封片, 光学显微镜下观察。分别取3个‘苏绿1号’和msm2015-1的花粉样本进行观察, 每个样本观察3个不同的视野, 统计不少于200粒花粉, 通过染色率来计算花粉的败育率。
1.5.2 成熟花粉粒核质发育检测 固定好的成熟花粉用镊子剖出置于载玻片上, 在花粉粒上方滴上一滴(10~20 μL) DAPI染液, 盖玻片封片, 在黑暗中反应15 min[26], 置于荧光倒置显微镜(蔡司Axio Vert A1)下观察并照相。分别取3个‘苏绿1号’和msm2015-1的花粉样本进行染色, 每个样本观察3个不同的视野。
1.5.3 花粉母细胞早期发育分析 将不同发育时期的花苞从卡诺固定液中取出, 用杂交镊剥离出花粉置于载玻片上, 滴入适量醋酸洋红染液, 染色2~5 min, 盖玻片封片, 光学显微镜观察花粉的形态特征, 区分不同的发育时期, 拍照并分析[25]。‘苏绿1号’和msm2015-1分别观察3组花苞样本。
2 结果与分析
2.1 绿豆雄性不育突变体的获得及表型分析
2015年7月在辐射诱变群体中发现一个绿豆株系出现育性分离, 该株系共有38株, 其中9株表现为不育, 命名为‘不育绿豆2015-1’(male sterile mungbean2015-1, 简写为msm2015-1)。表型分析发现, 营养生长期msm2015-1的株高和株型与‘苏绿1号’没有明显差异(图1-A)。盛花期, msm2015-1花器官外观形态发育正常, 花蕾、盛开的花朵及其旗瓣、翼瓣、龙骨瓣形态均正常(图1-B~D)。成熟期‘苏绿1号’叶片发黄脱落且有大量结实荚, 而msm2015-1生长势依旧旺盛, 叶片肥厚呈绿色不脱落, 不能正常结荚, 偶有小肉荚, 但在开花2~3 d后自然脱落(图1-E, F)。若土壤肥力充足, msm2015-1可无限持续开花数月。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1绿豆雄性不育突变体msm2015-1表型分析
A: 营养生长期; B: 花蕾; C: 盛开的花朵; D: 花蕾解剖图, 从左至右依次为旗瓣、翼瓣、龙骨瓣、雄蕊和雌蕊; E: 开花后第2天的小豆荚; F: 近成熟的豆荚。A图中标尺为10 cm, B~F图中标尺为1 cm。
Fig. 1Phenotypic analysis of the msm2015-1 mutant in mungbean
A: vegetative growth stage; B: flower buds; C: opening flowers; D: anatomy of the flower bud, from left to right in order: standard petals, wing petals, keel petals, stamens and pistils; E: the little pods on 2nd day after flowering; F: nearly ripen pods. In figure A, bar = 10 cm; in figure B to F, bar = 1 cm.
花药解剖结构分析发现, ‘苏绿1号’花药饱满正常开裂(图2-A, D), 有大量黄色花粉散出并附着于柱头(图2-B), 而msm2015-1花药发白, 没有正常开裂散粉(图2-A, E), 柱头上几乎没有花药附着(图2-C)。扫描电镜观察发现, 正常的成熟花粉粒呈饱满的近球形, 表面呈多个规则的多边形排列, 萌发孔可见(图2-F), 而msm2015-1的花粉粒大多皱缩呈扁帽子状, 且花粉粒大小不一, 表明纹路杂乱不规则, 未观察到正常的萌发孔(图2-G)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2绿豆雄性不育突变体msm2015-1花药及花粉粒形态观察
A: 花药, 白色箭头指示msm2015-1未正常开裂; B: ‘苏绿1号’柱头, 白色箭头指示大量花粉附着; C: msm2015-1柱头, 白色箭头指示几乎无花粉附着; D: ‘苏绿1号’花药的扫描电镜图; E: msm2015-1花药的扫描电镜图; F: ‘苏绿1号’成熟花粉粒的扫描电镜图; G: msm2015-1成熟花粉粒的扫描电镜图。A~C图中标尺为1 mm, D和E图中标尺为100 µm, F和G图中标尺为10 µm。
Fig. 2Morphology observation of msm2015-1’s anthers and pollen grains in mungbean
A: stamen, the white arrows indicate the indehiscent anther of msm2015-1; B: the pistil of Sulyu 1, the white arrow indicates the attached pollen grains on stigma; C: the pistil of msm2015-1, the white arrow indicates rarely pollen grains attached on stigma; D: scanning electron micrograph (SEM) image of Sulyu 1’s anther; E: SEM image of msm2015-1’s anther; F: SEM image of Sulyu 1’s mature pollen grains; G: SEM image of msm2015-1’s mature pollen grains. In figure A to C, bars = 1 mm; in figure D and E, bars = 100 µm; in fugure F and G, bars = 10 µm.
2.2 育性分离群体的遗传学分析
msm2015-1所在的育性分离群体(M3代)共有38株, 其中29株可育, 9株不育; 由这29个可育株衍生的M3:4株系中有16个株系发生分离, 在M4代统计了这些分离株系的分离比, 可育株系187株, 不育株系共有71株, χ23:1等于0.873, 小于P0.05=3.84 (表1), 表明msm2015-1雄性不育性状由单个隐性核基因控制。Table 1
表1
表1育性分离群体的遗传学分析
Table 1
| 表型 Phenotype | 观察值 Observed number | 理论值 Theoretical number | χ2 (3:1) |
|---|---|---|---|
| 可育株Fertile plants | 187 | 193.5 | 0.873 |
| 不育株Sterile plants | 71 | 64.5 |
新窗口打开|下载CSV
2.3 花粉发育的细胞学分析
2.3.1 成熟花粉生活力的检测 本研究首先用苯胺蓝染色观察花粉柱头萌发情况发现, ‘苏绿1号’柱头上附着的花粉粒及其萌发出的花粉管清晰可见(图3-A), 而msm2015-1中柱头上几乎看不到花粉粒(图3-B), 与图2-C结果一致。为了检测msm2015-1的花粉是否具有萌发活力, 我们用杂交镊剖开成熟花药, 挤出花粉粒进行体外萌发试验发现, ‘苏绿1号’的花粉粒在体外萌发正常, 而msm2015-1花粉粒的离体萌发率几乎为0 (图3-C, D)。Alexander染色结果显示, 野生型花粉可以均匀正常着色(图4-A), 而msm2015-1花粉大多不能着色(图4-B); 统计数据显示, msm2015-1花粉败育率为96.67% (图4-C)。I2-KI染色结果发现, 野生型花粉形状规则, 可以被均匀染色(图4-D), 而msm2015-1花粉染色异常(图4-E), 出现了典败、圆败和染败3种类型, 其中典败和圆败居多, 表明突变体花粉败育时期较早; 统计数据显示, msm2015-1花粉败育率为94.50% (图4-F)。同时, 我们用Alexander染色分析成熟花蕾的花药发现, ‘苏绿1号’花药囊里的花粉粒可以被染成紫红色, 形状规则饱满(图4-G); 而msm2015-1花药囊形状干瘪, 内部花粉粒着色异常(图4-H)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3绿豆雄性不育突变体msm2015-1花粉体内及体外萌发
A: ‘苏绿1号’花粉柱头萌发, 白色箭头指示柱头上花粉粒及其萌发出的花粉管; B: msm2015-1花粉柱头萌发, 白色箭头指示柱头上无花粉粒附着; C: ‘苏绿1号’成熟花粉体外萌发; D: msm2015-1成熟花粉体外萌发。图中标尺为100 µm。
Fig. 3Pollen germination of the msm2015-1 mutant in vivo and in vitro in mungbean
A: pollen germination on stigma of Sulyu 1, the white arrows indicate the pollen grains attached on stigma and germinated pollen tubes; B: pollen germination on stigma of msm2015-1, the white arrow indicates few pollen grains attached on stigma; C: mature pollen germination of Sulyu 1 in vitro; D: mature pollen germination of msm2015-1 in vitro. Bar = 100 µm.
图4
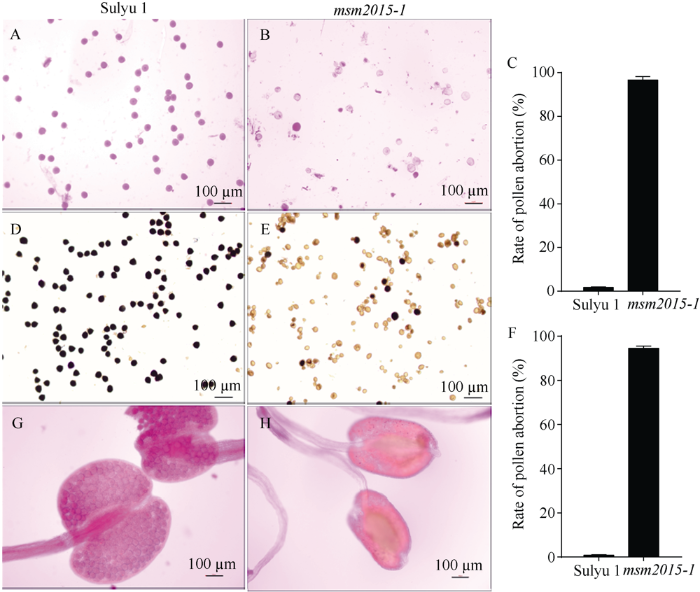 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4绿豆雄性不育突变体msm2015-1花粉活力的染色分析
A: ‘苏绿1号’成熟花粉的Alexander染色; B: msm2015-1成熟花粉的Alexander染色; C: Alexander染色花粉败育率统计; D: ‘苏绿1号’成熟花粉的I2-KI染色; E: msm2015-1成熟花粉的I2-KI染色; F: I2-KI染色花粉败育率统计; G: ‘苏绿1号’成熟花蕾的花药Alexander染色; H: msm2015-1成熟花蕾的花药Alexander染色。图中标尺为100 µm。
Fig. 4Pollen viability of the msm2015-1 mutant analyzed by staining analysis in mungbean
A: Alexander staining of Sulyu 1’s mature pollen; B: Alexander staining of msm2015-1’s mature pollen; C: statistics of pollen abortion rate of Alexander staining; D: I2-KI staining of Sulyu 1’s mature pollen; E: I2-KI staining of msm2015-1’s mature pollen; F: statistics of pollen abortion rate of I2-KI staining; G: Alexander staining of Sulyu 1’s anthers of mature flower bud; H: Alexander staining of msm2015-1’s anthers of mature flower bud. Bar = 100 µm.
2.3.2 成熟花粉细胞核发育的检测 绿豆的成熟花粉粒属于2-细胞型, 即当花粉从裂开花药中散出时, 雄配子仍在2-细胞的发育阶段, 含有1个生殖核和1个营养核[27]。DAPI染色结果显示, 在‘苏绿1号’的成熟花粉粒中可以检测到2个核, 紧凑且亮度高的为生殖核, 较为松散的为营养核(图5-A), 花粉粒性状规则。而在msm2015-1的成熟花粉粒中未观察到明显的细胞核, 且花粉粒大小不一(图5-B), 核质发育异常。
图5
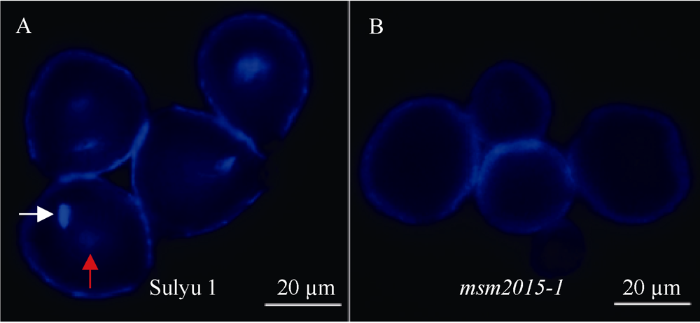 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5绿豆雄性不育突变体msm2015-1的花粉细胞核发育检测
A: ‘苏绿1号’成熟花粉DAPI染色, 白色和红色箭头分别指示生殖核和营养核; B: msm2015-1成熟花粉DAPI染色。图中标尺为20 µm。
Fig. 5Detection of pollen nuclear development in the msm2015-1 mutant
A: DAPI staining of Sulyu 1’s mature pollen, the white arrow indicates the generative nucleus, and the red arrow indicates the vegetative nucleus; B: DAPI staining of msm2015-1’s mature pollen. Bar = 20 µm.
2.3.3 花粉早期发育阶段细胞学观察 花粉碘染试验表明, msm2015-1败育发生在花粉发育早期, 为确定具体的败育时期, 我们分别对不同发育时期的花蕾进行醋酸洋红染色发现, msm2015-1的花粉在四分体时期出现了异常, 正常花粉粒会经减数分裂分成4个大小均等的小孢子, 而msm2015-1的花粉母细胞则出现了不均匀分裂和异常多分裂现象(图6-A), 其中异常多分裂较为常见, 可以观察到多种类型的分裂现象(图6-B), 最终导致花粉败育。表明四分体时期花粉母细胞的减数分裂异常是导致msm2015-1花粉败育的主要原因。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6绿豆雄性不育突变体msm2015-1花粉早期发育阶段分析
A: 花粉早期发育的各个时期, 白色箭头指示msm2015-1四分体时期的不对称和不均等分裂导致形成的大小不一的小孢子; B: 四分体时期出现的异常多分裂, 图中数字表示msm2015-1分裂出的小孢子个数。PMC: 花粉母细胞; Tetrad: 四分体; Msp: 小孢子; Pollen: 花粉。图中标尺为20 µm。
Fig. 6Developmental early stage analysis of msm2015-1’s pollen in mungbean
A: the early stages of pollen development, the white arrows indicate the uneven-size microspores caused by the asymmetry and inhomogeneity meiosis during the tetrad stage; B: the anomalous more fission of meiosis happened during the tetrad stage, the numbers of msm2015-1’s microspores are indicated by the Arabic numbers. PMC: pollen mother cell; Msp: microspore. Bar = 20 µm.
3 讨论
3.1 绿豆雄性不育突变体与杂种优势利用
60Co-γ辐射诱变是常用的育种手段, 可加快农作物新品种的选育进程。本研究利用该方法成功获得绿豆雄性不育突变体msm2015-1, 花药不能正常散粉且花粉败育, 座荚率几乎为0。在田间试验中, 本研究发现, msm2015-1有极少量的自结荚, 暗示雌配子可能是可育或者部分可育的, 不育株的后代可以稳定遗传雄性不育表型。自结荚可能是由于msm2015-1花粉未彻底败育, 抑或花粉母细胞减数分裂时会偶尔产生极少量的正常花粉, 由虫媒辅助授粉所致。豆科作物的杂种优势明显, 但受其花器官结构、易落花落荚、授粉方式等因素影响, 制种难度大, 杂种优势利用研究也相对落后[28]。木豆是目前世界上唯一商业化杂交制种的豆科植物。1991年, 印度国际半干旱热带作物研究所(ICRISAT)利用隐性细胞核不育系(GMS)育成并发布了首个木豆杂交种ICPH8, 与主栽品种对照增产超25.6%以上[29]。随后ICRISAT的科学家育成了基于细胞质不育系(CMS)的首个商业化杂交木豆ICPH 2671, 增产高达47% [30]。大豆杂交种研究已持续了数十年, 21世纪初期, 吉林省农业科学院育成并审定了世界上第1批杂交大豆, 由基于CMS的“三系法”杂交获得, 产量提高20%以上, 同时研究建立了“环境 昆虫 作物三位一体综合调控”制种体系[31,32]。然而, 大豆杂交制种仍然存在技术瓶颈, 因而至今尚未大面积商业化推广。其他豆类作物如菜豆, 其杂交种可增产高达47%, 虽已经发现了CMS突变体, 但同样限于杂交制种阻碍未能商业化推广[17]。
绿豆是严格的自花授粉作物, 天然异交率约1.68% [33], 严重制约着其杂交制种。因此, 绿豆杂种优势利用也将会遇到一些技术瓶颈, 只有通过优异资源的不断挖掘和现代生物技术的融入才能有效推动其发展。本研究组前期发现的绿豆花开张突变体(chasmogamous mutant, CM)翼瓣和龙骨瓣缺失, 花药外露, 打破了绿豆进行异花传粉的生理障碍, 可开发为较为理想的父本材料, 迈出了绿豆杂交制种的第一步[34]。因此当下选育可利用的绿豆雄性不育系是实现绿豆杂交制种的关键锁钥。绿豆雄性不育研究相对粮食作物(如水稻、小麦等)和大宗经济作物(如玉米、棉花、大豆等)落后很多, 目前尚无相关报道。本研究通过辐射诱变育种技术首次获得了绿豆雄性不育突变体msm2015-1。遗传分析发现, 育性分离群体的可育株和不育株的分离比符合3:1, 表明不育性状由单个隐性核基因控制。目前, 我们正在试验优化杂交组合构建定位群体, 以开展后续的基因定位和功能研究工作。
3.2 绿豆雄性不育突变体msm2015-1花粉败育的原因剖析
植物雄性生殖涉及多个发育过程, 包括雄蕊分生组织的特化、造孢细胞的形成及小孢子母细胞的分化、减数分裂、小孢子的成熟和授粉[35]。雄性不育可由孢子体或配子体花药组织的异常发育所致。大多数孢子体雄性不育突变体主要影响绒毡层和减数分裂细胞, 导致花粉败育或无花粉不育; 而配子体雄性不育突变体主要影响小孢子或花粉粒的发育[16]。msm2015-1的花药不能正常开裂散出花粉(图2), 花粉柱头染色亦未见花粉附着和花粉管伸长(图3), 表明花粉几乎不能与柱头接触授粉。花药开裂是植物完成授粉的重要步骤之一, 包括药室内壁的增厚、绒毡层的降解和裂口的形成3个过程, 其受到包括激素(如IAA、JA、GA等)和环境因素(如低温等)在内的复杂信号通路的调控[36,37]。很多雄性不育突变体是由于绒毡层细胞的异常分化和降解所致。研究发现, 参与绒毡层的发育调控的基因主要有bHLH转录因子、MYB转录因子、PHD-finger结构域蛋白等[38,39]。例如拟南芥DYT1 (DYSFUNCTIO NAL TAPETUM1)和AMS (ABORTED MICROSPOR ES), 水稻中对应同源基因UDT1 (UNDEVELOPED TAPETUM1)和TDR (TAPETUM DEGENERATION RETARDATION)等都属于bHLH转录因子[38,40]; 拟南芥MYB33、MYB65、TDF1 (DEFECTIVE in TAPETAL DEVELOPMENT and FUNCTION1)和AtMYB103/MS188以及水稻GAMYB等都属于MYB转录因子[39,41]; 拟南芥MS1 (MALE STERILITY1)、水稻PTC1 (PERSISTENT TAPETAL CELL1)等编码了PHD-finger结构域蛋白[38,42]。msm2015-1的花药开裂异常是否与绒毡层的发育相关需要进一步的研究验证。
从msm2015-1成熟花药中挤出的花粉粒在体外未萌发, 细胞质不能被Alexander和I2-KI染液正常着色(图4), 表明花粉几乎无生活力。碘染中典败和圆败居多, 表明花粉败育时期发生在花粉发育早期阶段。DAPI染色实验中, 在msm2015-1成熟花粉中未观察到细胞核(图5), 这可能是由于早期花粉母细胞减数分裂异常, 或者单核花粉细胞有丝分裂异常引起。我们通过对不同发育时期的花粉进行分析发现, msm2015-1的花粉母细胞出现了减数分裂异常, 四分体时期出现不均匀分裂及异常多分裂现象(图6), 导致产生了没有活力、大小不均一的小孢子。花粉母细胞减数分裂异常也是影响育性的常见原因, 在水稻、拟南芥等植物中发现的相关突变体很多, 可发生在减数分裂的各个时期, 尤其是减数分裂I前期的同源染色体配对和联会、后期的同源染色体分离和胞质分裂等。水稻中报道的与PAIR (pairing aberration in rice)相关的雄性不育突变体, 如pair3在同源染色体配对联会时发生异常, 最终导致了雌雄配子均败育[43]。油菜代表性温敏不育系(TGMS) TE5A株系, 也是同源染色体无法正常配对联会及形成二价体, 最终导致无花粉粒败育[44]。拟南芥ems1 (excess microsporocytes1)突变体虽然在减数分裂时核分裂是正常的, 但小孢子母细胞不进行胞质分裂, 导致小孢子未形成及最终的雄性不育[45]。水稻中DTM1 (DEFECTIVE TAPETUM AND MEIOC YTES 1)编码一类谷物中特异的内质网蛋白, 同时调控着花粉绒毡层的分化和降解及减数分裂, 表现为在减数分裂I早期停滞, 最终无花粉粒生成而败育[46]。水稻osagg1突变体表现出花药不开裂, 花粉粒大多数干瘪且典败表型, 与msm2015-1的表型较为相似, 研究发现, osagg1减数分裂早期重组和联会发生正常, 但重组交叉数明显减少, 最终导致了雌雄配子均败育[47]。然而, msm2015-1的花粉减数分裂异常具体发生在哪个阶段以及雌配子育性是否受到影响还有待进一步的研究验证。由于msm2015-1的花药不开裂, 且减数分裂异常, 推断其应属于孢子体雄性不育突变体, 败育的分子机制有待进一步的深入研究。
4 结论
本研究通过60Co-γ辐射诱变成功获得绿豆雄性不育突变体msm2015-1, 营养生长表型正常, 座荚率几乎为0, 不育表型可稳定遗传。遗传分析显示, 可育和不育株系的分离比符合3:1, 表明不育性状由单个隐性核基因控制。msm2015-1的花药开裂异常, 花粉几乎无生活力, 细胞核发育异常, 花粉败育发生在四分体时期, 由花粉母细胞减数分裂不均匀和异常多分裂所致, 属于核基因控制的孢子体雄性不育类型。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
