 ,, 陈姝琦, 郭晋隆, 阙友雄
,, 陈姝琦, 郭晋隆, 阙友雄 ,*福建农林大学农业农村部福建甘蔗生物学与遗传育种重点实验室 / 国家甘蔗工程技术研究中心, 福建福州 350002
,*福建农林大学农业农村部福建甘蔗生物学与遗传育种重点实验室 / 国家甘蔗工程技术研究中心, 福建福州 350002Molecular detection of G1 marker for orange rust resistance and analysis of candidate resistance WAK gene in sugarcane
WANG Heng-Bo ,, CHEN Shu-Qi, GUO Jin-Long, QUE You-Xiong
,, CHEN Shu-Qi, GUO Jin-Long, QUE You-Xiong ,*Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture and Rural Affairs / National sugarcane Engineering Technology Research, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
,*Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture and Rural Affairs / National sugarcane Engineering Technology Research, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China通讯作者:
收稿日期:2020-06-18接受日期:2020-10-14网络出版日期:2021-04-12
| 基金资助: |
Received:2020-06-18Accepted:2020-10-14Online:2021-04-12
| Fund supported: |
作者简介 About authors
E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (7876KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王恒波, 陈姝琦, 郭晋隆, 阙友雄. 甘蔗抗黄锈病G1标记的分子检测及候选抗病基因WAK的分析[J]. 作物学报, 2021, 47(4): 577-586. doi:10.3724/SP.J.1006.2021.04131
WANG Heng-Bo, CHEN Shu-Qi, GUO Jin-Long, QUE You-Xiong.
甘蔗作为世界上最重要的糖料和能源作物之一, 供应全世界食糖总产的80%和生物能源的60% [1]。同时, 甘蔗也是植物遗传学、多倍体基因组学研究的一种热点植物。甘蔗锈病是一种重要的流行性真菌病害, 给蔗糖产业带来巨大经济损失, 包括2个类型, 即分别由黑顶柄锈菌(Puccinia melanocephala Syd. et P. Syd.)和屈恩柄锈菌(Puccinia kuehnii Butler.) [2]引起的褐锈病和黄锈病。甘蔗黄锈病最早在澳大利亚发现, 2000年大流行于甘蔗栽培品种Q124 [3]。与甘蔗褐锈病相比, 甘蔗黄锈病发病的区域范围相对较窄, 主要分布在澳大利亚、美国、印度、巴西等国家的部分地区[3,4,5], 近年来发病蔗区呈现逐年扩大趋势, 引起甘蔗科技工作者尤其是育种家的广泛关注和高度重视。王晓燕等[6]于2014年在我国云南蔗区首次发现甘蔗黄锈病, 表明该病害在中国蔗区也存在流行发生的风险。因此, 对我国甘蔗种质资源的黄锈病抗性, 在精准检测的基础上, 进行系统地分析评价和抗性溯源, 具有十分重要的理论和实践意义。
甘蔗为遗传背景复杂、基因组庞大的多倍体植物, 尚未有利用基因定位方法获得抗病基因的报道。目前, 利用分子标记辅助育种技术, 选育和种植抗病品种是防治甘蔗病害最为经济有效的方法之一。例如: 在法国的栽培品种R570上, 发现和定位到抗褐锈病的Bru1基因, 被证实对多个国家和地区的褐锈病分离物具有广谱抗性, 现已开发出与Bru1基因紧密连锁的2个分子标记(R12H16和9O20-F4), 已经作为诊断标记在甘蔗抗褐锈病品种的选育中得到了广泛的应用[7,8]。此外, Yang等[1]在利用CP95-1039和CP88-1762杂交的拟“F1”分离群体, 鉴定到1个对表型贡献率为58%的QTL位点(qORR109), 进而开发了抗黄锈病基因的分子诊断标记G1, 为鉴定甘蔗黄锈病种质资源提供了一个重要的技术方法。Yang等[1]根据Unigene序列(转录本ID: Seq_695109)设计了基因特异性标记G1, 其候选基因和高粱的Sobic.002G166150以及拟南芥的RFO1 (RESISTANCE TO FUSARIUM OXYSPOR UM 1)基因属同源基因, 它是一类编码细胞壁关联受体激酶[9]。迄今, 除了抗褐锈病的Bru1和抗黄锈病G1标记外, 甘蔗中还报道了5个抗花叶病和11个抗黑穗病的DNA标记[10], 1个主效的抗甘蔗黄叶病基因位点[11], 但都仅限于抗性位点的发现, 尚未开发成可用的分子标记, 难以用于甘蔗抗病基因的快速鉴定和抗病种质的高效筛选。
目前, 国外甘蔗杂交育种计划中, Bru1标记常常被用于评估甘蔗种质资源和杂交后代无性系的褐锈病抗性[6]。但是, 关于甘蔗黄锈病抗性标记的应用, 除了纳入美国的育种计划外, 其他国家都还未有深入的研究, 也尚未有相关研究结果的报道。在我国, 甘蔗黄锈病是一种新发现的甘蔗真菌病害[6], 但关于甘蔗种质资源中抗黄锈病基因的分子检测未见其他报道。为深入了解我国和世界上重要的甘蔗栽培品种、野生种和近缘属中的抗黄锈病基因的分布状况, 并阐述抗病候选基因的起源及进化关系, 本研究拟采用抗黄锈病标记G1对中国及世界范围内重要的甘蔗栽培品种、野生种及近缘属材料, 进行抗黄锈病的分子检测, 进而对该标记扩增的代表性片段进行克隆测序、功能注释和聚类分析。旨在为国内外甘蔗种质资源的黄锈病抗性鉴定积累技术和经验, 为甘蔗对黄锈病抗性的起源和演化研究奠定基础, 最终为甘蔗抗黄锈病的分子育种和抗性基因的功能鉴定提供重要的研究基础和科学依据。
1 材料与方法
1.1 材料
用于黄锈病抗性分子检测的甘蔗栽培品种、野生种和近缘属种质总共204份, 其中包括170份栽培品种、28份甘蔗属材料(割手密种、大茎野生种和热带种)和6份近缘属(蔗茅属、芒属和河八王属)种质。国内甘蔗品种124份, 来自8个不同育种机构, 包括四川6份、江西1份、台湾15份、海南13份、福建9份、广西47份、云南10份和广东23份; 国外甘蔗品种46份, 其中美国30份, 其他国家16份。详见附表1和附表2。所有材料都来自国家甘蔗种质资源圃(National Germplasm Repository of Sugarcane)。Table S1
附表1
附表1170份甘蔗栽培品种的来源和G1标记的PCR检测结果
Table S1
| 编号 No. | 品种 Cultivar | 来源 Origin | G1标记 Amplification result | 备注 Note |
|---|---|---|---|---|
| 1 | 赣南 99-591 Gannan 99-591 | 中国江西 Jiangxi, China | - | S. hybrid |
| 2 | 四川 89-103 Sichuan 89-103 | 中国四川 Sichuan, China | + | S. hybrid |
| 3 | 内江 00-118 Neijiang 00-118 | 中国四川 Sichuan, China | + | S. hybrid |
| 4 | 内江 03-218 Neijiang 03-218 | 中国四川 Sichuan, China | - | S. hybrid |
| 5 | 内江 92-44 Neijiang 92-44 | 中国四川 Sichuan, China | + | S. hybrid |
| 6 | 内江 90-112 Neijiang 90-112 | 中国四川 Sichuan, China | + | S. hybrid |
| 7 | 四川 73-219 Sichuan 73-219 | 中国四川 Sichuan, China | + | S. hybrid |
| 8 | 新台糖 27号 ROC27 | 中国台湾 Taiwan, China | - | S. hybrid |
| 9 | 新台糖 1号 ROC 1 | 中国台湾 Taiwan, China | + | S. hybrid |
| 10 | 新台糖 16号 ROC 16 | 中国台湾 Taiwan, China | + | S. hybrid |
| 11 | 新台糖 11号 ROC11 | 中国台湾 Taiwan, China | + | S. hybrid |
| 12 | 新台糖 26号 ROC 26 | 中国台湾 Taiwan, China | + | S. hybrid |
| 13 | 新台糖 95-0432 ROC 95-0432 | 中国台湾 Taiwan, China | + | S. hybrid |
| 14 | 新台糖 95-8899 ROC 95-8899 | 中国台湾 Taiwan, China | + | S. hybrid |
| 15 | 新台糖 20号 ROC 20 | 中国台湾 Taiwan, China | + | S. hybrid |
| 16 | 新台糖 21号 ROC 21 | 中国台湾 Taiwan, China | + | S. hybrid |
| 17 | 新台糖 23号 ROC 23 | 中国台湾 Taiwan, China | - | S. hybrid |
| 18 | 新台糖 24号 ROC 24 | 中国台湾 Taiwan, China | - | S. hybrid |
| 19 | 新台糖 10号 ROC10 | 中国台湾 Taiwan, China | - | S. hybrid |
| 20 | PT 43-52 | 中国台湾 Taiwan, China | + | S. hybrid |
| 21 | F108 | 中国台湾 Taiwan, China | - | S. hybrid |
| 22 | 新台糖 22号 ROC 22 | 中国台湾Taiwan, China | + | S. hybrid |
| 23 | 崖城 05-179 Yacheng 05-179 | 中国海南Hainan, China | + | S. hybrid |
| 24 | 崖城 71-374 Yacheng 71-374 | 中国海南Hainan, China | + | S. hybrid |
| 25 | 崖城 93-26 Yacheng 93-26 | 中国海南Hainan, China | - | S. hybrid |
| 26 | 崖城 94-30 Yacheng 94-30 | 中国海南Hainan, China | + | S. hybrid |
| 27 | 崖城 94-46 Yacheng 94-46 | 中国海南Hainan, China | + | S. hybrid |
| 28 | 崖城 97-46 Yacheng 97-46 | 中国海南Hainan, China | - | S. hybrid |
| 29 | 崖城 98-11 Yacheng 98-11 | 中国海南Hainan, China | - | S. hybrid |
| 30 | 崖城 98-2 Yacheng 98-2 | 中国海南Hainan, China | + | S. hybrid |
| 31 | 崖城 96-66 Yacheng 96-66 | 中国海南Hainan, China | - | S. hybrid |
| 32 | 崖城 01-76 Yacheng 01-76 | 中国海南Hainan, China | + | S. hybrid |
| 33 | 崖城 96-4 Yacheng 96-4 | 中国海南Hainan, China | - | S. hybrid |
| 34 | 崖城 99-6 Yacheng 99-6 | 中国海南Hainan, China | + | S. hybrid |
| 35 | 崖城 96-24 Yacheng 96-24 | 中国海南Hainan, China | + | S. hybrid |
| 36 | 福农 02-3924 Funong 02-3924 | 中国福建Fujian, China | - | S. hybrid |
| 37 | 福农 04-3504 Funong 04-3504 | 中国福建Fujian, China | + | S. hybrid |
| 38 | 福农 99-20169 Funong 99-20169 | 中国福建Fujian, China | - | S. hybrid |
| 39 | 福农 38号 Funong 38 | 中国福建Fujian, China | + | S. hybrid |
| 40 | 福农 39号 Funong 39 | 中国福建Fujian, China | - | S. hybrid |
| 41 | 福农 41号 Funong 41 | 中国福建Fujian, China | + | S. hybrid |
| 42 | 闽糖 96-261 Mintang 96-261 | 中国福建Fujian, China | + | S. hybrid |
| 43 | 农林 8 Nonglin 8 | 中国福建Fujian, China | + | S. hybrid |
| 44 | 华南65-21 Huanan 65-21 | 中国广东Guangdong, China | - | S. hybrid |
| 45 | 桂糖 94-119 Guitang 94-119 | 中国广西Guangxi, China | - | S. hybrid |
| 46 | 桂糖 94-38 Guitang 94-38 | 中国广西Guangxi, China | - | S. hybrid |
| 47 | 桂糖 96-211 Guitang 96-211 | 中国广西Guangxi, China | + | S. hybrid |
| 48 | 柳城 01-1137 Liucheng 01-1137 | 中国广西Guangxi, China | + | S. hybrid |
| 49 | 柳城 04-382 Liucheng 04-382 | 中国广西Guangxi, China | + | S. hybrid |
| 50 | 柳城 05-129 Liucheng 05-129 | 中国广西Guangxi, China | + | S. hybrid |
| 51 | 桂糖 02-761 Guitang 02-761 | 中国广西Guangxi, China | + | S. hybrid |
| 52 | 桂糖 73-167 Guitang 73-167 | 中国广西Guangxi, China | + | S. hybrid |
| 53 | 柳城 03-182 Liucheng 03-182 | 中国广西Guangxi, China | + | S. hybrid |
| 54 | 桂糖 03-591 Guitang 03-591 | 中国广西Guangxi, China | + | S. hybrid |
| 55 | 桂糖 03-1156 Guitang 03-1156 | 中国广西Guangxi, China | - | S. hybrid |
| 56 | 桂糖 03-1403 Guitang 03-1403 | 中国广西Guangxi, China | + | S. hybrid |
| 57 | 桂糖 03-2357 Guitang 03-2357 | 中国广西Guangxi, China | - | S. hybrid |
| 58 | 桂糖 04-1007 Guitang 04-1007 | 中国广西Guangxi, China | + | S. hybrid |
| 59 | 桂糖 08-278 Guitang 08-278 | 中国广西Guangxi, China | - | S. hybrid |
| 60 | 桂糖 02-390 Guitang 02-390 | 中国广西Guangxi, China | + | S. hybrid |
| 61 | 桂糖 05-2605 Guitang 05-2605 | 中国广西Guangxi, China | - | S. hybrid |
| 62 | 桂糖 05-2743 Guitang 05-2743 | 中国广西Guangxi, China | + | S. hybrid |
| 63 | 桂糖 05-322 Guitang 05-322 | 中国广西Guangxi, China | + | S. hybrid |
| 64 | 桂糖 05-3661 Guitang 05-3661 | 中国广西Guangxi, China | + | S. hybrid |
| 65 | 桂糖 05-375 Guitang 05-375 | 中国广西Guangxi, China | + | S. hybrid |
| 66 | 桂糖 05-378 Guitang 05-378 | 中国广西Guangxi, China | + | S. hybrid |
| 67 | 桂糖 05-3846 Guitang 05-3846 | 中国广西Guangxi, China | - | S. hybrid |
| 68 | 桂糖 08-297 Guitang 08-297 | 中国广西Guangxi, China | + | S. hybrid |
| 69 | 桂糖 35号 Guitang 35 | 中国广西Guangxi, China | - | S. hybrid |
| 70 | 桂糖 05-827 Guitang 05-827 | 中国广西Guangxi, China | + | S. hybrid |
| 71 | 桂糖 07-713 Guitang 07-713 | 中国广西Guangxi, China | - | S. hybrid |
| 72 | 桂糖 02-1247 Guitang 02-1247 | 中国广西Guangxi, China | + | S. hybrid |
| 73 | 桂糖 02-208 Guitang 02-208 | 中国广西Guangxi, China | - | S. hybrid |
| 74 | 桂糖 02-619 Guitang 02-619 | 中国广西Guangxi, China | + | S. hybrid |
| 75 | 桂糖 00-245 Guitang 00-245 | 中国广西Guangxi, China | + | S. hybrid |
| 76 | 桂糖 96-211 Guitang 96-211 | 中国广西Guangxi, China | + | S. hybrid |
| 77 | 桂糖 00-122 Guitang 00-122 | 中国广西Guangxi, China | - | S. hybrid |
| 78 | 桂糖 02-351 Guitang 02-351 | 中国广西Guangxi, China | - | S. hybrid |
| 79 | 桂糖 09-03 Guitang 09-03 | 中国广西Guangxi, China | + | S. hybrid |
| 80 | 桂糖 96-167 Guitang 96-167 | 中国广西Guangxi, China | + | S. hybrid |
| 81 | 桂糖 97-69 Guitang 97-69 | 中国广西Guangxi, China | - | S. hybrid |
| 82 | 桂糖 00-173 Guitang 00-173 | 中国广西Guangxi, China | - | S. hybrid |
| 83 | 桂糖 02-467 Guitang 02-467 | 中国广西Guangxi, China | + | S. hybrid |
| 84 | 桂糖 29号 Guitang 29 | 中国广西Guangxi, China | + | S. hybrid |
| 85 | 桂糖 30号 Guitang 30 | 中国广西Guangxi, China | - | S. hybrid |
| 86 | 桂糖 31号 Guitang 31 | 中国广西Guangxi, China | - | S. hybrid |
| 87 | 桂糖 92-66 Guitang 92-66 | 中国广西Guangxi, China | + | S. hybrid |
| 88 | 桂糖 00-257 Guitang 00-257 | 中国广西Guangxi, China | + | S. hybrid |
| 89 | 桂糖 94-119 Guitang 94-119 | 中国广西Guangxi, China | - | S. hybrid |
| 90 | 桂糖35号 Guitang 35 | 中国广西Guangxi, China | + | S. hybrid |
| 91 | 柳城 03-1137 Liucheng 03-1137 | 中国广西Guangxi, China | + | S. hybrid |
| 92 | 德蔗 93-88 Dezhe 93-88 | 中国云南Yunnan, China | + | S. hybrid |
| 93 | 云蔗 02-2332 Yunzhe 02-2332 | 中国云南Yunnan, China | - | S. hybrid |
| 94 | 云蔗 02-2540 Yunzhe 02-2540 | 中国云南Yunnan, China | + | S. hybrid |
| 95 | 云蔗 02-588 Yunzhe 02-588 | 中国云南Yunnan, China | + | S. hybrid |
| 96 | 云蔗 03-194 Yunzhe 03-194 | 中国云南Yunnan, China | + | S. hybrid |
| 97 | 云蔗 04-214 Yunzhe 04-214 | 中国云南Yunnan, China | + | S. hybrid |
| 98 | 云蔗 05-51 Yunzhe 05-51 | 中国云南Yunnan, China | + | S. hybrid |
| 99 | 云蔗 06-407 Yunzhe 06-407 | 中国云南Yunnan, China | + | S. hybrid |
| 100 | 云蔗 94-343 Yunzhe 94-343 | 中国云南Yunnan, China | - | S. hybrid |
| 101 | 云南 65-225 Yunzhe 65-225 | 中国云南Yunnan, China | + | S. hybrid |
| 102 | 粤农 73-204 Yuenong 73-204 | 中国广东Guangdong, China | + | S. hybrid |
| 103 | 粤甘 34号 Yuegan 34 | 中国广东Guangdong, China | - | S. hybrid |
| 104 | 粤甘 16号 Yuegan 16 | 中国广东Guangdong, China | + | S. hybrid |
| 105 | 粤农 73-204 Yuenong 73-204 | 中国广东Guangdong, China | - | S. hybrid |
| 106 | 粤农 86-295 Yuenong 86-295 | 中国广东Guangdong, China | - | S. hybrid |
| 107 | 粤糖 00-236 Yuetang 00-236 | 中国广东Guangdong, China | + | S. hybrid |
| 108 | 粤糖 55 Yuetang 55 | 中国广东Guangdong, China | + | S. hybrid |
| 109 | 粤糖 83-271 Yuetang 83-271 | 中国广东Guangdong, China | + | S. hybrid |
| 110 | 粤糖 93-159 Yuetang 93-159 | 中国广东Guangdong, China | + | S. hybrid |
| 111 | 粤糖 94-128 Yuetang 94-128 | 中国广东Guangdong, China | + | S. hybrid |
| 112 | 粤糖 96-86 Yuetang 96-86 | 中国广东Guangdong, China | + | S. hybrid |
| 113 | 湛蔗 19号 Zhanzhe 19 | 中国广东Guangdong, China | + | S. hybrid |
| 114 | 湛蔗 22号 Zhanzhe 22 | 中国广东Guangdong, China | + | S. hybrid |
| 115 | 湛蔗 24号 Zhanzhe 24 | 中国广东Guangdong, China | - | S. hybrid |
| 116 | 湛蔗 74-141 Zhanzhe 74-141 | 中国广东Guangdong, China | + | S. hybrid |
| 117 | 粤甘 24号 Yuegan 24 | 中国广东Guangdong, China | + | S. hybrid |
| 118 | 粤糖 89-240 Yuetang 89-240 | 中国广东Guangdong, China | + | S. hybrid |
| 119 | 湛蔗 92-126 Zhanzhe 92-126 | 中国广东Guangdong, China | - | S. hybrid |
| 120 | 湛蔗 26号 Zhanzhe 26 | 中国广东Guangdong, China | + | S. hybrid |
| 121 | 湛蔗 80-101 Zhanzhe 80-101 | 中国广东Guangdong, China | + | S. hybrid |
| 122 | 粤糖 00-319 Guitang00-319 | 中国广东Guangdong, China | + | S. hybrid |
| 123 | 粤糖 60号 Yuetang 60 | 中国广东Guangdong, China | - | S. hybrid |
| 124 | 科5 Ke 5 | 中国广东Guangdong, China | + | S. hybrid |
| 125 | FR94-280 | 法国 France | + | S. hybrid |
| 126 | FR99-49 | 法国 France | - | S. hybrid |
| 127 | RB83-5089 | 巴西 Brazil | + | S. hybrid |
| 128 | Q208 | 澳大利亚 Australia | - | S. hybrid |
| 129 | Q117 | 澳大利亚 Australia | - | S. hybrid |
| 130 | Q200 | 澳大利亚 Australia | + | S. hybrid |
| 131 | Q209 | 澳大利亚 Australia | + | S. hybrid |
| 132 | Co1001 | 印度 India | + | S. hybrid |
| 133 | Co281 | 印度 India | + | S. hybrid |
| 134 | Co290 | 印度 India | + | S. hybrid |
| 135 | PINDAR | 印度 India | - | S. hybrid |
| 136 | Co419 | 印度 India | + | S. hybrid |
| 137 | POJ2878 | 印度尼西亚 Indonesia | - | S. hybrid |
| 138 | NCO376 | 南非 South Africa | + | S. hybrid |
| 139 | NCO310 | 南非 South Africa | + | S. hybrid |
| 140 | CP67-412 | 美国 USA | + | S. hybrid |
| 141 | CP72-1210 | 美国 USA | + | S. hybrid |
| 142 | CP72-2086 | 美国 USA | - | S. hybrid |
| 143 | CP72-330 | 美国 USA | + | S. hybrid |
| 144 | CP72-3591 | 美国 USA | + | S. hybrid |
| 145 | CP82-1592 | 美国 USA | + | S. hybrid |
| 146 | CP84-1198 | 美国 USA | - | S. hybrid |
| 147 | CP85-1308 | 美国 USA | + | S. hybrid |
| 148 | CP86-1633 | 美国 USA | + | S. hybrid |
| 149 | CP88-1762 | 美国 USA | + | S. hybrid |
| 150 | CP89-1509 | 美国 USA | + | S. hybrid |
| 151 | CP89-2143 | 美国 USA | - | S. hybrid |
| 152 | CP92-1213 | 美国 USA | + | S. hybrid |
| 153 | CP94-1100 | 美国 USA | + | S. hybrid |
| 154 | CP94-1340 | 美国 USA | + | S. hybrid |
| 155 | CP96-1602 | 美国 USA | + | S. hybrid |
| 156 | H32-8560 | 美国 USA | + | S. hybrid |
| 157 | HoCP91-555 | 美国 USA | + | S. hybrid |
| 158 | HoCP92-624 | 美国 USA | - | S. hybrid |
| 159 | HoCP93-746 | 美国 USA | + | S. hybrid |
| 160 | HoCP95-988 | 美国 USA | - | S. hybrid |
| 161 | HoCP94-806 | 美国 USA | + | S. hybrid |
| 162 | HoCP95-950 | 美国 USA | - | S. hybrid |
| 163 | CP80-1277 | 美国 USA | + | S. hybrid |
| 164 | CP57-641 | 美国 USA | + | S. hybrid |
| 165 | CP92-1666 | 美国 USA | - | S. hybrid |
| 166 | CP93-182 | 美国 USA | - | S. hybrid |
| 167 | CP49-50 | 美国 USA | + | S. hybrid |
| 168 | CP67-412 | 美国 USA | + | S. hybrid |
| 169 | CP28-11 | 美国 USA | - | S. hybrid |
| 170 | R570 | 法国 France | - | S. hybrid |
新窗口打开|下载CSV
Table S2
附表2
附表234份甘蔗属和近缘属材料的来源及G1标记的PCR检测结果
Table S2
| 编号 No. | 品种 Name | 来源 Origin | G1标记 Amplification result | 备注 Note |
|---|---|---|---|---|
| 1 | 贵州 78-2-12 Guizhou 78-2-12 | 中国贵州 Guizhou, China | + | Erianthus arundinaceus |
| 2 | 云南 95-19 Yunnan 95-19 | 中国云南 Yunnan, China | - | Erianthus rockii |
| 3 | 广西 79-8 Guangxi 79-8 | 中国广西 Guangxi, China | - | Miscanthus floridulus |
| 4 | 云南 95-35 Yunnan 95-35 | 中国云南 Yunnan, China | - | Miscanthus sinensis |
| 5 | 广西 89-13 Guangxi 89-13 | 中国广西 Guangxi, China | + | Narenga porphyrooma |
| 6 | 广东 64号 Guangdong 64 | 中国广东 Guangdong, China | - | Narenga porphyrooma |
| 7 | HATUNI | 印度 India | + | S. barberi |
| 8 | Katha | 印度 India | - | S. barberi |
| 9 | Nangas | 印度 India | - | S. barberi |
| 10 | LA-purple | 印度尼西亚 Indonesia | - | S. officinarum |
| 11 | Badila | 印度尼西亚 Indonesia | - | S. officinarum |
| 12 | 路达仕 Loethers | 美国 USA | - | S. officinarum |
| 13 | 黑车里本 Black cheribon | 美国 USA | - | S. officinarum |
| 14 | 克里斯塔林娜 Crystalina | 美国 USA | - | S. officinarum |
| 15 | 云南大野Yunnandaye | 中国云南 Yunnan, China | - | S. robustum |
| 16 | 福建大野Fujiandaye | 中国福建 Fujian, China | + | S. robustum |
| 17 | 51NG3 | 印度尼西亚 Indonesia | - | S. robustum |
| 18 | 57NG208 | 印度尼西亚 Indonesia | - | S. robustum |
| 19 | NG77004 | 印度尼西亚 Indonesia | - | S. robustum |
| 20 | MOL-6081 | 美国 USA | + | S. robustum |
| 21 | 桂林竹蔗 Guilinzhuzhe | 中国广西 Guangxi, China | + | S. sinense |
| 22 | Youba | 中国云南 Yunnan, China | - | S. sinense |
| 23 | 松溪竹蔗Songxizhuzhe | 中国福建 Fujian, China | - | S. sinense |
| 24 | 贵州 78-1-11 Guizhou 78-1-11 | 中国贵州 Guizhou, China | + | S. spontaneum |
| 25 | 贵州 78-2-28 Guizhou 78-2-28 | 中国贵州 Guizhou, China | + | S. spontaneum |
| 26 | 四川 79-1-26 Sichuan79-1-26 | 中国四川 Sichuan, China | + | S. spontaneum |
| 27 | 四川 79-2-11 Sichuan 79-2-11 | 中国四川 Sichuan, China | + | S. spontaneum |
| 28 | 云南 75-2-11 Yunnan 75-2-11 | 中国云南 Yunnan, China | + | S. spontaneum |
| 29 | 广东 21号 Guangdong 21 | 中国广东 Guangdong, China | + | S. spontaneum |
| 30 | 广东 30号 Guangdong 30 | 中国广东 Guangdong, China | + | S. spontaneum |
| 31 | 福建 89-1-1 Fujian 89-1-1 | 中国福建 Fujian, China | + | S. spontaneum |
| 32 | 福建 89-1-16 Fujian 89-1-16 | 中国福建 Fujian, China | + | S. spontaneum |
| 33 | 印度1号 Yindu 1 | 印度 India | + | S. spontaneum |
| 34 | 印度2号 Yindu 2 | 印度 India | + | S. spontaneum |
新窗口打开|下载CSV
1.2 蛋白组数据的获取
从法国农业研究所甘蔗基因组中心(1.3 黄锈病抗性标记G1的PCR扩增和分析
1.3.1 引物合成 依据Yang等[1]开发的黄锈病抗性标记G1方法对所选的204份甘蔗栽培品种、野生种及近缘属种质进行检测。G1标记上游引物为5'-ACCATGGAAATCCATACGuitangC-3', 下游引物为5'-GGCCAACACTTAGGCCAATA-3'。由生工生物工程(上海)股份有限公司合成引物。G1标记预期扩增产物长度为911 bp。1.3.2 DNA提取和PCR扩增体系 采用CTAB法[15]从蔗叶中提取基因组DNA。PCR的反应体系配置参考端木卜文等[16]的方法, 即每25 μL反应体积中含有DNA模板2 μL、上游和下游引物各(10 μmol L-1) 0.5 μL、ddH2O 9.5 μL、2×Taq Plus Master Mix (Dye) 12.5 μL, 其中2×Taq Plus Master Mix (Dye)试剂购自北京康为世纪生物科技有限公司。所有扩增均在T100 Thermal CYachengler (Bio-Rad Research, USA)扩增仪上进行。PCR反应参照Yang等[1]建立的扩增程序, 94℃预变性5 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸45 s, 35个循环; 最后在72℃下延伸5 min, 4℃保存。所有PCR扩增产物用1.5%琼脂糖凝胶电泳检测。100 bp DNA Ladder (100~1500 bp)购自北京康为世纪生物科技有限公司。
1.4 黄锈病抗性标记G1候选基因的克隆、测序和鉴定
1.4.1 扩增产物的回收、克隆与测序 利用2%琼脂糖凝胶电泳分析PCR扩增产物, 挑选差异性扩增条带, 胶回收目标DNA片段, 纯化后, 连接到pMD18-T载体上, 从每个连接转化的反应板上挑取5个阳性克隆, 扩增培养后由生工生物工程(上海)股份有限公司进行双向测序。1.4.2 细胞壁连接的类受体激酶WAK的鉴定
以高粱细胞壁关联的受体激酶(WAK) Sobic. 002G166150的蛋白为种子序列, 进行本地BlastP比对甘蔗栽培品种(R570)单倍体蛋白组数据库, 蛋白质筛选标准e-value值为10-2, 相似性为40%以上, 获得与高粱Sobic.002G166150的相似度较高蛋白序列。
1.5 生物信息学分析方法和工具
利用 Pfam (2 结果与分析
2.1 甘蔗栽培品种抗黄锈病标记G1的PCR检测
基于抗黄锈病标记G1, 对国内外甘蔗栽培品种共170份进行PCR检测发现, 中国栽培品种124份, 含有抗性标记G1的有83份(占比66.9%); 国外栽培品种46份, 含有抗性标记G1的有31份(占比67.4%), 其中来自美国的30个甘蔗栽培品种中, 含有抗性标记G1的有21份(占比70%), 阳性率高于中国甘蔗栽培品种。2.2 甘蔗野生种与近缘属材料的抗黄锈病标记G1的PCR检测
对28份甘蔗属野生种进行抗黄锈病标记G1检测发现, 含有抗性标记的有15份, 阳性率为53.6%。甘蔗属野生种的检测结果分别是印度种(1/3, HATUNI)、中国种(1/3, 桂林竹蔗)、大茎野生种(2/6, MOL-6081和福建大野)、割手密种(11/11)呈现阳性结果, 但是占甘蔗栽培品种染色体组70%~80%的热带种没有检测到911 bp的阳性结果。利用G1标记对6份甘蔗近缘属材料进行检测发现, 蔗茅属(1/2, 贵州78-2-12)、河八王属(1/2, 广西89-13)呈现阳性结果, 而芒属的2个材料检测结果为阴性。表明, G1标记关联的候选基因也分布于甘蔗野生种和近缘属材料中, 其中所有参试割手密种质G1检测结果都为阳性。图1
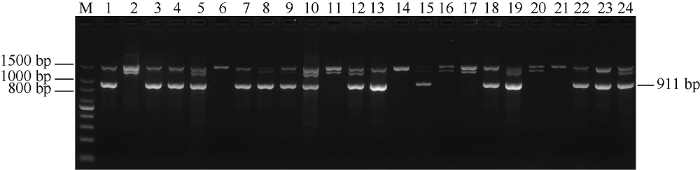 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1G1标记在部分栽培品种中的扩增结果
1: HoCP 94-806; 2: 赣南99-591; 3: 粤糖00-236; 4: 桂糖05-827; 5: 桂糖00-257; 6: 崖城97-46; 7: 湛蔗80-101; 8: CP 67-412; 9: 桂糖05-322; 10: 崖城94-46; 11: 桂糖08-278; 12: 桂糖00-245; 13: CP 89-1509; 14: 桂糖05-3846; 15: 桂糖29; 16: 崖城93-26; 17: CP 72-2086; 18: 崖城94-30; 19: CP 92-1213; 20: HoCP 92-624; 21: 桂糖05-2605; 22: 崖城96-24; 23: 湛蔗22; 24: 崖城99-6; M:100 bp DNA ladder。
Fig. 1Electrophoretic patterns of G1 primers amplified in some Saccharum hybrid
1: HoCP 94-806; 2: Gannan 99-591; 3: Yuetang 00-236; 4: Guitang 05-827; 5: Guitang 00-257; 6: Yacheng 97-46; 7: ZZ 80-101; 8: CP 67-412; 9: Guitang 05-322; 10: Yacheng 94-46; 11: Guitang 08-278; 12: Guitang 00-245; 13: CP 89-1509; 14: Guitang 05-3846; 15: Guitang 29; 16: Yacheng 93-26; 17: CP 72-2086; 18: Yacheng 94-30; 19: CP 92-1213; 20: HoCP 92-624; 21: Guitang 05-2605; 22: Yacheng 96-24; 23: ZZ 22; 24: Yacheng 99-6; M:100 bp DNA ladder.
2.3 G1标记PCR扩增产物序列的获得与分析
利用G1标记检测甘蔗种质过程中发现, 在部分种质扩增到了与目标条带(911 bp)不一致的非特异性条带, 如图2中的泳道2、4、6、11、13、19、20所代表的分别为广西89-13、印度1号、LA-purple、桂林竹蔗、四川79-1-26、福建89-1-1和福建大野。通过比较分析, 挑选12个具有代表性的差异条带进行胶回收和克隆测序, 每个样品均挑选5个阳性克隆测序。从12个甘蔗种质中得到了34个候选基因的单倍型, 不同基因型种质有1~5个等位基因, 扩增片段大小范围分别是678~693、911~914、1073~1075和1303~1505 bp (图3)。聚类结果表明, G1标记所在基因型可以分为3组, 第1组来源于割手密种和大茎野生种; 第2组来源于大茎野生种、热带种和河八王属, 其中热带种LA-purple的678 bp片段和河八王属的693 bp片段间亲缘关系较近, 可能由共同祖先分化而来; 第3组是来源于割手密种、大茎野生种和栽培品种, 核酸片段间相似度较高, 多态性低, 表明甘蔗栽培品种的抗性候选基因主要来源于割手密种。图2
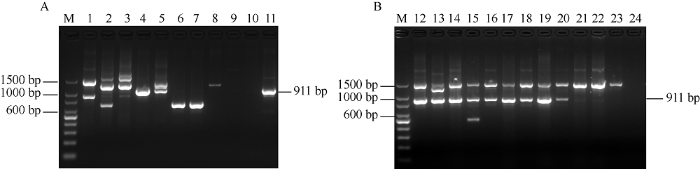 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2G1标记在部分甘蔗野生种中的扩增结果
1: 贵州78-2-12; 2: 广西89-13; 3: 广东64号; 4: 印度1号; 5: 广西79-8; 6: LA-purple; 7: 路达仕; 8: 云南95-19; 9: Katha; 10: 云南 95-35; 11: 桂林竹蔗; 12: 四川79-2-11; 13: 四川79-1-26; 14: 贵州78-2-28; 15: 贵州78-1-11; 16: 广东30号; 17: 广东21号; 18: 福建89-1-16; 19: 福建89-1-1; 20: 福建大野; 21: NG 77-004; 22: 57NG208; 23: 云南大野; 24: 51NG3; M: 100 bp DNA ladder。
Fig. 2Electrophoretic patterns of G1 markers amplified in Saccharum genus
1: Guizhou 78-2-12; 2: Guangxi 89-13; 3: Guangdong 64; 4: Yindu 1; 5: Guangxi 79-8; 6: LA-purple; 7: Loethers; 8: Yunnan 95-19; 9: Katha; 10: Yunnan 95-35; 11: Guilinzhuzhe; 12: Sichuan 78-2-11; 13: Sichuan 79-1-26; 14: Guizhou 78-2-28; 15: Guizhou 78-1-11; 16: Guangdong 30; 17:Guangdong 21; 18: Fujian 89-1-16; 19: Fujian 89-1-1; 20: Fujiandaye; 21: NG77-004; 22: 57NG208; 23: Yunnandaye; 24: 51NG3; M: 100 bp DNA ladder.
图3
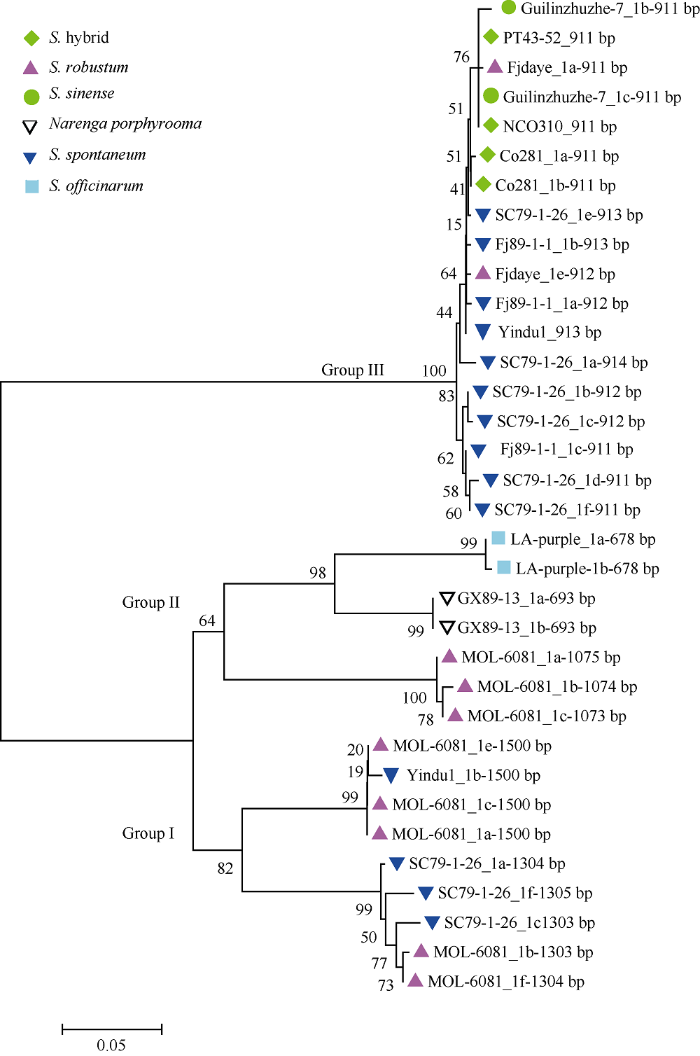 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3利用G1标记对不同甘蔗属种质扩增序列的系统进化树分析
Fig. 3Phylogenetic tree analysis of amplified sequences from Saccharum genus using G1 marker
2.4 G1标记候选基因编码蛋白WAK的鉴定和结构特征分析
将2.3中克隆得到的所有DNA片段都在NCBI上进行序列比对发现, 所有克隆片段基因都比对到高粱XM_002459982.2基因上, 通过高粱上的注释发现它是一种细胞壁的类受体激酶基因。同时, G1标记所在基因与拟南芥的RFO1基因属于直系同源基因[9], 表明本研究的G1标记的候选基因也可能是一类水平抗性基因, 不是种间特异性抗性基因。将高粱XM_002459982.2与Sobic.002G166150的蛋白序列进行比较发现, 两者相似性为96.8%, 前者蛋白序列的N端比后者仅多了30个氨基酸残基, 可能是由不同注释方法引起的差异。以高粱Sobic.002G166150的蛋白为种子序列, 进行本地BlastP比对甘蔗栽培品种(R570)单倍体蛋白组数据库, 得到3个相似度较高的蛋白序列Sh_208E10_ p000080 (相似度53%)、Sh_239A14_p000040 (相似度49.5%)和Sh_222N03_p000030 (相似度43.4%) (命名为ScWAK1、ScWAK2和ScWAK3)。通过Pfam软件分析发现, 3个蛋白都具有典型的植物细胞壁关联激酶结构特征, 包括细胞壁受体结构(GUB_ WAK_bind) 的胞外域、跨膜域和具有激酶活性的胞内域(图4)。再与拟南芥(WAK2, PRO25和RFO1)、水稻(OsDEES1)已鉴定的植物细胞壁关联激酶进行蛋白序列比对(图5)发现, Sh_239A14_ p000040蛋白在跨膜区的前端有EGF重复结构域, 在胞内域也具有典型的ATP结合基序和激酶活性位点。
图4
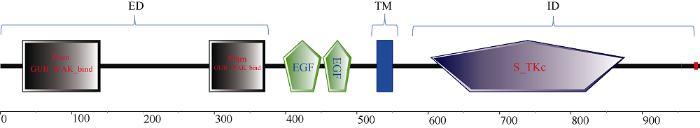 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4甘蔗ScWAK2蛋白结构域示意图
ED: 胞外域; TM: 跨膜域; ID: 胞内域。
Fig. 4Schematic diagram of the domain composition of ScWAK2 protein
ED: extracellular domain; TM: transmembrane region; ID: intracellular domain; EGF2: EGF2-like region; EGF-Ca: calcium-binding EGF-like domain.
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5拟南芥、水稻、高粱和甘蔗WAK蛋白的序列比对
EGF1: 表皮生长因子重复序列; EGF2: 钙结合类表皮生长因子结构域; TM: 跨膜域; ATP-B: ATP结合位点; KAS: 激酶活性位点。
Fig. 5Multiple sequences alignment of WAK protein from Arabidopsis, rice, sorghum, and sugarcane
EGF1: EGF1-like region; EGF2: calcium-binding EGF-like domain; TM: transmembrane region; ATP-B: ATP-binding region; KAS: kinase active site are underlined.
2.5 甘蔗G1标记候选蛋白与其他物种中已鉴定WAK蛋白的聚类分析
聚类分析结果表明, 3个甘蔗的WAK蛋白序列和高粱、水稻聚类为一组, 表明它们可能具有相似功能(图6)。而拟南芥的2个成员(WAK2和PRO25)为一组, 且二者是由串联重复事件产生。但水稻的OsWAK50和拟南芥的RFO1聚为一组, 表明二者可能起源于单双子叶分化之前, 序列相似性仅为32.2%。MEME软件的预测结果显示, 来自栽培品种R570的Sh_208E10_p000080、Sh_239A14_p000040和Sh_222N03_p000030蛋白和高粱、水稻的WAK蛋白一样具有10个基序, 除了OsDEES1蛋白少了C端的一个motif 5, 其余2组的4个WAK蛋白有9个完整的基序。根据Wang等[14]研究结果, 水稻中有4个OsDEES1的旁系同源基因, 都具有完整的C端, 表达谱分析表明, OsDEES1及旁系同源基因有不同的表达模式, 导致不同功能。综上分析, 本研究推测甘蔗栽培品种的3个ScWAK蛋白也可能与OsDEES1具有相似的功能。图6
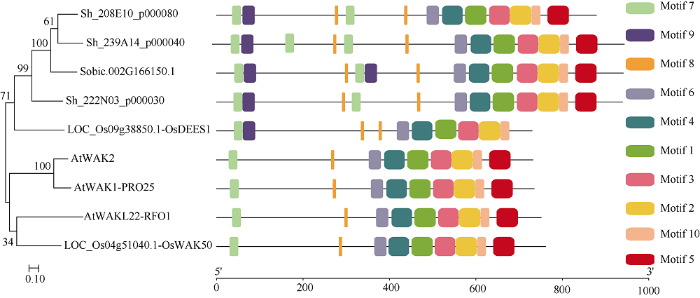 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6甘蔗与其他物种间WAK蛋白的系统进化分析和结构域预测
Fig. 6Phylogenetic analysis and motif prediction of WAK protein from sugarcane and other species
为了进一步了解WAK蛋白在物种间的进化关系, 从拟南芥的蛋白数据库得到了21个WAKL蛋白[12], 水稻中获得125个WAK/WAKL[17], 甘蔗栽培品种R570中得到了134个, 菠萝蛋白数据库中鉴定到20个, 高粱中鉴定了73个。通过生物信息分析发现, 在单双子叶物种中, WAK/WAKL基因数量存在显著差异, 且单子叶植物的WAK基因多于双子叶的拟南芥, 但缺少ρ全基因复制事件的菠萝WAK基因数目为20, 与拟南芥相差不大, 这表明WAK基因数量的扩增现象可能发生在ρ全基因组复制事件之后。
3 讨论
现代甘蔗栽培品种是热带种(S. officinarum L., 2n=80, x=10)和割手密种(S. spontaneum L., 2n=40~128, x=8)杂交产生的杂交种, 再与热带种进行回交产生杂种后代, 具有遗传背景高度杂合、多倍体和非整倍体性, 且染色体数目在100~130之间[18]。割手密种具有耐寒性、抗病性和再生能力强等优良特性, 经“高贵化”育种方法将甘蔗野生种质血缘引入甘蔗栽培品种[19]。甘蔗栽培品种中来源割手密种的染色体数目大约占10%~15%, 种间重组的染色体数目大约占5%~10%。甘蔗黄锈病是近年来发生在蔗区的一种新的甘蔗流行性病害, 感病甘蔗品种的产量损失严重, 培育抗病品种是防控该病害最有效的策略。甘蔗育种从花穗杂交到品种审定往往需要12年左右时间, 具有投入大、周期长等缺点。因此, 了解甘蔗育种亲本和其他野生或近缘属种质资源中抗黄锈病基因的分布状况, 不仅有利于筛选抗性亲本和科学组配杂交组合, 还能提高抗黄锈病分子育种的效率, 对于培育优良抗病品种、高效地防控甘蔗病害具有重要意义。Yang等[1]利用群体遗传学方法证实, 甘蔗黄锈病的抗性是由多个基因控制, 借助高密度遗传图谱, 定位到3个抗黄锈病基因位点(qORR109、qORR102和qORR4), 分别解释表型变异的58%、8%和12%, 其中前2个位点对抗病性具有正效应, 而后1个位点为负效应。此外, Yang等[1]还对应设计了96对SSR标记和61对基因特异性标记, 经反复测试, 开发了qORR109位点特异性高的G1标记, 该标记与黄锈病抗性存在显著的关联。根据候选基因编码的蛋白序列比对后发现, G1标记的候选基因编码的蛋白序列与高粱Sobic. 002G166150的蛋白序列相似度最高, 属于细胞壁关联激酶类, 推测G1的候选基因可能是一类水平抗性基因, 不是种间特异性抗性基因。本研究中, 利用G1标记对204个甘蔗栽培品种、野生种和近缘属种质的检测结果表明, 我国甘蔗栽培品种中抗性标记检出率为66.9%, 国外的甘蔗栽培品种检出率为67.4%。检出结果与Yang等[1]在F1分离群体中检测结果(检出率为65.8%)基本类似。我们推测, 黄锈病的抗性候选基因广泛分布于大多数甘蔗栽培品种中, 这可能是甘蔗黄锈病相对其他甘蔗病害发病面积相对较小的主要原因之一。但是, 端木卜文等[16]在180份甘蔗材料中检测到G1标记, 占比5.6%, 与我们的甘蔗栽培品种中占比66.9%相比, 结果相差较大。
野生种是现代甘蔗栽培品种中抗病基因的重要来源[20], 亟须对其进行抗病鉴定、筛选优良抗源并进一步挖掘抗病基因资源, 最终为抗病分子育种提供重要抗源材料。同时, 我们基于抗病诊断标记G1, 追踪甘蔗野生种质中其标记候选基因的起源和进化, 对深入分析甘蔗抗病遗传基础和选育优良抗病品种具有重要价值。本研究中, 对34份甘蔗野生种及近缘属材料进行抗黄锈病标记G1检测发现, 含有抗性标记的有17份(阳性率为50%), 其中28份甘蔗属材料中检测到抗性标记的有15份(阳性率为53.6%)、6份甘蔗近缘属中有2份材料(来自蔗茅属和河八王属)呈现阳性结果。表明G1标记的候选基因在甘蔗野生种和近缘属中都广泛分布, 其中割手密种质中抗性候选基因占最多, 这与前人研究中针对甘蔗种质资源中褐锈病的抗源分析结果基本一致[21]。
运用G1标记扩增抗性基因的单倍型进行聚类分析表明, 34个扩增基因片段按大小, 可分为4类, 其中678~693 bp扩增基因片段来源于热带种LA- purple和割手密种广西89-13, 而1073~1075 bp来源于大茎野生种Mol-6081, 三者都同属于聚类分析的第2组。911~914 bp扩增基因片段来源于割手密种四川79-1-26和福建大茎野生种、中国种和栽培品种, 都同属于聚类分析的第3组, 也进一步阐明甘蔗栽培品种中的抗性基因主要来源割手密种。1303~1305 bp扩增基因片段来源于割手密种四川79-1-26和大茎野生种Mol-6081, 而1500 bp扩增基因片段来源于大茎野生种Mol-6081, 且2种扩增片段类型亲缘关系较近, 都属于聚类分析的第1组。从甘蔗栽培品种G1标记的扩增结果来看(图1), 抗性基因片段主要有3种类型, 一种是G1标记的候选基因扩增片段为911 bp, 另外2种分别为大约1300 bp和1500 bp, 即使没有扩增911 bp候选基因片段, 也有1300 bp和1500 bp扩增片段。表明, 除了来源于割手密种的染色体外, 甘蔗栽培品种也具有来源于大茎野生种的染色体片段。热带种被认为是从大茎野生种家驯化而来, 不仅两者具有相同的起源中心(新几内亚)和染色体基数x=10 [22], 而且利用SSR分子标记技术对甘蔗属进行聚类分析的研究证实, 热带种与大茎野生种具有较近的亲缘关系[23], 本研究结果从侧面也证明了其结论的准确性。
Verica等[24]利用WAK1的蛋白序列对拟南芥和水稻数据库进行比对, 找到一类与WAK结构相似的WAK类似基因(WAK like genes, WAKLs), 除了少数基因缺少某些序列外(跨膜域和信号肽等), 大部分基因具有WAK的典型结构特征, 且水稻中WAKL基因的数量远多于拟南芥[17]。根据He等[25]研究结果, 在拟南芥1号染色30 kb内鉴定到了5个高度相似的WAK基因(依次WAK4、WAK5、WAK3、WAK1和WAK2), 同时, WAKL1-7基因间都是成簇排列, 表明WAK/WAKL基因家族都发生了多次串联复制事件。本研究中, 甘蔗栽培品种R570的基因组是基于高粱基因组组装而成的一套单倍体基因组, 仅有4660 BAC大片段序列, 鉴定了134个WAK/WAKL蛋白, 目前尚无法确定编码这些蛋白的基因复制类型。将甘蔗、高粱、水稻与拟南芥的WAK蛋白进行序列比对发现, 与拟南芥蛋白WAK相比, 来自C4作物高粱和甘蔗的WAK蛋白N端胞外域都具有额外的140氨基酸, 可能存在其他特殊的功能, 而C端的氨基酸数量与拟南芥、高粱的WAK蛋白的氨基酸基本一致, 但该结果与Wang等[14]报道的水稻OsDEES1分析结果不一致。需要特别注意的是, WAK蛋白在胞内激酶结构域相似性较高(69.1%), 表明该家族比较保守, 在细胞内可能传递或介导相似的信号通路; 但是胞外域同源性就很低, 大约27.3%~33.6%之间, 表明这类蛋白的胞外域结构变异大, 可以结合不同类型的配基, 来应答不同的环境信号, 分析结果与He等[25]报道相一致。
甘蔗褐锈病和黄锈病抗性都属于数量性状, 受多基因控制[1,21,26]。前人根据主效基因的定位结果, 分别建立了与甘蔗褐锈病和黄锈病抗性紧密连锁的分子标记(R12H16、9O20-F4和G1)及其检测方法[1,11]。研究表明, 褐锈病抗性标记检测与表型鉴定之间的关联分析准确性较低, 即表型鉴定为抗病的甘蔗植株其分子标记检测结果可能为阴性[26], 这些结果暗示除了Bru1外, 还有其他抗性基因的存在[20,26]。造成这些结果的原因是已经建立的甘蔗遗传图谱密度较低[1,11], 但数量性状抗性则由多个基因位点控制[1,21,26], 因此需要进一步增加遗传图谱密度, 找出所有控制抗性的基因位点, 并建立多个抗性位点的标记检测方法, 这种情况下分子标记检测与表型鉴定之间的关联分析才显得更有意义[26]。本研究中, 黄锈病抗性属于多基因控制, 仅进行单一分子标记检测与表型鉴定的关联验证, 意义和价值不大。进一步的研究, 需要在加密甘蔗遗传图谱的基础上, 获得控制甘蔗黄锈病抗性的所有基因位点并开发出系列标记, 进而将所有这些标记的检测结果与表型鉴定结果相互验证、相互映衬, 以获得真实可靠的甘蔗黄锈病抗性鉴定结果, 为甘蔗抗黄锈育种奠定良好的基础。
4 结论
本研究揭示了G1标记的候选基因广泛分布于甘蔗栽培品种、野生种和近缘属, 其中割手密种含有该基因比例最高。基于比较基因组学, 从甘蔗栽培品种R570蛋白数据库中鉴定到3个与候选抗黄锈病WAK基因编码蛋白相似度较高的蛋白, 蛋白结构特征和保守结构域分析表明, 该蛋白为一种细胞壁连接的类受体激酶。聚类分析揭示G1标记扩增的候选基因可分为3组, 第1组来源于割手密种和大茎野生种; 第2组来源于于大茎野生种、热带种和河八王属; 第3组来源于割手密种、大茎野生种和栽培品种, 推测甘蔗栽培品种的G1标记候选基因主要来源于割手密种。以上结果为甘蔗抗黄锈病基因的图位克隆及抗性溯源甚至抗性分子机制的解析积累了重要的理论和实践基础。附表 请见网络版: 1) 本刊网站
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URLPMID:29616061 [本文引用: 12]
In: Ricaud C, Egan B T, Gillaspie A G, Hughes C G, eds.
[本文引用: 1]
[本文引用: 2]
URLPMID:30786370 [本文引用: 1]
URLPMID:30743713 [本文引用: 1]
[本文引用: 3]
[本文引用: 3]
URLPMID:18757946 [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
URLPMID:17047910 [本文引用: 1]
DOI:10.1007/s00122-012-1875-xURLPMID:22572763 [本文引用: 3]

Modern sugarcane cultivars (Saccharum spp., 2n = 100-130) are high polyploid, aneuploid and of interspecific origin. A major gene (Bru1) conferring resistance to brown rust, caused by the fungus Puccinia melanocephala, has been identified in cultivar R570. We analyzed 380 modern cultivars and breeding materials covering the worldwide diversity with 22 molecular markers genetically linked to Bru1 in R570 within a 8.2 cM segment. Our results revealed a strong LD in the Bru1 region and strong associations between most of the markers and rust resistance. Two PCR markers, that flank the Bru1-bearing segment, were found completely associated with one another and only in resistant clones representing efficient molecular diagnostic for Bru1. On this basis, Bru1 was inferred in 86 % of the 194 resistant sugarcane accessions, revealing that it constitutes the main source of brown rust resistance in modern cultivars. Bru1 PCR diagnostic markers should be particularly useful to identify cultivars with potentially alternative sources of resistance to diversify the basis of brown rust resistance in breeding programs.
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
URLPMID:22885936 [本文引用: 3]
URLPMID:7433111 [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
URLPMID:15105442 [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
URLPMID:12068092 [本文引用: 1]
[本文引用: 2]
[本文引用: 5]
