 ,**, 李淮琳
,**, 李淮琳 ,**, 胡利民, 范楚川
,**, 胡利民, 范楚川 ,*, 周永明华中农业大学作物遗传改良国家重点实验室, 湖北武汉 430070
,*, 周永明华中农业大学作物遗传改良国家重点实验室, 湖北武汉 430070Genetic analysis and molecular characterization of multilocular trait in the srb mutant of Brassica rapa L.
YANG Yang ,**, LI Huai-Lin
,**, LI Huai-Lin ,**, HU Li-Min, FAN Chu-Chuan
,**, HU Li-Min, FAN Chu-Chuan ,*, ZHOU Yong-MingNational Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University, Wuhan 430070, Hubei, China
,*, ZHOU Yong-MingNational Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University, Wuhan 430070, Hubei, China通讯作者:
收稿日期:2020-06-5接受日期:2020-09-13网络出版日期:2021-03-12
| 基金资助: |
Received:2020-06-5Accepted:2020-09-13Online:2021-03-12
| Fund supported: |
作者简介 About authors
杨阳, E-mail:
李淮琳, E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (9823KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
杨阳, 李淮琳, 胡利民, 范楚川, 周永明. 白菜型油菜srb多室性状的遗传分析与分子鉴定[J]. 作物学报, 2021, 47(3): 385-393. doi:10.3724/SP.J.1006.2021.04123
YANG Yang, LI Huai-Lin, HU Li-Min, FAN Chu-Chuan, ZHOU Yong-Ming.
油菜是我国重要的油料作物, 其角果一般由两心皮的雌蕊发育而来, 角果内被假隔膜分为两室, 种子着生于其中, 外被两片壳状果瓣。在自然界中也发现了多室油菜突变体, 其角果由多心皮雌蕊发育而成, 角果内被假隔膜分为3~5室, 外被3~5片壳状果瓣。这种自发突变体资源十分稀少, 其中白菜型油菜(Brassica rapa, AA, 2n=20)中主要有印度的黄籽沙逊多室油菜[1]和中国西藏的桑日白油菜[2]等2种多室材料; 在芥菜型油菜(B. juncea, AABB, 2n=36)中有山西的三筒油菜、贵州的四轮油菜、青海的多室油菜和四川的四棱油菜等多室油菜[3]。已有研究表明, 多室油菜相对于两室油菜主要具有两大优良特性: (1)多室油菜具有较多的每角果粒数, 可显著提高单株产量, 在油菜的高产育种中具有应用潜力[4,5,6]; (2)多室角果的抗裂角性较强, 可用于抗裂角的研究和育种[7]。因此, 多室油菜作为一种新的种质资源, 阐明其形成的遗传和分子机理, 不仅可以丰富油菜花器官形态建成的理论, 也有助于油菜高产新品种的培育。
遗传研究表明, 白菜型油菜中的多室/两室相对性状受1对主效核基因的控制, 两室性状对多室性状表现为完全显性, 且无细胞质效应的影响[1-2,4]。通过图位克隆的方法, Fan等[8]发现, 拟南芥CLV3 (CLAVATA3)的同源基因调控黄籽沙逊ml4多室角果的形成; 转基因互补测验和体外多肽的处理试验证明, 该基因的1个单核苷酸突变(C/T)导致其CLE motif中第9位的脯氨酸突变成亮氨酸, 引起CLV3多肽活性的丧失, 最终导致了油菜多室角果的产生[8]。在芥菜型油菜中, 多室性状受1个隐性核基因[5]或2个独立遗传的隐性核基因[6,9]控制, 同样两室对多室表现为完全显性, 且无细胞质效应的影响。通过基因的精细定位, Xiao等[10]和Xu等[11]分别将拟南芥CLV3多肽信号的受体CLV1 (CLAVATA1)的同源基因作为芥菜型油菜A7染色体上的多室候选基因。Xiao等[12]进一步证实, BjuA07.CLV1基因编码区和启动子上的序列变异导致了芥菜型油菜多室的产生。在模式植物拟南芥中, CLV信号途径调控了茎顶端分生组织内干细胞的分裂与分化之间动态平衡; 当CLV3多肽信号或其受体发生突变时, CLV信号的传递就会受到影响, 从而导致顶端分生组织的干细胞数目增加、多心皮雌蕊和多室角果的产生[13,14]。鉴于CLV信号途径在植物多室性状形成中的重要作用, Yang等[15]利用基因编辑技术对甘蓝型油菜中的CLV3、CLV1和CLV2等同源基因进行了突变, 创建了具有稳定多室性状的突变体资源。由此表明, CLV信号途径在不同类型油菜的多室角果形成过程中具有功能保守性。
来自西藏的桑日白油菜(简称srb)是目前在我国发现的仅有的白菜型多室突变材料, 与黄籽沙逊多室油菜具有完全不同的来源; 该突变体的多室性状表现稳定, 且受1对隐性基因控制[2]。但至今仍然没有该材料中的多室基因精细定位和克隆的相关研究报道。因此, 本研究对srb突变体的遗传进行了分析, 并通过与ml4突变体的等位测验以及候选基因的验证, 发现了该材料中存在的一种新的BrCLV3基因等位突变导致了多室角果的产生。该研究为进一步深入解析BrCLV3基因参与油菜多室性状形成的分子机制提供了重要的材料。
1 材料与方法
1.1 试验材料及其种植
所用的白菜型油菜包括两室黄籽沙逊(野生型, 简称WT)、多室黄籽沙逊ml4以及来自西藏的多室srb。将srb分别与WT和ml4进行正反交得到F1, 然后自交产生F2分离群体, 用于srb多室性状的遗传分析。所有材料于2017年9月在华中农业大学油菜玻璃温室进行盆栽种植, 花盆直径25 cm, 每盆定苗4株, 参照正常方法管理温室, 翌年1月至2月份调查花器官数目和角果心皮数目变异。拟南芥突变体clv3-2和野生型Landsberg erecta (ler)购自美国Arabidopsis Biological Resource Center (ABRC)。在昼/夜16 h/8 h、22℃/18℃、光照强度115~144 μmol m-2 s-1的培养室内生长。1.2 BrCLV3等位基因的比较测序
在白菜型油菜中仅存在1个CLV3的同源拷贝, 即位于A4染色体上的BrCLV3 (Bra034340)。针对该基因的不同区域共设计了3对PCR引物进行扩增, 其中DXP118/DXP120扩增2260 bp的启动子区域, DXP117/DXP121扩增基因编码区, DXP125/DXP136扩增2541 bp的3°下游区。具体引物序列见表1。扩增产物连入pMD18-T载体上, 每个扩增片段挑选4~5个阳性克隆采用载体通用引物测序; 使用Sequencher 3.1.2软件比对分析测序结果。Table 1
表1
表1本研究中所用的引物序列
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) |
|---|---|
| 18S rRNA F | AGGCCCGGGTAATCTTTG |
| 18S rRNA R | TCAACGCGAGCTGATGAC |
| DXP109 | AAGGAGGTTTAAGGGATATGAGA |
| DXP113 | TTAATTAAGGAGGTTTAAGGGATATGAGA |
| DXP114 | GGCGCGCCTACAAAATGGATTCGAGGACTC |
| DXP117 | TTAATTAACACGGGATGTTTAGAACACGGGA |
| DXP118 | GTTGTTCTTTACTCTGGTAATGAGATAGGA |
| DXP120 | TGTGACGCTTTAGGTAGTAGGCAG |
| DXP121 | TACCAACGTCTTCATCGCCCAACT |
| DXP125 | GCAAAGTGGTGACGTGAGCGAAAT |
| DXP129 | GGGAGGAGCAAATGGAATTGAAG |
| DXP136 | CCATGGATCTATTTAGGTACCCCAT |
| DXP246 | AGGACCTGACCCTTTGCTCG |
| DXP247 | CAGGACCTGACCCTTTGCATC |
| DXP248 | AGGCTGCGAATTGTTGAATTTTT |
新窗口打开|下载CSV
1.3 SNP分子标记开发与基因型分析
利用SNAPER程序[15], 针对Brclv3Asp12中的C/G单核苷酸变异开发特异性的SNP标记, 其中引物对DXP246/249和DXP248/DXP249分别特异性扩增Brclv3Asp12和BrCLV3等位基因。扩增产物通过1%的琼脂糖凝胶电泳进行检测。引物序列见表1。SNP标记的PCR扩增体系含50 ng μL-1的模板DNA 2.0 μL、10×PCR buffer 1.0 μL、2 mmol L-1 dNTPs 0.8 μL、10 μmol L-1引物各0.15 μL、2 U μL-1Taq DNA聚合酶0.15 μL, 添加ddH2O至10 μL。PCR扩增程序为94℃预变性4 min; 94℃变性30 s, 59℃退火30 s, 72℃延伸30 s, 扩增34个循环; 最后72℃延伸10 min。1.4 Brclv3Asp12的超量表达载体构建与遗传转化
设计分别带有Pac I和Asc I酶切接头的引物对DXP113/DXP114, 从srb突变体的cDNA中克隆Brclv3Asp12等位基因, 通过酶切连接方法连入pMDC83质粒载体的35S启动子后面, 获得35S::Brclv3ASP12超量表达载体。引物序列见表1。载体质粒转化农杆菌菌株GV3101后通过蘸花法转化拟南芥clv3-2突变体。收获的种子播种到含有潮霉素抗性的0.5×MS培养基上筛选转基因阳性植株。1.5 石蜡切片的制作与显微观察
选取花蕾进行石蜡切片的制作, 具体操作程序见Fan等[8]的方法。采用Nikon eclipse 80i显微镜(日本)观察切片并照相。1.6 多肽的合成与体外处理
分别合成野生型多肽BrCLV3 (RTVPSGPD PLHH)和突变型多肽Brclv3ASP12 (RTVPSGPDPLHD), 纯度 > 95% (金斯瑞, 中国南京)。用超纯水溶解成1 mmol L-1母液后过滤消毒, 保存于-20℃冰箱中备用。将表面消毒的拟南芥种子在添加多肽的液体和固体培养基上培养, 分别观察多肽对茎顶端分生组织(shoot apical meristem, SAM)和主根生长的影响。具体操作程序见Fan等[8]的方法。每种处理至少设置3次生物学重复。1.7 RNA抽提和基因表达分析
抽提拟南芥生长20 d的叶片RNA进行RT-PCR的基因表达量检测。RNA抽提、反转录和RT-PCR等程序详见Fan等[8]的方法。BrCLV3和内参基因18S rRNA的表达检测引物对分别为DXP109/DXP129和18S rRNA F/R, 序列详见表1。2 结果与分析
2.1 多室白菜型油菜srb的角果形态分析
对多室白菜型油菜srb的花器官和角果变异进行观察和分析发现, 其花器官数目变异与多室黄籽沙逊ml4类似, 即: 花萼和花瓣等花器官数目正常; 雄蕊数目基本正常, 但在极少数花中可以观察到7个(图1-a~j); 雌蕊相对于WT明显增粗。srb的角果多室性状遗传稳定, 单株多室角果比例94.7%~100.0%, 平均为97.9%, 每角果具有3~4个心皮(平均3.5个心皮)。多室角果平均长、宽和厚分别为37.0、6.4和3.8 mm; 较两室角果显得短而粗。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1多室白菜型油菜的花器官和角果表型观察
a~b、c~f、g~j分别代表WT、多室ml4和srb的花器官数目比较; k~l、m~p、q~v分别代表WT、ml4和srb的角果及其横切面显示心皮数目变异; 横切石蜡切片显示在花发育第9~11时期的WT (两心皮, w)、ml4 (3~4心皮, x~y)和srb (2~4心皮, w~y)的雌蕊心皮变异; lc: locule; O: ovule; M: medial region; L: lateral region; 标尺为2 mm (k, m, o, q, s, u)、0.5 mm (l, o, p, r, t, v)和100 μm (w~y)。
Fig. 1Phenotypic observation of floral and silique morphology of mutilocular B. rapa
a-b, c-f, g-j respesent the number of floral organs in WT, ml4 and srb, respectively; k-l, m-p, q-v respesent siliques with different carpel numbers in WT, ml4 and srb, respectively; cross-sections of gynoecia of WT (two carpels, w), ml4 (3-4 carpels, x and y) and srb (2-4 carpels, w to y) at stage 9-11; lc: locule; O: ovule; M: medial region; L: lateral region. Bar = 2 mm (k, m, o, q, s, u), 0.5 mm (l, o, p, r, t, v), and 100 μm (w-y).
对子房进行石蜡切片观察, WT材料的子房为两室, 是由2个心皮相对发育成一个完整的假隔膜, 将心皮分割成2个腔室, 假隔膜两侧分别着生1列种子; srb的三室子房则由3个心皮向中间发育形成“Y”字型假隔膜, 将角果分割成3个腔室, 假隔膜上着生3列种子, 果皮分为3瓣(图1-x); 在srb和ml4的四心皮子房内, 2个近乎平行排列的假隔膜将子房内腔分隔成3个腔室, 中间的腔室比两侧的腔室大, 中间的腔室着生2排胚珠, 而两侧的腔室各着生1排胚珠, 其假隔膜的横切面呈“II”型(图1-y)。
2.2 白菜型油菜srb多室性状的遗传分析
为确定srb中多室性状的遗传规律, 将其与两室白菜型油菜WT进行正反交, F1单株全部表现为两室, 表明srb中的多室性状由隐性核基因控制, 且无细胞质效应(表2)。在F2分离群体中, 两室表型单株(78株)与多室表型单株(23株)符合3∶1的分离比(χ2=0.27, P>0.05)。表明srb中的多室性状受1对隐性核基因控制。Table 2
表2
表2亲本和F1材料的多室角果比例
Table 2
| 材料 Material | 范围 Range (%) | 均值±标准差 Mean±SD (%) |
|---|---|---|
| ml4 mutant | 79.6-100.0 | 97.90±5.10 |
| srb mutant | 96.0-100.0 | 96.40±0.03 |
| WT | 0 | — |
| ml4*srb F1 | 100.0 | — |
| srb*ml4 F1 | 100.0 | — |
| WT*srb F1 | 0 | — |
| srb*WT F1 | 0 | — |
新窗口打开|下载CSV
为确定srb中的多室基因是否与我们前期克隆的多室基因Brclv3相同, 进一步将srb与ml4进行等位测验发现, 它们的正反交F1和F2分离群体的所有单株全部表现为多室(表2)。表明srb中的多室基因与ml4中的多室基因等位, 因此它们的多室性状可能均由BrCLV3基因的突变所导致。
2.3 白菜型油菜srb中多室候选基因BrCLV3的克隆与序列分析
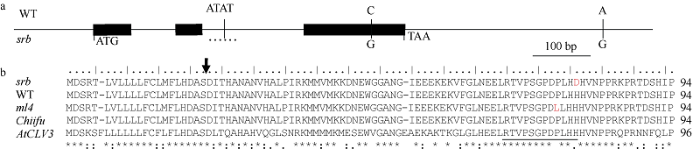
我们对srb中的BrCLV3等位基因的编码区、2.3 kb的启动子区和2.5 kb的3°端侧翼序列进行比较测序。与WT中的BrCLV3序列比对分析, 共发现3处碱基序列变异(图2-a)。其中, 位于3°端的SNP差异和第2个内含子中ATAT插入/缺失差异都不会引起该基因蛋白序列的改变, 而位于第3个外显子中的C/G单核苷酸突变可导致编码蛋白的1个氨基酸替换。进一步比较ml4、srb和Chiifu-401 (已发表基因组序列的白菜, 两室表型)之间的氨基酸序列差异发现, 该突变氨基酸位于CLE motif的第12位, 由组氨酸突变成天冬氨酸, 将其命名为Brclv3Asp12; 它与前期在ml4中发现的CLE motif上的碱基变异不同, 因此Brclv3Asp12是一个新的等位突变, 可引起CLV3多肽信号的序列突变(图2-b)。在拟南芥中, CLE motif是CLV3多肽信号分子的重要功能域, 由12个保守的氨基酸组成, 其中第12位组氨酸对于维持茎顶端分生组织的大小至关重要[16,17]。因此, 本研究新发现的第12位His-to-Asp氨基酸替换可能影响BrCLV3基因的正常功能发挥, 从而影响角果的正常发育。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2BrCLV3基因结构和氨基酸序列比对
a: BrCLV3基因结构以及突变体srb与野生型材料间的碱基变异; 黑色方框表示编码区; 序列比较可以发现srb与野生型间存在2个单核苷酸突变和1个ATAT的插入/缺失突变。b: 白菜型油菜及拟南芥中CLV3同源基因的氨基酸序列比对; 箭头为CLV3信号肽序列剪切位点, 下划线为C端保守结构域CLE motif, 红色标识突变的氨基酸。
Fig. 2BrCLV3 gene structure and amino acid sequences alignment
a: BrCLV3 gene structure and natural variations between the alleles from WT and srb; black boxes represents the coding regions; there are two single nucleotide substitutions and one ATAT insertion/deletion in BrCLV3 gene regions between WT and srb. b: alignment of the amino acid sequences of CLV3 from B. rapa (srb, WT, ml4, Chiifu-401, and Arabidopsis); the putative signal sequence cleavage site is indicated by arrow, the conserved domain (CLE motif) at its C-terminus is underlined, and the amino acid changes in srb and ml4 are highlighted by the red highlighted font.
2.4 Brclv3Asp12等位基因特异的SNP标记在分离群体中的表型共分离验证
针对Brclv3Asp12中的C/G单核苷酸变异开发了特异性的SNP标记, 并对srb × WT杂交产生的F2分离群体进行了BrCLV3基因型的鉴定。结果表明, BrCLV3纯合基因型(AA)单株都为两室角果表型, Brclv3Asp12纯合基因型单株(aa)都为多室角果表型, 杂合基因型单株(Aa)表现为两室或近乎两室角果表型(图3); 3种基因型单株的比例(AA∶Aa∶aa)符合1∶2∶1的分离比(χ2=0.80, P>0.05)。该结果证实Brclv3Asp12中的C/G变异与多室表型共分离, 表明该SNP变异可能是引起srb中多室角果产生的原因。图3
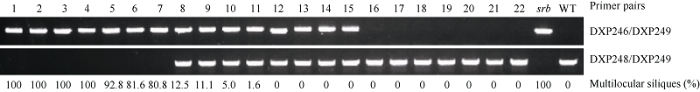 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3利用Brclv3Asp12等位基因特异性SNP标记对srb*WT的F2群体进行基因型和多室表型的共分离检测
Fig. 3Co-segregation analysis of genotype and multilocular phenotype in srb*WT F2 population by Brclv3Asp12 allele-specific SNP marker
2.5 白菜型油菜srb多室候选基因的转基因功能互补验证
构建Brclv3Asp12等位基因的超量表达载体并转化拟南芥clv3-2突变体。获得的大部分转基因株系仍都表现为clv3-2的突变表型, 包括茎扁平、花序茎顶端分生组织显著增大和角果全部为多室等(图4-i~n)。本研究也发现, 5个独立的转化家系都能够部分恢复clv3-2突变体的表型, 包括部分角果表现为两室(图4-c, d)和较为正常的花序顶端分生组织(图4-o, p); 未发现能够完全恢复clv3-2突变表型的转基因植株。在这些部分恢复的转基因家系中BrCLV3基因表达量较clv3-2都显著增加(图4-s)。统计分析表明, 它们的心皮数都较clv3-2显著减少, 但是都未能恢复到野生型的水平(图4-t)。表明Brclv3Asp12等位基因与已报道的BrCLV3功能类似, 仍然具有参与茎顶端分生组织大小及多室角果发育调控的作用, 只是功能有所减弱。因此Brclv3Asp12中的组氨基酸/天冬氨酸突变可以引起BrCLV3等位基因的部分功能丧失, 从而导致多室角果的产生。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4转化35S::Brclv3Asp12可以部分恢复拟南芥clv3-2多室突变表型
野生型拟南芥ler为两室角果(a, b)和正常花序(q, r), clv3-2突变体的角果主要为5~6室(i~l)和异常增大的花序顶端分生组织(m, n), 35S::Brclv3Asp12转化clv3-2突变体产生了部分表型恢复单株, 其角果为2~6室(c~l)和较为正常花序(o, p)。部分恢复转基因家系中BrCLV3转录水平的RT-PCR检测(s)以及单株角果心皮数统计分析(t)。小写字母表示在0.05水平下差异显著。标尺为0.5 mm。
Fig. 4Phenotypes of 35S::Brclv3Asp12 transgenic plants in the clv3-2 background
The phenotypes of bilocular siliques (a, b) and normal inflorescence (q, r) in ler, multilocular siliques with 5-6 locular (i-l) and enlarged inflorescence (m, n) in clv3-2, and 35S::Brclv3Asp12 transgenic plants with partly rescue phenotypes, including 2-6 carpels (c-l) and normal inflorescence (o, p). Gene expression (s) and phenotype analysis of carpel numbers per plant (t) in five independent 35S::Brclv3Asp12 transgenic lines, which showed partially rescued phenotypes; the data and error bars represent the mean ± SD (n ≥ 15 plants for each line). Bars superscripted by lowercase letters indicate significant differences at the 0.05 probability level. Bar = 0.5 mm.
2.6 白菜型油菜srb中多室候选基因的体外多肽处理验证
为了进一步明确srb中Brclv3Asp12等位基因变异对其产物的活性影响, 本研究针对CLE motif序列合成了野生型多肽BrCLV3和突变型多肽Brclv3Asp12, 并对拟南芥clv3-2突变体和野生型Ler进行了体外处理。在液体培养条件下, 对拟南芥幼苗的SAM大小进行了测量。经野生型多肽BrCLV3处理后, 拟南芥clv3-2突变体的SAM面积显著减小(图5-b, d, e), 与野生型Ler对照在未处理时的SAM面积无显著差异(图5-a, d, e); 表明BrCLV3多肽具有抑制茎顶端分生组织生长的活性, 通过添加外源BrCLV3多肽可以将clv3-2突变体中增大的SAM恢复到野生型的状态。在Brclv3Asp12多肽处理条件下, clv3-2突变体的SAM面积也显著减小, 但仍极显著大于BrCLV3多肽处理下的clv3-2突变体以及未处理的野生型Ler (图5-a~e); 表明Brclv3Asp12中的组氨基酸/天冬氨酸突变可以引起CLV3多肽活性的部分丧失, 使其不能正常调控茎顶端分生组织的生长。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5不同多肽处理对拟南芥SAM大小的影响
1: 未添加多肽(a, b)、添加1 μmol L-1 Brclv3Asp12多肽(c)和1 μmol L-1 BrCLV3多肽(d)处理下的野生型ler (a)和突变体clv3-2 (b, c, d)生长9 d的SAM观察; SAM相对大小是通过测量SAM侧平面上2个对生叶原基(箭头指示处)以上的面积; 标尺为50 μm。2: 不同多肽处理9 d后拟南芥SAM大小比较(e), 每种处理至少统计20个单株; 大写字母表示0.01水平下差异显著。
Fig. 5Effects of different peptides on the SAMs in Arabidopsis
1: ler (a) and clv3-2 (b, c, d) plants were grown on 1/2 MS liquid media (a, b) containing 1 μmol L-1 Brclv3Asp12 peptide (c) and 1 μmol L-1 BrCLV3 peptide (d), and 9-day-old Arabidopsis seedlings were observed; the area of the SAM was measured on a median plane by calculating the area above the straight line from the upper edges of two opposite leaf primordia (arrowheads); Bar = 50 μm. 2: area of the SAM after different peptide treatments for nine days (e), the data and error bars represent the mean ± SD (n ≥ 20 plants for each line). Bars superscripted by lowercase letters indicate significant differences at the 0.01 probability level.
前期研究表明, 野生型多肽BrCLV3也能显著抑制根系生长[8]。因此, 我们在固体培养基上检测了不同多肽处理浓度条件对拟南芥的根长及根顶端分生组织(root apical meristem, RAM)生长的影响。在1 nmol L-1 BrCLV3多肽或Brclv3Asp12多肽处理条件下, 拟南芥的主根长或RAM大小相对于未添加多肽的对照处理无显著差异(图6-a~c, h~j, o, p)。在10 nmol L-1多肽处理条件下, Brclv3Asp12多肽处理条件下的拟南芥主根长或RAM大小与未添加多肽的对照处理间无显著差异(图6-a, d, h, k, q, r); 但是BrCLV3多肽处理会显著抑制拟南芥主根或RAM生长(图6-a, e, h, l, q, r)。在100 nmol L-1多肽处理条件下, BrCLV3和Brclv3Asp12多肽处理均会极显著抑制拟南芥主根或RAM生长(图6-f, g, m, n, s, t)。该结果进一步证实srb中的Brclv3Asp12具有较低的多肽活性。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6不同多肽处理对野生型拟南芥主根和RAM的影响
未添加多肽(a, h)和分别添加1 nmol L-1 (b, c, i, j, o, r)、10 nmol L-1 (d, e, k, l, p, s)、100 nmol L-1 (f, g, m, n, q, t)浓度的突变型多肽Brclv3Asp12 (b, d, f, i, k, m)和野生型多肽Brclv3 (c, e, g, j, l, n)处理8 d对拟南芥ler的主根生长的抑制作用。每种处理至少统计26个单株, **表示0.01水平下差异显著。a~g中标尺为1 cm, h~n为100 μm。黑色箭头指示根分生组织和伸长区的边界。
Fig. 6Effects of different peptides on the root and RAM in Arabidopsis
Arabidopsis seedlings of 8-day-old were grown on agar media without (a, h) or with 1 nmol L-1 (b, c, i, j, o, r), 10 nmol L-1 (d, e, k, l, p, s), 100 nmol L-1 (f, g, m, n, q, t) of the BrCLV3Asp12 (b, d, f, i, k, m) or Brclv3 (c, e, g, j, l, n) peptides, respectively. The data and error bars represent the mean ± SD (n ≥ 26 plants for each line). ** indicates significant difference at the 0.01 probability level. Bar = 1 cm (a-g). Bar=100 μm (h-n). The black arrows indicate the border between the root meristematic and elongation zones.
3 讨论
很多研究已经证明白菜型油菜的多室性状受1对隐性核基因控制[1-2,4]。在前期研究中, 我们首次成功图位克隆了白菜型黄籽沙逊ml4中的多室基因; 发现Brclv3基因第3个外显子中的1个单核苷酸突变(C/T)导致其CLE motif中第9位的脯氨酸的突变, 从而导致其产生多室表型[8]。在本研究中, 遗传分析发现, srb中的多室性状同样受1对隐性核基因控制, 这与前人的结果一致[2]; 进一步的等位测验发现, srb中的多室基因与ml4中的相同(表2)。比较测序分析发现, srb的CLE motif中存在一种新的单核苷酸突变(C/G), 可导致该保守结构域的第12位组氨酸突变为天冬氨酸(图2)。进一步通过拟南芥中的遗传转化试验和体外多肽处理试验证实, 该单核苷酸突变可以引起BrCLV3基因功能的部分丧失, 并引起多室角果的产生(图4~图6)。大量研究表明, 拟南芥CLV3基因编码的蛋白经过对CLE motif的剪切和修饰, 最终形成包含12~13个氨基酸的多肽信号来行使其所有功能[19,20]。已有的研究表明, CLE motif中每一位氨基酸对CLV3多肽功能的重要性有所不同。为了评估它们的贡献大小, Kondo等[17]通过氨基酸替换和体外多肽处理相结合的方法进行研究发现, R1、P9、H11和H12依次是影响CLV3功能最重要的4个氨基酸, 而T2、S5、P7和L10等4个氨基酸的重要性最低。通过体外CLV3多肽信号与其受体进行竞争性结合的试验表明, R1、H12、G6、P4和V3等5个氨基酸是影响CLV3信号与CLV1胞外受体结合最重要的氨基酸[17]。为了在植物体内更为准确地评价每个氨基酸的作用大小, Song等[18]对CLV3多肽进行丙氨酸的替换和拟南芥clv3-2突变体互补转化试验发现, 在CLV3调控SAM稳态过程中, D8、H11、G6、P4、R1和P9等6位氨基酸的作用最为重要, 其次为H12和L10, 而T2、V3、S5和P7等氨基酸的作用并不重要。在这些研究中, P9对CLV3多肽都表现出重要的贡献。因此, 当白菜型油菜BrCLV3基因中的第9位脯氨酸发生自然突变时, 会导致该基因功能的丧失, 并引起多室角果的产生[8]。H12对CLV3多肽的功能也十分重要, 但重要性相对P9较弱[17,18]。因此, 不难理解在本研究中新发现的Brclv3Asp12等位突变仅能引起CLV3多肽活性的部分丧失(图4~图6)。由于H12是参与CLV3多肽信号与其受体结合的重要氨基酸[17], 我们推测srb中BrCLV3基因脯氨酸到天冬氨酸的突变可能主要通过减弱CLV3多肽信号与受体结合的能力而降低了其活性。该结论还需要进一步的研究证据去证实。
4 结论
来自我国西藏的白菜型油菜srb具有稳定的多室角果表型, 该性状受1对隐性核基因控制, 且与黄籽沙逊ml4中的多室基因等位。比较测序分析发现, srb中BrCLV3基因的CLE motif中存在一种新的单核苷酸突变, 可导致该保守结构域的第12位组氨酸突变为天冬氨酸。针对该SNP开发的Brclv3Asp12等位基因特异标记在分离群体中与多室表型共分离表明, 该SNP变异可能是引起srb油菜产生多室角果的原因。通过转基因互补测验和体外多肽的处理试验都证明, Brclv3Asp12等位突变可以导致CLV3多肽活性的减弱。因此, 本研究推测H12是参与白菜型油菜中CLV3多肽信号与其受体结合的重要氨基酸。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 3]
[本文引用: 5]
[本文引用: 5]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 8]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/s41598-018-23636-4URLPMID:29593311 [本文引用: 1]

Multilocular trait has recently attracted considerable attention for its potential to increase yield. Our previous studies indicated that two genes (Bjln1 and Bjln2) are responsible for multilocular siliques in Brassica juncea and the Bjln1 gene has been delimited to a 208-kb region. In present study, the Bjln1 gene was successfully isolated using the map-based cloning method. Complementation test indicated that the BjuA07.CLV1 (equivalent to BjLn1) could rescue the multilocular phenotype and generate bilocular siliques. Two amino acids changes at positions 28 and 63 in BjuA07.clv1 as well as a 702-bp deletion in its promoter have been proved to affect the carpel numbers. Microscopic analyses suggested that BjuA07.CLV1 is involved in the maintenance of shoot and floral meristem size. The expression level of BjuA07.clv1 was significantly reduced in the SAM. Furthermore, WUS, CLV2, CLV3, RPK2 and POL, key genes in the CLV/WUS signal pathway, showed lower expression level in the multilocular plants. These data suggest that the mutations in the CDS and promoter of BjuA07.clv1 reduced its function and expression level, which disturbed CLV/WUS signal pathway, thereby leading to the enlargement of the shoot and floral meristem and resulting in the multilocular siliques.
[本文引用: 1]
URLPMID:10761929 [本文引用: 1]
DOI:10.1111/pbi.12872URLPMID:29250878 [本文引用: 2]

Multilocular silique is a desirable agricultural trait with great potential for the development of high-yield varieties of Brassica. To date, no spontaneous or induced multilocular mutants have been reported in Brassica napus, which likely reflects its allotetraploid nature and the extremely low probability of the simultaneous random mutagenesis of multiple gene copies with functional redundancy. Here, we present evidence for the efficient knockout of rapeseed homologues of CLAVATA3 (CLV3) for a secreted peptide and its related receptors CLV1 and CLV2 in the CLV signalling pathway using the CRISPR/Cas9 system and achieved stable transmission of the mutations across three generations. Each BnCLV gene has two copies located in two subgenomes. The multilocular phenotype can be recovered only in knockout mutations of both copies of each BnCLV gene, illustrating that the simultaneous alteration of multiple gene copies by CRISPR/Cas9 mutagenesis has great potential in generating agronomically important mutations in rapeseed. The mutagenesis efficiency varied widely from 0% to 48.65% in T0 with different single-guide RNAs (sgRNAs), indicating that the appropriate selection of the sgRNA is important for effectively generating indels in rapeseed. The double mutation of BnCLV3 produced more leaves and multilocular siliques with a significantly higher number of seeds per silique and a higher seed weight than the wild-type and single mutant plants, potentially contributing to increased seed production. We also assessed the efficiency of the horizontal transfer of Cas9/gRNA cassettes by pollination. Our findings reveal the potential for plant breeding strategies to improve yield traits in currently cultivated rapeseed varieties.
DOI:10.1104/pp.124.4.1483URLPMID:11115864 [本文引用: 1]

We developed a modified allele-specific PCR procedure for assaying single nucleotide polymorphisms (SNPs) and used the procedure (called SNAP for single-nucleotide amplified polymorphisms) to generate 62 Arabidopsis mapping markers. SNAP primers contain a single base pair mismatch within three nucleotides from the 3' end of one allele (the specific allele) and in addition have a 3' mismatch with the nonspecific allele. A computer program called SNAPER was used to facilitate the design of primers that generate at least a 1,000-fold difference in the quantity of the amplification products from the specific and nonspecific SNP alleles. Because SNAP markers can be readily assayed by electrophoresis on standard agarose gels and because a public database of over 25,000 SNPs is available between the Arabidopsis Columbia and Landsberg erecta ecotypes, the SNAP method greatly facilitates the map-based cloning of Arabidopsis genes defined by a mutant phenotype.
DOI:10.1016/j.bbrc.2008.09.139URL [本文引用: 5]
DOI:10.1093/mp/ssr120URL [本文引用: 2]

As a peptide hormone, CLV3 restricts the stem cell number in shoot apical meristem (SAM) by interacting with CLV1/CLV2/CRN/RPK2 receptor complexes. To elucidate how the function of the CLV3 peptide in SAM maintenance is established at the amino acid (AA) level, alanine substitutions were performed by introducing point mutations to individual residues in the peptide-coding region of CLV3 and its flanking sequences. Constructs carrying such substitutions, expressed under the control of CLV3 regulatory elements, were transformed to the clv3-2 null mutant to evaluate their efficiencies in complementing its defects in SAMs in vivo. These studies showed that aspartate-8, histidine-11, glycine-6, proline-4, arginine-1, and proline-9, arranged in an order of importance, were critical, while threonine-2, valine-3, serine-5, and the previously assigned hydroxylation and arabinosylation residue proline-7 were trivial for the endogenous CLV3 function in SAM maintenance. In contrast, substitutions of flanking residues did not impose much damage on CLV3. Complementation of different alanine-substituted constructs was confirmed by measurements of the sizes of SAMs and the WUS expression levels in transgenic plants. These studies established a complete contribution map of individual residues in the peptide-coding region of CLV3 for its function in SAM, which may help to understand peptide hormones in general.
URLPMID:16751438 [本文引用: 1]
URLPMID:16902141 [本文引用: 1]
