 ,2,*, 惠乾龙1, 方振名2, 李姗姗2, 凌辉2, 阙友雄1, 袁照年
,2,*, 惠乾龙1, 方振名2, 李姗姗2, 凌辉2, 阙友雄1, 袁照年 ,1,*
,1,*Identification, localization and expression analysis of beta-carotene isomerase gene family in sugarcane
HUANG Ning ,2,*, HUI Qian-Long1, FANG Zhen-Ming2, LI Shan-Shan2, LING Hui2, QUE You-Xiong1, YUAN Zhao-Nian
,2,*, HUI Qian-Long1, FANG Zhen-Ming2, LI Shan-Shan2, LING Hui2, QUE You-Xiong1, YUAN Zhao-Nian ,1,*
,1,*通讯作者:
收稿日期:2020-06-15接受日期:2020-09-13网络出版日期:2021-05-12
| 基金资助: |
Received:2020-06-15Accepted:2020-09-13Online:2021-05-12
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (7465KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
黄宁, 惠乾龙, 方振名, 李姗姗, 凌辉, 阙友雄, 袁照年. 甘蔗β-胡萝卜素异构酶基因家族的鉴定、定位和表达分析[J]. 作物学报, 2021, 47(5): 882-893. doi:10.3724/SP.J.1006.2021.04128
HUANG Ning, HUI Qian-Long, FANG Zhen-Ming, LI Shan-Shan, LING Hui, QUE You-Xiong, YUAN Zhao-Nian.
分蘖或分枝是水稻、小麦、大麦和甘蔗等禾本科植物生长发育过程中普遍存在的一种发育生物学现象[1,2], 也是一种影响作物产量的重要农艺性状, 通常受植物激素[3,4]、生物胁迫[5,6]及非生物胁迫调控[7,8]。甘蔗是热带和亚热带地区重要的糖料作物, 蔗茎是糖分储藏和收获的重要部位, 获得更多有效分蘖茎, 能够提高甘蔗产量[9]。甘蔗有效分蘖茎是由主茎地下基部未伸长节间的侧芽发育而来的成熟个体[2]。当受黑穗病菌侵染后, 甘蔗分蘖增多、蔗茎变细, 蔗梢长出黑鞭, 引起其有效茎数及蔗茎中蔗糖含量严重下降, 最终导致甘蔗产量降低和品质变劣[10]。
1966年, Cook等[11]首次从棉花根系中分离得到一类萜类小分子化合物—独脚金内酯(strigolactones, SLs), 能够抑制植物分蘖或分枝[12,13], 调控植物对各种生物和非生物胁迫的响应[14]。β-胡萝卜素异构酶(D27)可以产生独脚金内酯前体或中间产物, 调控独脚金内酯生物合成[15]。据报道, 水稻[16]和拟南芥[15]中D27基因突变体均表现为分枝增多。小麦TaD27基因沉默突变体植株分蘖数增多, 而过表达小麦TaD27突变体植株分蘖数减少[17]。
迄今, 关于甘蔗D27基因, 只有1篇基因克隆及其组织特异性和非生物胁迫下表达模式的报道[18], 尚未见该基因家族鉴定在甘蔗中的研究报道。本研究首先在甘蔗原始亲本割手密种基因组中鉴定D27基因家族, 并进行生物信息学分析; 其后, 基于植物生长调节剂处理相关和受黑穗病菌侵染相关甘蔗栽培种转录组数据, 对甘蔗栽培种中与割手密种D27基因家族同源基因的表达模式进行分析; 最后, 筛选并克隆出1个同时参与分蘖和响应黑穗病菌胁迫的甘蔗栽培种D27基因, 并对该基因进行生物信息学分析, 多种胁迫下的表达定量和亚细胞定位分析。研究旨在为解析D27在甘蔗分蘖过程及与黑穗病菌互作过程中的作用提供理论依据。
1 材料与方法
1.1 甘蔗割手密种D27基因家族鉴定
Waters等[15]发现, 在91个真核生物D27蛋白序列中, 均包含1个功能未知的保守结构域DUF4033, 使用NCBI中的conserved domains工具检索发现包含该结构域的蛋白, 通过将反式-β-胡萝卜素异构成 9-顺式-β-胡萝卜素, 参与SL的生物合成, 可使用DUF4033检索D27蛋白家族。以甘蔗原始亲本割手密种基因组的基因序列、蛋白序列及染色体位置信息为基础, 结合甘蔗栽培种转录组序列, 构建甘蔗基因家族鉴定模型。通过在线数据库(1.2 甘蔗割手密种D27基因家族的生物信息学分析
1.2.1 系统进化树构建及结构域分析 使用interpro在线软件(1.2.2 顺式元件预测 基于甘蔗割手密种基因组染色体位置信息, 使用TBtools软件[20]中的Gtf/Gff3序列提取(Gtf/Gff3 sequences Extract)工具, 提取甘蔗割手密种D27基因家族成员CDS上游2000 bp的启动子序列, 将提取到的序列提交至PlantCare (
1.3 甘蔗栽培种ScD27.1基因的筛选与克隆
1.3.1 植物材料及处理 参考Ling等[22]的方法培养甘蔗主要栽培品种ROC22组培苗, 分别使用ABA (100 μmol L-1)、MeJA (100 μmol L-1)、SA (5 mmol L-1)和H2O2 (500 mmol L-1) 水溶液处理长势一致的组培苗, 并于0 h和6 h取整株组培苗作为样品, 保存于-80°C。1.3.2 总RNA提取和cDNA合成 采用TRIzol法提取甘蔗总RNA后, 使用DNaseI对RNA样品进行处理, 同时使用 PrimeScript RT-PCR Kit (Perfect for Real Time)合成cDNA。
1.3.3 差异表达ScD27.1基因筛选 项目组前期研究发现, 甘蔗受6-BA (6-benzylaminopurine, 2 mg L-1)和DA-6 (Diethylaminoethylhexanoate, 10 mg L-1)共同诱导后分蘖增多, 同时前人研究表明, 黑穗病菌侵染导致甘蔗分蘖增多[10], 说明植物生长调节剂(6-BA和DA-6)和黑穗病菌均引起了甘蔗分蘖相关代谢途径调控基因的变化。因此, 本研究以甘蔗割手密种D27基因家族所编码的氨基酸序列为探针, 分别在6-BA (2 mg L-1)和DA-6 (10 mg L-1)共同诱导的甘蔗栽培种ROC22转录组 (数据未公布)和黑穗病菌胁迫的甘蔗栽培种ROC22和YC05-179转录组[21]数据库中进行tblastn比对, 提取与甘蔗割手密种D27基因家族同源的甘蔗栽培种D27基因家族在2个转录组中的表达数据, 筛选2个转录组中均差异表达的甘蔗割手密种D27基因。
1.3.4 ScD27.1基因的克隆和分析 以在6-BA (2 mg L-1)和DA-6 (10 mg L-1)共同诱导(数据未公布)和黑穗病菌胁迫的甘蔗栽培种转录组[21]中均差异表达的甘蔗割手密种D27基因Sspon.06G0012830-1A的序列作为参考设计PCR扩增引物ScD27.1-F/R (表1), 通过ExTaq酶(TaKaRa, 中国大连)在甘蔗栽培种ROC22整株组培苗cDNA中进行扩增, 扩增程序如下: 94℃ 4 min; 94℃ 30 s, 58℃ 30 s, 72℃ 1 min 30 s, 35个循环; 72℃ 10 min。目的片段PCR产物经过Gel Extraction Kit (Omega, 中国北京) 纯化后连接至pMD19-T载体, 并转化大肠杆菌DH5α进行TA克隆及测序。同时, 使用ORF Finder (
1.4 甘蔗栽培种ScD27.1基因的表达分析
1.4.1 生物信息学分析 分别使用在线工具ExPaSy (1.4.2 qRT-PCR表达分析 参考甘蔗割手密种D27基因家族顺式元件预测结果, 分析参与植物生长发育和逆境响应的植物激素信号分子ABA、MeJA、SA[32,33]和H2O2[34]如何调控甘蔗D27基因的转录表达。使用qRT-PCR技术, 以q-ScD27.1-F/R (表1)为引物, CAC和CUL为内参基因[22], 分析ScD27.1基因在ABA、MeJA、SA和H2O2胁迫下的表达模式。为了获得准确基因相对表达分析结果, 在3倍梯度稀释的ROC22 cDNA样品中对ScD27.1基因的定量引物进行特异性扩增检测和扩增效率检测。基因的相对表达量计算及差异显著性分析分别使用2-ΔΔCT算法[23]和新复极差法DPS (7.05)。qRT-PCR反应体系及扩增程序均参照SYBR Green PCR Master Mix试剂盒说明书。
Table 1
表1
表1引物列表
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) |
|---|---|
| ScD27.1-F | CTCGCAGCCTCACAAACGCGGGCGG |
| ScD27.1-R | TCTCAAGCCAACGGTCTCCTA |
| G-ScD27.1-F | GGGGACAAGTTTGTACAAAAAAGCAGGCTTCATGGCCGTGCTTCCGCGACC |
| G-ScD27.1-R | GGGGACCACTTTGTACAAGAAAGCTGGGTCCGCCTGAAGTTTGGGACAGA |
| q-ScD27.1-F | GGGTGCTCAAGAAAT |
| q-ScD27.1-R | CTCGTTGGTGAAGAAGTC |
| CAC-F | ACAACGTCAGGCAAAGCAAA |
| CAC-R | AGATCAACTCCACCTCTGCG |
| CUL-F | TGCTGAATGTGTTGAGCAGC |
| CUL-R | TTGTCGCGCTCCAAGTAGTC |
新窗口打开|下载CSV
1.4.3 亚细胞定位分析 参考Gateway BP Clonase II Enzyme mix (Invitrogen, 美国加利福尼亚)说明书, 以pMD19-T-ScD27.1质粒为模板, G-ScD27.1-F/R (表1)为引物, 构建入门载体pDONR-Zeo-ScD27.1。根据Gateway LR Clonase II Enzyme mix (Invitrogen, 美国加利福尼亚)说明书, 通过LR反应构建亚细胞定位载体pFAST-R06-ScD27.1。将pFAST-R06和pFAST-R06- ScD27.1质粒分别转入农杆菌GV3101并涂板(含50 μg mL-1壮观霉素和35 μg mL-1利福平), 28℃倒置培养2 d后, 进行菌液PCR鉴定。分别将含有pFAST-R06 和pFAST-R06-ScD27.1质粒的农杆菌注射侵染烟草叶片表皮细胞(操作参考Su等[24]), 48 h后, 用16.5 μmol L-1的渥曼青霉素(Wortmannin, Wort)处理烟草叶片, 并在0 h和0.5 h后[25]通过激光共聚焦显微镜(Leica, 德国韦茨拉尔)观察烟草叶片表皮细胞[26]。
2 结果与分析
2.1 甘蔗割手密种D27基因家族鉴定
通过HMM共检索到5个具有完整DUF4033保守结构域的甘蔗割手密种D27序列, 分别为Sspon. 06G0012830-1A、Sspon.06G0012830-3C、Sspon. 06G0016140-2C、Sspon.07G0014180-2B和Sspon. 07G0014180-3C, 分别定位于6A、6C、6C、7B、7C染色体(图1-A)。多序列比对结果显示, 甘蔗割手密种D27基因家族成员间的氨基酸序列一致性为52.36%, 其中Sspon.07G0014180-2B与Sspon.07G0014180-3C一致性最高, 为90.09%, Sspon.06G0016140-2C与Sspon. 07G0014180-2B一致性最低, 为20.41% (图1-B), 说明甘蔗割手密种D27基因家族氨基酸序列间差异较大。图1
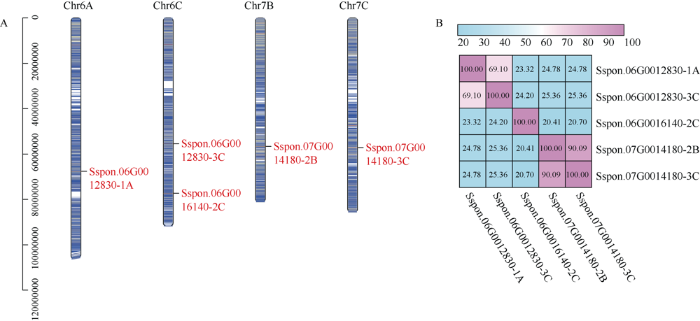 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1甘蔗割手密种D27基因家族鉴定
A: 甘蔗割手密种D27s染色体分布; B: 甘蔗割手密种D27s氨基酸序列间相似性。
Fig. 1Genome wide identification of D27 gene family in Saccharum spontaneum
A: chromosomal location of D27s in Saccharum spontaneum; B: amino acid sequence similarity of D27s in Saccharum spontaneum.
2.2 甘蔗割手密种D27基因家族的生物信息学分析
2.2.1 系统进化树构建及结构域分析 使用甘蔗割手密种的5个D27s氨基酸序列与其他5个物种(拟南芥、水稻、高粱、小米及玉米)的62个D27s氨基酸序列共同构建系统进化树, 结果如图2所示。6个物种的D27s蛋白聚类成7个系统发育分支, 定位于甘蔗割手密种7B染色体的Sspon.07G0014180-2B和7C染色体的Sspon.07G0014180-3C分布于分支I, 定位于6A染色体的Sspon.06G0012830-1A和6C染色体的Sspon.06G0012830-3C分布于分支V, 定位于6C染色体的Sspon.06G0016140-2C分布于分支VII, 并且甘蔗割手密种D27s与高粱D27s 在系统发育分支中距离最近。Smart search检索到的结构域包括Pfam: DUF4033、Pfam: COesterase和Pfam: Abhydrolase_3等, 说明D27基因家族除了包含典型的Pfam: DUF4033结构域外, 还可能包含其他结构域, 但这些结构域在进化过程中不保守。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2基于甘蔗割手密种和其他5个物种D27s氨基酸序列的系统进化树及结构域分析
横坐标表示蛋白氨基酸序列的长度; 线条颜色表示所用到的物种(Species); 条码颜色表示蛋白的结构域(Domains)。
Fig. 2Phylogenetic tree and domain analysis based on the amino acid sequences of D27s in Saccharum spontaneum and other 5 species
The horizontal axis indicates the amino acid length of the proteins; the color line represents the protein from the different species; the color bar code represents the different domain of protein.
2.2.2 顺式元件预测 为了解甘蔗割手密种D27基因家族成员的调控功能, 使用PlantCare对甘蔗割手密种D27基因家族成员CDS上游2000 bp的启动子序列进行分析, 同时提取与胁迫响应/诱导相关的14类顺式元件(图3)。其中与植物激素响应相关的顺式元件包括ABA响应元件、MeJA响应元件、GA响应元件和SA响应元件。与植物生长发育相关的顺式元件包括玉米醇溶蛋白代谢调控元件、分生组织表达调控元件、种子特异性调控元件和胚乳表达调控元件。与胁迫响应相关的顺式元件包括低温响应元件、厌氧诱导元件、光响应元件、干旱诱导元件、防御和应激反应元件和伤害响应元件。甘蔗割手密种D27基因家族所有成员的启动子区均含有厌氧诱导元件、光响应元件、MeJA响应元件和GA响应元件。Sspon.06G0012830-3C和Sspon.06G0016140-2C的启动子区分别含有特有的种子特异性调控元件和胚乳表达调控元件。推测厌氧诱导元件、光响应元件、MeJA响应元件和GA响应元件相关的反式作用因子可能可以结合到甘蔗割手密种D27基因家族启动子区, 从而受植物激素响应和胁迫诱导表且部分成员在特定组织器官中特异性表达。
图3
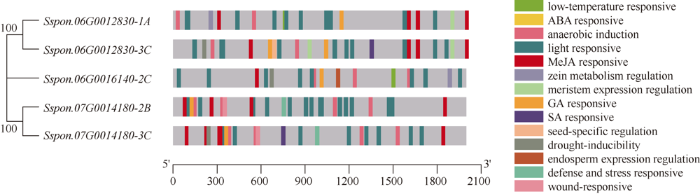 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3甘蔗割手密种D27s顺式元件预测
横坐标表示的基因启动子区核苷酸长度; 条码颜色表示启动子区不同的顺式元件。
Fig. 3Prediction of cis-elements in Saccharum spontaneum D27s
The horizontal axis indicates region nucleotide length of gene promoter; the color bar code represents the different cis-element in the promoter region.
2.3 甘蔗栽培种ScD27.1基因的筛选与克隆
2.3.1 差异表达ScD27.1基因筛选 经tblastn比对后, 甘蔗割手密种D27基因家族在植物生长调节剂诱导甘蔗栽培种ROC22分蘖转录组数据中存在3条相似性较高的序列, 分别为c116894.graph_c0、c112688.graph_c0和c161113.graph_c0; 在甘蔗栽培种ROC22和YC05-179应答黑穗病菌侵染转录组数据中存在3条相似性较高的序列, 分别为Sugarcane_Unigene.66941、Sugarcane_Unigene.58014和Sugarcane_Unigene.87626。D27s序列间相似性详见表2。Table 2
表2
表2甘蔗割手密种与栽培种D27s间序列相似性
Table 2
| 基因名称 Gene ID | 6-BA和DA-6共同诱导甘蔗栽培种ROC22 分蘖转录组 Transcriptome of sugarcane cultivar ROC22 treated with 6-BA and DA-6 | 甘蔗栽培种ROC22和YC05-179应答黑穗病菌 侵染转录组 Transcriptome of sugarcane cultivar ROC22 and YC05-179 responding to Sporisorium scitamineum infection | ||||
|---|---|---|---|---|---|---|
| c116894. graph_c0 | c112688. graph_c0 | c161113. graph_c0 | Sugarcane_ Unigene.66941 | Sugarcane_ Unigene.58014 | Sugarcane_ Unigene.87626 | |
| Sspon.06G0012830-3C | 94.57 | 94.96 | ||||
| Sspon.06G0012830-1A | 97.93 | 98.34 | ||||
| Sspon.07G0014180-2B | 82.33 | 98.31 | ||||
| Sspon.07G0014180-3C | 80 | 82.42 | ||||
| Sspon.06G0016140-2C | 97.06 | 95.83 | ||||
新窗口打开|下载CSV
6-BA和DA-6诱导甘蔗栽培种ROC22分蘖转录组中, c112688.graph_c0 (P = 0.006)和c116894. graph_c0 (P = 0.02)经6-BA和DA-6处理后的表达量,相对于对照组均显著性下调表达, 且在处理20 d时下调表达幅度最大, 分别为对照组的-0.54和-0.42倍(图4-A)。受黑穗病菌侵染后, Sugarcane_Unigene.58014在甘蔗抗黑穗病品种YC05-179和甘蔗感黑穗病品种ROC22中均无显著差异表达; 尽管Sugarcane_Unigene.66941在甘蔗抗黑穗病品种YC05-179受侵染后48 h和120 h的下调表达并不显著, 但其在感黑穗病品种ROC22受侵染后48 h和120 h的上调表达均达到显著水平(P = 0.01) (图4-B)。此外, 由于c161113.graph_c0和Sugarcane_ Unigene.87626在转录组中的FPKM值均小于0.2, 属于极低表达, 不符合数据分析要求。
图4
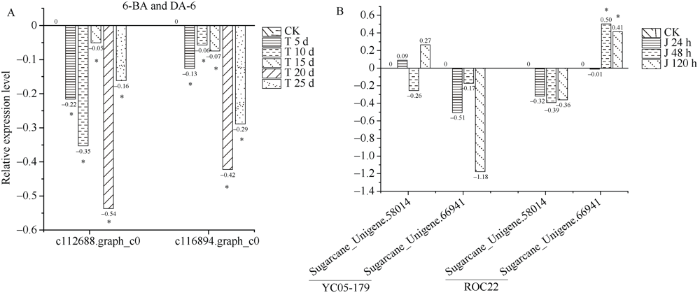 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同转录组中甘蔗栽培种D27s基因的表达
A: 表达数据来源于6-BA和DA-6共同诱导甘蔗栽培种ROC22分蘖相关转录组; B: 表达数据来源于甘蔗栽培种ROC22和YC05-179应答黑穗病菌侵染转录组。X轴表示出现在甘蔗转录组数据中的转录本序号; Y轴表示相对于对照组而言, 转录本在处理组中的相对表达量, 其中*代表相对表达量显著差异(P < 0.05)。
Fig. 4Expression of D27s gene in different transcriptome in sugarcane cultivar
A: the transcriptomic data from 6-BA and DA-6 induced tillering in sugarcane cultivar ROC22; B: the transcriptomic data from sugarcane cultivar ROC22 and YC05-179 in response to Sporisorium scitamineum infection. X-axial represents the accession of transcript presenting in the sugarcane transcriptomic data, while Y-axial represents the relative expression of transcript in the treatment sample comparing to the control and the significantly different expression data (P < 0.05) was marked by the asterisk (*).
综上所述, 与甘蔗割手密种D27基因家族中Sspon.06G0012830-1A相似性分别为97.93%和98.34%的甘蔗栽培种c116894.graph_c0和Sugarcane_Unigene.66941 (表2)分别在6-BA和DA-6共同诱导甘蔗栽培种ROC22分蘖转录组和甘蔗栽培种ROC22应答黑穗病菌侵染转录组中显著差异表达, 推测与甘蔗割手密种Sspon. 06G0012830-1A同源的甘蔗栽培种D27基因同时参与甘蔗分蘖调控及黑穗病菌响应, 可用于下一步的研究。
2.3.2 ScD27.1基因克隆 根据琼脂糖凝胶电泳结果可知, PCR扩增获得1条约1127 bp的特异条带(图5-A)。PCR产物经连接, 转化后进行测序分析。测序结果经ORF Finder (
图5
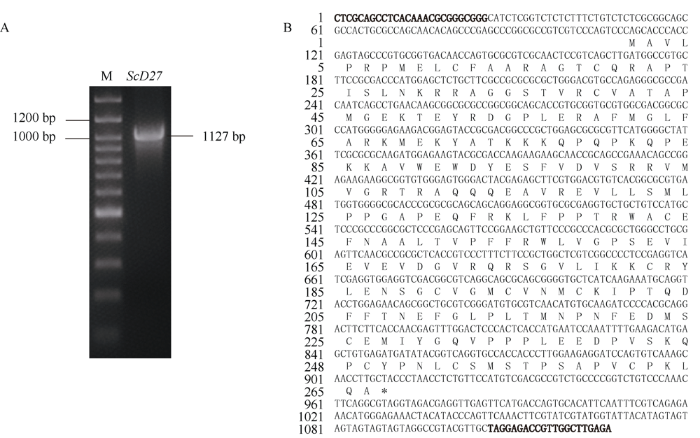 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5甘蔗栽培种ScD27.1基因的克隆与测序
A: ScD27.1基因的RT-PCR产物的琼脂糖电泳分析; M代表marker 100 bp-III DNA marker (Generay, 中国上海)。B: ScD27.1基因的开放读码框(*, 终止密码子)及其编码氨基酸序列, 粗体部分为特异性引物在基因序列中的位置。
Fig. 5Cloning and sequencing of ScD27.1 gene in sugarcane cultivar
A: agrose electrophoretic analysis of RT-PCR product of ScD27.1; M: 100 bp-III DNA marker (Generay, Shanghai, China). B: the open reading frame of ScD27.1 (*, stop codon) and its aa sequence; the sequence fragment complementary to primer is bolded.
2.4 甘蔗栽培种ScD27.1基因的表达分析
2.4.1 生物信息学分析 生物信息学分析结果显示, 甘蔗栽培种ScD27.1编码266个氨基酸, 等电点为8.91, 分子量为30.00 kD, 属于不稳定蛋白。二级结构主要包括α-螺旋和无规则卷曲(表3)。甘蔗栽培种ScD27.1具有叶绿体转运肽可能定位于叶绿体, 包含4个泛素化位点和18个磷酸化位点(表3)。Table 3
表3
表3生物信息学分析结果
Table 3
| 生物信息学分析 Bioinformatics analysis | 结果Result | |
|---|---|---|
| 一级结构特性 Primary structure characteristics | 氨基酸长度 Length of amino acids | 266 |
| 等电点 Theoretical pI | 8.91 | |
| 分子量 Molecular weight (kD) | 30.00 | |
| 不稳定系数 Instability index (II) | 56.40 | |
| 二级结构类型 Secondary structure types | α-螺旋 Alpha helix | 30.08% |
| 延伸链 Extended strand | 12.41% | |
| 无规则卷曲 Random coil | 57.52% | |
| 蛋白亚细胞定位 Protein subcellular location | Plant-Ploc工具 Plant-Ploc tool | 叶绿体Chloroplast |
| ProtComp 9.0工具 ProtComp 9.0 tool | 膜结合叶绿体Membrane bound Chloroplast | |
| WoLFPSORT工具 WoLFPSORT tool | 叶绿体Chloroplast | |
| 功能位点 Function sites | 靶向肽类型 Type of targeting peptide | 叶绿体转运肽Chloroplast transit peptide |
| 泛素化位点 Ubiquitination sites | 4 | |
| 磷酸化位点 Phosphorylation sites | 18 | |
新窗口打开|下载CSV
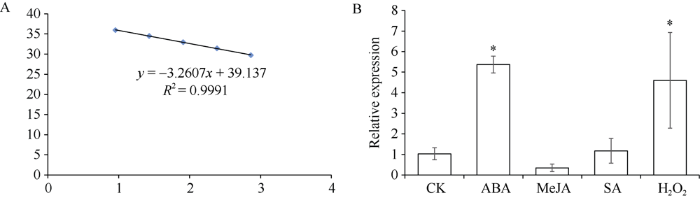
2.4.2 qRT-PCR表达分析 ScD27.1基因引物扩增效率为1.026, 在0.95~1.05之间, 扩增曲线具有很好的相关性(R2 = 0.9991), 说明引物具有良好的扩增特异性(图6-A)。受MeJA胁迫后, ScD27.1基因的表达量相对于对照组下调表达; 受ABA、SA及H2O2胁迫后, ScD27.1基因的表达量相对于对照组上调表达, 并且在受ABA和H2O2胁迫后显著高于对照组, 分别为对照组的5.37倍和4.60倍(图6-B)。推测ScD27.1基因受ABA及H2O2显著诱导表达, 但对MeJA、SA胁迫响应不明显。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6ScD27.1基因在不同胁迫下的表达
A: ScD27.1基因定量引物扩增效率曲线; B: ScD27.1基因在ABA、MeJA、SA及H2O2胁迫下的表达。*表示在0.05水平差异显著; 误差线代表各组的标准误差(n = 3)。
Fig. 6Expression of ScD27.1 gene under different stresses
A: the amplification efficiency curve of the primer pairs of ScD27.1; B: expression of ScD27.1 gene under different stress of ABA, MeJA, SA, and H2O2. *: significant difference at the 0.05 probability level; the error bars represent the standard error of the group (n = 3).
2.4.3 亚细胞定位分析 烟草叶片表皮细胞亚细胞定位结果如图7所示, 空载35S::GFP定位于细胞膜及细胞核, 35S::ScD27.1::GFP定位在细胞膜上, 胞内也出现了点状荧光, 如叶绿体。Wort能够促进细胞内液泡前体或者运输小泡发生融合形成更大的膜泡结构[25,27]。经过Wort处理0.5 h后观察发现, 空载35S::GFP的定位未发生改变, 烟草叶片表皮细胞中未观察到具有绿色荧光的膜泡结构。然而, 尽管35S::ScD27.1::GFP的定位也未发生改变, 但在烟草叶片表皮细胞中可以观察到含有绿色荧光的膜泡结构, 因此, ScD27.1可能定位于细胞膜和叶绿体, 并参与细胞内膜泡运输或由液泡前体、胞内运输小泡完成其在在胞质内的分拣运输过程。
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7ScD27.1蛋白的亚细胞定位鉴定
A~F为自然状态下蛋白亚细胞定位, 标尺为10 μm; G~L为渥曼青霉素(wortmannin, 16.5 μmol L-1)处理后的蛋白亚细胞定位, 标尺为15 μm。
Fig. 7Identification of the subcellular location of ScD27.1 protein
The figures from A to F indicate the cellular location of the protein under natural condition and the bar scale was 10 μm; the figures from G to L indicate the cellular location of the protein under wortmannin (16.5 μmol L-1) treatment and the bar scale was 15 μm.
3 讨论
SLs是一种广泛存在、能够抑制植物分蘖或分枝的植物激素[12,13]。目前, 在拟南芥[15]、水稻[16]和小麦[17]中均有关于SLs合成相关基因d27突变体中分蘖增多的报道, 说明D27基因能够通过抑制SLs合成来减少植物分蘖或分枝。本研究中, ScD27.1在分蘖相关转录组中的转录本c116894.graph_c0, 经6-BA和DA-6 (具有促进分蘖功能)处理后相对于对照组, 显著下调表达, 与前人研究结果相同[15,16,17]。SLs除了在生长发育过程中起作用外, 还被认为能够响应病原菌侵染[28]。番茄SLs合成相关基因Slccd8突变体对灰葡萄球菌和链格孢菌均更敏感[29]。拟南芥SLs信号转导相关基因Atmax2突变体对果胶杆菌和假丁香单胞菌的敏感性增加, 但对灰葡萄球菌的敏感性不增加[30]。拟南芥SLs生物合成(max1、max3和max4)和信号转导(max2)突变体对带化红球菌更加敏感[31]。甘蔗SLs合成相关基因ScD27.1的同源基因Sugarcane_Unigene.66941在抗病品种中受黑穗病菌抑制表达, 在感病品种中受黑穗病菌诱导表达, 说明ScD27.1响应黑穗病菌侵染, 但其在甘蔗分蘖及甘蔗与黑穗病菌互作过程中的作用还需进一步试验验证。
ABA、MeJA和SA作为重要的植物激素信号分子, 不仅能够调控植物生长发育, 同时参与植物逆境反应[32,33]。活性氧主要包括O2-和H2O2, 也是植物中一种重要的信号分子, 在植物受病原体侵染或其生长发育过程中发挥作用[34]。ScD27.1基因受ABA、SA及H2O2胁迫后上调表达, 受MeJA胁迫后下调表达, 但SA及MeJA胁迫下差异表达不显著, 推测ScD27.1基因受ABA和H2O2诱导表达, 不受MeJA和SA调控。Abuauf等[35]在ABA处理拟南芥侧根后对AtD27进行表达分析, 得到了相似的结果。苜蓿根系在营养缺乏条件下, 激发活性氧生成的NADPH氧化酶活性增强, SLs合成相关基因MtCCD7、MtCCD8、MtD27基因上调表达[36], 说明活性氧与SLs合成相关基因可能存在协同作用, 这与ScD27.1基因受H2O2诱导表达的研究结果相似。真核生物中由转录因子等反式作用因子结合基因启动子区启动基因表达转录, 然而一般情况下反式作用因子常常形成同源或异源复合体行使其功能, 基因的表达往往不受单一顺式元件调控。因此, ScD27.1基因的割手密同源基因启动子区域虽然具有SA和MeJA响应元件, 但ScD27.1也有可能在某些条件下不响应SA和MeJA的诱导表达。
D27同源基因存在于藻类(蓝藻)和高等植物, 但不存在于动物或真菌中, 是一种植物特有蛋白[16]。本研究首次从甘蔗割手密种基因组中鉴定出D27基因家族的5个成员, 并从甘蔗栽培种ROC22中克隆出1个同时参与分蘖和黑穗病菌胁迫响应的割手密种同源D27基因, 该甘蔗栽培种ScD27.1基因编码266个氨基酸。该蛋白等电点为8.91, 分子量为30.00 kD, 具有DUF4033结构域, 与已报道的编码288个氨基酸, 等电点为5.04, 分子量为71.58 kD, 具有2个锌指蛋白结构域的甘蔗D27基因[18]同源性为31.40%, 推测2个甘蔗D27基因同属于甘蔗D27基因家族, 可能具有不同的生物学功能。目前关于D27亚细胞定位的报道较少, Waters等[16]发现, 拟南芥D27定位于质体, 水稻D27定位于叶绿体, 本研究中甘蔗ScD27.1定位于细胞膜和叶绿体。随着越来越多的D27s被发现, D27的亚细胞定位研究将会更加深入。甘蔗割手密种D27基因家族顺式元件预测结果显示, D27s参与植物激素响应、生长发育调控及胁迫响应。其中关于D27参与ABA、MeJA和SA激素响应已在本研究中验证, 干旱胁迫[37]、光胁迫[38]和磷饥饿胁迫[39]调控已有相关报道。进一步的研究中, SL在低温胁迫[40]、种子萌发[41]和果实发育[42]过程中的作用可作为D27s相关调控功能研究的参考。
4 结论
本研究首次鉴定出5个甘蔗割手密种D27基因家族成员, 并对其进行染色体定位、系统进化、结构域及顺式元件分析。其后, 筛选并克隆到1个在甘蔗分蘖转录组和甘蔗应答黑穗病侵染转录组中均差异表达的甘蔗栽培种ScD27.1基因。该基因编码266个氨基酸, 为等电点8.91、分子量30.00 kD的不稳定蛋白, 二级结构主要包括α-螺旋和无规则卷曲。表达分析显示, 该基因受ABA和H2O2诱导表达, 不受MeJA和SA调控。亚细胞定位明确了ScD27.1蛋白定位于细胞膜和叶绿体。以上结果不仅为解析甘蔗ScD27.1基因在信号传导机制及胁迫响应机制中的功能作用提供参考, 还为深入了解甘蔗受黑穗病菌侵染后的抗病机制与分蘖表型之间的关系研究提供新思路。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1105/tpc.107.055087URLPMID:18708477 [本文引用: 1]

Genes controlling hormone levels have been used to increase grain yields in wheat (Triticum aestivum) and rice (Oryza sativa). We created transgenic rice plants expressing maize (Zea mays), rice, or Arabidopsis thaliana genes encoding sterol C-22 hydroxylases that control brassinosteroid (BR) hormone levels using a promoter that is active in only the stems, leaves, and roots. The transgenic plants produced more tillers and more seed than wild-type plants. The seed were heavier as well, especially the seed at the bases of the spikes that fill the least. These phenotypic changes brought about 15 to 44% increases in grain yield per plant relative to wild-type plants in greenhouse and field trials. Expression of the Arabidopsis C-22 hydroxylase in the embryos or endosperms themselves had no apparent effect on seed weight. These results suggested that BRs stimulate the flow of assimilate from the source to the sink. Microarray and photosynthesis analysis of transgenic plants revealed evidence of enhanced CO(2) assimilation, enlarged glucose pools in the flag leaves, and increased assimilation of glucose to starch in the seed. These results further suggested that BRs stimulate the flow of assimilate. Plants have not been bred directly for seed filling traits, suggesting that genes that control seed filling could be used to further increase grain yield in crop plants.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
URLPMID:17780042 [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 5]
[本文引用: 5]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
URLPMID:32585190 [本文引用: 5]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
URLPMID:26537047 [本文引用: 1]
[本文引用: 2]
URLPMID:20585568 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:24112811 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
URLPMID:29538660 [本文引用: 1]
URLPMID:28285407 [本文引用: 1]
[本文引用: 1]
URLPMID:29341173 [本文引用: 1]
URLPMID:22516816 [本文引用: 1]
DOI:10.1186/s12870-019-1673-6URL [本文引用: 1]
