 ,*, 崔翠
,*, 崔翠 ,*西南大学农学与生物科技学院, 重庆 400715
,*西南大学农学与生物科技学院, 重庆 400715QTL mapping of seed germination-related traits in Brassica napus L. under aluminum toxicity stress
WANG Rui-Li, WANG Liu-Yan, YE Sang, Gao Huan-Huan, LEI Wei, WU Jia-Yi, YUAN Fang, MENG Li-Jiao, TANG Zhang-Lin, LI Jia-Na, ZHOU Qing-Yuan ,*, CUI Cui
,*, CUI Cui ,*College of Agronomy and Biotechnology, Southwestern University, Chongqing 400715, China
,*College of Agronomy and Biotechnology, Southwestern University, Chongqing 400715, China通讯作者:
收稿日期:2019-10-16接受日期:2020-01-15网络出版日期:2020-06-12
| 基金资助: |
Received:2019-10-16Accepted:2020-01-15Online:2020-06-12
| Fund supported: |
作者简介 About authors
E-mail:1525731297@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (1990KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王瑞莉, 王刘艳, 叶桑, 郜欢欢, 雷维, 吴家怡, 袁芳, 孟丽姣, 唐章林, 李加纳, 周清元, 崔翠. 铝毒胁迫下甘蓝型油菜种子萌发期相关性状的QTL定位[J]. 作物学报, 2020, 46(6): 832-843. doi:10.3724/SP.J.1006.2020.94154
WANG Rui-Li, WANG Liu-Yan, YE Sang, Gao Huan-Huan, LEI Wei, WU Jia-Yi, YUAN Fang, MENG Li-Jiao, TANG Zhang-Lin, LI Jia-Na, ZHOU Qing-Yuan, CUI Cui.
铝毒是酸性土壤中制约植物生长的重要因素之一[1]。在酸性土壤条件下(pH<5), 结合态铝解离成有毒离子态从而降低土壤中养分利用率, 抑制植物生长[2], 使植物表现萎蔫矮小, 叶片黄化卷曲易老化、坏死等缺素症状[3]。我国油菜种植区, 尤其是长江以南地区每年因为铝毒危害造成的油菜减产相当严重[4]。在甘蓝型油菜的耐铝毒研究中, 前人主要分析甘蓝型油菜幼苗期或成株期的一些生理生化的变化, 包括油菜根系分泌的柠檬酸、苹果酸、有机酸以及相关代谢酶的活性[5]、叶片的光合作用和有机物运输、抗逆生理指标[6]等。种子萌发期作为作物生长发育重要的起始阶段, 直接影响作物的收获及其经济效益。郜欢欢等[7]研究表明, 不同品种(系)油菜萌发期对铝毒的耐性具有显著性差异, 采用多种方法综合性评价铝毒对油菜相关性状的影响, 成功筛选出萌发期耐铝毒较强的油菜种质。针对油菜萌发期耐铝毒进行相关遗传因子研究和挖掘耐逆基因, 有助于了解油菜对铝胁迫的响应机制, 对筛选和培育耐铝油菜品种具有重要意义。随着分子生物学的发展, 分子标记遗传图谱广泛应用于数量性状基因研究。近年来, 研究者们利用分子标记技术, 通过全基因组关联分析和QTL定位, 对多种作物相关性状遗传机制进行研究, 并取得巨大进展[8,9,10,11,12,13]。SNP标记具有数量多, 分布广和规模化等优点, 已成功地应用于油菜复杂性状的QTL检测。在农艺性状方面, Yang等[8]采用SNP分子标记技术, 对167个油菜品系的双单倍体群体进行QTL分析, 鉴定出45个与油菜长角果相关性状的QTL。荐红举等[9]利用2795个SNP位点的遗传图谱, 准确定位了5种环境条件下甘蓝型油菜千粒重的QTL, 共检测到影响油菜千粒重的14个QTL, 并在置信区间内筛选到16个与粒重相关的基因。Liu等[10]利用油菜60K SNP芯片技术构建高密度遗传图谱, 在4种不同环境中, 对种子颜色与细胞壁纤维组分进行QTL定位, 共鉴定出与之相关的11个QTL。另外, SNP标记也常被应用于逆境胁迫下油菜相关性状的QTL定位。Wan等[11]对214份油菜自交系萌发期的发芽率、根长、鲜重进行了耐盐性评价, 利用GWAS共鉴定出110个SNP位点和56个可能与盐胁迫相关的候选基因。侯林涛等[12]利用高密度SNP连锁遗传图谱, 采用复合区间法, 对盐胁迫环境下油菜幼苗的鲜重和干重进行QTL定位, 共检测到与盐胁迫相关的6个QTL, 并筛选到耐盐基因8个。Zhang等[13]在油菜种子苗期利用SNP标记对相对根长进行耐镉性检测, 通过GWAS找到4个与耐镉性状相关的QTL, 并挖掘出7个与耐镉相关的候选基因。关于作物耐铝毒分子机制的研究是当今的热点问题, 缓解和克服作物铝毒害的最有效途径是筛选耐铝基因及培育耐铝性强的作物。植物上获得的第一个耐铝毒基因是Sasaki等[14]用差减杂交技术, 在铝毒胁迫下从小麦(Triticum aestivum L.)根尖中分离得到的苹果酸转运蛋白基因Ta ALMT1。Huang等[15]从铝敏感水稻(Oryza sativa L.)突变体中克隆到一种属于ABC家族的蛋白复合体基因STAR1, 该基因是植物耐铝性相关的最重要的转录因子之一。Liu等[16]发现了1个与铝胁迫相关的Alp基因,该基因是编码多药及毒性复合物排出转运蛋白家族MATE, 且能够促进柠檬酸的分泌从而增强植株的耐铝性。铝毒是影响作物产量的重要因素。尽管前人通过种质资源筛选[7]、生理指标测定[5,6]、耐铝基因挖掘[14,15,16]等方法揭示铝胁迫下油菜萌发期相关性状的遗传机理, 而利用SNP分子标记技术定位铝胁迫下油菜萌发期相关性状QTL及筛选抗性基因, 迄今还未见报道。本研究利用油菜6K SNP芯片构建高密度遗传连锁图谱, 通过QTL作图法对铝胁迫下油菜萌发期的相对发芽势、相对发芽率、相对根长、相对芽长和相对干重进行定位, 并将油菜基因序列与拟南芥序列比对分析, 根据基因功能注解筛选可能与铝胁迫相关的基因, 以期为选育和筛选油菜耐铝品种提供理论依据。
1 材料与方法
1.1 供试材料
供试材料为182份重组自交系(recombinant inbred lines, RILs)及其亲本10D130和中双11号(简称: ZS11)。该群体以10D130为母本, ZS11为父本进行杂交, 采用单粒传法连续自交7代获得。ZS11是中国农业科学院油料作物研究所选育的常规优质油菜品种, 10D130是由西南大学油菜工程技术研究中心通过羽衣甘蓝和芥菜型油菜种间杂交, 在后代中选育获得的衍生品系。2017—2018年在重庆市北碚区歇马镇油菜试验基地种植实验材料, 在油菜初花期套袋自交, 种子完全成熟后收取每株系5株正常植株的种子, 自然风干后保存。所有材料均由西南大学油菜工程技术研究中心提供。1.2 适宜铝胁迫浓度筛选
配制溶液的试剂为A1Cl3·6H2O, 设0(CK)、20、40、60、80、100、120和140 μg mL-1 8个铝胁迫浓度。分别从ZS11与10D130两个亲本中选择大小均匀, 籽粒饱满的20粒种子进行铝胁迫试验。首先用75%浓度乙醇对供试种子消毒, 用蒸馏水清洗3次。然后将其均匀摆放在铺有2层滤纸的培养皿中, 分别加入3 mL不同浓度的铝毒溶液。每处理重复3次。每隔2 d更换培养皿中滤纸并补充相应浓度的铝胁迫溶液。将培养皿置光照培养箱萌发生长, 箱内温度25℃, 相对湿度85%, 光暗时间16 h /8 h。7 d后测定其胚根长度, 通过根长筛选耐铝胁迫的适宜浓度。1.3 重组自交系群体耐铝性筛选
按照浓度筛选时的方法和培养条件对182份甘蓝型油菜用筛选出来的铝浓度进行种子萌发胁迫试验。处理3 d时统计发芽势, 7 d时从每个培养皿中随机选择10株长势基本一致的幼苗统计发芽率、根长和芽长(下胚轴长), 并将这10株幼苗在105℃下杀青10 min, 75℃烘干24 h后测量干重。用于计算相对发芽势(relative germination vigor, RGV), 相对发芽率(relative germination rate, RGR)、相对根长(relative root length, RRL)、相对芽长(relative bud length, RBL)及相对干重(relative dry weight, RDW)值, 求取平均值。以蒸馏水处理种子萌发作为对照, 且对照和处理均设置3次重复。各性状的相对值=胁迫下的性状测定值/对照性状测定值。
1.4 数据处理和统计分析
运用DPS 19.0[17]对处理后的数据进行方差分析、相关性分析, 运用SPSS 17.0[18]对重组自交系的表型数据进行描述性统计, 计算其最大值、最小值、 均差、标准差等。1.5 遗传图谱的构建及QTL定位分析
从每个株系5个幼嫩植株取叶片混合样0.15 g, 利用DNA提取试剂盒DP321-03 (天根, 中国北京)提取DNA并稀释至50 ng μL-1用于SNP标记分析。严格按照Infinium HD Assay Ultra操作说明书(Illumina Inc公司)进行DNA样品的预处理(等位扩增、片段化及富集)、与芯片杂交、洗涤、安装流动室、单碱基延伸、染色及包埋。芯片准备好后运用Illumina HiScan扫描仪的iScan Control Software软件扫描, 然后利用GenomeStudio genotyping software v2011软件分析扫描结果, 获取各个样本的SNP基因型数据, 并为获得的SNP标记命名, 命名方法以A-9550556为例, A表示SNP, 95505568代表GenomeStudio genotyping software生成的相应SNP位点索引号。构建连锁图谱采用JoinMap 4.0软件[19], 选用Kosambi[20]函数将重组值转换为图距单位(cM), 取最小阈值LOD2.0对所有标记分组, 每个染色体上标记顺序通过两两标记之间最小重组频率计算, 构建用于QTL定位的遗传连锁图谱。采用软件Map QTL对相对发芽势、相对发芽率、相对根长、相对芽长、相对干重进行QTL定位及效应检测。LOD≥3时, 即认为该区间可能存在一个QTL。QTL按照McCouch等[21]的方法命名, 即小写字母“q”加上性状缩写名字、染色体和QTL序号。其中QTL的序号是指同一条染色体上多个QTL按LOD值的大小为标准进行排序, 如qRGV-A01-1表示相对发芽势在A01染色体上的第1个QTL。
1.6 候选基因分析
将检测到的QTL的置信区间在甘蓝型油菜基因组上查询到对应的序列, 然后与TAIR网站上的拟南芥基因组序列进行Blast比对, E-value阈值设置为E-20[22], 筛选出可能与铝胁迫相关的候选基因。2 结果与分析
2.1 适宜铝胁迫浓度的筛选
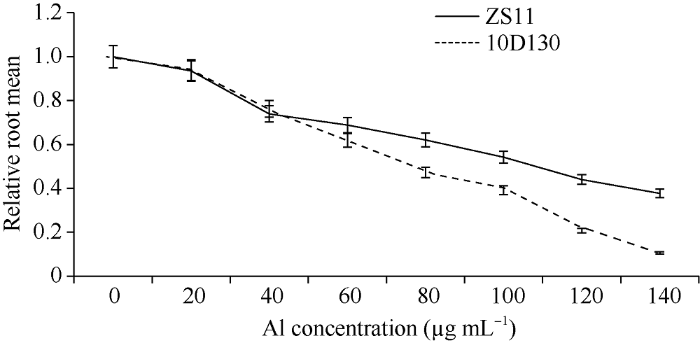
由图1可以看出, 随着铝胁迫浓度增加, 两亲本的相对根长均呈下降趋势, 但两亲本的下降幅度不同。铝胁迫浓度为20 μg mL-1、40 μg mL-1、60 μg mL-1时, 两亲本的相对根长下降幅度相近, 无显著差异。铝胁迫浓度为120 μg mL-1、140 μg mL-1时, 10D130受到严重抑制, 部分根和芽萎蔫缩小甚至腐烂死亡, 不利于品种间耐铝性差异筛选。但铝胁迫浓度在80 μg mL-1、100 μg mL-1时, ZS11对铝胁迫的耐受能力明显比10D130强, 根系的生长在亲本间受到的影响不同并能够较好地区分品种间耐铝性差异。但是油菜在铝胁迫浓度80 μg mL-1时的根长较100 μg mL-1时易观察, 更有利于后期试验。故选择80 μg mL-1铝胁迫浓度为油菜萌发期耐铝毒种质资源筛选的适宜浓度。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同浓度铝对油菜相对根长的影响
Fig. 1Effects of different concentrations of aluminum on root length of rapeseed
2.2 亲本及重组自交系群体表型性状分析及相关性分析
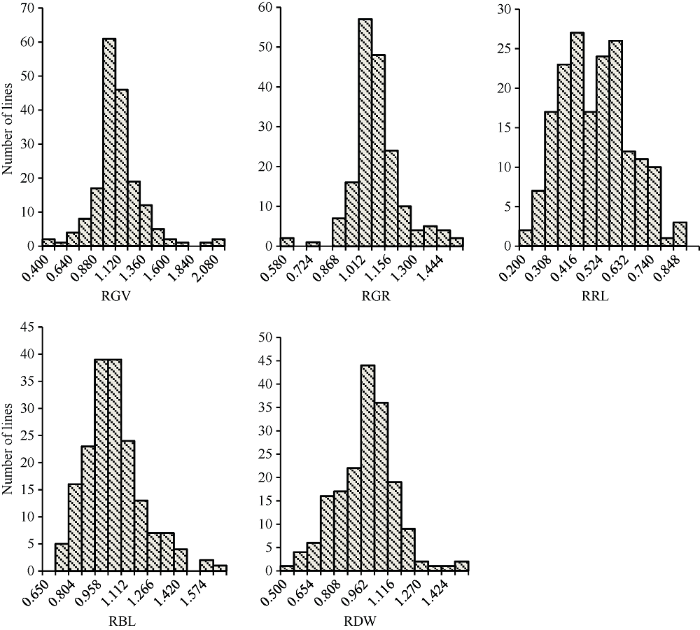
在80 μg mL-1铝胁迫条件下测定182份油菜的5个性状, 并统计其相对值, 结果如表1。各性状变异系数为13.40%~31.30%, 其中相对发芽率变异系数最小, 为13.40%, 相对根长的变异系数最大, 为31.30%。由图2可以看出, 重组自交系群体各性状相对值均连续变化, 适合于QTL分析。Table 1
表1
表1重组自交系群体及亲本油菜在铝胁迫环境下各性状的分布特征
Table 1
| 相关性状 Relative trait | 亲本 Parents | RIL群体 RIL population | |||||
|---|---|---|---|---|---|---|---|
| ZS11 | 10D130 | 均值Mean | 极差Range | 标准差SD | 变异系CV(%) | ||
| 相对发芽势 RGV | 0.982 | 0.967 | 1.032** | 1.667 | 0.230 | 22.3 | |
| 相对发芽率 RGR | 0.983 | 0.982 | 1.043** | 1.030 | 0.140 | 13.4 | |
| 相对根长 RRL | 0.621 | 0.472 | 0.465** | 0.733 | 0.146 | 31.3 | |
| 相对芽长 RBL | 0.955 | 0.987 | 0.994** | 1.158 | 0.178 | 17.9 | |
| 相对干重 RDW | 0.987 | 0.990 | 0.920** | 1.125 | 0.175 | 19.0 | |
新窗口打开|下载CSV
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2最适铝胁迫处理下油菜品系各性状相对值的频率分布图
RGV: 相对发芽势; RGR: 相对发芽率; RRL: 相对根长; RBL: 相对芽长; RDW: 相对干重。
Fig. 2Frequency distribution of relative values of various characters of rape lines under optimum aluminum stress
RGV: relative germination vigor; RGR: relative germination rate; RRL: relative root length; RBL: relative bud length; RDW: relative dry weight.
铝胁迫下, 相对发芽势与相对发芽率呈显著正相关, 相关系数为0.404; 相对根长与相对发芽率极显著负相关, 相关系数为0.252; 相对干重与相对发芽势显著负相关, 相关系数为0.148。相对芽长与其他相关性状指标相关不显著(表2)。
Table 2
表2
表2油菜种子铝胁迫处理后各性状间的相关性分析
Table 2
| 测定指标Index | 相对发芽势RGV | 相对发芽率RGR | 相对根长RRL | 相对芽长RBL | 相对干重RDW |
|---|---|---|---|---|---|
| 相对发芽势RGV | 1 | ||||
| 相对发芽率RGR | 0.404** | 1 | |||
| 相对根长RRL | 0.101 | 0.053 | 1 | ||
| 相对芽长RBL | -0.108 | -0.109 | 0.062 | 1 | |
| 相对干重RDW | -0.148* | -0.252** | -0.075 | -0.020 | 1 |
新窗口打开|下载CSV
2.3 遗传连锁图谱
利用包含5058个标记的6K SNP芯片对186个RILs材料进行基因型鉴定, 从中筛选出1897个高质量多态性的SNP标记, 约占37.5%。基于这些标记构建遗传连锁图谱。获得用于QTL定位的图谱覆盖甘蓝型油菜基因组3214.19 cM, 平均图距为1.69 cM。每条染色体长度范围为86.51~98.72 cM, 平均长度为169.17 cM。染色体标记数目在24~153之间, 平均数目为99.84个。但各染色体分布不均, 其中染色体A03、C03和C04上标记分布较多, 分别为139、147和153个; 而染色体C05、C08和C09上的标记数目较少, 分别只有48、26和24个。此外各染色体标记密度也有较大差异, C04密度最大, 平均间距仅1.10 cM, 而密度最小的C08平均间距达6.13 cM。2.4 油菜耐铝相关性状QTL分析
检测到与铝胁迫相关的QTL 23个(图3和表3), 分别位于A01、A02、A03、A08、A09、A10、C01、C03、C04和C08染色体上, A基因组与C基因组分别有17个和6个, LOD值介于3.00~5.26, 能够解释的表型变异为7.70%~13.10%。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3甘蓝型油菜耐铝胁迫QTL在SNP连锁群上的分布情况
RGV: 相对发芽势; RGR: 相对发芽率; RRL: 相对根长; RBL: 相对芽长; RDW: 相对干重。
Fig. 3Distribution of QTL for aluminum tolerance in Brassica napus on SNP genetic map
RGV: relative germination vigor; RGR: relative germination rate; RRL: relative root length; RBL: relative bud length; RDW: relative dry weight.
Table 3
表3
表3利用复合区间作图法检测到油菜萌发期在铝胁迫下的QTL
Table 3
| 性状 Trait | QTL | 标记区间 Marker interval | LOD | 表观贡献率 PVE (%) | 加性效应 Additive effect | 置信区间 Confidence interval (cM) |
|---|---|---|---|---|---|---|
| 相对发芽势RGV | qRGV-A01-1 | AX-177912497-AX-179306831 | 4.33 | 10.90 | -0.0282 | 37.410-43.975 |
| qRGV-A01-2 | AX-182171878-AX-182150271 | 3.90 | 9.90 | -0.0217 | 141.657-155.683 | |
| qRGV-A03-1 | AX-95507427-AX-177832788 | 4.20 | 10.60 | 0.0064 | 179.611-222.454 | |
| qRGV-A03-2 | AX-95504605-AX-177831059 | 3.74 | 9.50 | 0.0033 | 93.552-97.113 | |
| qRGV-A03-3 | AX-95681175-AX-95665748 | 3.23 | 8.20 | -0.0236 | 121.496-124.157 | |
| qRGV-A08 | AX-95506362-AX-182175648 | 5.26 | 13.10 | -0.0402 | 8.146-12.834 | |
| qRGV-C01-1 | AX-182087666-AX-95638042 | 3.43 | 8.70 | -0.0123 | 160.226-163.199 | |
| qRGV-C01-2 | AX-177910610-AX86223402 | 3.00 | 7.70 | -0.0072 | 1.826-6.674 | |
| qRGV-C03 | AX-95665064-AX-105309102 | 4.17 | 10.50 | -0.0022 | 6.340-10.132 | |
| 相对发芽率RGR | qRGR-C04 | AX-95636072-AX-182161180 | 3.12 | 8.00 | 0.0329 | 34.378-38.45 |
| 相对根长RRL | qRRL-A03-1 | AX-182087696-X-182147367 | 3.14 | 8.00 | -0.0349 | 144.851-146.986 |
| qRRL-A03-2 | AX-95509347-AX-95509401 | 3.11 | 8.00 | -0.0366 | 207.579-211.5 | |
| qRRL-A09 | AX-95635531-AX-182177329 | 3.36 | 8.60 | -0.0348 | 59.898-79.773 | |
| qRRL-C03 | AX-95662770-AX-177910217 | 3.23 | 8.20 | -0.0274 | 218.487-221.508 | |
| 相对芽长RBL | qRBL-A03 | AX-95636441-AX-177911244 | 3.12 | 8.00 | -0.0038 | 32.513-47.814 |
| qRBL-A08-1 | AX-95663434-AX-95506362 | 3.34 | 8.50 | -0.0158 | 2.275-8.146 | |
| qRBL-A09-1 | AX-177912380-AX-177829538 | 4.07 | 10.30 | 0.0216 | 178.878-188.216 | |
| qRBL-A09-2 | AX-177832428-AX-182127697 | 3.53 | 9.00 | 0.0224 | 6.106-15.138 | |
| qRBL-C08 | AX-95665611-AX-86227922 | 4.75 | 11.90 | 0.0115 | 94.661-132.074 | |
| 相对干重RDW | qRDW-A09-1 | AX-182158057-AX-182154686 | 3.60 | 7.80 | 0.0196 | 127.938-128.931 |
| qRDW-A09-2 | AX-95682972-AX-182133711 | 3.05 | 9.10 | 0.0067 | 275.002-280.965 | |
| qRDW-A10-1 | AX-182087443-AX-65636575 | 4.09 | 10.30 | 0.0050 | 129.25-131.783 | |
| qRDW-A10-2 | AX-177829985-AX-182146546 | 3.90 | 9.90 | 0.0036 | 160.157-160.711 |
新窗口打开|下载CSV
2.4.1 相对发芽势与相对发芽率的QTL 铝胁迫条件下, 检测到9个与相对发芽势相关的QTL, 分别位于A01、A03、A08、C01、C03染色体, 可解释的表型变异为7.70%~13.10%。其中qRGV-A08可解释的表型最高, 为13.10%, 位于A08染色体, 加性效应为-0.0402, 增效基因来自于ZS11。检测到1个与相对发芽率相关的QTL, 分布在C04染色体上, 贡献率为8.00%。
2.4.2 相对根长与相对芽长的QTL 检测到与相对根长相关的QTL 4个, 分布在A03、A09、C03染色体上, 可解释的表型变异为8.00%~8.60%。其中, qRRL-A09可解释的表型最高, 位于A09染色体上。此外, 检测到与相对芽长相关的QTL有5个, 分布在A03、A08、A09、C08染色体上, 表型变异为8.00%~11.90%。其中, 贡献率最大为11.9%, qRBL-C08位于C08染色体上, 加性效应值为0.0115。
2.4.3 相对干重的QTL 检测到与相对干重相关的QTL有4个, 分布在A09、A10染色体上, 可解释表型变异7.80%~10.30%。其中, qRDW-A10-1可解释的表型变异最大, 贡献率为10.30%, 位于A10染色体上。
2.5 候选基因的筛选
根据已经公布的甘蓝型油菜基因组测序结果, 将23个QTL置信区间内的甘蓝型油菜序列与拟南芥的序列比对, 并注释和分析候选基因功能, 共筛选出30个可能与铝毒胁迫相关的候选基因(表4)。Table 4
表4
表4甘蓝型油菜基因组中QTL置信区间候选基因与拟南芥逆境胁迫相关基因的比对
Table 4
| 性状 Trait | 物理区间 Physical interval | 甘蓝型油菜基因编号 Gene ID in B. napus | 基因登录号 Gene accession | 基因注释 Gene annotation | 参考文献 Reference |
|---|---|---|---|---|---|
| 相对发芽势RGV | 18835423-22795371 | BnaA01g26740D | AT3G18440 | Aluminum-activated malate transporter 9 (ALMT9) | [14] |
| 20061150-26605700 | BnaA03g57410D | AT3G06130 | Heavy metal-associated domain (HMA) | [23] | |
| BnaA03g39800D | AT5G61240 | Leucine-rich repeat (LRR) family protein | [24] | ||
| 14408144-15038093 | BnaA03g03270D | AT5G11250 | Disease resistance protein (TIR-NBS-LRR class) | ||
| BnaA03g14650D | AT2G31660 | Super sensitive to ABA and drought2 (SAD2) | [25] | ||
| 11435749-11630658 | BnaA03g13730D | AT2G30140 | UDP-Glycosyltransferase superfamily protein | [26] | |
| 1012939-2022032 | BnaA08g30510D | AT4G19960 | K+ uptake permease 9 (KUP9) | [27] | |
| BnaA08g19190D | AT1G24620 | EF hand calcium-binding protein family (CML25) | [28] | ||
| BnaA08g26970D | AT1G08430 | Aluminum-activated malate transporter 1 (ALMT1) | |||
| 676816-1129401 | BnaC01g23380D | AT3G51490 | Metallothionein 3 (MT3) | [29] | |
| BnaC01g01650D | AT4G37270 | Response to toxic substance (HMA) | |||
| 3925832-4284222 | BnaC03g08920D | AT5G18370 | Disease resistance protein (TIR-NBS-LRR class) family | [30] | |
| 相对发芽率RGR | 3627529-9882343 | BnaC04g12580D | AT2G27780 | Transcription factor IIS family protein | [31] |
| 相对根长RRL | 17577932-2005963 | BnaA03g35920D | AT3G20750 | Zinc ion binding (GATA) | [32] |
| 24406111-29734315 | BnaA03g35900D | AT5G26717 | Putative membrane lipoprotein | [33] | |
| BnaA03g54580D | AT1G34370 | Sensitive to proton rhizotoxicity 1 (STOP1) | [15] | ||
| 866809-2227131 | BnaA09g11920D | AT1G64065 | Late embryogenesis abundant (LEA) | [34] | |
| BnaA09g14610D | AT3G43570 | GDSL-like Lipase/Acylhydrolase superfamily protein | [35] | ||
| 51210223-55837858 | BnaC03g04310D | AT5G44050 | MATE efflux family protein | [16] | |
| BnaC03g65810D | AT4G34710 | Response to osmotic stress (ADC2) | [36] | ||
| 相对芽长RBL | 3249677-4604524 | BnaA03g39360D | AT5G02490 | Heat shock protein 70 (Hsp 70) family protein | [37] |
| 598224-1012939 | BnaA08g01480D | AT1G52490 | F-box associated interaction domain | [38] | |
| 22081699-23394648 | BnaA09g02290D | AT3G28415 | ABC transporter family protein | [39] | |
| BnaA09g30790D | AT1G22220 | F-box family protein | |||
| BnaA09g30810D | AT1G22190 | Response to toxic substance (RAP2.4) | [40] | ||
| 575326-705822 | BnaA08g28220D | AT1G05250 | Peroxidase superfamily protein | [41] | |
| 19580994-23049951 | BnaC08g07240D | AT1G33110 | MATE efflux family protein | ||
| 相对干重RDW | 32408555-33029777 | BnaA09g48330D | AT1G49360 | F-box family protein | |
| 16531371-16654826 | BnaA10g24620D | AT3G26180 | Cytochrome P450 proteins | [42] | |
| BnaA10g25760D | AT5G04410 | Regulation of flavonoid biosynthetic process (NAC) | [43] |
新窗口打开|下载CSV
相对发芽势区间内筛出12个与铝毒胁迫相关的候选基因。A01染色体上的基因BnaA01g26740D和A08染色体上的基因BnaA08g26970D分别与拟南芥基因AT3G18440和AT1G08430同源, 均为多种酸的转运蛋白, 主要通过分泌苹果酸来增强植株的耐铝性。A08染色体上的基因BnaA08g30510D和基因BnaA08g01910D分别与拟南芥基因AT1G24620和AT2G19600同源, 均参与植物生长发育中非生物胁迫的调控。A03染色体上的基因BnaA03g57410D 和C01染色体上的BnaC01g23380D 分别与拟南芥基因AT3G06130和AT3G51490同源, 均与有害金属的结合或解毒有关, 限制植物细胞的氧化损伤。A03染色体上的基因BnaA03g39800D、BnaA03g 03270D与C03染色体上的基因BnaC03g 08920D分别与拟南芥基因AT5G61240、AT5G11250和AT5G 18370同源, 均可增强植株的抗病性和防御功能。A03染色体上的基因BnaA03g13730D与拟南芥基因AT2G30140同源, 与乙酰氨基葡糖脱乙酰酶有关, 响应于抗菌的反应。A03染色体上的基因BnaA03g14650D与拟南芥基因AT2G31660同源, 在大多数植物组织中表达, 参与脱落酸激活反应。
相对发芽势的QTL置信区间内找到1个与铝毒胁迫相关的候选基因。在C04染色体上的基因BnaC04g12580D与拟南芥基因AT2G27780同源, 是一种转录因子, 通过诱导耐逆基因的表达增强植株的耐逆性。
相对根长的QTL置信区间内找到7个与铝毒胁迫相关的候选基因。在A03染色体上的基因BnaA03g54580D和C03染色体上的基因BnaC03g 04310D与拟南芥基因AT1G34370和AT5G44050同源, 与有机酸的分泌有关。位于A09染色体上的基因BnaA09g14610D与拟南芥基因AT3G43570同源, 是GDSL脂肪酶具有广泛底物特异性的水解酶。位于A09染色体上的基因BnaA09g11920D拟南芥基因AT1G64065同源, 与LEA蛋白有关。位于A03染色体上的基因BnaA03g35920D拟南芥基因AT3G 20750同源, 属于锌指蛋白, 在调控植物生长发育和应对逆境胁迫过程中发挥着重要的作用。位于C03染色体上的基因BnaC03g65810D与拟南芥基因AT4G34710同源, 是一种精氨酸脱羧酶, 催化多胺生物合成, 参与植物的各种非生物胁迫响应。
相对芽长的QTL置信区间内找到7个与铝毒胁迫相关的候选基因。在A03染色体上的基因BnaA03g 39360D与拟南芥基因AT5G02490同源, 属于热击蛋白。位于A08染色体上的基因BnaA08g 01480D和A09染色体上的基因BnaA09g30790D与拟南芥基因AT1G52490和AT1G22220同源, 为F-box蛋白家族成员。位于A09染色体上的基因BnaA09g02290D和A08染色体上的基因BnaA08g28220D分别与拟南芥基因AT3G28415和AT1G05250同源, 前者属于ABC转运蛋白的多药抗性相关蛋白, 后者是过氧化物酶, 具有较强的防御措施。位于A09染色体上的基因BnaA09g30810D与拟南芥基因AT1G22190同源, 该基因编码一种假定的转录因子, 响应渗透胁迫及非生物胁迫。位于C08染色体上的基因BnaC08g07240D拟南芥基因AT1G33110同源, 属于多药及毒性复合物排出转运蛋白家族。
相对干重的QTL置信区间内找到3个与铝胁迫相关的候选基因。A09染色体上的基因BnaA09g 48330D与拟南芥基因AT1G49360同源, 为F-box蛋白家族成员, 调控植物的抗逆反应。A10染色体上的基因BnaA10g24620D与拟南芥基因AT3G26180同源, 为细胞色素P450基因家族成员。A10染色体上的基因BnaA10g25760D与拟南芥基因AT5G 04410同源, 该基因作为转录激活因子可调节类黄酮生物合成, 增加植物类黄酮的含量, 能增强植物抵御逆胁迫的能力。
3 讨论
3.1 表型及QTL定位分析
土壤中积累过多的离子态铝对油菜的生长发育具有显著影响, 尤其对植物根部损害极大[44]。研究表明不同作物间或同一作物不同品种间的耐铝性均存在差异[45], 因此适宜的铝胁迫浓度是筛选油菜萌发期耐性资源的关键。根据前人经验[46], 本试验设计了8个浓度梯度进行铝胁迫浓度筛选, 最后筛选出与郜欢欢等[7]研究结果相近的80 μg mL-1铝溶液作为种子萌发期的处理浓度, 并以该溶液处理182份油菜种子, 综合分析相对发芽势、相对发芽率、相对根长、相对芽长、相对干重5个性状, 这些相对性状均表现出广泛的表型变异, 且数据呈现连续性分布, 符合数量性状遗传特征, 适宜于QTL分析。近年来, 分子标记技术多被用于研究作物耐逆性状, 在筛选优质、高产、多抗育种中发挥着重要作用[47]。过去常用于遗传连锁图谱构建的第二代分子标记主要是RFLP、AFLP、RFLP、ISSR和SSR等, 但这些传统的标记构建的高密度遗传连锁图谱是有限的, 而且耗时耗力。随着高通量测序技术的发展, SNP因具有良好的多态性和极高的丰度成为植物遗传育种研究中的理想遗传标记[48], 众多研究者利用SNP标记对多种作物进行遗传连锁图谱构建。如周清元等[49]运用全基因关联分析, 研究苯磺隆残留对油菜种子萌发的影响, 检测到16个SNP位点, 筛选出了25个可能与苯磺隆相关的候选基因。卫银可等[50]利用SNP标记研究了盐胁迫下甘蓝型油菜种子萌发的影响, 共检测到24个与表型相关的位点。
关于作物响应铝胁迫的分子机理方面, 研究者已经利用分子标记在水稻(Oryza sativa L.)[51]、小麦(Triticum aestivum L.)[52]、玉米(Zea mays L.)[53]中检测到多个耐铝毒相关的QTL和候选基因, 这些结果为多方面挖掘耐铝基因, 完善作物耐铝毒评价体系提供一定的参考。本研究利用高密度SNP遗传图谱, 对铝毒胁迫处理下的182份油菜种子的相对发芽势、相对发芽率、相对根长、相对芽长、相对干重进行QTL定位分析, 共检测到23个QTL, 分布于A01、A02、A03、A08、A09、A10、C01、C03、C04和C08染色体上。其中, 在A03染色体上同时检测到相对发芽势、相对芽长以及相对根长相关QTL。同样, A08、A09、C01、C03染色体上的同一区域均存在2个或2个以上相对性状的QTL, 即热区现象[54]。另外, 本研究在A08染色体2.275~12.834 cM处连续检测到相对发芽势qRGV-A08与相对发芽率位点qRBL-A08-1, 在A03染色体179.611~ 222.454 cM处检测到的相对发芽势qRGV-A03-1和相对根长qRRL-A03-2重叠, 表明这些QTL具有“一因多效”作用。
3.2 候选基因筛选
植物的耐铝性能主要与外部排斥和内部耐受机制有关。外部排斥主要通过细胞壁与铝的结合形成沉淀物[55]、质膜对铝的选择透性[56]、根际周围较高的pH值[57]、根冠细胞分泌出的粘性物及根系磷酸的分泌[58]等阻止植株吸收大量的铝从而减轻铝毒害, 内部耐受机制主要与细胞内有机酸鳌合[59]、逆境蛋白质[60]、抗铝酶的诱导及酶活性的提高[61]有关, 使植物根系将已吸收的离子态铝转化成结合态的铝, 从而缓解体内铝毒害作用。目前, 有机酸的分泌被认为是植物耐铝最重要的一个机制[62]。铝胁迫下植物分泌的有机酸主要有苹果酸、柠檬酸和草酸。本文中, ALMT1和MATE基因在多个QTL区间内出现。在相对发芽势的物理区间内检测到ALMT1基因, 其主要通过分泌的苹果酸来增强植株的抗逆性[14]。相对根长和相对芽长的物理区间内检测到的MATE基因属于多药及毒性复合物排出转运蛋白家族, 该基因主要通过控制Al3+激活柠檬酸的释放来增强植株的耐铝性[16]。相对根长的物理区间内检测到的STOP1基因, 在植株受到铝胁迫时被活化, 激活的STOP1蛋白进一步诱导植物体内其他的耐铝基因转录分泌更多的有机酸来增强植株的抗性[15]。植物受到逆境胁迫时会激活一系列分子途径并调控相关基因表达和生理反应来适应逆境[63]。如植物体内会诱导一些酶产生。本文中, 在A09染色体上的基因BnaA09g14610D编码GDSL脂肪酶[35], 于A08染色体上的基因BnaA08g28220D编码过氧化物酶[41], 均在多种植物的防御反应中起作用。此外, 植物体内会通过一些激活因子调节某些化合物的生成来维持正常的生理生化代谢。如植物体内生成的黄酮类化合物, 通过消耗过剩的磷酸丙糖、ATP和NADPH形成能量安全阀, 从而减轻非生物胁迫造成的损伤[43]。本文在A10染色体上筛选到一个BnaA10g25760D基因, 该基因作为一种转录激活因子调节植物体内黄酮类生物合成。此外还找出多种与逆境胁迫相关的蛋白, 如在A09染色体筛选到的基因BnaA09g30790D编码F-box蛋白, 该蛋白多数情况下以SCF复合体泛素化蛋白降解逆境蛋白的方式调控植物的抗逆反应[38]。位于A09染色体上的基因BnaA09g11920D编码的LEA蛋白, 是一组含有大量甘氨酸的亲水性极强蛋白, 对多种非生物胁迫具有很强的抵抗能力[34]。位于A03染色体上的基因BnaA03g20750和BnaA03g39360D分别编码热击蛋白[32]和锌指蛋白[37], 均与植物的逆境胁迫有关。
4 结论
共检测到铝胁迫下23个油菜种子萌发相关性状的QTL, 覆盖A、C基因组, 贡献率超过10%的有9个, 最大贡献率是13.10%。得到30个耐逆相关基因, 这些基因可能主要通过有机酸的分泌、转录因子诱导耐铝基因的表达和抗氧化防御来促进油菜对铝胁迫的抗逆性。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
DOI:10.1371/journal.pone.0083052URL [本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
.
[本文引用: 3]
[本文引用: 3]
DOI:10.1111/j.1744-7917.2012.01519.xURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.tplants.2005.07.001URL
DOI:10.1186/1756-6606-3-30URL
DOI:10.1006/jmbi.1999.3007URL [本文引用: 1]
DOI:10.1074/jbc.M002595200URL
[本文引用: 1]
DOI:10.1016/j.plipres.2004.09.002URL [本文引用: 1]
DOI:10.1111/ejb.1994.221.issue-3URL
DOI:10.1046/j.1432-1327.1998.2581014.xURL [本文引用: 1]
DOI:10.1016/S0092-8674(00)80403-1URL [本文引用: 1]
DOI:10.1007/s00425-002-0889-zURL
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s10681-006-9195-3URL [本文引用: 1]
DOI:10.6026/bioinformationURL [本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2019.03.002URL [本文引用: 1]

目的 研究苯磺隆残留对油菜种子萌发的影响,运用全基因组关联分析(genome-wide association analysis,GWAS)揭示苯磺隆胁迫下油菜萌发期相关性状的遗传因子和候选基因,探究油菜在苯磺隆逆境胁迫下的生理形态所反映的基因调控机制,为耐苯磺隆油菜品种的研究提供参考。方法 以241份甘蓝型油菜品种(系)为材料、25 mg·L -1苯磺隆溶液为处理液、蒸馏水为对照进行发芽试验。发芽7 d测定并计算相对发芽率、相对根长和相对鲜重。结合芸薹属60K SNP芯片分析群体基因型,通过STRUCTURE软件和TASSEL软件分别对该群体进行群体结构分析以及亲缘关系和LD衰减分析。为有效排除假关联的影响,采用一般线性模型(GLM)和混合线性模型(MLM)中的6种模型进行比较,确定每个性状GWAS分析的最优模型。同时,利用TASSEL软件在最优模型下对241份材料的3个性状分别进行全基因组关联分析,根据关联SNP位点的LD区间序列预测候选基因。 结果 241份品种(系)群体可分为P1(94份材料)和P2(147份材料)2个亚群,其中约56.28%的材料之间的亲缘关系值为0。全基因组关联分析(K+PCA模型)共检测到16个与性状显著关联的SNP位点,这些位点可解释9.42%—13.14%的表型变异率。通过分析显著SNP位点的LD区间与甘蓝型油菜对应的区间序列,筛选出25个候选基因可能与油菜耐苯磺隆有关,其中9个为细胞色素P450家族基因,5个参与谷胱甘肽合成或代谢过程,2个为多药耐药相关蛋白基因。同时发现与相对发芽率显著相关的基因ATGSTU19编码谷胱甘肽转移酶,参与毒素分解过程,在各种胁迫反应中起重要作用。在相对根长和相对鲜重共同鉴定到的候选基因BnaC02g27690D功能未知。结论 共检测到16个SNP位点与耐苯磺隆性状显著关联,筛选出25个候选基因可能与油菜耐苯磺隆有关。
DOI:10.3864/j.issn.0578-1752.2019.03.002URL [本文引用: 1]

目的 研究苯磺隆残留对油菜种子萌发的影响,运用全基因组关联分析(genome-wide association analysis,GWAS)揭示苯磺隆胁迫下油菜萌发期相关性状的遗传因子和候选基因,探究油菜在苯磺隆逆境胁迫下的生理形态所反映的基因调控机制,为耐苯磺隆油菜品种的研究提供参考。方法 以241份甘蓝型油菜品种(系)为材料、25 mg·L -1苯磺隆溶液为处理液、蒸馏水为对照进行发芽试验。发芽7 d测定并计算相对发芽率、相对根长和相对鲜重。结合芸薹属60K SNP芯片分析群体基因型,通过STRUCTURE软件和TASSEL软件分别对该群体进行群体结构分析以及亲缘关系和LD衰减分析。为有效排除假关联的影响,采用一般线性模型(GLM)和混合线性模型(MLM)中的6种模型进行比较,确定每个性状GWAS分析的最优模型。同时,利用TASSEL软件在最优模型下对241份材料的3个性状分别进行全基因组关联分析,根据关联SNP位点的LD区间序列预测候选基因。 结果 241份品种(系)群体可分为P1(94份材料)和P2(147份材料)2个亚群,其中约56.28%的材料之间的亲缘关系值为0。全基因组关联分析(K+PCA模型)共检测到16个与性状显著关联的SNP位点,这些位点可解释9.42%—13.14%的表型变异率。通过分析显著SNP位点的LD区间与甘蓝型油菜对应的区间序列,筛选出25个候选基因可能与油菜耐苯磺隆有关,其中9个为细胞色素P450家族基因,5个参与谷胱甘肽合成或代谢过程,2个为多药耐药相关蛋白基因。同时发现与相对发芽率显著相关的基因ATGSTU19编码谷胱甘肽转移酶,参与毒素分解过程,在各种胁迫反应中起重要作用。在相对根长和相对鲜重共同鉴定到的候选基因BnaC02g27690D功能未知。结论 共检测到16个SNP位点与耐苯磺隆性状显著关联,筛选出25个候选基因可能与油菜耐苯磺隆有关。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1146/annurev.pp.36.060185.002301URL [本文引用: 1]
DOI:10.1093/oxfordjournals.aob.a083953URL [本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.117.1.19URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
