 ,2,3,*, 许莉萍
,2,3,*, 许莉萍 ,1,4,*
,1,4,*Cloning and expression analysis of sugarcane Fe/S precursor protein gene ScPetC
ZHENG Qing-Lei1, YU Chen-Jing1, YAO Kun-Cun1, HUANG Ning1, QUE You-Xiong1,4, LING Hui ,2,3,*, XU Li-Ping
,2,3,*, XU Li-Ping ,1,4,*
,1,4,*通讯作者:
收稿日期:2019-11-10接受日期:2020-01-15网络出版日期:2020-06-12
| 基金资助: |
Received:2019-11-10Accepted:2020-01-15Online:2020-06-12
| Fund supported: |
作者简介 About authors
E-mail:zhengqinglei1666@163.com.。

摘要
关键词:
Abstract
Keywords:
PDF (6020KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
郑清雷, 余陈静, 姚坤存, 黄宁, 阙友雄, 凌辉, 许莉萍. 甘蔗Rieske Fe/S蛋白前体基因ScPetC的克隆及表达分析[J]. 作物学报, 2020, 46(6): 844-857. doi:10.3724/SP.J.1006.2020.94171
ZHENG Qing-Lei, YU Chen-Jing, YAO Kun-Cun, HUANG Ning, QUE You-Xiong, LING Hui, XU Li-Ping.
甘蔗(Saccharum spp. hybrids)是最重要的糖料作物和重要的能源作物[1]。甘蔗花叶病和黄叶病是甘蔗生产上最主要的2种病毒性病害, 严重影响甘蔗产量[2,3,4]。感染花叶病的甘蔗叶片会出现黄绿相间的嵌纹、条斑等症状, 严重时导致叶片失绿[2]。高粱花叶病毒(Sorghum mosaic virus, SrMV)属于马铃薯Y病毒属(Potyvirus), 是引起甘蔗花叶的主要原因之一[5]。甘蔗黄叶病毒(Sugarcane yellow leaf virus, SCYLV)属马铃薯卷叶病毒属(Polerovirus), 甘蔗感染后也会出现失绿症状[3], 但其典型症状是叶片的中脉发黄[3]。研究这2种病毒与宿主甘蔗基因的互作机制对甘蔗抗病育种具有重要意义。
一般而言, 植物RNA病毒的基因组具有多个开放读码框(open reading frame, ORF), 它们编码的蛋白控制着病毒侵染植物过程中的不同机制, 但不同的病毒之间也存在一些功能相似的蛋白。P1和P0蛋白分别是SrMV和SCYLV基因编码的首个蛋白, 并且都参与病毒—寄主互作以及病毒抑制宿主免疫反应[6,7,8,9,10,11]。前人通过对马铃薯Y病毒属的李痘病毒(Plum pox virus, PPV) P1蛋白进行研究, 发现此蛋白并没有直接的沉默抑制效应, 但可以通过自身剪切, 与HC-Pro配合行使沉默抑制功能[8,9]; 同属的黄瓜脉黄病毒 (Cucumber vein yellowing virus, CVYV) P1蛋白中的P1a前导蛋白对控制病毒特异性识别寄主具有重要作用[8]。在对植物致病方面, 当从PPV基因组中移除编码P1蛋白的区域后, 受PPV侵染的本氏烟(Nicotiana benthamiana)叶片坏死和萎缩症状加深[9]; 相反地, 当马铃薯卷叶病毒属的甘蔗黄叶病毒P0蛋白缺失N端的15个氨基酸后, 该蛋白则会丢失对植物的致病性[10]。另外, 也有报道称其同属的甜菜西黄病毒(Beet western yellows virus, BWYV) P0区域能转录出一个参与病毒和寄主相互识别作用的蛋白[11]。
叶绿体是高等植物进行光合作用的场所。一方面, 对植物的生长发育起着重要作用; 另一方面, 也成为自身健康生长的隐患[12,13]。当植物感染病毒后, 会利用叶绿体进行复制扩繁, 破坏叶绿体相关的结构原件, 影响光系统、电子传递链等过程, 最终影响植物正常生长[13]。截至目前, 已经发现多个植物叶绿体蛋白会同病毒蛋白互作并参与病毒侵染过程, 洋葱1,5-二磷酸核酮糖羧化酶/加氧酶大亚基(Rubisco large subunit, RbcL)和1,5-二磷酸核酮糖羧化酶/加氧酶小亚基(Rubisco small subunit, RbcS)都能与马铃薯Y病毒属的青葱黄条病毒 (Shallot yellow stripe virus, SYSV)、芜菁花叶病毒(Turnip mosaic virus, TuMV)、大豆花叶病毒(Soybean mosaic virus, SMV) P3蛋白互作, 参与叶片失绿症状的形成[14]。甘蔗花叶病毒(Sugarcane mosaic virus, SCMV)的VPg会和甘蔗NAD(P)H脱氢酶复合体O亚基在叶绿体内发生互作, 阻碍电子循环, 影响叶绿体的形成, 最终导致花叶病症[15]。半夏(Pinellia ternata)中的细胞色素b6f复合体还原型铁硫蛋白前体(Cytochrome b6f complex Rieske Fe/S precursor protein, PetC)会和大豆花叶病毒(Soybean mosaic virus, SMV)P1蛋白发生互作, 引起寄主对病毒的适应性改变[16]。在马铃薯卷叶病毒属病毒蛋白的研究中, 拟南芥S-相激酶相关蛋白(S-phase kinaserelated protein 1, AtASK1)能与甜菜西黄病毒(Beet western yellows virus, BWYV)、南瓜蚜传黄化病毒(Cucurbit aphid-borne yellows virus, CABYV)的P0蛋白发生互作, 降低植物对病毒的抵抗能力; 敲除本氏烟草内拟南芥AtASK1同源基因NbSKP1后, 感病本氏烟恢复对病毒的抵抗; 同时, 在突变P0氨基酸序列中最保守的F基序后, P0丢失了沉默抑制功能, 并且不再与AtASK1互作[17]。本氏烟草1,5-二磷酸核酮糖羧化酶/加氧酶大亚基装配因子2 (Rubisco Assembly Factor 2, RAF2)会与芸薹黄化病毒(Brassica yellows virus, BrYV)的P0蛋白互作, 并协助病毒进行侵染[18]。
植物的光合电子链主要由PSII (光反应系统II)、质体醌(plastoquinone, PQ)、细胞色素b6f复合体(cytochrome b6f complex, Cyt b6f)、质蓝素(plastocyanin, PC)、PSI (光反应系统I)和铁氧还原蛋白组成; 电子传递方式主要分为非环式电子传递、环式电子传递和假环式传递3种。在这3种电子传递过程中, Cyt b6f皆有参与[19]。Cyt b6f复合体包含4个大亚基 (细胞色素f、细胞色素b6、Fe/S蛋白和亚基IV)和4个小亚基 (PetG、PetI、PetM和PetN)[20]。自从Rieske等人在线粒体细胞色素bc1中发现大量携带有[2Fe-2S]结合域的蛋白之后, 这类蛋白就被大家称为Rieske蛋白[21,22]。现已从菠菜(Spinacia oleracea)[23]、豌豆(Pisum sativum)[24]等植物细胞色素b6f复合体中分离到Rieske Fe/S蛋白, 并且了解到该蛋白是由细胞核基因PetC编码[25], 在细胞质基质中合成蛋白前体, 由N端信号肽引导至叶绿体基质, 后被加工成成熟蛋白, 结合到类囊体膜上[26,27], 与细胞色素f、细胞色素b6和亚基IV共同装配成叶绿体细胞色素b6f复合体, 参与光合电子传递过程[28,29,30]。在转入PetC基因的水稻(Oryza sativa)[31]和拟南芥(Arabidopsis thaliana)[32]的试验中发现, PetC成熟蛋白在叶片内富集会提高光合系统电子传递量, 从而提高产量。西瓜在强光干旱胁迫下通过转变PetC蛋白翻译后修饰模式, 稳定此蛋白的表达量, 维持电子传递量, 进而缓解胁迫对植物的危害[33]。
时至今日, 越来越多植物中编码PetC的基因被克隆出来[31,32,33,34], 并发现它会响应强光[33]、模拟干旱[34]等非生物胁迫。不仅如此, 植物PetC在响应生物胁迫方面也有报道, 在感染了白粉病菌(Erysiohe graminis)的小麦(Triticum aestivum)表达序列标签(Expressed Sequence Tags, EST)的表达文库中, 编码PetC的基因出现了差异表达[35]。课题组[36]前期在黑穗病菌(Sporisorium scitamineum)侵染甘蔗黑穗病易感与抗性品种后, 质谱分析结果显示, 甘蔗高感品种Ya71-374中PetC相对于高抗品种NCo376中的表达量增加。Ling等[37]利用RNA定量的方法对感染SrMV甘蔗叶片进行分析, 结果显示ScPetC在抗性品种YZ01-1314中下调表达, 在易感品种ROC22、FN40中上调表达。虽然编码ScPetC成熟蛋白的序列已经被克隆出来并被命名为SoCYT[34], 但与此不同的是, 本研究中克隆到的是甘蔗细胞色素b6f复合体铁硫亚基蛋白前体基因。通过在本氏烟叶片进行瞬时表达, 我们观察了ScPetC亚细胞定位情况, 并利用酵母双杂交和双分子荧光互补实验, 验证该蛋白与SrMV-P1蛋白、SCYLV-P0蛋白的互作情况, 研究结果对深入了解PetC如何参与病毒引起甘蔗叶片变黄症状奠定一定的理论和实践基础。
1 材料与方法
1.1 材料和处理方法
供试甘蔗基因型为我国主栽品种新台糖22号, 由福建农林大学农业农村部福建甘蔗生物学与遗传育种重点实验室提供。RT-PCR克隆材料: 取植株的+1叶(第1片可见肥厚带的叶片), 用锡纸包好, 液氮速冻, 保存于-80℃冰箱。
组织特异性分析材料: 参照黄宁等[38]方法, 从田间选取健康长势一致的植株9株, 清理根部泥土, 取白色幼根作为材料; 从地面以上可见完整第1节间算起, 选取第7~8节段, 用75%酒精擦拭表皮, 从侧芽、蔗皮、蔗髓取样; 叶片选取甘蔗+1叶。以上样品均选择3株混合作为一个重复, 共3个生物学重复, 用锡箔纸包好所有材料, 立刻投入液氮速冻, 保存于-80℃冰箱。
不同外源胁迫处理材料: 考虑到植物会释放内源激素来抵抗病毒的侵染[13], 因此我们用不同外源胁迫处理甘蔗的方法来模拟病毒侵染。参照苏亚春等[39]方法, 在田间随机选取长势一致的植株, 将其蔗茎砍成单芽茎段、洗净, 放在含有100 mg L-1多菌灵(福瑞得, 中国郑州)水溶液中进行52℃温浴脱毒30 min, 然后将这些茎段种在无菌土中(16 h光/ 8 h暗, 28℃)培养, 直至长出蔗苗, 切下蔗苗用于无菌苗的诱导生根。随后放入蒸馏水中培养一段时间待其生长稳定, 从中挑选一部分健壮且长势一致的蔗苗, 置于250 mmol L-1氯化钠(sodium chloride, NaCl)、100 mmol L-1氯化铜(copper chloride, CuCl2)、500 mmol L-1氯化镉(cadmium chloride, CdCl2)的水溶液中培养, 并于0、6、12、24 h取样; 取另一部分蔗苗在100 μmol L-1脱落酸(abscisic acid, ABA)、5 mmol L-1水杨酸 (salicylic acid, SA) (含0.01%吐温-20, v/v)和25 mmol L-1茉莉酸甲酯(methyl jasmine, MeJA)(含0.01%吐温-20, v/v)水溶液中培养, 并于0、3、6、12 h取样, 每个处理选择3株混合作为1个重复, 共取3个生物学重复。每个样品取样完成、液氮速冻, 保存于-80℃冰箱。
1.2 RNA提取与cDNA的合成
采用TRIzol Reagent (Invitrogen, Carlsbad, USA)试剂提取所有甘蔗样品的总RNA, 提取方法参照Liu等[40], cDNA第一链合成方法参照RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, Lithuania, Vilnius)和PrimerScript RT-PCR Kit (Takara, 中国大连)试剂盒说明书。1.3 甘蔗ScPetC基因序列获取与RT-PCR克隆
基于课题组构建的感染SrMV叶片的甘蔗转录组uingene注释库, 挖掘得到ScPetC基因unigene序列(转录本ID: T2_Unigene_BMK.38583), 并根据其序列设计克隆特异性引物ScPetC-F/R (表1), 以甘蔗叶片cDNA为模板, 进行PCR扩增。PCR扩增程序为94℃ 4 min; 94℃ 30 s, 55℃ 30 s, 72℃ 60 s, 40个循环; 72℃ 10 min; 随后进行回收、纯化、测序与鉴定。Table 1
表1
表1引物序列及用途
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) | 用途 Usage |
|---|---|---|
| ScPetC-F | TGGACGCCAGGGAGTGAAC | 基因克隆 Gene cloning |
| ScPetC-R | TGTAGCAACAACGCCTTCGG | |
| ScPetC-QF | GTACAACAACCAGGGCAAGG | 实时荧光定量PCR qRT-PCR |
| ScPetC-QR | CAGGGACAGGAGGCATACAT | |
| CAC-F | ACAACGTCAGGCAAAGCAAA | 内参基因 Reference gene |
| CAC-R | AGATCAACTCCACCTCTGCG | |
| CUL-F | TGCTGAATGTGTTGAGCAGC | 内参基因 Reference gene |
| CUL-R | TTGTCGCGCTCCAAGTAGTC | |
| ScPetC-Subloc-F | CGAACGATACTCGAGGTCGACATGGCGACCTCCGCG | 亚细胞定位载体 Vector for subcellular localization |
| ScPetC-Subloc-R | GCTCACCATACTAGTGGATCCTGCCTTCCACCACGG | |
| ScPetC-AD-F | CCATGGAGGCCAGTGAATTCATGGCGACCTCCGCGGCGCT | 酵母双杂交载体 Vector for Y2H |
| ScPetC-AD-R | AGCTCGAGCTCGATGGATCCTGCCTTCCACCACGGGTCCT | |
| SrMV-P1-BK-F | TGGCCATGGAGGCCGAATTCATGGCAGGAGCATGGAGCAC | 酵母双杂交载体 Vector for Y2H |
| SrMV-P1-BK-R | CGCTGCAGGTCGACGGATCC AAAATAAGTAATTTCATTGA | |
| SCYLV-P0-BK-F | TGGCCATGGAGGCCGAATTCATGCTTTTCAACGAATTCTC | 酵母双杂交载体 Vector for Y2H |
| SCYLV-P0-BK-R | CGCTGCAGGTCGACGGATCCTATATCATGAGAATAGGTGC | |
| ScPetC-YN-F | TCTGAGGAGGATCTTCCCGGGATGGCGACCTCCGCGGCGCT | 双分子荧光互补实验载体 Vector for BiFC |
| ScPetC-YN-R | AGGGCATGCCTGCAGGTCGACGTGCCTTCCACCACGGGTCCT | |
| SrMV-P1-YC-F | TCTAGGAGCTCGGTACCCGGGATGGCAGGAGCATGGAGCAC | 双分子荧光互补试验载体 Vector for BiFC |
| SrMV-P1-YC-R | ATCGTATGGGTACATACTAGTAAAATAAGTAATTTCATTGA | |
| SCYLV-P0-YC-F | CTAGGAGCTCGGTACCCGGGATGCTTTTCAACGAATTCTC | 双分子荧光互补实验载体 Vector for BiFC |
| SCYLV-P0-YC-R | TCGTATGGGTACATACTAGTTATATCATGAGAATAGGTGC |
新窗口打开|下载CSV
1.4 生物信息学分析
利用ExPaSy、Prabi、SWISSMODEL在线软件, 对ScPetC进行一、二、三级结构预测, 使用NCBI conserved domains、SignalP 4.1 Server、TMHMM 2.0 Server、ProtScale和WoLFPSORT, 分别进行保守结构域、信号肽、跨膜结构域、疏水性和亚细胞定位预测, 在线软件网址如表2所示。使用DNAMAN 6.0将ScPetC基因编码的氨基酸序列与NCBI下载的来自其他植物的PetC的氨基酸进行多序列比对。参考Schmidt等[41]的方法, 使用MEGA 6.0软件对ScPetC、其他高等植物PetC和细胞色素bc1 Rieske Fe/S蛋白、蓝藻细菌细胞色素b6f Rieske Fe/S蛋白和细菌细胞色素c Rieske Fe/S蛋白进行进化树构建。通过MEME对植物氨基酸进行motif (基序)预测, 在Adobe Photoshop CS6上进行图片美化。Table 2
表2
表2生物信息学研究的数据库和软件
Table 2
| 工具Tool | 网址Website |
|---|---|
| ORF Finder | https://www.ncbi.nlm.nih.gov/orffinder/ |
| ExPaSy | http://web.expasy.org/protparam/ |
| Prabi | https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html |
| SWISSMODEL | http://swissmodel.expasy.org/interactive |
| SignalP 4.1 Server | http://www.cbs.dtu.dk/servers/SignalP/ |
| NCBI conserved domain | http: //blast.ncbi.nlm.nih.gov/ |
| WoLFPSORT | https://wolfpsort.hgc.jp/ |
| TMHMM 2.0 Server | http://www.cbs.dtu.dk/servers/TMHMM/ |
| ProtScale | https://web.expasy.org/protscale/ |
| MEME | http://meme-suite.org/ |
新窗口打开|下载CSV
1.5 酵母双杂交实验
以pMD19-ScPetC、pMD19-SrMV-P1、pMD19- SCYLV-P0 (课题组前期实验获得)质粒为模板, 以ScPetC-AD-F/R、SrMV-P1-BK-F/R、SCYLV-P0-BK-F/ R (表1)为引物, 通过PCR、胶回收获得基因编码序列。随后使用ClonExpress II One Step Cloning Kit (诺唯赞, 中国南京)同源重组的方法, 将基因编码序列导入经过限制性内切酶EcoR I和BamH I (Thermo Scientific, Lithuania, Vilnius)双酶切的pGADT7、pGBKT7载体中, 构建载体pGADT7-ScPetC、pGBKT7-P1、pGBKT7-P0。测序正确的阳性质粒以共转化方式导入酵母Y2HGold感受态细胞(上海维地, 中国上海)。实验参照Matchmaker Gold酵母双杂交系统说明书, 在SDO (SD/-Trp)固体培养基上进行毒性验证, 在SDO (SD/-Trp/X-α-Gal/AbA)固体培养基上进行自激活验证, 在QDO (SD/-Ade/-His/ Leu/-Trp/X-α-Gal)和QDO/X/A (SD/-Ade/-His/Leu/- Trp/X-α-Gal/AbA)固体培养基上进行互作验证。1.6 植物表达载体构建
以携带有ScPetC、SrMV-P1、SCYLV-P0基因的相关质粒为模板, 用引物ScPetC-YN-F/R、SrMV-P1- YC-F/R、SCYLV-P0-YC-F/R (表1)进行PCR、胶回收获得基因编码序列。随后使用ClonExpress II One Step Cloning Kit同源重组的方法, 将基因编码序列导入经过限制性内切酶Apa I和Sal I、Smal I和Spel I双酶切的pCAMBIA1300S-YN、pCAMBIA2300S- YC[42]载体中, 构建载体pCAMBIA1300S-YN- ScPetC、pCAMBIA2300S-YC-P1、pCAMBIA2300S- YC-P0用于双分子荧光互补试验 (Bimolecular Fluorescent Complimentary, BiFC)。以pMD19-T-ScPetC阳性质粒为模板, 使用引物ScPetC-Subloc-F/R (表1)进行PCR、胶回收获得基因编码序列。随后使用ClonExpress II One Step Cloning Kit同源重组的方法, 将基因编码序列导入经过限制性内切酶Sal I和BamH I双酶切的pCAMBIA2300-YFP载体中, 构建载体pCAMBIA2300-ScPetC-YFP用于蛋白亚细胞定位实验。
1.7 本氏烟草叶片注射与荧光观察
将pCAMBIA1300S-YN-ScPetC、pCAMBIA 2300S-YC-P1、pCAMBIA2300S-YC-P0和pCAMBIA 2300-ScPetC-YFP转化农杆菌菌株GV3101 (上海唯地, 中国上海), 在含有35 μg mL-1利福平和50 μg mL-1卡纳霉素的YPD液体培养基中扩繁后, 收集农杆菌菌体, 用MS盐缓冲液悬浮, 并将菌体悬浮液OD600调至0.8。加入乙酰丁香酮(工作浓度200 μmol L-1), 28℃避光诱导培养2 h, 随后注射本氏烟叶片下表皮, 于48 h后在激光共聚焦显微镜(Leica TCS SP8, 曼海姆, 德国)下拍摄YFP荧光(激发光波长514 nm, 捕获波长为530~590 nm)、叶绿体自发荧光(激发光波长552 nm, 捕获波长为650~680 nm)。1.8 实时荧光定量PCR (Quantitative real-time PCR, qRT-PCR)分析
根据ScPetC基因序列设计特异性定量引物ScPetC-QF/QR (表1), 以clathrin adaptor complex (CAC)和cullin (CUL)作为内参基因[43]。参照SYBR Green PCR Master Mix (Roche, 中国上海)试剂盒说明书配制定量反应体系, 进行定量PCR, 以检测目的基因在甘蔗的不同组织(根、芽、叶、蔗髓和蔗皮)和不同外源胁迫(SA、MeJA、ABA、NaCl、CuCl2和CdCl2)处理样品中的相对表达量。定量PCR程序为50℃ 2 min; 95℃预变性10 min, 95℃变性15 s, 60℃退火延伸1 min, 40个循环; 增加熔解曲线, 95℃ 15 s, 60℃ 1 min, 95℃ 15 s, 60℃ 15 s。每个样品设3次技术重复和3次生物学重复, 阴性对照以无菌水为模板, 定量数据采用2-ΔΔCT法计算基因相对表达量。使用DPS 7.05对数据进行显著性分析, Original 8.0软件做柱状图。2 结果与分析
2.1 甘蔗ScPetC基因克隆及生物信息学分析
采用基于SrMV侵染甘蔗的转录组数据库基因Unigene序列设计扩增引物, 以叶片cDNA为模板, 扩增得到一条长824 bp的片段 (图1-A)。扩增产物经过连接、转化、测序, 获得ScPetC基因序列。经过ORF Finder在线分析, ScPetC基因的完整开放读码框为678 bp, 编码225个氨基酸。与SoCYT基因(GenBank登录号为JQ712582)进行序列比对发现, 核酸相似度达到73.87%, ScPetC在5°端比SoCYT多129个碱基, 在3°端比SoCYT少了97个碱基, 但不影响蛋白编码。氨基酸比对结果显示, 2条基因编码的氨基酸序列相似度为84.44% (图1-B), 经过进一步的分析, ScPetC氨基酸链的N端比SoCYT多出33个氨基酸残基, 并且2条链中的第47个(丙氨酸A~缬氨酸V)、第70个(丝氨酸S~甘氨酸G)氨基酸不同。综上结果表明, 克隆自现代杂交种的ScPetC与成熟蛋白基因SoCYT的编码序列和蛋白序列高度保守, 仅存在个别位点的差异。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1甘蔗ScPetC基因的RT-PCR扩增及其编码氨基酸序列
(A) M: marker 100 bp; I: RT-PCR产物。(B) ScPetC: 甘蔗细胞色素b6f复合体还原型铁硫蛋白前体序列; SoCYT: 甘蔗细胞色素b6f复合体铁硫亚基氨基酸序列[34]。
Fig. 1RT-PCR amplification of ScPetC gene in sugarcane and its amino acid sequence
(A) M: DNA marker 100 bp; I: RT-PCR product. (B) ScPetC: Sugarcane cytochrome b6f complex reduced iron-sulfur protein precursor sequence; SoCYT: Sugarcane cytochrome b6f complex iron-sulfur subunit amino acid sequence[34].
利用ExPaSy在线软件对ScPetC一级结构进行预测, 结果显示该蛋白分子式为C1054H1668N294O315S11, 相对分子量为23.85 kD, 疏水性平均值为-0.146, 蛋白不稳定系数为21.61, 等电点为8.19 (表3)。蛋白不稳定系数小于40, 等电点大于7.5, 表明该蛋白为稳定的碱性蛋白; 通过SignaIP 4.1 server、TMHMM 2.0 Server和NCBI conserved domains软件对ScPetC结构域或基序进行预测, 结果表明该蛋白无信号肽(图2-A), 为非分泌蛋白, 并且在第66个到第88个氨基酸之间存在一个跨膜区域(图2-B), 属于PRK13474超家族(图2-C)。因此推测ScPetC是一个碱性稳定亲水非分泌蛋白。
Table 3
表3
表3ScPetC一级结构预测分析
Table 3
| 一级结构特性Primary structure characteristic | 预测结果Predicted result |
|---|---|
| 编码的氨基酸个数Number of coding amino acids | 225 |
| 等电点 Theoretical pI | 8.19 |
| 分子量 Molecular weight (×103) | 23.85 |
| 分子式 Formula | C1054H1668N294O315S11 |
| 不稳定系数 Instability index (II) | 21.61 |
| 平均疏水性Grand average of hydropathicity (GRAVY) | -0.146 |
新窗口打开|下载CSV
图2
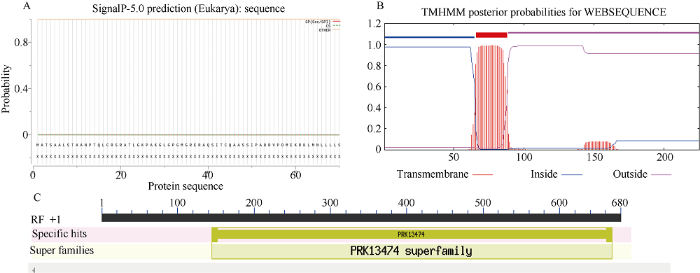 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2甘蔗ScPetC的生物信息学软件预测结果
A: 信号肽; B: 跨膜结构域; C: 保守结构域。
Fig. 2Prediction result of sugarcane ScPetC by bioinformatics software
A: signal peptide; B: transmembrane domain; C: conservative domain.
ScPetC的二级结构预测结果显示, α螺旋、延伸链和无规则卷曲的氨基酸残基数分别为42、49和134个, 占比分别为18.67%、21.78%和59.56%。
根据SWISSMODEL三维结构预测, 比较甘蔗与单子叶植物水稻、双子叶植物半夏和菠菜PetC三维空间结构 (图3), 甘蔗ScPetC构象与其他3种植物空间构象基本相似, 都具有N末端α螺旋结构和[2Fe-2S]结合域, 但甘蔗该蛋白的构象中多出了一个α螺旋结构(图3-A)。
图3
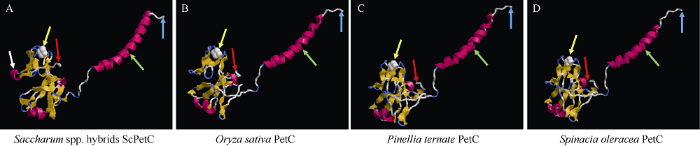 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3甘蔗、水稻、半夏和菠菜的PetC成熟蛋白三级结构预测
黄色箭头处为PetC蛋白的[2Fe-2S]结合域; 蓝色和红色箭头所指位点为氨基酸链的N端和C端; 绿色箭头所指位点为α螺旋。图A中白色箭头表示ScPetC与其他植物PetC的差异α螺旋所在位置。
Fig. 3Predicted third structure of mature PetC in Saccharum spp. hybrids, Oryza sativa, Pinellia ternate, and Spinacia oleracea
Yellow arrow is the conservative binding domain [2Fe-2S] of PetC; blue and red arrows represent the N-terminus and C-terminus of the amino acid chain; green arrows represent α helix. White arrow represents the α helix in sugarcane that is different from other plants of tertiary structure in figure A.
根据WoLFPSORT对ScPetC氨基酸序列的扫描结果, 了解到该蛋白定位于甘蔗细胞的亚细胞结构中的可能性由大到小, 分别为叶绿体类囊体(65.7%)、线粒体(15.38%)、细胞质(13.29%)、细胞核(11.59%)、液泡(11.01%)和叶绿体基质(8.95%)。因此, 本研究推测ScPetC最有可能定位于叶绿体类囊体。
2.2 甘蔗ScPetC的保守结构域及系统进化
对比甘蔗与其他植物PetC氨基酸序列(图4), 发现甘蔗与高粱(Sorghum bicolor)、水稻、半夏、本氏烟、菠菜和豌豆的PetC序列相似度分别是97.35%、84.14%、70.74%、68.87%、66.95%和64.38%。这7种植物的PetC序列中均含有N末端的转移多肽区域、跨膜α螺旋区域、结合[2Fe-2S]的Rieske区域和靠近C末端的脯氨酸环区域(图4)。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4甘蔗ScPetC与其他植物PetC氨基酸序列对比
红色方框表示ScPetC内为已报道保守氨基酸基序。CAM57108: 半夏; XP_015647138: 水稻; XP_002441121: 高粱; P08980: 菠菜; P26291: 豌豆; CAA45705: 本氏烟。
Fig. 4Amino acid sequence aligenment of sugarcane ScPetC and other plant PetC
Red squares indicate the reported conserved motif of amino acid regions within the ScPetC. CAM57108: Pinellia ternate; XP_015647138: Oryza sativa; XP_002441121: Sorghum bicolor; P08980: Spinacia oleracea; P26291: Pisum sativum; CAA45705: Nicotiana benthamiana.
将甘蔗与27个其他物种PetC的氨基酸序列构建系统进化树(图5)。结果显示, 所有物种的PetC可以被划分为细胞色素bc1复合体和细胞色素b6f复合体2个亚类。在细胞色素b6f复合体亚类中, 不同物种的PetC可以被分为5组(I、II、III、IV、V), 其中甘蔗与高粱的PetC聚为一个分支, 表明其亲缘关系较近。细胞色素bc1复合体亚类中, 不同物种的PetC可以被分为2组(VI、VII)。MEME软件预测结果显示, ScPetC和其他高等植物细胞色素b6f复合体PetC一样具有6个motif。综上, 本研究推测ScPetC也可能与其他植物PetC具有相似的功能。
图5
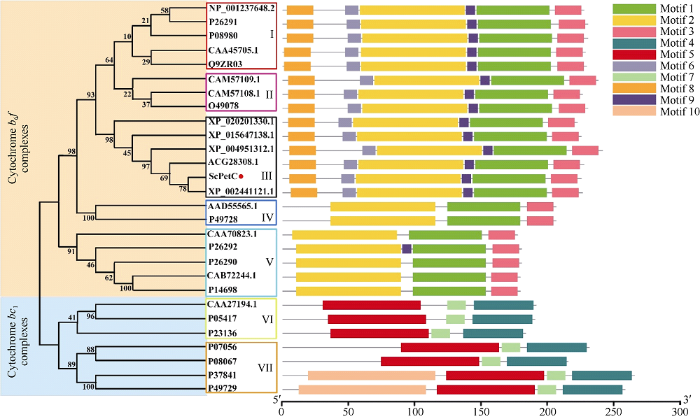 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5甘蔗ScPetC与其他物种PetC的系统进化树分析与motif预测
图中进化树橘色部分代表细胞色素b6f复合体类, 蓝色部分代表细胞色素bc1复合体类; III组中的红色圆圈标记为ScPetC; 不同颜色的方框代表不同的组(I、II、III、IV、V、VI、VII)。NP_001237648.2: 大豆; XP_015647138.1: 水稻; XP_0202013301.1: 小麦; Q9ZR03.1: 拟南芥; P26291: 豌豆; AAD55565.1: 团藻; CAA27194: 类红球细菌; CAA45705: 本氏烟; CAA70823: 席藻; CAB72244: 鱼腥藻; CAM57108.1: 半夏; CAM57109.1: 马蹄莲; O49078: 贝母; P05417: 脱氮副球菌; P08067: 酿酒酵母; P08980: 菠菜; P14698: 蓝藻; P23136: 深红红螺菌; P26290: 集胞藻; P26291: 豌豆; P26292: 聚球藻; P37841: 马铃薯; P49728: 衣藻; Q9ZR03: 拟南芥; XP_002441121: 高粱; ACG28308: 玉米; XP_004951312: 小米。
Fig. 5Phylogenetic tree analysis of sugarcane ScPetC and PetC in other species and their corresponding motif prediction
The orange part of the phylogenetic tree represents the cytochrome b6f complex cluster, the blue part represents the cytochrome bc1 complex cluster; the red cycle is labeled as ScPetC; the different color boxes in the figure represent different groups (I, II, III, IV, V, VI, VII). NP_001237648.2: Glycine max; XP_015647138.1: Oryza sativa; XP_0202013301.1: Triticum aestivum; Q9ZR03.1: Arabidopsis thaliana; P26291: Pisum sativum; AAD55565.1: Volvox carteri f nagariensis; CAA27194: Rhodobacter sphaeroides; CAA45705: Nicotiana tabacum; CAA70823: Phormidium laminosum; CAB72244: Trichormus variabilis; CAM57108.1: Pinellia ternata; CAM57109.1: Zantedeschia aethiopica; O49078: Fritillaria agrestis; P05417: Paracoccus denitrificans; P08067: Saccharomyces cerevisiae; P08980: Spinacia oleracea; P14698: Desmonostoc sp. PCC; P23136: Rhodospirillum rubrum; P26290: Synechocystis sp. PCC; P26291: Pisum sativum; P26292: Synechococcus sp. PCC; P37841: Solanum tuberosum; P49728: Chlamydomonas reinhardtii; Q9ZR03: Arabidopsis thaliana; XP_002441121: Sorghum bicolor; ACG28308: Zea mays; XP_004951312: Setaria italica. motif 1: X6NAXCTHLGCVVPX3ENKFXCPCHGSX10GPAP; motif 2: NLX11PDX3RX3NLX22PX3GX3GXXAKGXXGNDX6LX7LXXGLKGDPTYX2V; motif 3: X7WXETDFRTX3PWW; motif 4: XGDX3 GWFCPCHGSHYDX2GRIRXGPAPXNLX15; motif 5: X7MX4DX2AX5 VX7GX6 WXGKPVFXRXRX4IX5VX4LXDX10; motif 6: X2AXSIX ADXV; motif 7: XWLX3GXCTHLGCX; motif 8: X9QLX10; motif 9: LVVEXDXT; motif 10: FX5FX3DDSSX2RSXSPSLXSXFLX3RGFS SNSVSPAHX2GLVXDLPXTVAAIKNPXSKIVYDX2 NHERYPPGDPSKRAFAYFVLTGGRFVY.
2.3 甘蔗ScPetC的亚细胞定位
由图6可知, 对照组中YFP黄色荧光信号在本氏烟叶表皮细胞的细胞膜、细胞核和细胞质均有分布; ScPetC-YFP融合蛋白的黄色荧光信号既定位于质膜、细胞质, 又与叶绿体的自荧光信号重合, 显示出橙色, 表明ScPetC定位于叶绿体(图6)。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6甘蔗ScPetC亚细胞定位结果
农杆菌介导ScPetC及空载体在本氏烟叶片瞬时表达48 h后的亚细胞定位结果; 本氏烟叶片表皮细胞被用于明场、黄色荧光、叶绿体自发荧光、明场和黄色及红色荧光叠加后的图像分析; 蓝色箭头1、2分别表示细胞核、质膜; 红色虚线框表示被放大区域; 比例尺=50 μm; 35S::YFP: 携带空载pCAMBIA2300-YFP的农杆菌菌株; 35S:: ScPetC::YFP: 携带重组载体pCAMBIA2300-ScPetC-YFP的农杆菌菌株。
Fig. 6Results of subcellular localization of sugarcane ScPetC
Subcellular localizations of the Agrobacterium tumefaciens mediated transformation of ScPetC and empty vector in Nicotiana benthamiana leaves after 48 h infiltration; the epidermal cells of Nicotiana benthamiana were used for taking images of visible light, yellow fluorescence, chloroplast autofluorescence, and merged visible light. Blue arrows 1 and 2 indicate nucleus and plasma membrane. The area in the red rectangle is magnified. Bar=50 μm; 35S::YFP: the Agrobacterium tumefaciens strain carrying the empty vector pCAMBIA2300-YFP; 35S:: ScPetC::YFP: the Agrobacterium tumefaciens strain carrying the recombinant vector pCAMBIA2300-ScPetC-YFP.
2.4 甘蔗ScPetC与病毒蛋白的互作
酵母双杂交互作实验中, 分别导入以下质粒组合pGADT7-T+pGBKT7-Lam、pGADT7-T+pGBKT7- 53、pGADT7-ScPetC+pGBKT7-P1、pGADT7-ScPetC+ pGBKT7-P0、pGADT7-ScPetC+pGBKT7、pGADT7+ pGBKT7-P1、pGADT7+pGBKT7-P0到Y2Hgolden菌株中, 它们均能在DDO (SD/-Leu/-Trp)固体培养基上正常生长, 说明质粒组合成功转入酵母感受细胞。同时, 在QDO (SD/-Ade/-His/-Leu/-Trp/X-α-Gal)和QDO/X/A (SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA)固体培养基上, 阳性对照能正常生长并在加入X-α-Gal后表现出蓝色, 阴性对照不能正常生长, pGADT7-ScPetC+pGBKT7-P1不能在酵母缺陷培养基上生长(图7-A), 而pGADT7-ScPetC+pGBKT7- P0能在缺陷培养基上生长并且在加入X-α-Gal后成功显色, 说明ScPetC与SrMV-P1蛋白不存在互作, 与SCYLV-P0蛋白存在互作(图7-B)。图7
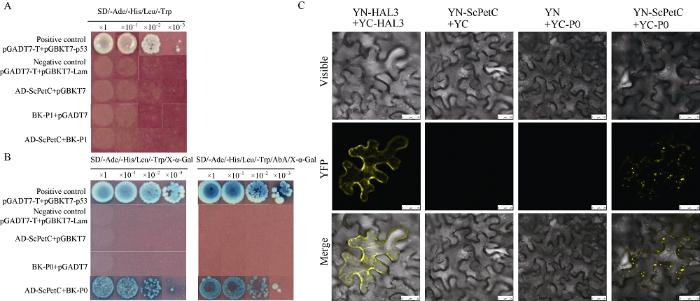 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7甘蔗ScPetC与高粱花叶病毒和甘蔗黄叶病毒蛋白的互作实验验证
A: 甘蔗ScPetC与SrMV-P1蛋白的酵母双杂交互作验证。B: 甘蔗ScPetC与SCYLV-P0蛋白的酵母双杂交互作验证; SD/-Ade/-His/Leu/-Trp: 腺嘌呤、组氨酸、亮氨酸和色氨酸营养缺陷型平板培养基; SD/-Ade/-His/Leu/-Trp/X-α-Gal: 腺嘌呤、组氨酸、亮氨酸和色氨酸营养缺陷型平板培养基(添加5-溴-4-氯-3-吲哚-α-D-半乳糖苷); SD/-Ade/-His/Leu/-Trp/X-α-Gal/AbA: 腺嘌呤、组氨酸、亮氨酸和色氨酸营养缺陷型平板培养基(添加5-溴-4-氯-3-吲哚-α-D-半乳糖苷和金担子素A)。C: ScPetC与SCYLV-P0蛋白的双分子荧光互补实验; YC、YN、YN-ScPetC和YC-P0分别代表质粒pCAMBIA2300S-YC、pCAMBIA2300S-YN、pCAMBIA2300S-YN-ScPetC和pCAMBIA2300S-YC-P0 [42]。
Fig. 7The interaction assay of sugarcane ScPetC with virus proteins of Sorghum mosaic virus (SrMV) or Sugarcane yellow leaf virus (SCYLV)
A: ScPetC was verified by yeast double-hybrid interaction with SrMV-P1 protein. B: ScPetC was verified by yeast double-hybrid interaction with SCYLV-P0 protein; SD/-Ade/-His/Leu/-Trp: synthetic dropout medium plate without adenine, histidine, leucine, tryptophan; SD/-Ade/-His/Leu/-Trp/X-α-Gal: synthetic dropout medium plate without adenine, histidine, leucine, tryptophan (plus 5-bromo-4-chloro-3- indoxyl-α-D-galactopyranoside); SD/-Ade/-His/Leu/-Trp/X-α-Gal/AbA: synthetic dropout medium plate without adenine, histidine, leucine, tryptophan (plus 5-bromo-4-chloro-3-indoxyl-α-D-galactopyranoside and aureobasidin A). C: the bimolecular fluorescence complementation (BiFC) assay of the interaction between ScPetC and SCYLV-P0 protein; YC, YN, YN-ScPetC, YC-P0 represent the plasmids pCAMBIA2300S-YC, pCAMBIA2300S-YN, pCAMBIA2300S-YN-ScPetC, pCAMBIA2300S-YC-P0, respectively[42].
为进一步验证互作结果, 本研究将ScPetC基因构入pCAMBIA1300S-YN载体, 形成YN-ScPetC; SCYLV-P0基因构入pCAMBIA2300S-YC载体, 形成YC-P0; 结果在注射YN-ScPetC和YC-P0的本氏烟叶片细胞内出现了黄色荧光(图7-C)。酵母互作和双分子荧光互补实验的结果一致, 说明ScPetC和SCYLV-P0确实存在互作。
2.5 甘蔗ScPetC基因的转录表达模式分析
由图8-A可知, ScPetC基因在甘蔗叶片中的表达量最高, 其次是蔗皮、蔗芽和蔗髓, 在根中几乎不表达。分析结果显示, 该基因在叶片中的表达量分别是蔗髓、蔗芽、蔗皮和根部表达量的15、15、4和174倍, 说明该基因在叶绿体和线粒体丰富的细胞中均有表达。图8
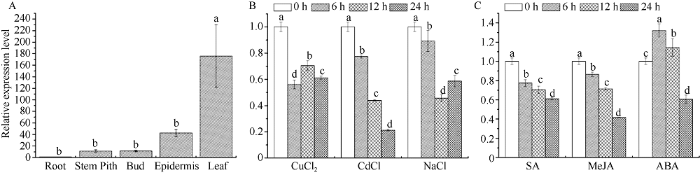 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8甘蔗ScPetC基因的转录表达模式分析
A: 甘蔗ScPetC基因在甘蔗不同组织中的表达情况; B和C: 甘蔗ScPetC基因在不同外源胁迫下的相对表达情况。不同的小写字母(a、b、c、d)表示差异显著性(P ≤ 0.05); 误差线为每组处理的标准误差(n = 3)。
Fig. 8Transcriptional expression pattern analysis of sugarcane ScPetC gene
A: the tissure-specific expression analysis of ScPetC gene in sugarcane; B and C: relative expression of ScPetC in sugarcane under different exogenous stresses. Bars with different superscripts (a, b, c, d) represent differ significantly (P ≤ 0.05) and error bars represent the standard error of each treating group (n = 3).
分析ScPetC基因在不同外源胁迫下的表达特性, 结果表明在对甘蔗施以CuCl2、CdCl2和NaCl处理后, ScPetC的表达量下降并显著低于对照(图8-B); 用SA、MeJA处理甘蔗后, ScPetC表达量随着施用时间延长, 持续下降; 甘蔗在受ABA处理3 h后, ScPetC的表达量显著提高并达到峰值, 为对照组的1.3倍, 当处理时间达到6 h时, 表达量下降但仍高于对照, 处理达到12 h时, 表达量下降并显著低于对照(图8-C)。我们推测该基因可以在短时间内积极响应ABA的胁迫。
3 讨论
植物受到病毒侵染时, 会通过改变体内相关基因的表达量来抵抗病毒侵染。叶绿体作为植物重要的细胞器, 其中的基因与蛋白也会参与到病毒抵御过程[13]。到目前为止, 已经发现多个叶绿体蛋白能参与到病毒的复制、移动、致病等过程中[13]。ScPetC成熟蛋白是植物细胞色素b6f复合体的元件之一, 在叶绿体光合电子转运过程中起重要的作用[20], 但是关于植物ScPetC与病毒蛋白互作研究仍比较少见, 截至目前只有两例, 一例是半夏PetC与马铃薯Y病毒属SMV-P1蛋白互作[16]; 另一例是拟南芥PetC与马铃薯Y病毒属TuMV-HC-Pro蛋白互作[44]。本研究是首次报道ScPetC与马铃薯卷叶病毒属SCYLV- P0蛋白互作。ScPetC属于PRK13474超家族, 包含由半胱氨酸和组氨酸组成的(CTHXXC, CPCHXX) Rieske结构域 (图4)。这个结构域位于氨基酸链的C端附近, 是Rieske家族蛋白主要特征[41]。高等植物Rieske蛋白主要被分为两类, 分别是细胞色素b6f复合体类和细胞色素bc1复合体类。本研究中ScPetC属于细胞色素b6f复合体类, 其N端存在一个由33个氨基酸组成的区域, 在梁潘霞等[34]克隆到的SoCYT基因编码氨基酸链中并不存在。通过与其他植物PetC氨基酸序列比对后, 认识到这段氨基酸是转移多肽区域, 其中的保守序列与前人研究结果相一致[23,24], 因此我们确定克隆到的是甘蔗叶绿体细胞色素b6f复合体Rieske Fe/S蛋白前体基因。生物信息学分析显示, ScPetC为碱性蛋白, 不同于SoCYT基因所编码蛋白质pI值小于7的结果[34], 其主要原因是N端转移多肽区内存在多个碱性氨基酸引起ScPetC整体平均pI值大于7。使用SWISSMODEL对ScPetC进行三级结构预测, 其结果表明其与拟南芥PetC成熟蛋白在三维结构上极为相似[44], 说明植物PetC蛋白在结构上极为保守, 极可能行使高度保守的生物学功能。经过仔细比对观察, 发现ScPetC三级结构组成是从第55个缬氨酸V开始, N端转移多肽不在ScPetC成熟蛋白的三维构象中。另外, 在甘蔗与其他植物PetC蛋白三级结构的对比结果中, 我们发现ScPetC多出一段α螺旋结构(图3-A), 这或许是ScPetC和SrMV-P1蛋白之间不存在互作的原因, 这与半夏PetC蛋白和SMV-P1蛋白互作的结果有所不同[16]。从所构建的系统进化树中, 我们发现甘蔗和高粱的PetC蛋白被聚为一簇, 表明其亲缘关系最近, 这和前人研究结果一致[34]。有研究表明, 植物PetC一共有5个外显子保守区域[25], 本研究结果显示, ScPetC有6个motif, 包含了上述的5个保守区域。因此, 可以推测ScPetC与其他植物PetC具有相似的功能。
蛋白质的生物学功能与其在细胞中的定位密切相关。本研究对ScPetC亚细胞定位进行预测, 结果显示, 此蛋白定位在叶绿体类囊体的概率最大为65.70%, 细胞质的概率为13.29%, 叶绿体基质的概率为8.95%。在本氏烟叶片中的亚细胞定位分析表明, ScPetC定位在细胞质、细胞膜和叶绿体, 这与拟南芥PetC融合GFP荧光标签在本氏烟叶片细胞内的亚细胞定位结果相似[44]。课题组前期在SrMV侵染甘蔗的转录组研究中, 发现ScPetC基因发生了差异表达, 且在抗感品种中表现出不同的表达模式[37]。前人研究表明半夏PetC和马铃薯Y病毒属SMV-P1蛋白存在互作[16]。但酵母双杂交实验结果显示, SrMV-P1蛋白和ScPetC不存在互作, 因此, 我们比对了SrMV和SMV的P1蛋白氨基酸序列, 发现相似性只有9.25%; 半夏和甘蔗的PetC蛋白之间相似率为70.74% (图1-B), 我们推测是序列上的差异导致马铃薯Y病毒属病毒的P1蛋白不能与其寄主PetC蛋白互作, 这种互作可能只存在某些物种之中, 因而ScPetC基因在宿主受到SrMV侵染时所发生的差异表达可能是其他未知机制引起的。与此同时, 酵母双杂交和BiFC实验结果显示, ScPetC与SCYLV-P0蛋白互作发生在细胞膜周和细胞质内, 这和拟南芥PetC蛋白与TuMV-HC-Pro蛋白存在互作的结果相一致[44]。PetC蛋白是由核基因PetC编码的, 在细胞质中形成蛋白前体, 然后被引导到叶绿体内, 经过加工后的成熟蛋白铆在类囊体膜上, 参与Cyt b6f的形成。因此, 推测SCYLV-P0与ScPetC在细胞质中发生互作, 可能阻断了ScPetC由细胞质向叶绿体运输的过程, 影响了Cyt b6f正常组装, 破坏光合电子传递过程, 从而引起了甘蔗叶片变黄等症状。另外, SCYLV-P0蛋白和马铃薯Y病毒属病毒HC-Pro蛋白都具有沉默抑制的功能[10, 44], 但ScPetC是否参与P0蛋白沉默抑制作用仍需进一步验证。
在转PetC基因融合GUS标签的拟南芥中, GUS基因在叶片、茎、花、荚均有表达, 在根中却没有表达[25]。甘蔗组织表达定量结果显示, ScPetC在根中的表达量相对于蔗芽、蔗髓、蔗皮、叶片表现很低; 相反地, 其在叶中表达量最高。该基因之所以会在蔗芽、蔗髓、蔗皮等组织中有少量表达, 可能因为ScPetC是细胞核基因, 普遍存在于植物不同组织细胞中。课题组前期对感染SrMV的甘蔗易感和抗性品种进行了RNA-seq和qRT-PCR定量相关实验, 结果表明ScPetC基因在SrMV易感品种ROC22和FN40中上调表达, 在抗性品种YZ01-1413中下调表达[37]。由于没有找到SCYLV侵染甘蔗的中间载体, 也无法通过人工对甘蔗实现该病毒的接种, 因此并没有相关材料。但相关研究表明, SA或MeJa信号通路与病毒侵染相关[13], 因此我们用SA或MeJa模拟病毒等生物胁迫侵染。截至目前, 植物中的PetC基因在ABA、MeJA、SA等激素处理条件的定量表达分析尚无人报道。ABA是响应干旱、盐胁迫等非生物的关键调控因子[45]。在本研究中, 发现短时间的ABA处理可以引起ScPetC基因上调表达。推测其原因是: 在施加ABA后, 甘蔗叶片缺水、细胞渗透压变化, 引起光合效率降低, 植物为了补偿光合作用而上调表达光合组分基因, 但长时间的高表达对植物造成负担, 于是降低基因表达量以适应低光合作用。SA、JA作为植物系统获得抗性(systemic acquired resistance, SAR)和诱导系统抗性(induced systemic resistance, ISP)的重要信号分子[46]。SA、MeJA处理甘蔗后, PetC基因下调表达, 说明在植物受生物胁迫过程中, 植物可能通过抑制ScPetC的表达, 降低光合作用。用CuCl2、CdCl2溶液处理后, 甘蔗因受到重金属离子的毒害作用, ScPetC下调表达。NaCl处理条件下, PetC基因的表达量下降, 这与黄瓜幼苗在NaCl胁迫下, 叶片中的PetC基因的下调表达结果相似, 这同样可能是由于高盐环境的刺激引起了甘蔗叶片气孔闭合, CO2吸收量下降, 光合电子传递速率降低[47]。
4 结论
从甘蔗主栽品种新台糖22号叶片中成功分离到ScPetC基因, 该基因长824 bp, 包含一个678 bp的ORF, 编码226个氨基酸, 含有半胱氨酸和组氨酸[2Fe-2S]结合域, 属于PRK13474超家族。ScPetC为碱性稳定亲水非分泌蛋白, 其二级结构只有α螺旋、延伸链、无规则卷曲; 从ScPetC的序列、三维结构推测, PetC蛋白在植物中高度保守, 具有相似的生物学功能。ScPetC定位于细胞质、叶绿体和细胞膜, 与SrMV-P1蛋白不存在互作, 但与SCYLV-P0蛋白存在互作。ScPetC基因在甘蔗叶片中的表达量最高, 在蔗肉、蔗芽、蔗皮表达量较低, 在根中几乎不表达。在外源激素SA和MeJA、重金属 (CuCl2、CdCl2)和高盐(NaCl)溶液处理下, 均呈现下调表达; 但短时间ABA处理, 可以引起ScPetC基因的上调表达。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
URL [本文引用: 3]
DOI:10.1016/j.virol.2008.10.034URL [本文引用: 3]
DOI:10.1016/0042-6822(92)90073-XURL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 6]
DOI:10.1007/s11262-011-0596-6URL [本文引用: 1]

The P3 protein encoded by Shallot yellow stripe virus onion isolate (SYSV-O) interacted in the Yeast Two-hybrid (Y2H) system and in co-immunoprecipitation (Co-IP) assays with the large subunit of the ribulose-1,5-bisphosphate carboxylase/oxygenase (RubisCO) protein that is encoded by the rbcL gene of its onion host. Dissection analysis by Y2H showed that the main part of SYSV P3 (amino acids 1-390) and onion RbcL (amino acids 1-137) were responsible for the interaction. The P3 proteins encoded by Onion yellow dwarf virus (OYDV), Soybean mosaic virus Pinellia isolate (SMV-P), and Turnip mosaic virus (TuMV) also interacted with RbcL, suggesting that a P3/RbcL interaction might exist generally for potyviruses. An interaction between P3 of these potyviruses and the small subunit of RubisCO (RbcS) was also demonstrated. Moreover, the P3N-PIPO protein encoded by a newly identified open reading frame embedded within the P3 cistron also interacted with both RbcL and RbcS. It is possible that the potyvirus P3 protein affects the normal functions of RubisCO which thus contributes to symptom development.
DOI:10.3724/SP.J.1006.2019.94002URL [本文引用: 1]

NAD(P)H脱氢酶(NDH)复合体介导循环电子传递, 对于维持叶绿体高效的光合作用具有重要作用。甘蔗(Saccharum spp. hybrid)中NDH复合体应答及参与甘蔗花叶病毒(Sugarcane mosaic virus, SCMV)的侵染尚未见报道。本研究克隆了甘蔗NDH复合体的O亚基, 命名为ScNdhO, 其开放读码框(open reading frame, ORF)长度为471 bp, 编码长度为156 aa的蛋白。生物信息学分析表明, ScNdhO为稳定的亲水性蛋白, 不存在信号肽, 无跨膜结构域; 蛋白二级结构元件多为无规则卷曲, 具有典型的NDH复合体O亚基结构域; 系统进化树分析表明, 该蛋白属于NDH复合体O亚基蛋白家族。实时荧光定量 PCR分析发现, ScNdhO基因的表达具有明显的组织特异性, 在成熟甘蔗叶片中的表达量最高, 在茎中的表达量最低, 在根中几乎不表达; ScNdhO基因在SCMV侵染早期上调表达, 后期下调表达。亚细胞定位分析表明, ScNdhO定位于叶绿体。酵母双杂交(yeast two hybrid, Y2H)和双分子荧光互补(bimolecular fluorescence complementation, BiFC)实验表明, ScNdhO与SCMV-VPg互作。推测ScNdhO被SCMV选择性利用, 可能参与SCMV基因组复制及花叶病症状的产生。
DOI:10.3724/SP.J.1006.2019.94002URL [本文引用: 1]

NAD(P)H脱氢酶(NDH)复合体介导循环电子传递, 对于维持叶绿体高效的光合作用具有重要作用。甘蔗(Saccharum spp. hybrid)中NDH复合体应答及参与甘蔗花叶病毒(Sugarcane mosaic virus, SCMV)的侵染尚未见报道。本研究克隆了甘蔗NDH复合体的O亚基, 命名为ScNdhO, 其开放读码框(open reading frame, ORF)长度为471 bp, 编码长度为156 aa的蛋白。生物信息学分析表明, ScNdhO为稳定的亲水性蛋白, 不存在信号肽, 无跨膜结构域; 蛋白二级结构元件多为无规则卷曲, 具有典型的NDH复合体O亚基结构域; 系统进化树分析表明, 该蛋白属于NDH复合体O亚基蛋白家族。实时荧光定量 PCR分析发现, ScNdhO基因的表达具有明显的组织特异性, 在成熟甘蔗叶片中的表达量最高, 在茎中的表达量最低, 在根中几乎不表达; ScNdhO基因在SCMV侵染早期上调表达, 后期下调表达。亚细胞定位分析表明, ScNdhO定位于叶绿体。酵母双杂交(yeast two hybrid, Y2H)和双分子荧光互补(bimolecular fluorescence complementation, BiFC)实验表明, ScNdhO与SCMV-VPg互作。推测ScNdhO被SCMV选择性利用, 可能参与SCMV基因组复制及花叶病症状的产生。
DOI:10.1111/mpp.2007.8.issue-6URL [本文引用: 4]
DOI:10.1073/pnas.0510784103URL [本文引用: 1]
DOI:10.1093/jxb/ery131URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/jxb/eru495URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/BF00337775URL [本文引用: 2]
DOI:10.1007/BF00040617URL [本文引用: 2]
DOI:10.1093/pcp/pcf062URL [本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 8]
[本文引用: 8]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 5]
[本文引用: 5]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
