 ,2,3,*, 畅志坚
,2,3,*, 畅志坚 ,2,3,*
,2,3,*Genetic analysis and chromosomal localization of powdery mildew resistance gene in wheat germplasm CH1357
CHEN Fang1, QIAO Lin-Yi2,3, LI Rui2, LIU Cheng4, LI Xin2,3, GUO Hui-Juan2, ZHANG Shu-Wei2, CHANG Li-Fang2, LI Dong-Fang5, YAN Xiao-Tao2, REN Yong-Kang2, ZHANG Xiao-Jun ,2,3,*, CHANG Zhi-Jian
,2,3,*, CHANG Zhi-Jian ,2,3,*
,2,3,*通讯作者:
第一联系人:
收稿日期:2019-01-18接受日期:2019-05-12网络出版日期:2019-05-21
| 基金资助: |
Received:2019-01-18Accepted:2019-05-12Online:2019-05-21
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (4122KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
陈芳, 乔麟轶, 李锐, 刘成, 李欣, 郭慧娟, 张树伟, 常利芳, 李东方, 阎晓涛, 任永康, 张晓军, 畅志坚. 小麦新种质CH1357抗白粉病遗传分析及染色体定位[J]. 作物学报, 2019, 45(10): 1503-1510. doi:10.3724/SP.J.1006.2019.91011
CHEN Fang, QIAO Lin-Yi, LI Rui, LIU Cheng, LI Xin, GUO Hui-Juan, ZHANG Shu-Wei, CHANG Li-Fang, LI Dong-Fang, YAN Xiao-Tao, REN Yong-Kang, ZHANG Xiao-Jun, CHANG Zhi-Jian.
小麦(Tritium aestivum L., 2n = 6x = 42, AABBDD)是世界上主要粮食作物之一, 其产量和品质与粮食安全密切相关。由禾本科布氏白粉菌Blumeria graminis (DC.) f. sp. tritici (Bgt)侵染引起的白粉病是限制小麦产量和品质的一种主要病害, 在全世界小麦主产区普遍发生, 尤其是在过量使用氮肥和大量种植半矮秆小麦品种的国家盛行[1,2]。据全国农业技术推广服务中心测报, 2018年小麦白粉病发病面积预计高达603万公顷。其中, 对长江中下游、江淮、滇南、陇南、晋南、豫北、鲁中南高产灌区等麦区生产危害尤为严重(http://www.natesc. org.cn/sites/cb/)。挖掘抗病基因进行小麦遗传改良, 培育适应当地的抗病品种是控制病害最有效的措施, 对小麦种业发展和保障我国粮食安全具有重要意义[3]。
迄今为止, 国内外已鉴定出100多个抗小麦白粉病基因或QTL, 其中已被正式命名的基因位点有64个[4]。其中, 一些已被广泛应用于小麦的育种和生产, 如Pm2、Pm4、Pm8和Pm21等。然而, 由于小麦白粉菌具有菌株多样、病菌毒性基因变异快等特点, 大多数广泛种植的品种在推广应用3年至5年便开始逐渐丧失抗性[5,6]。例如, 20世纪70年代引进的小麦-黑麦T1BL·1RS易位系上抗白粉病基因Pm8的过度利用, 使得其毒性菌株的频率直线上升, 导致1990年小麦白粉病大流行, 对小麦产量造成严重损失[7,8]。因此, 持续挖掘和定位新的抗白粉病基因, 开发可用于分子育种的功能标记, 进行抗病基因的合理布局, 将对小麦品种的抗性改良起到积极的推进作用。
CH1357是八倍体小偃麦小偃7430与普通小麦冀麦26杂交, 再与中8701杂交选育而来的小偃麦渗入系, 其在成株期对白粉病表现出优良抗性, 苗期对多个菌株表现为免疫或高抗, 具有较高的育种应用价值。本研究对CH1357的白粉病抗性进行遗传分析, 并确定CH1357中白粉病抗性基因所在染色体的位置, 旨在为克隆并有效利用该抗源种质提供理论依据。
1 材料与方法
1.1 供试材料与白粉病菌株
白粉病苗期抗病性鉴定材料包括抗病亲本CH1357 (系谱为中8701//冀麦26/小偃7430), 感病亲本为台长29 (TC29)和绵阳11 (MY11), 台长29/CH1357的F1、BC1和483个F2:3家系, 绵阳11/CH1357的F1、BC1和411个F2:3家系。其中2个杂交组合的F2群体作为作图群体, 其F2:3家系用于统计抗病性的分离比, 以确定控制白粉病抗病基因的个数, F1和BC1群体的鉴定结果用于确定抗病基因的显隐性。Pm2a、Pm2b和Pm2c的载体品种UIka/8*Cc、KM2939和鸟麦用于不同白粉菌株的抗性反应比较。其中, UIka/8*Cc为前苏联品种; KM2939为小麦-冰草远缘杂交获得的新种质, 其系谱为4201/CMH83. 605//FC[16]; 鸟麦为地方品种[17]。
上述遗传群体F1、BC1和F2:3家系的抗病性鉴定在苗期进行, 所用白粉菌株为E09, 由中国农业科学院植物保护研究所周益林研究员惠赠, 本实验室通过活体幼苗保存。32个在我国中、北部小麦种植区采集并分离的白粉病菌株用于研究抗病亲本CH1357对不同菌株的抗性反应(表1), 由中国科学院遗传与发育生物学研究所农业资源研究中心安调过博士提供。
Table 1
表1
表1CH1357、台长29 (TC29)和绵阳11 (MY11)苗期对32个白粉菌株的抗性反应
Table 1
| 白粉菌株Bgt | 材料Material | 白粉菌株Bgt | 材料Material | 白粉菌株Bgt | 材料Material | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| CH1357 | TC29 | MY11 | CH1357 | TC29 | MY11 | CH1357 | TC29 | MY11 | |||
| B09 | 0 | 4 | 4 | B33 | 0 | 4 | 4 | B50 | 3 | 4 | 4 |
| B13 | 0 | 4 | 4 | B37 | 0 | 4 | 4 | B51 | 2 | 4 | 4 |
| B14 | 4 | 4 | 4 | B38 | 1 | 4 | 4 | B52 | 0 | 4 | 3 |
| B15 | 0 | 4 | 4 | B39 | 0 | 4 | 4 | B55 | 0 | 4 | 4 |
| B17 | 0 | 4 | 4 | B40 | 0 | 4 | 4 | B56 | 0 | 4 | 4 |
| B21 | 0 | 4 | 4 | B41 | 0 | 4 | 4 | B57 | 0 | 4 | 4 |
| B22 | 0 | 4 | 4 | B42 | 0 | 4 | 4 | E09 | 0 | 4 | 4 |
| B23 | 0 | 4 | 3 | B44 | 0 | 4 | 4 | E18 | 4 | 4 | 4 |
| B25 | 0 | 4 | 4 | B46 | 0 | 4 | 3 | E21 | 0 | 4 | 4 |
| B28 | 0 | 4 | 4 | B48 | 0 | 4 | 4 | E23-1 | 0 | 4 | 4 |
| B30 | 0 | 4 | 4 | B49 | 0 | 4 | 4 | - | - | - | - |
新窗口打开|下载CSV
1.2 苗期白粉病抗病性评价
在人工气候室中对供试材料进行苗期白粉病抗病性鉴定。利用75%酒精溶液对种子消毒后种植于72穴育苗盘内, 每穴播5粒种子, 每个育苗盘种植8个感病品种, 台长29作为感病对照, 以确保病害的充分发生。人工气候室的光照强度为125 μmol m-2 s-1, 光周期为12 h, 温度控制在16~22℃, 湿度控制在65%~70%。种植约10 d后用喷雾器喷湿幼苗, 将预先繁殖好的新鲜白粉菌采用人工扫抹法对二叶期幼苗接菌, 每材料处理5株苗, 重复鉴定3次。接菌约12 d, 待对照充分发病后, 采用0~4级分级标准[9]调查每株材料的侵染类型(infection type, IT)。IT = 0为免疫; IT = 0; 为近免疫; IT = 1为高抗; IT = 2为中抗; IT = 3为中感; IT = 4为高感。调查数据用SPSS软件进行c2检验, 以推断抗病基因的数目及显隐性。1.3 基因组DNA提取及PCR扩增
三叶期剪取台长29/CH1357和绵阳11/CH1357的F2单株叶片及亲本叶片, 利用CTAB法[10,11]提取基因组DNA。采用分离群体分组分析法(bulked segregant analysis, BSA), 根据抗病调查结果随机选取10株纯合抗病植株(表型为0级和0; 且其F2:3家系植株全部为抗病)和10株纯合感病植株(表型为4级且其F2:3家系植株全部为感病), 分别将其DNA等量混合建立抗病池和感病池。根据GrainGenes (https://wheat.pw.usda.gov/GG3/)公布的引物序列, 选用分布于小麦21条染色体的767对SSR引物在亲本台长29、绵阳11、CH1357以及抗病池和感病池间筛选多态性。根据筛选结果, 再补充差异标记所在染色体的其他分子标记。筛选的多态性引物进一步利用11个抗病单株和11个感病单株验证, 对多态性的引物利用作图群体进行PCR扩增。
PCR体系15 μL, 含2 μL DNA模板, 1.5 μL 10× buffer (10 mmol L-1 Tris-HCl, pH 8.3, 50 mmol L-1 KCl, 1.5 mmol L-1 MgCl2), 0.3 μL dNTP (0.2 mmol L-1), 2 μL引物(10 μmol L-1)和0.15 μL Taq酶。PCR扩增程序为95℃变性5 min, 95℃变性30 s, 55~62℃ (依引物退火温度而定)复性30 s, 72℃延伸40 s, 35个循环, 72℃延伸10 min, 12℃保存。利用8%非变性聚丙烯酰胺凝胶(Acr与Bis质量比为19:1)电泳检测PCR扩增产物, 硝酸银染后显色照相并观察结果。
1.4 染色体定位及遗传连锁图谱的构建
根据分子标记检测结果及抗病鉴定结果, 利用Haldane函数计算目标基因与标记之间的遗传距离(cM), 借助MapMaker 3.0软件[12]构建遗传连锁图谱。2 结果与分析
2.1 CH1357、台长29和绵阳11的白粉病抗性
利用32个白粉菌株分别接种亲本CH1357、台长29和绵阳11的两叶期幼苗, CH1357对E09等27个菌株均表现为免疫(IT = 0), 对B38表现为高抗(IT = 1), 对B51分别表现为中抗(IT = 2), 对B50表现为中感(IT = 3), 对B14和E18表现为高感(IT = 4); 台长29和绵阳11对32个白粉菌株均表现为感白粉病(IT = 3或4)(表1)。2.2 CH1357的白粉病抗性遗传分析
利用E09对抗病亲本CH1357、感病亲本台长29和绵阳11以及这2个抗感杂交组合的F1、BC1和F2:3家系群体进行苗期抗病性鉴定, 以分析控制CH1357中白粉病抗性基因的数目及显隐性。2个杂交组合的正反交F1植株对E09菌株均表现为免疫或近免疫(IT = 0或0;), 与抗病亲本CH1357的抗病反应类型一致, 说明CH1357中的白粉病抗性受显性核基因控制。经χ2检验2个杂交组合后代BC1植株的抗、感分离比例符合孟德尔单基因遗传(表2)。利用E09菌株对台长29/CH1357的483个F2:3家系进行抗病性鉴定, 其中纯合抗病家系为120个, 抗、感分离的家系为231个, 纯合感病家系为132个, 抗性分离比例符合1:2:1 (χ2 = 1.509, P = 0.470)。利用同一白粉菌株接种CH1357的另一组合绵阳11/CH1357的411个F2:3家系, 其中纯合抗病家系为108个, 发生抗、感分离的家系为208个, 纯合感病家系为95个, 经χ2检验符合孟德尔分离比例1:2:1 (χ2 = 0.883, P = 0.643)(表3)。上述CH1357两个杂交组合后代的表型鉴定结果表明CH1357对白粉菌株E09的抗性由单显性核基因控制, 将其暂命名为PmCH1357。Table 2
表2
表22个作图群体不同世代对白粉菌株E09的苗期抗性和分离比率
Table 2
| 亲本/组合 Parent/cross | 对白粉菌株E09的侵染类型 Infection types to Bgt isolates E09 | 理论比率 Theoretical ratio R:S | χ2值 χ2 value | P值 P-value | |||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | 0; | 1 | 2 | 3 | 4 | ||||
| CH1357 (P1) | 12 | 8 | |||||||
| 台长29 Taichang 29 (P2) | 5 | 15 | |||||||
| 绵阳11 Mianyang 11 (P3) | 5 | 14 | |||||||
| P2/P1 (F1) | 13 | 7 | |||||||
| P1/P2 (F1) | 15 | 5 | |||||||
| P2/P1//P2 (BC1) | 14 | 10 | 4 | 2 | 12 | 17 | 1:1 | 0.017 | 0.896 |
| P3/P1 (F1) | 14 | 5 | |||||||
| P1/P3 (F1) | 16 | 4 | |||||||
| P3/P1//P3 (BC1) | 12 | 14 | 2 | 1 | 12 | 15 | 1:1 | 0.071 | 0.789 |
新窗口打开|下载CSV
Table 3
表3
表32个F2:3作图群体对白粉菌株E09的苗期抗性
Table 3
| F2: 3家系表现型 Phenotype of F2:3 lines | 杂交组合 Hybrid cross | ||||
|---|---|---|---|---|---|
| CH1357/Taichang 29 | CH1357/Mianyang 11 | ||||
| 实际值 Actual value | 期望值 Expected value | 实际值 Actual value | 期望值 Expected value | ||
| 纯合抗病株 Resistant plants | 120 | 120.75 | 108 | 102.75 | |
| 抗性分离株 Heterozygous plants | 231 | 241.50 | 208 | 205.50 | |
| 纯合感病株 Susceptible plants | 132 | 120.75 | 95 | 102.75 | |
| 合计 Total | 483 | 411 | |||
| χ2 (1:2:1) | 1.509 | 0.883 | |||
| P值P-value | 0.470 | 0.643 | |||
新窗口打开|下载CSV
2.3 PmCH1357的染色体定位
所选的767对SSR引物中, 406对(52.9%)在亲本CH1357和台长29间存在多态性, 进一步在抗、感池间筛选多态性, 并利用抗、感小群体进行验证, 发现标记Xcfd81和Xgwm190在亲本、抗感池以及抗感小群体中均能扩增出一致的多态性条带(图1)。通过小麦数据库GrainGenes (https://wheat.pw.usda. gov/GG3/)及Wheat-urgi (https://wheat-urgi.versailles. inra.fr/), Xcfd81和Xgwm190位于染色体5DS。随后, 又利用5DS上已发表的与抗白粉病基因连锁的标记及其他SSR引物(共91对)进一步筛选, 发现6对引物Xbwm8、Xbwm9、Xbwm20、Xbwm21、Xbwm25[13]和Xmp510[14]在抗、感亲本和抗、感池间具有多态性。利用上述8对引物对台长29/CH1357的421个F2单株DNA进行扩增, 通过连锁分析, 初步将CH1357的抗白粉病基因定位于5D染色体短臂, 其两侧邻近标记Xcfd81和Xbwm8的遗传距离分别为2.0 cM和11.3 cM (图2-a)。又用上述8对引物在绵阳11、CH1357及其抗、感病池和抗、感病小群体间进行多态性鉴定, 发现这些引物与绵阳11/CH1357中的抗白粉病基因连锁。进一步对绵阳11/CH1357的341个F2单株进行DNA扩增, 通过遗传连锁分析, 将绵阳11/CH1357中的抗白粉病基因定位于染色体5DS, 两侧邻近标记为Xcfd81和Xbwm8, 遗传距离分别为1.5 cM和8.9 cM (图2-b)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1SSR标记Xcfd81和Xgwm190在CH1357 F2群体中的扩增结果
M: marker; Pr: 抗病亲本CH1357; Ps: 感病亲本台长29; Br: 抗病池; Bs: 感病池; 1~6: 纯合抗病株; 7~12: 纯合感病株。
Fig. 1Amplification result of SSR markers Xcfd81 and Xgwm190 in F2 population from wheat variety CH1357
M: marker; Pr: resistant parent CH1357; Ps: susceptible parent Taichang 29; Br: resistant bulk; Bs: susceptible bulk; 1-6: homozygous resistant plants; 7-12: homozygous susceptible plants.
图2
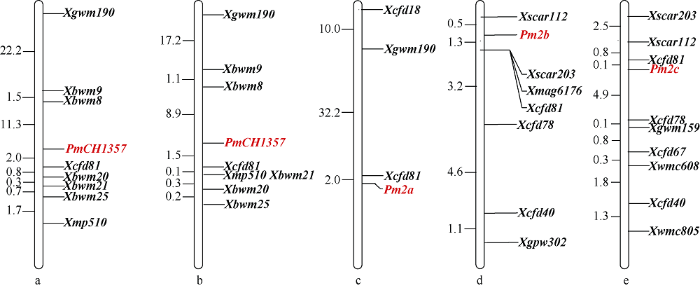 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2 PmCH1357在群体台长29/CH1357 (a)与绵阳11/CH1357 (b)中的遗传定位及其与Pm2位点其他基因的比较
Fig. 2Genetic mapping of PmCH1357 with populations Taichang 29/CH1357 (a) and Mianyang 11/CH1357 (b) and comparison with other genes in Pm2 loci
2.4 PmCH1357与染色体5DS上其他抗白粉病基因的比较
利用与PmCH1357连锁的8对引物对Pm2a、Pm2b、Pm2c的载体品种UIka、KM2939、鸟麦进行DNA扩增, 发现5对标记(Xcfd81、Xbwm20、Xbwm21、Xbwm25和Xmp510)在CH1357和3个抗白粉病基因的载体品种中的扩增条带都一致(图3)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3CH1357中连锁标记与染色体5DS上部分已知抗白粉病基因的比较
M: marker; 1: 台长29; 2: CH1357; 3: UIka (Pm2a) ; 4: KM2939 (Pm2b); 5: 鸟麦(Pm2c)。
Fig. 3Comparison of linkage markers in CH1357 with some documented stocks with known powdery mildew resistance genes on chromosome arm 5DS
M: marker; 1: Taichang 29; 2:CH1357; 3: UIka (Pm2a); 4: KM2939 (Pm2b); 5: Niaomai (Pm2c).
利用12个白粉菌株对PmCH1357、Pm2a、Pm2b和Pm2c的载体品种进行苗期白粉病抗性鉴定(表4)表明, CH1357对B38、B40、B51分别表现为高抗、免疫和中抗, 而UIka/8*Cc (Pm2a)对该3个菌株均表现为中感; CH1357对E18、E21分别表现为高感和免疫, 而KM2939 (Pm2b)对E18、E21的抗性反应分别为高抗和中感; CH1357对B14、E14均表现为高感, 而鸟麦(Pm2c)对B14、E14的抗性反应均为免疫。可见PmCH1357与Pm2a、Pm2b和Pm2c对12个白粉菌株的抗性反应明显不同。
Table 4
表4
表4CH1357与染色体5DS上已知抗白粉病基因对12个白粉菌株的抗性反应比较
Table 4
| 品种/品系 Variety/line | 抗白粉病基因 Pm gene | 白粉菌株 Blumeria graminis tritici isolate | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B13 | B14 | B38 | B40 | B41 | B50 | B51 | B56 | E09 | E18 | E21 | E23-1 | ||
| CH1357 | PmCH1357 | 0 | 4 | 1 | 0 | 0 | 3 | 2 | 0 | 0 | 4 | 0 | 0 |
| UIka/8*Cc | Pm2a | 0 | 4 | 3 | 3 | 1 | 4 | 3 | 0; | 0; | 4 | 0; | 0; |
| KM2939 | Pm2b | 0 | 4 | 1 | 0 | 0; | 4 | 0 | 0; | 0; | 1 | 3 | 0; |
| 鸟麦Niaomai | Pm2c | 0 | 0 | 2 | 0 | 0 | 4 | 0 | 0 | 0; | 0 | 0; | 0; |
新窗口打开|下载CSV
3 讨论
小麦白粉病菌株具有群体大、变异快等特点, 在抗源单一的情况下, 长期广泛种植含单一抗病基因的品种, 一旦出现新的毒性菌株, 会导致抗病基因的抗性丧失, 引起小麦白粉病大流行, 从而对小麦生产造成严重威胁[5,6]。目前虽然定位了大量的小麦主效抗白粉病基因, 但其中许多已对优势白粉病菌株丧失抗性, 可有效用于生产上的抗病基因甚少。因此, 不断挖掘新的抗白粉病基因, 保持抗病基因抗源的多元化至关重要。利用我国中、北部搜集的32个白粉菌株对CH1357进行苗期白粉病抗性鉴定, CH1357对其中的29个菌株具有抗性(表1)。由此可见, CH1357对我国中、北部的白粉病具有广谱型抗性, 在生产上具有较大的应用潜力。通过对台长29/CH1357和绵阳11/CH1357的2个F2分离群体进行抗病性遗传分析和抗病基因的鉴定, 发现CH1357的白粉病抗性受一对显性核基因控制, 其抗病基因PmCH1357位于5DS染色体上。由于单基因遗传一般对病原菌表现为垂直抗性, 极容易被新的病原菌致病型所克服, 因此CH1357在生产上应用时应当注意, 应尽量避免单独使用PmCH1357, 与其他抗病基因结合使用, 可以有效增加品种的抗病性, 并延长其抗病持久性。
目前, 已在小麦5DS染色体上鉴定出多个抗白粉病基因, 如来源于前苏联品种UIka的Pm2a[15], 冰草衍生品系KM2939和PB3558的Pm2b[16]和PmPB3558[13], 小麦地方品种鸟麦的Pm2c[17], 中国品种良星66、中麦155、汶农14、婴泊700和Subtil的PmLX66[18]、PmZ155[19]、PmW14[18]、PmYB[20]和PmSub[21]以及来源于德国品种Tabasco的Pm48[22]、法国品种FG-1的PmFG[23]和英国品种Brock的MlBrock等[24]。其中PmPB3558、PmLX66、PmZ155、PmW14、PmYB等可能是Pm2a的等位基因, 但Pm48不是Pm2a的等位基因, 因为利用15个白粉病菌株对Tabasco × Ulka/8*Cc (Chancellor)杂交的F2群体进行等位性测验发现这2个基因对测验菌株的抗性反应不同[23]。上述报道中的抗白粉病基因都与分子标记Xcfd81紧密连锁(图2), 其中Pm2a与标记Xcfd81的遗传距离为2.0 cM (图2-c), Pm2b为1.3 cM (图2-d), Pm2c为0.1 cM (图2-e), PmPB3558为5.5 cM, PmLX66为2.8 cM, PmZ155为3.6 cM, PmW14为1.8 cM, PmYB为0.9 cM, PmSub为0.9 cM, Pm48为3.1 cM, PmFG为0.3 cM, MlBrock为0.1 cM, 而PmCH1357在2个遗传群体中与标记Xcfd81的遗传距离分别为2.0 cM和1.5 cM。因此, 推测PmCH1357可能也位于Pm2位点或附近。PmCH1357在2个作图群体中连锁标记的顺序和遗传距离不完全相同, 可能是遗传背景差异造成的。
在同一染色体位点存在多个等位基因这一现象并不罕见。小麦白粉病抗性中, 已在Pm1[25]、Pm2[17]、Pm3[26]、Pm4[27]、Pm5[28]和Pm24[29]位点鉴定出多个抗病等位基因。迄今为止, 已在Pm3基因座上鉴定出17个功能等位基因。类似于Pm3, 在Pm2基因座上鉴定出越来越多的等位基因, 丰富了该位点的多样性。PmCH1357与Pm2是否具有等位关系, 尚需经过等位性测试进行证明。Sanchez- Martin等[30]利用突变体测序的方法获得了Pm2位点上的1个功能基因Pm2a, 根据该基因序列设计引物扩增本研究中的抗病材料, 结果显示二者序列并无差异。而PmCH1357与Pm2a、Pm2b和Pm2c对不同白粉菌株的抗病反应存在明显差异(表4), 推测PmCH1357与5DS上的其他抗白粉病基因不同, 可能是一个新的抗源。其连锁的分子标记, 可用于分子标记辅助选择(MAS), 提高育种效率。
4 结论
小麦种质CH1357对我国不同地区采集的32个白粉菌株中的27个表现为免疫或近免疫, 可作为我国黄淮及北部冬麦区的白粉病优质抗源, 其白粉病抗性受1对显性核基因控制, 暂命名为PmCH1357, 并将其抗病基因初步定位于小麦5DS染色体, 两侧连锁标记Xcfd81和Xbwm8的遗传距离分别为2.0 cM/11.3 cM和1.5 cM/8.9 cM, 推断PmCH1357与染色体5DS上的其他抗白粉病基因不同, 可能是一个新的抗源。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
