 ,1,*, 雷永1, 廖伯寿
,1,*, 雷永1, 廖伯寿 ,1,*
,1,*Expression profiles of FAD2 genes and their responses to cold stress in peanut
XUE Xiao-Meng1, LI Jian-Guo1, BAI Dong-Mei2, YAN Li-Ying1, WAN Li-Yun1, KANG Yan-Ping1, HUAI Dong-Xin ,1,*, LEI Yong1, LIAO Bo-Shou
,1,*, LEI Yong1, LIAO Bo-Shou ,1,*
,1,*通讯作者:
第一联系人:
收稿日期:2018-12-27接受日期:2019-05-12网络出版日期:2019-06-13
| 基金资助: |
Received:2018-12-27Accepted:2019-05-12Online:2019-06-13
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (3174KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
薛晓梦, 李建国, 白冬梅, 晏立英, 万丽云, 康彦平, 淮东欣, 雷永, 廖伯寿. 花生FAD2基因家族表达分析及其对低温胁迫的响应[J]. 作物学报, 2019, 45(10): 1586-1594. doi:10.3724/SP.J.1006.2019.84177
XUE Xiao-Meng, LI Jian-Guo, BAI Dong-Mei, YAN Li-Ying, WAN Li-Yun, KANG Yan-Ping, HUAI Dong-Xin, LEI Yong, LIAO Bo-Shou.
花生(Arachis hypogaea L.)是世界范围内主要的油料作物之一, 集中分布在热带、亚热带以及温带地区[1]。我国是主要的花生生产国, 目前种植面积达到近500万公顷, 占全球的20%。我国花生总产的一半左右用于榨油, 是世界上最大的花生消费国[2,3]。
花生的脂肪酸组成对其营养价值、食用品质、存储和加工性能以及市场价值等方面起着决定性作用。油酸(C18:1)和亚油酸(C18:2)是花生脂肪酸的主要成分, 其总和约占80%, 高油酸花生中油酸含量达到75%以上[4]。油酸能选择性地降低人体血液中有害的低密度胆固醇, 而保持有益的高密度胆固醇, 可有效预防心血管疾病的发生, 而且高油酸花生抗氧化能力强、货架期长, 因此受到广大消费者和花生加工企业的青睐。
在高油酸花生推广的过程中发现, 高油酸品种在低温条件下出苗率低, 特别在东北地区播种遭遇低温时常烂种, 高油酸品种表现不耐低温[5]。花生高油酸性状是由2对Δ12脂肪酸脱氢酶(fatty acid desaturase 2, FAD2)基因隐性突变导致的[6]。已有研究报道, 拟南芥(Arabidopsis thaliana) fad2突变体植株在低温条件下生长缓慢, 植株矮小, 耐低温能力显著低于野生型拟南芥[7,8]。酵母(Saccharomyces cerevisiae)的ScFAD2基因在低温处理2 h后ScFAD2转录水平上调, 之后其表达量回复到日常水平[9]。棉花(Gossypium hirsutum)的GhFAD2-3和GhFAD2-4在低温处理下表达量显著提高, 而GhFAD2-1和GhFAD2-2的表达不受温度影响[10]。花生具有多个AhFAD2家族基因, 它们在不同组织中的表达量不尽相同[11]。对于花生中的AhFAD2家族基因与花生耐寒性的关系鲜有报道。研究花生AhFAD2基因在低温胁迫条件下的响应水平, 对解析高油酸花生的耐寒性具有重要意义。
本研究从栽培种花生中克隆得到7个FAD2基因, 并通过荧光定量PCR (qRT-PCR)探究其在高油酸花生(ZH413)和普通油酸花生(ZH16)各组织器官中的表达模式, 通过比较ZH413和ZH16在低温胁迫条件下的发芽率、各AhFAD2基因在低温下的表达模式来分析花生FAD2基因与其耐低温能力的相关性, 将为解析和改良高油酸花生的耐寒性提供理论和技术基础。
1 材料与方法
1.1 试验材料
普通油酸花生中花16 (ZH16)油酸含量为54.3%, 高油酸花生中花413 (ZH413)油酸含量为78.8%, 均为珍珠豆型花生。种植试验在中国农业科学院油料作物研究所试验基地(武昌)进行, 于2017年5月初播种, 8月底收获。1.2 试剂与测序分析
大肠杆菌感受态Trans10、pEASY-Blunt Cloning Kit、Taq聚合酶、RNA抽提试剂盒均购自全式金生物科技有限公司; SYBR荧光PCR染料、反转录试剂盒等均购自诺唯赞生物科技有限公司; PCR引物的合成和测序由武汉擎科生物科技有限公司协助完成。1.3 总RNA的提取及cDNA的合成
花生播种后6 d, 分别收集ZH16和ZH413的胚根、胚轴、子叶和真叶; 60 d后分别收集ZH16和ZH413的根、茎、新叶、老叶、花以及未入土的果针; 100 d后分别收集ZH16和ZH413发育的种子, 并根据其种子形态划分为5个时期。将所有收集到的样品液氮速冻后, 存于-80℃备用。取100 mg左右的样品置液氮冷却的研钵中, 加入液氮迅速研磨成粉, 按照RNA提取试剂盒的方法提取总RNA。通过分光光度计和1%的琼脂糖凝胶电泳检测提取的总RNA质量, 取1 μg的DNA-free RNA根据反转录试剂盒提供的方法和将其反转为cDNA。
1.4 FAD2家族基因的克隆和测序分析
利用已知的花生FAD2基因(KF741365和KF741366)编码的氨基酸序列, 在花生基因组信息(http://www.peanutbase. org/)中进行blast分析, 得到花生中所有AhFAD2基因序列信息, 并根据核苷酸序列设计引物(表1)。分别以ZH16和ZH413发育种子的cDNA为模板, 克隆得到所有AhFAD2基因, 送公司测序。利用Copmuter PI/MW (https://web.expasy.org/protparam/)预测FAD2蛋白质的等电点及相对分子质量。Table 1
表1
表1克隆AhFAD2基因使用的引物及其序列
Table 1
| 基因 Gene | 基因注册号 Accession No. | 上游引物 Forward primer (5°-3°) | 下游引物 Reverse primer (5°-3°) |
|---|---|---|---|
| AhFAD2-1A | Aradu.G1YNF | GATTATTGACTTGCTTTGTAGTAGTGC | ACACAAACGTTTTCAACTCTGAC |
| AhFAD2-1B | Araip.S3GXY | CAGAACCATTAGCTTTGTAGTAGTGC | ACACAAACGTTTCCAACTCTGAC |
| AhFAD2-2 | Araip.65EGG | CAGAACCATTAGCTTTGTAGTAGTGC | ACACAAACGTTTCCAACTCTGAC |
| AhFAD2-3A | Aradu.10027244 | AGCACAACCGATAATACTCTCCCAA | TTATTCTGAGCACAACCGATAATA |
| AhFAD2-3B | Araip.D6HPL | CTCTGTTCCTCCTTCAAACAGGACG | TAATCAACCATCCTAATTGGCAGAA |
| AhFAD2-4A | Aradu.7W39T | ATGGGGTCTGGGGGTCATTCTTCCG | TTAAAGCTTATTATACCAAAGAACACCTTT |
| AhFAD2-4B | Araip.WI51C | ATGGGGTCTGGTGGTCATTCTG | TTAAAGCTTATTATACCAAAGAACACCT |
新窗口打开|下载CSV
1.5 FAD2家族基因的表达模式分析
通过在线工具Integrated DNA Technologies (http://sg. idtdna.com/scitools/Applications/RealtimePCR/)设计AhFAD2基因的荧光定量PCR引物(表2)。Table 2
表2
表2Real time PCR引物及其碱基序列
Table 2
| 基因 Gene | 引物名称 Primer name | 引物序列 Primer sequence (5°-3°) |
|---|---|---|
| AhFAD2-1A and AhFAD2-1B | RTAhFAD2-1-F | TTTATGTCTCAGATTCATCTGT |
| RTAhFAD2-1-R | CCTCTTAACCAGTCCCATTCG | |
| AhFAD2-2 | RTAhFAD2-2-F | TTCTAATTTATGTCTCAGGACTCAG |
| RTAhFAD2-2-R | CCATAATCTCTGTCCACTGTTGCCA | |
| AhFAD2-3A and AhFAD2-3B | RTAhFAD2-3-F | GGTCTTATCCGTCTTGTCATGG |
| RTAhFAD2-3-R | AGATGAATCGTAATGTGGCAATG | |
| AhFAD2-4A and AhFAD2-4B | RTAhFAD2-4-F | TGGCCTTTGTACTGGTTCG |
| RTAhFAD2-4-R | GGACGAGAAGGAAAGAATGGAG | |
| AhActin | Actin-F | TAAGAACAATGTTGCCATACAGA |
| Actin-R | GTTGCCTTGGATTATGAGC |
新窗口打开|下载CSV
以ZH16和ZH413不同生长时期各组织的cDNA为模板, 按照TaKaRa荧光定量试剂盒SYBR Premix ExTaq说明书进行PCR, 反应体系为20 μL, 包含SYBR Premix ExTaq (2×) 10 μL、引物(F/R)各0.5 μL、cDNA模板1 μL、ddH2O 8 μL。反应程序为95℃变性3 min; 95℃变性30 s, 60℃退火15 s, 72℃延伸20 s, 测荧光值, 40个循环; 最后计算溶解曲线以0.1℃ s-1的速度从60℃升至90℃。设每个反应3个重复, 利用2-ΔΔCt法计算基因的相对表达量。利用Graph Pad Prism 5软件和Microsoft Excel软件处理和分析实验数据。
1.6 低温胁迫试验
分别挑选50粒ZH16和ZH413的饱满种子, 置培养皿中充分吸胀后, 分别置15℃和25℃培养箱中, 分别在1、3、6 d统计的发芽种子, 并选取5粒有代表性的种子提取其总RNA, 并反转得到cDNA。以上试验重复3次。发芽率(%) = 发芽的种子数/参试种子总数×100
利用上述设计的FAD2家族基因荧光定量PCR引物,按照翊圣荧光定量试剂盒SYBR Premix ExTaq说明书进行qRT-PCR。
2 结果与分析
2.1 花生AhFAD2家族基因的克隆
利用已知的花生FAD2基因(KF741365和KF741366)编码的氨基酸序列, 在花生基因组信息网站(https://www. peanutbase.org/)中进行blast分析, 共得到7个AhFAD2基因。分别以ZH16和ZH413发育种子的cDNA为模板, 克隆测序得到这些基因ORF的序列信息, 并根据它们在花生基因组中的位置和同源性分别命名为AhFAD2-1A、AhFAD2-1B、AhFAD2-2、AhFAD2-3A、AhFAD2-3B、AhFAD2-4A和AhFAD2- 4B (表3), AhFAD2-1A/B为1对同源基因, 分别位于A09和B09染色体上, 均编码379个氨基酸, 相对分子质量为43.65 kDa, pI为8.9; AhFAD2-2中第451位的G突变为T, 形成终止密码子, 导致翻译提前终止; AhFAD2-3A/B为1对同源基因, 分别位于A06和B06染色体上, 分别编码349个和383个氨基酸, 相对分子质量分别为39.7 kDa和43.8 kDa, PI分别为8.85和8.80; AhFAD2-4A/B一对同源基因, 分别位于A09和B09染色体上, 均编码387个氨基酸, 相对分子质量为45.0 kDa, pI分别为8.94和9.04。Table 3
表3
表3花生FAD2家族基因信息
Table 3
| 基因编号 Gene | 基因注册号 Accession No. | 染色体 Chr. | 翻译阅读框 ORF (bp) | 氨基酸残基 Len (aa) | 相对分子质量 Molecular weight (kDa) | 等电点 pI |
|---|---|---|---|---|---|---|
| AhFAD2-1A | Aradu.G1YNF | A09 | 1140 | 379 | 43.65 | 8.90 |
| AhFAD2-1B | Araip.S3GXY | B09 | 1140 | 379 | 43.65 | 8.90 |
| AhFAD2-2 | Araip.65EGG | B09 | 453 | 150 | 17.20 | 8.30 |
| AhFAD2-3A | Aradu.10027244 | A06 | 1050 | 349 | 39.70 | 8.85 |
| AhFAD2-3B | Araip.D6HPL | B06 | 1152 | 383 | 43.80 | 8.80 |
| AhFAD2-4A | Aradu.7W39T | A09 | 1164 | 387 | 45.00 | 8.96 |
| AhFAD2-4B | Araip.Wi51C | B09 | 1164 | 387 | 45.00 | 9.04 |
新窗口打开|下载CSV
2.2 花生AhFAD2基因的表达分析
利用荧光定量PCR分析各AhFAD2基因在高油酸花生ZH413和普通油酸ZH16的15个组织中的表达模式(图1)表明, AhFAD2-1A/B主要在花生发育种子中表达, AhFAD2-1A/B在ZH16的花中也高量表达, 但该基因在ZH413中表达量较低。在种子发育的各个时期, ZH16中AhFAD2-1A/B表达量均高于ZH413。AhFAD2-2的表达模式与AhFAD2-1A/B类似, 虽然在花生的各组织均有表达, 但表达量都很低。AhFAD2-3A/B在花生的各组织均有表达, 但主要在叶片和茎中表达, 而在种子中的表达量相对较低。AhFAD2-3A/B在ZH16幼嫩叶片和果针中的表达量比在ZH413中高, 而AhFAD2-3A/B在ZH413花和发育早期的种子中的表达量比在ZH16中高。AhFAD2-4A/B主要在根和花中高量表达, 在花中的表达量最高, 是根中表达量的1000倍左右。AhFAD2-4A/B在ZH16和ZH413各组织中的表达量没有显著差异。通过比较AhFAD2-1A/B、AhFAD2-3A/B和AhFAD2-4A/B在花生种子发育各时期的表达量发现, AhFAD2-1A/B在ZH16和ZH413的种子发育中后期表达量最高。AhFAD2-3A/B在ZH16和ZH413种子发育各时期均有表达, 且在ZH413的种子发育初期表达量最高。而AhFAD2-4A/B在ZH16和ZH413种子发育各时期表达量都很低。以上结果表明, 花生各AhFAD2 基因的表达模式不尽相同, 其可能在不同发育阶段、不同组织中发挥作用, 例如AhFAD2-1A/B是花生种子中决定油酸含量的关键基因, 而AhFAD2-3A/B在营养组织中的表达量较高, 可能是调控花生营养组织中不饱和脂肪酸含量的主要基因。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1AhFAD2基因在15个花生组织中的表达水平
A: 本研究中涉及到的15个花生组织。I: 播种6 d后的胚根; II: 播种6 d后的胚轴; III: 播种6 d后的子叶; IV: 播种6 d后的真叶; V: 播种60 d后的根; VI: 播种60 d后的果针; VII: 播种60 d后的茎; VIII: 播种60 d后的幼嫩叶片; IX: 播种60 d后的成熟叶片; X: 播种60 d后的花; XI: 白色、扁平的发育中的种子; XII: 白色、水滴形的发育中的种子; XIII: 白色、鱼雷形的发育中的种子; XIV: 浅粉色、圆形的发育中的种子; XV: 深粉色、成熟的种子。B: AhFAD2基因在15个花生组织中的表达水平。白色表示普通油酸材料ZH16; 灰色表示高油酸材料ZH413。经单因素方差分析差异达到显著水平。* P < 0.05; ** P < 0.01; *** P < 0.001。C: AhFAD2基因在花生发育种子中的表达分析。标有不同小写字母的柱值表示经单因素方差分析和最小显著差异法(LSD)检验差异达到显著水平(P < 0.05)。
Fig. 1Expression levels of AhFAD2 genes in 15 peanut tissues
A: 15 peanut tissues involved in this study. I: radicle after 6 days of sowing; II: hypocotyl after 6 days of sowing; III: cotyledon after 6 days of sowing; IV: true leaves after 6 days of sowing; V: root after 60 days of sowing; VI: peg after 60 days of sowing; VII: stem after 60 days of sowing; VIII: yong leaves after 60 days of sowing; IX: mature leaves after 60 days of sowing; X: flowers after 60 days of sowing; XI: white and flat developing seeds; XII: white and drop-shaped developing seeds; XIII: white and torpedo-shaped developing seeds; XIV: light pink and round developing seeds; XV: dark pink and mature seeds. B: expression analysis of AhFAD2 genes in 15 tissues of peanut. The white column indicates normal oleate peanut ZH16, the gray column indicates high oleate peanut ZH413. Differences reached a significant level by one-way analysis of variance. * P < 0.05, ** P < 0.01, *** P < 0.001. C: expression analysis of AhFAD2 genes in developing seeds. Bars superscripted by different lowercase letters are significantly different at P < 0.05 by one-way ANOVA and least significant difference (LSD) test.
2.3 低温处理对ZH16和ZH413发芽率的影响
在25℃和15℃温度处理下, 分别统计ZH16和ZH413种子的发芽率(表4)。25℃条件下, 种子浸泡24 h后即可露白; 而在15℃条件下, 种子的萌发时间显著延长, 种子在3 d后开始露白。在25℃条件下, ZH16的种子发芽率为91.33%, ZH413的种子发芽率为94.66%, 差异不显著; 而在15℃条件下, ZH16的种子发芽率为45.00%, ZH413的种子发芽率为98.67%, ZH16的发芽率显著低于ZH413 (表4和图2)。以上结果表明, 虽然低温均延长了ZH16和ZH413的萌发时间, 但是ZH413在低温处理6 d后发芽率仍然达到90%以上, 而ZH16在低温处理下发芽率显著降低。因此, 高油酸花生的耐寒性并不一定比普通油酸花生差。Table 4
表4
表4不同温度处理条件下普通油酸花生ZH16和高油酸花生ZH413的种子发芽率
Table 4
| 温度 Temperature (℃) | ZH16种子发芽率 Germination rate of ZH16 (%) | ZH413种子发芽率 Germination rate of ZH413 (%) |
|---|---|---|
| 25 | 91.33±5.25 bc | 94.66±3.77 b |
| 15 | 45.00±7.34 c | 98.67±0.94 a |
新窗口打开|下载CSV
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同温度处理下普通油酸花生ZH16和高油酸花生ZH413的种子发芽情况
Fig. 2Seed germination test of normal oleate ZH16 and high oleate ZH413 under different temperatures
2.4 低温胁迫对AhFAD2基因在高油酸和普通油酸花生中表达模式的影响
为了调查AhFAD2基因在低温胁迫条件下是否参与了花生的低温响应过程, 利用荧光定量PCR分析了不同温度处理下普通油酸花生ZH16和高油酸花生ZH413萌发种子中各AhFAD2基因的表达模式(图3)。研究发现, 在25℃条件下, ZH16和ZH413中AhFAD2-1A/B随着处理时间的延长, 其表达量逐渐增加(图3-a, d)。而在15℃条件下, ZH16中AhFAD2-1A/B前3 d的表达量与25℃处理条件下的表达量差异不显著; 在处理第6天, AhFAD2-1A/B在15℃条件下的表达量比在25℃条件下的表达量显著提高(图3-a)。处理第1天, ZH413中AhFAD2-1A/B在15℃条件下的表达量比在25℃条件下的表达量显著上调20倍以上, 但在第3天后其表达量显著下调, 比在25℃条件下的表达量显著下调10倍以上(图3-d), 表明AhFAD2-1A/B是受低温诱导表达的基因, 在ZH16中响应较慢, 但在ZH413中响应非常快。图3
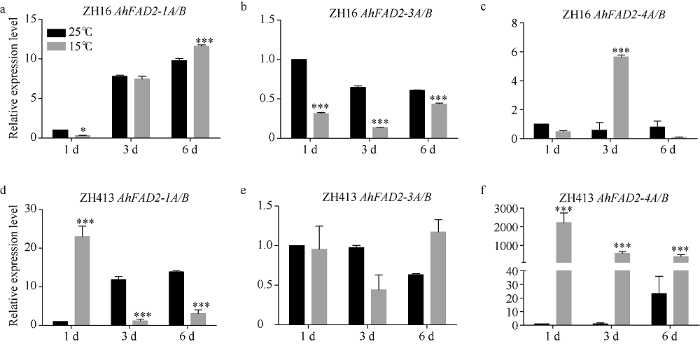 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3在不同温度处理下各AhFAD2基因在ZH16和ZH413中的表达分析
a: 在不同温度处理下, AhFAD2-1A/B在ZH16中的表达模式; b: 在不同温度处理下, AhFAD2-3A/B在ZH16中的表达模式; c: 在不同温度处理下, AhFAD2-4A/B在ZH16中的表达模式; d: 在不同温度处理下, AhFAD2-1A/B在ZH413中的表达模式; e: 在不同温度处理下, AhFAD2-3A/B在ZH413中的表达模式; f: 在不同温度处理下, AhFAD2-4A/B在ZH413中的表达模式。经单因素方差分析差异达到显著水平, * P < 0.05; ** P < 0.01; *** P < 0.001。
Fig. 3Expression analysis of AhFAD2 genes in ZH16 and ZH413 under different temperature
a: expression pattern of AhFAD2-1A/B in ZH16 under different temperature treatment conditions; b: expression pattern of AhFAD2-3A/B in ZH16 under different temperature treatment conditions; c: expression pattern of AhFAD2-4A/B in ZH16 under different temperature treatment conditions; d: expression pattern of AhFAD2-1A/B in ZH413 under different temperature treatment conditions; e: expression pattern of AhFAD2-3A/B in ZH413 under different temperature treatment conditions; f: expression pattern of AhFAD2-4A/B in ZH413 under different temperature treatment conditions. Significant differences are determined by one-way analysis of variance. * P < 0.05, ** P < 0.01, *** P < 0.001.
在25℃条件下, ZH16和ZH413中AhFAD2-3A/B表达量均随着时间的延长而逐渐减少(图3-b, e)。在15℃条件下, ZH16中AhFAD2-3A/B的表达量显著下调, 且始终比其在25℃条件下的表达量低(图3-b); 而ZH413中AhFAD2-3A/B的表达量与其在25℃条件下的表达量差异不显著(图3-e)。
在25℃条件下, ZH16中AhFAD2-4A/B不同时间点的表达量变化不显著(图3-c); 而ZH413中AhFAD2-4A/B在6 d后表达量显著上调(图3-f)。在15℃条件下, ZH16中AhFAD2-4A/B的表达量第3天出现显著上调, 在第6天时又显著下调(图3-c); 而ZH413中AhFAD2-4A/B的表达量从第1天就显著上调, 且在处理的6 d中表达量一直维持在高水平, 虽然呈现下降趋势, 但始终比其在25℃条件下的表达量高20倍以上(图3-f)。以上结果表明, AhFAD2- 4A/B受低温诱导表达, 在ZH16中其表达量呈先上升后下降的趋势, 而在ZH413中始终维持在高水平表达, 呈微弱下降趋势。
综合以上结果得出, 在低温胁迫种子萌发过程中, AhFAD2-1A/B和AhFAD2-4A/B均受低温诱导表达, 而在高油酸材料中AhFAD2-1A/B和AhFAD2-4A/B的响应速度都比在普通油酸材料中快, 表达量上调的倍数也比在普通油酸材料中多, 特别是AhFAD2-4A/B基因在高油酸材料受到低温胁迫时始终维持在高水平表达, 推测其高水平的表达部分弥补了突变的AhFAD2-1A/B的功能。
3 讨论
花生属于温带和亚热带作物, 整个生育期需要足够的光照强度和合适的温度条件, 温度是限制花生种植分布的重要因素。低温会造成花生烂种增多、发芽率降低、出苗迟缓, 致使基本苗减少, 生育期延长, 最终导致减产。已有研究表明, 细胞中多不饱和脂肪酸的含量与植物的抗寒能力具有一定相关性, 多不饱和脂肪酸含量越高, 抗寒性越强[12,13,14,15,16]。脂肪酸脱氢酶是生物体内调控不饱和脂肪酸合成的关键酶, 细胞中脂肪酸脱氢酶的种类和数量是决定植物抗寒性的重要因素[17,18,19]。本研究系统分析了花生FAD2家族全部AhFAD2基因, 并调查了这些AhFAD2基因在花生15个组织中的表达模式, 以及它们在受到低温胁迫时表达模式的变化。FAD2 基因是一个含有多个成员的基因家族, 甘蓝型油菜中含有4个BnFAD2基因[20], 红花(Carthamus tinctorius)中含有11个CtFAD2基因[21]。本研究从栽培种花生中共克隆到7个AhFAD2基因, 其中6个成对出现, 分布在A、B亚基因组的相应位置, 仅AhFAD2-2基因没有找到A亚基因组相对应的拷贝。AhFAD2-2基因的第451位碱基G突变为T, 形成终止密码子, 导致翻译提前终止, 翻译的蛋白不具有功能。阮建等[11]研究发现花生FAD2家族中含有6个基因, 与本研究结果基本一致, 但本研究克隆得到Araip.D6HPL在A06染色体上的同源基因Aradu.10027244。
已有大量研究报道, AhFAD2-1A和AhFAD2-1B是与高油酸花生形成相关的AhFAD2基因[22,23,24,25], 通过表达模式分析发现, 相较于其他AhFAD2基因, AhFAD2-1A/B在发育种子中的表达量最高, 因此AhFAD2-1A/B基因是花生种子中最重要的AhFAD2基因。这也解释了为什么花生中存在6个有功能的AhFAD2基因, 仅AhFAD2-1A和AhFAD2- 1B发生突变就可以使花生种子中油酸含量从40%提高到80%。
AhFAD2-3A/B在花生发育种子中的表达量排第二, 但其在营养组织中的表达量更高。AhFAD2-4A/B在花生发育种子中的表达量极低, 但是在根和花中的表达量很高。以上结果表明, 花生的AhFAD2基因具有表达的组织偏好性, 以此实现不同AhFAD2基因在花生生长发育过程中的分工。在其他植物中也发现了类似现象, 红花中11个CtFAD2基因也具有表达的组织特异性, CtFAD2-1和CtFAD2-10主要在花和发育的种子中表达, CtFAD2-2在各个组织中都表达, 而CtFAD2-5和CtFAD2-8主要在根中特异表达[21]。
AhFAD2-1A/B和AhFAD2-4A/B均在受到低温胁迫后上调表达, 特别是在高油酸花生中, AhFAD2-1A/B和AhFAD2-4A/B的响应速度和上调倍数均比在普通油酸材料中快且多。在其他植物中也发现FAD2基因受低温诱导表达。橄榄中的OeFAD2-1在橄榄冷驯化的过程中参与冷胁迫响应, 转录活性提高, 提高种子中亚油酸含量, 促进角质的形成, 从而保护胚乳[26]。棉花中的GhFAD2-3和GhFAD2-4受到低温胁迫后, 转录水平显著上调[10]。唐桂英等[27]通过低温处理花生幼苗叶片发现, AhFAD2-2A/B (对应本研究中的AhFAD2-3A/B)受低温胁迫诱导表达。但本研究中AhFAD2-3A/B在受到低温胁迫后没有表现出转录水平的变化, 可能由于处理的样品是萌发种子, 也许它更多参与花生苗期或中后期的调控。大豆中GmFAD2-2在营养生长组织和发育的种子中均有表达, 但在受到冷胁迫刺激时, 转录水平并无明显差异[28]。
高油酸花生中AhFAD2-1基因发生突变, 引起种子中甘油三酯的脂肪酸组成变化, 即在大幅提高油酸含量的同时也大幅降低亚油酸的含量[29]。但是这种变化可能不局限于甘油三酯, 种子膜脂中亚油酸含量也有可能大幅降低[30,31]。而细胞膜中, 多不饱和脂肪酸(比如亚油酸、亚麻酸)含量越高, 越有利于细胞膜的流动性[32]。当低温胁迫时, 细胞膜流动性下降, 黏度增加, 运输功能下降, 严重时细胞膜从常态的液晶相转变为凝胶相, 膜的结构改变, 透性增大, 最终致细胞死亡[33]。AhFAD2-1基因主要在发育的种子中表达, 而在种子发育的过程中, 高油酸花生中合成的亚油酸总量可能比普通油酸花生中的总量少, 也有可能造成高油酸花生的细胞膜中亚油酸含量偏低, 即高油酸花生种子细胞膜流动性可能比普通油酸花生的差。因此, 当高油酸花生和普通油酸花生在萌发时遭遇低温胁迫, 有可能因为种子发育过程中造成的膜脂中亚油酸含量的差异, 从而影响萌发过程中的细胞膜流动性, 最终表现为发芽率的差异。本研究通过比较高油酸花生ZH413和普通油酸花生ZH16在低温处理下的发芽率发现, ZH413的发芽率并没有显著下降, 而ZH16发芽率显著下降, 说明在影响花生耐寒性的诸多因素中, AhFAD2-1A/B功能的缺失并不是决定其耐寒性的主要因素。AhFAD2-1A/B主要在种子中表达, 其功能的缺失并不会影响花生营养器官的生长发育, 而AhFAD2-3A/B主要在营养器官中发挥作用, 高油酸花生中该基因并没有发生突变, 理论上不会影响其营养器官的耐寒性。在萌发的种子中, 虽然高油酸花生中AhFAD2-1A/B丧失了功能, 但AhFAD2-4A/B在受到低温胁迫时持续显著上调表达, 也部分弥补了AhFAD2-1A/B缺失的功能, 及时合成亚油酸, 从而维持细胞膜的流动性, 保障了高油酸花生的耐寒性。因此, 高油酸花生的耐寒性是否一定比普通油酸花生差, 这一论断仍然有待继续深入研究。本研究结果为高油酸在高纬度、高海拔地区的普及提供了可能性, 通过筛选耐寒性较强的高油酸品种可以实现其在高纬度、高海拔地区的种植。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
