 ,4,*
,4,*Function analysis of 5′ untranslated region introns in drought-resistance gene TaSAP1
CHANG Jian-Zhong1, DONG Chun-Lin1, ZHANG Zheng1, QIAO Lin-Yi2, YANG Rui1, JIANG Dan1, ZHANG Yan-Qin1, YANG Li-Li1, WU Jia-Jie3, JING Rui-Lian ,4,*
,4,*通讯作者:
收稿日期:2018-12-12接受日期:2019-05-12网络出版日期:2019-05-17
| 基金资助: |
Received:2018-12-12Accepted:2019-05-12Online:2019-05-17
| Fund supported: |
作者简介 About authors
E-mail:cjzyfx@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (7373KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
常建忠, 董春林, 张正, 乔麟轶, 杨睿, 蒋丹, 张彦琴, 杨丽莉, 吴佳洁, 景蕊莲. 小麦抗逆相关基因TaSAP1的5′非翻译区内含子功能分析[J]. 作物学报, 2019, 45(9): 1311-1318. doi:10.3724/SP.J.1006.2019.81053
CHANG Jian-Zhong, DONG Chun-Lin, ZHANG Zheng, QIAO Lin-Yi, YANG Rui, JIANG Dan, ZHANG Yan-Qin, YANG Li-Li, WU Jia-Jie, JING Rui-Lian.
逆境相关蛋白(stress associated protein, SAP)是植物中一类具有A20/AN1锌指结构域的蛋白。A20锌指由一个或多串联Cys2/Cys2锌指结构组成, 首次在人类血管内皮细胞的TNFα-诱导蛋白中发现[1]; AN1首次发现于爪蟾受精卵动物半球母系来源RNA编码蛋白中, 其结构模式为CX(2) CX(9,12) CX(1,2) CX(4) CX(2) HX(5) HXC[2]。A20/AN1锌指蛋白在动物中主要参与免疫应答和细胞凋亡等生理过程[3], 在植物中主要参与对逆境的响应, 故称作逆境相关蛋白。
对植物SAP相关基因的研究较为广泛, 在水稻中过量表达OsiSAP8可增强花期植株对干旱和盐胁迫的抗性, 且不会造成减产[4]; 蒺藜苜蓿MtSAP1基因过表达可使转基因烟草植株中一氧化氮含量显著增加, 从而提高对渗透胁迫的抗性[5]; 拟南芥AtSAP9除参与干旱、低温、盐和ABA胁迫应答以外, 还可受病原菌诱导上调表达, 过表达该基因导致植株对ABA和渗透胁迫的敏感性增加[6]; 拟南芥AtSAP13受Cd、ABA和盐胁迫诱导上调表达, 过表达该基因可增强植株对有毒重金属(AsIII、Cd和Zn)、干旱和盐胁迫的抗性[7]; 在干旱条件下, 水稻过表达獐茅AlSAP基因可增加分蘖数和结实率, 进而提高产量50%~90%[8]。可见, SAP基因参与植物对各种逆境的响应, 且能在一定程度上改善植株抗逆性, 但是其作用机制尚不明确。
内含子是断裂基因中的非编码序列, 通过选择性剪接丰富蛋白质的多样性[9], 还可以影响宿主基因的表达[10], 这种现象在植物中受到广泛关注, 已报道了大量相关基因, 例如玉米Hsp82、Sh1、Adh1、GapA1和Ub1[11,12,13,14,15], 水稻OsPB-73、rubi3和OsTub6[16,17,18], 拟南芥MHX、PUX7、PYM和PhADF1[19,20,21]。拟南芥UBQ10基因启动子与其第一内含子融合后使大麦中荧光素酶报告基因的表达量增加3倍[22]。内含子对基因表达的影响并非受单一机制控制, 不同植物或基因的内含子可通过特有机制调控宿主基因表达, 且不是所有内含子都具有这种效应[14]。植物SAP家族一个显著特点是大多数基因编码区无内含子, 杨树和玉米SAP家族中无内含子的基因分别占80%和90%[23], 而5′非翻译区常含有内含子(5′ untranslated region intron, 5UI) [4-5,24-25]。已报道的研究工作普遍关注SAP基因本身的生物学功能, 尚无文献报道SAP家族5UI的功能。小麦TaSAP1参与了植株对各种逆境的响应, 在拟南芥中过表达可增强植株抵抗干旱等胁迫的能力[26]。我们发现小麦TaSAP1基因具有2个5UI [27], 本研究将TaSAP1基因2个5UI缺失突变, 构建表达载体, 转化二穗短柄草(Brachypodium distachyon), 通过分析GUS活性水平, 研究TaSAP1启动子及其5UI的生物学功能, 为植物抗逆遗传育种提供诱导性启动子, 也为进一步研究TaSAP1 5UI功能提供理论基础。
1 材料与方法
1.1 植物材料及胁迫处理
利用本实验室保存的“旱选10号”克隆TaSAP1启动子; 二穗短柄草Bd21, 用于遗传转化和功能验证。利用人工气候箱种植二穗短柄草, 生长条件为20 h光照(24℃)、4 h黑暗(18℃)。选取各载体3个阳性株系, 种植于营养钵(7.0 cm × 5.0 cm × 7.8 cm), 每钵营养土重量一致, 并定量给水。植株生长2周后进行不同胁迫处理, 对于干旱和盐胁迫, 分别在钵中加入10 mL PEG-6000 (-0.5 MPa)和NaCl溶液(250 mmol L-1); 对于低温胁迫, 将幼苗移入4℃光照培养箱; 对于外源ABA诱导, 直接喷洒ABA溶液(50 μmol L-1)至叶片湿润。以正常生长, 无胁迫处理为对照。处理8 h后取样, 液氮速冻, -70℃保存待用。
1.2 TaSAP1启动子克隆及顺式作用元件分析
前期利用引物Sap2F/Sap2R已获得TaSAP1侧翼序列, 包含编码区510 bp、启动子区2.5 kb和3′非翻译区1.1 kb, 命名为TaSAP1-A2 [27]。在此基础上设计引物Tsp1FP1/Tsp1RP0, 以含TaSAP1-A2的质粒为模板, 获得TaSAP1启动子序列, 命名为P1。利用顺式作用元件分析工具PLACE (http://www.dna.affrc. go.jp/PLACE/signalup.htm)和PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子序列, 预测顺式作用元件。1.3 TaSAP1启动子5′UTR内含子的缺失及表达载体的构建
设计引物TaspF1/R1 (F: 5′-CACACATTCATCC TAACCCATT-3′; R: 5′-GCGATTCCTCTCCGGCGAT CCCCTAGGAGGGGGAGGACGA-3′)、TaspF2/R2 (F: 5′-TCGTCCTCCCCCTCCTAGGGGATCGCCGGAGA GGAATCGC-3′; R: 5′-GGCTTTGATTTAACTGGAA ATCAG-3′)和TaspF1/R3 (F: 5′-CACACATTCATCC TAACCCATT-3′; R: 5′-GGCTTTGATTTAACTGATA GGAGGAAGCCCTC-3°) , 正、反向引物5′端分别引入Hind III和Sal I两个酶切位点。利用引物TaspF1/ R1和TaspF2/R2, 以P1为模板, 进行PCR; 将回收产物等量混合作为模板, 用引物TaspF1/R2进行扩增; 将回收产物连接到pEAZY-Blunt simple vector, 酶切和测序验证, 获得缺失Intron-1的启动子片段, 命名为-1I。在引物TspR3 5′端引入13 bp 5UI序列(图1红色所示序列)。然后以P1为模板, 利用引物TspF1/R3进行扩增, 获得缺失Intron-2的片段(-2I)。以-1I为模板, TspF1/R3为引物扩增, 获得双内含子缺失突变体(Δ2I)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1TaSAP1 5′UTR内含子缺失突变示意图
Fig. 1Sketch map of deletion mutation of TaSAP1 5UIs
1.4 二穗短柄草转化和阳性植株检测
将正确的P1、-1I、-2I和Δ2I重组质粒用Hind III和Sal I双酶切, 和经相同内切酶处理过的pCAMBIA1391z (简写为P91z)载体片段进行连接, 经酶切测序验证, 构建成P91z-P1、P91z-(-1I)、P91z- (-2I)和P91z-Δ2I重组质粒(图2)。图2
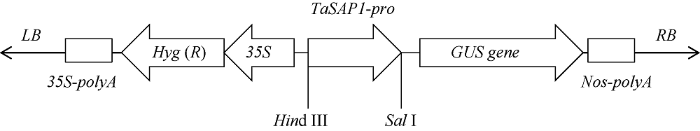 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2过表达载体构建示意图
Fig. 2Sketch map of overexpression vector construction
将上述重组质粒DNA转入农杆菌AGL1感受态, 培养农杆菌菌液, 通过农杆菌介导的方法转化二穗短柄草幼胚愈伤组织[28], 经分化生长获得再生植株, 利用PCR和GUS组织化学染色的方法筛选阳性植株。为使PCR检测更便捷, 根据P1、-1I、-2I和Δ2I的共有序列, 设计了一对扩增产物为714 bp的引物 TaSP1pf1/r1 (F: 5′-GCGAAATGCGTCCATAGCG-3′; R: 5′-TCGTCGCG ATTCCTCTCCG-3′), 用于阳性植株的检测。
1.5 GUS组织化学染色
依据Jefferson的方法[29], 将待染色短柄草组织放入2.0 mL离心管, 加入X-GLUC染色液, 37℃保温过夜, 次日取出脱色, 体视显微镜(LEICA M165FC)下观察照相。X-GLUC染色液含64 mL 0.2 mol L-1 Na2HPO4, 38 mL 0.2 mol L-1 NaH2PO4, 1 mL 0.1 mol L-1 K3[Fe(CN)6], 1 mL 0.1 mol L-1 K4[Fe(CN)6], 4 mL 0.5 mol L-1 Na2EDTA, 50 mL甲醇, 200 mg X-GLUC和120 μL Triton-X, 定容至250 mL。1.6 GUS酶活测定
参照Jefferson [29]的荧光检测法测定GUS活性。取0.1 g样品于预冷的研钵中, 在液氮中迅速研成粉末, 加入1 mL GUS酶提取液(100 mmol L-1 K3PO4, pH 7.8, 1 mmol L-1 EDTA, 1% Triton X-100), 用漩涡仪振荡混匀, 16,200 × g离心10 min, 收集上清液, 得到GUS粗酶提取液。以4-MUG为作用底物进行酶促反应后, 反应产物在激发波长350 nm、发射波长455 nm条件下, 用酶活荧光测量仪(DQ200)测定荧光强度, 考马斯亮蓝法测定蛋白质含量。2 结果与分析
2.1 TaSAP1启动子克隆及顺式作用元件分析
前期已克隆到TaSAP1启动子序列2.5 kb, 其2个内含子位于5′端非翻译区(5′UTR)。将翻译起始密码ATG中的A定义为+1, Intron-1和Intron-2分别位于-967 bp ~ -814 bp和-771 bp ~ -13 bp。TaSAP1启动子全长含有多种顺式作用元件(图3), 包括基本的调控元件TATA-box、CAAT-box等, 一些逆境和组织特异表达相关顺式元件, 如ARE、MBS、Skn-1 motif等(表1)。此外, 该基因5′UTR内含子中也存在一些重要元件, 如TATA-box、CAAT-box和ABRE等。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3TaSAP1启动子序列及其顺式作用元件分布
顺式元件用红色背景显示。
Fig. 3Sequence and cis-acting elements distribution of TaSAP1 promoter
The cis-acting elements are highlighted in red.
Table 1
表1
表1 TaSAP1启动子主要顺式作用元件及预测的功能
Table 1
| 元件名称 Name | 序列 Sequence | 功能 Function | 位置 Location (bp) |
|---|---|---|---|
| ABRE | GACACGTGGC/TACGTG | ABA响应 cis-acting element involved in abscisic acid responsivenes | -937 to -926, -510 to -504 |
| ARE | AAACCA | 低氧响应 cis-acting regulatory element essential for anaerobic induction | -1256 to -1249 |
| Box-W1 | GGTCAA | 真菌诱导响应 Fungal elicitor responsive element | -2062 to -2055 |
| CGTCA-motif | CGTCA | 茉莉酸甲酯响应 cis-acting regulatory element involved in MeJA-responsiveness | -2107 to -2101 |
| CCAAT-box | CCGTTG | MYB转录因子结合元件 MYB binding site | -1176 to -1169, -658 to -651 |
| GC-motif | CGGGGGC | 低氧特异增强元件 Enhancer-like element involved in anoxic specific inducibility | -1534 to -1526 |
| LTR | CCGAAA | 低温响应 cis-acting element involved in low-temperature responsiveness | -1233 to -1226, -1207 to -2199 |
| MBS | TGACCGA | MYB转录因子结合元件 MYB binding site | -1448 to -1440, -39 to -32 |
| Skn-1 motif | GTCAT | 胚乳特异表达元件 cis-acting regulatory element required for endosperm expression | -1323 to -1317, -1108 to -1102 |
| TGACG-motif | TGACG | 茉莉酸甲酯响应 cis-acting regulatory element involved in MeJA-responsiveness | -1914 to -1908 |
| WUN-motif | TCATTGCGAA | 伤害响应 Wound-responsive element | -2103 to -2092 |
新窗口打开|下载CSV
2.2 TaSAP1 5′UTR内含子的缺失、载体构建及遗传转化
利用重叠PCR对5′UTR内含子进行缺失突变得到-1I、-2I和Δ2I三个缺失片段, 将P1和3个内含子缺失片段用Hind III和Sal I双酶切, 与经相同酶切的pCAMBIA1391z连接, 通过酶切检测获得正确的重组质粒P91z-P1、P91z-(-1I)、P91z-(-2I)和P91z-Δ2I (图4)。通过农杆菌介导法转化二穗短柄草幼胚愈伤组织, 经共培养、潮霉素筛选和分化, 获得再生植株(图5), PCR检测阳性植株, 最终获得含P91z-P1、P91z-(-1I)、P91z-(-2I)和P91z-Δ2I的转基因阳性植株10、21、17和24株。图4
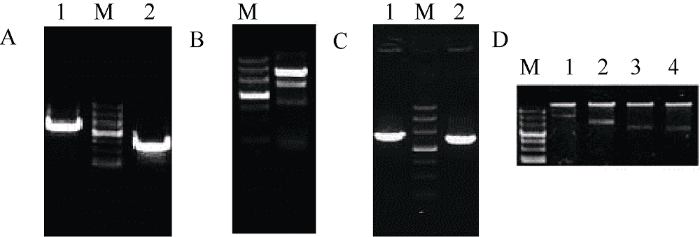 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4TaSAP1 5UI缺失突变及载体构建
M: marker III (天根); A: 分别用TaspF1/R1 (泳道1)和TaspF2/R2 (泳道2)进行第1轮PCR扩增; B: 用TaspF1/R2进行第2轮PCR扩增, 缺失Intron-1; C: 用TspF1/R3进行PCR扩增获得-2I片段(泳道1); 用TspF1/R3扩增获得Δ2I片段(泳道2); D: 1 ~ 4泳道依次为载体P91z-P1、P91z-(-1I)、P91z-(-2I)和P91z-Δ2I的酶切验证。
Fig. 4Deletion mutation of TaSAP1 5UIs and construction of expression vectors
M: marker III (Tiangen); A: 1st cycle PCR with primers TaspF1/R1 (lane 1) and TaspF2/R2 (lane 2); B: deletion of intron-1 by 2nd cycle PCR with TaspF1/R2; C: -2I and Δ2I fragments were amplified with primers TspF1/R3 (lane 1) and TspF1/R3 (lane 2), respectively; D: lanes 1 to 4 show the double digestion of P91z-P1, P91z-(-1I), P91z-(-2I), and P91z-Δ2I, respectively.
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5二穗短柄草的遗传转化
A: 短柄草幼胚分化的愈伤组织; B: 筛选中褐化的胚型愈伤组织; C和D: 再生的转基因植株; E和F: 移栽后的转基因植株。
Fig. 5Genetic transformation of Brachypodium distachyon
A: callus differentiated from immature embryo of Brachypodium distachyon; B: brown embry ogenic callus; C and D: regeneration of transgenic plants; E and F: transgenic plants after transplanting.
2.3 二穗短柄草GUS组织化学染色
转P91z-P1、P91z-(-1I)和P91z-(-2I)短柄草阳性植株各组织化学染色均为阳性(图6-A), 而转P91z- Δ2I阳性植株不能被GUS着色, 可见当2个内含子同时缺失时, TaSAP1启动子失去活性; 转P1阳性植株的GUS活性是转P91z-(-1I)的2.7倍, 且差异达到显著水平(P<0.05), 而其与转P91z-(-2I)阳性植株的GUS活性之间差异不显著(P>0.05) (图6-B)。可见, Intron-1可以保证P1的基本活性。图6
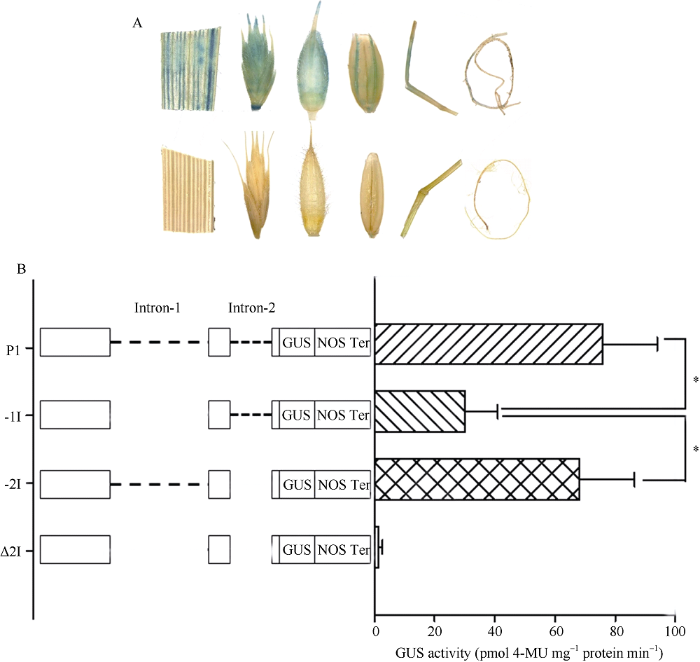 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6转基因阳性二穗短柄草植株GUS染色及定量分析
A: 转基因阳性(上排)和非转基因(下排)二穗短柄草GUS染色分析。从左至右依次为叶片、幼穗、颖壳、种子、幼茎和幼根。B: 转基因阳性二穗短柄草GUS定量分析。*表示两者之间差异在0.05水平上显著(t检验)。
Fig. 6Histochemical staining and quantification of GUS activity in transgenic Brachypodium distachyon
A: histochemical GUS staining analysis of transgenic (upper) and non-transgenic (lower) Brachypodium distachyon. The tissues from the left to right are leaf, young panicle, glume, seed, young stem and young root, respectively. B: quantification of GUS activity in transgenic Brachypodium distachyon. * indicate significant difference at P < 0.05 (t-test).
2.4 不同胁迫条件下的GUS染色和定量分析
对转P91z-P1、P91z-(-1I)、P91z-(-2I)和P91z-Δ2I阳性植株胁迫处理发现, TaSAP1启动子P1活性可受干旱、低温和外源ABA诱导, 显著上调表达, 其中受干旱胁迫上调表达程度最高, 约是对照的10倍(P<0.01), 其次为外源ABA和低温(4℃)分别是对照的6倍(P<0.01)和4倍(P<0.05); 转P91z-(-1I)阳性植株GUS活性也可以受以上3种胁迫诱导上调, 分别是对照的5倍(P<0.05)、2倍(P<0.05)和4倍(P<0.05); 以上各载体阳性植株, 在NaCl胁迫下均变化不显著(P>0.05)。转P91z-(-2I)阳性植株GUS受不同胁迫处理后, 与对照相比, 未见显著变化(P>0.05); 转P91z-Δ2I阳性植株对各种胁迫诱导没有响应, 未检测到GUS活性(图7)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7TaSAP1启动子及其内含子缺失突变体对不同逆境的响应
A: 胁迫条件下转基因二穗短柄草叶片的GUS组织化学染色; B: 胁迫条件下转基因二穗短柄草的GUS定量分析。NaCl、PEG、4°C和ABA表示生长2周后的二穗短柄草分别在NaCl (250 mmol L-1)、PEG-6000 (-0.5 MPa)、4°C和ABA (50 μmol L-1)条件下处理8 h, CK为无处理对照。*和**分别表示胁迫处理与对照(CK)的酶活差异在0.05和0.01水平上显著。
Fig. 7Response of promoter and 5UI deletion mutants of TaSAP1 to different stresses
A: histochemical GUS staining activity in transgenic Brachypodium distachyon leaves under different stresses. B: quantification of GUS activity in transgenic Brachypodium distachyon under different stresses. NaCl, PEG, 4°C and ABA represents two-week Brachypodium distachyon plant treated with NaCl (250 mmol L-1), PEG-6000 (-0.5 MPa), 4°C and ABA (50 μmol L-1) for 8 h, respectively; CK is the control without stress treatment. * and ** indicate significant difference between a stress treatment and CK at the 0.05 and 0.01 probability levels, respectively.
3 讨论
植物在长期进化过程中, 形成一套复杂精细的基因调控网络, 能够在转录、转录后、翻译及翻译后水平进行基因表达调控。启动子是调控外源基因表达的主要元件, 目前已克隆了相当数量的启动子[20,21,22,23,24,25,26,27,28,29,30,31], 然而启动子主要在转录水平起作用, 调控方式单一, 很难达到精细调控的目的。因此, 迫切需要发掘能够在多个水平调控基因表达的重要元件。真核生物内含子可以在转录、转录后和翻译等多水平影响基因表达, 是优化外源基因表达的重要元件。大部分内含子都位于基因编码区, 如人类约90%的内含子位于编码区; 内含子还存在于基因的5′或3′非翻译区, 如人类35%的5′非翻译区存在内含子[32]。5UI在不同基因家族中分布频率不等, 如起调控作用的基因往往富含5UI[32], 5UI在基因中分布的“偏好性”暗示其可能具有某些特殊的功能。此外, 5UI更接近宿主基因的转录起始位点, 较编码区内含子更方便调控基因表达, 且序列一般长于编码区内含子, 可能具有更多的转录因子结合位点[19], 因此5UI较编码区内含子更具研究及实际应用价值。小麦TaSAP1基因有2个5UI [27]。本研究表明TaSAP1启动子P1属于诱导型启动子, 可受干旱、低温和外源ABA胁迫上调表达, 该启动子可用于逆境相关转基因育种中对外源基因的精细调控; 这两个5UI同时缺失导致TaSAP1启动子失活, 单独缺失一个5UI导致部分功能丧失, 其中单独缺失Intron-1突变导致P1活性显著降低, 但不影响P1对外界胁迫的响应, 而单独缺失Intron-2, 对P1本身活性无显著影响, 但失去对外界胁迫的响应能力。说明5UI对于TaSAP1启动子的功能至关重要, 两个5UI功能不同, Intron-1具有增强P1活性的功能, Intron-2对于P1响应逆境胁迫非常重要。目前关于内含子增强基因表达的机制尚未完全揭示, 一些内含子序列本身具有可增强基因转录起始频率的顺式作用元件, 如番茄蛋白酶抑制剂II内含子序列[33], 但大部分起增强表达作用的内含子并不会改变基因的转录起始频率, 这种现象称作内含子介导的增强作用(intron- mediated enhancement, IME), IME产生的机制相对复杂, 目前还没有被完全解释。内含子参与基因对逆境的响应还未见报道, 本研究发现Intron-2参与P1对逆境的响应, 推测其可能是由于Intron-2中存在ABRE、MBS和CCAAT-box等逆境相关顺式作用元件。
小麦遗传转化相对较难, 且周期长, 小麦启动子多数通过转化拟南芥来研究[31,34], 小麦和拟南芥分属单双子叶植物, 遗传背景差异较大可能会导致研究误差, 如水稻Actin-1启动子在玉米中活性较高, 而烟草中无活性[35]。二穗短柄草与小麦同属早熟禾亚科, 是研究小麦的理想模式植物[36], 本研究利用二穗短柄草为转化受体研究TaSAP1启动子功能, 较用拟南芥和烟草, 研究结果更接近真实情况, 更具说服力。
4 结论
小麦TaSAP1启动子P1可受干旱、低温和外源ABA胁迫上调表达, 其中受干旱胁迫上调表达程度最高, 约是对照的10倍; TaSAP1 5UI对于启动子功能发挥至关重要, 2个5UI均突变可导致P1失活; Intron-1具有增强P1活性的功能, 而Intron-2可使P1响应外界逆境胁迫。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 4]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
