 , 李燕
, 李燕 , 李新国
, 李新国
*通讯作者(Corresponding authors): 万书波, E-mail: wansb@saas.ac.cn; 李新国, E-mail: lixinguo@tom.com 第一作者联系方式: E-mail: yangsha0904@126.com, Tel: 0531-83179692
收稿日期:2014-11-06 接受日期:2015-05-04网络出版日期:2015-05-15基金:
摘要
关键词:花生叶片cDNA文库; AhCaM; 泛素; 酵母双杂交系统; 蛋白质相互作用
Screening of AhCaM-Interactive Proteins in Peanuts Using Yeast Two Hybrid System
YANG Sha
 , LI Yan
, LI Yan , LI Xin-Guo
, LI Xin-Guo
Abstract
Keyword:cDNA library of peanut leaf; AhCaM; Ubiquitin; Yeast two hybrid system; Protein interaction
Show Figures
Show Figures










花生是以种子为经济指标的喜钙作物, 在缺钙条件下常出现胚败育而导致减产[1]。Ca2+信号通路是植物中已确认的主要信号转导途径, 以Ca2+和CaM为核心的钙信使系统在植物对外界信号的感受、传递和响应过程中起作用[2, 3]。然而钙调素本身并没有任何酶活性, 只有活化后进一步与其靶蛋白中的短肽序列结合, 才能诱发其结构变化, 从而调控植物细胞分裂、伸长、生长、发育和抗逆等[4], 因此Ca2+-CaM信号转导的差异性主要依赖于它的靶蛋白, 分离出更多的靶蛋白将有助于探明Ca2+/CaM调控通路的分子机制, 了解CaM的多种作用途径, 为提高花生产量提供理论依据。CaM广泛地分布于几乎所有已知的真核生物中, 是由148个氨基酸组成的单链可溶性球蛋白, 分子量约16 700, 具较好的热稳定性、酸性和保守性[5]。CaM具有EF和CD两种手型结构, 在空间构型上有很大的灵活性和化学上的稳定性, 当细胞内钙离子浓度升高时, 钙离子会结合到钙调素结合蛋白的EF手型结构域上破坏钙调素结合蛋白的氢键网络, 释放钙调素结合结构域, 结合了钙离子的钙调素再结合到钙调素结合蛋白上, 从而将信号传导下去[6, 7]。
研究表明, 钙离子参与包括干旱、盐胁迫、冷和热刺激在内的非生物胁迫应答, 不同的非生物胁迫信号能改变细胞内钙离子水平, 这是植物应答非生物胁迫的早期报道[8]。遗传学研究显示钙调素相关的信号途径在胁迫应答中发挥调节作用, 非生物刺激诱导的钙调素或钙调素类似蛋白在很多植物中已被鉴定出来, 并且作为诱饵蛋白通过蛋白之间的相互作用分离得到下游的靶蛋白, 钙调素或钙调素类似蛋白及其下游结合蛋白在植物适应非生物胁迫中具有重要作用。Ca2+/CaM可以通过磷酸酶(PP7)调节热刺激转录因子(HSF1)的活性, 从而增强热激蛋白的表达, 提高耐热性[9]; 在钙离子介导的对盐胁迫的应答中, 钙调素也是重要的感知分子[10], CaM结合到At-MYB2上, 从而提高MYB2的DNA结合活性和转录活性, 提高盐耐受能力[11]。对于冷适应的调节, 则是通过钙/钙调素受体激酶(CRLK1)实现的[12]。后来研究发现, 无论在植物体外还是体内CRLK1都能与有丝分裂原活化蛋白(MAP)激酶家族成员MEKK1相互作用[13]。在crlk1突变株中, 寒冷触发的MAP激酶活性被抑制, 并且冷诱导的涉及MAP激酶活性信号的表达水平也发生改变。迄今为止, 关于花生中CaM的功能及其相互作用蛋白的研究尚未见报道。
我们从花生叶片中分离得到钙调素基因, 前期研究发现, 花生中CaM可以调控叶黄素循环介导的热耗散过程, 从而提高高温强光胁迫下花生叶片光合机构的稳定性及其抗逆性[14]。为了进一步找出响应逆境胁迫的钙调素下游靶蛋白, 本试验利用酵母双杂交技术, 筛选和初步研究与花生CaM相互作用的蛋白, 为解决更多的钙介导的相关基因调控问题, 深入了解钙和钙/钙调素调节的基因网络打好基础, 将有助于开发新的花生品种, 加强对环境胁迫的耐受性。
1 材料与方法1.1 试验材料选用生产上广泛种植的花生(Arachis hypogaeaL.)品种花育22。克隆载体pMD18-T购自TaKaRa公司, 诱饵表达载体pGBKT7、pGADT7、酵母菌株AH109、Y187购自Clontech公司。酵母双杂交试剂盒BD Matchmaker Library Construction & Screening Kits、Aureobasidin A (AbA)、酵母培养和转化试剂购自Clontech公司。酵母质粒提取试剂盒(TIANprep Yeast Plasmid DNA Kit)和总RNA提取试剂盒(Plant RNAprep Plant Kit)购自北京天根生化公司, DNA重组所用各种酶、DNAmarker、胶回收纯化试剂盒、LB培养基胰蛋白胨和酵母提取物购自TaKaRa公司, 引物合成和测序由上海生物工程公司完成。
1.2 诱饵蛋白表达载体构建用基因特异引物5′ -CATATGATGGCGGATCCG CTCACC-3′ 和5′ -CTGCAGCTAGGCCATCATGACC TTG-3′ 通过高保真聚合酶Primer star PCR扩增AhCaM基因CDS区(420 bp), 连到pMD18-T克隆载体, 同时在其两端引入NdeI和PstI酶切位点, 将PCR产物回收, 并与pGBKT7载体同时进行双酶切, 酶切产物回收后采用T4 DNA连接酶连接过夜, 并转化大肠杆菌DH5α 感受态细胞, PCR鉴定得到阳性转化子, 经酶切和测序验证。
1.3 诱饵蛋白毒性及自激活检测将构建的pGBKT7-AhCaM质粒和pGBKT7空载体分别转化Y2HGold酵母感受态细胞, 涂布于SD/-Trp、SD/-His/-Trp、SD/-Trp/-Ade固体培养基上, 观察pGBKT7-AhCaM和pGBKT7空载体菌落生长状况。进一步用蓝白斑筛选试验, 确定诱饵蛋白是否具有自激活。挑取SD/-Trp/X-α -gal平板上的单菌落(直径大于2 mm)接种于SD/-Trp/Kan液体培养基, 30℃振荡培养(250转 min-1), 24 h内OD600能否超过0.8, 以检测诱饵蛋白是否含有毒性。
1.4 花生cDNA文库的构建将生长21 d的花生幼苗进行高温(40℃)强光(1200 μ mol m-2 s-1 PFD)处理6 h, 采用RNAprep pure Plant Kit试剂盒(TIANGEN, Beijing)提取处理后的花生叶片总RNA, 采用 SMART MMLV Reverse Transcriptase (Clontech, BD), 以CDS III Primer和SMART III Oligo反转录合成cDNA第1链, 并通过Advantage 2 Polymerase LD-PCR扩增合成dsDNA, 最后通过CHROMA SPINTM TE-400柱纯化回收大于500 bp dsDNA, 转入Y187酵母菌株, 构建花生叶片cDNA文库。
1.5 酵母的共转化筛选采用醋酸锂的方法制备酵母感受态细胞, 在10 mL的灭菌离心管中加入20 μ L dscDNA, 6 μ L pGADT7-Rec, 5 μ L pGBKT7-AhCaM, 20 μ L变性处理的Herring Tests Carrier DNA, 600 μ L酵母感受态细胞以及2.5 mL新鲜配制的PEG/LiAc溶液, 混匀后, 30℃温育45 min, 加入160 μ L DMSO, 42℃水浴热休克20 min, 离心弃上清液, 重悬沉淀于3 mL YPD Liquid Medium中, 30℃摇培90 min, 离心, 弃上清液, 重悬沉淀于800 μ L 0.9% NaCl中, 取150 μ L共转化产物涂布于四缺培养基SD/-Ade/-His/- Leu/-Trp, 筛选花育22中与AhCaM互作的蛋白, 30℃培养直至菌落长出。同时将共转化产物涂布于培养基SD/-Leu, SD/-Leu/-Trp计算转化效率。挑取四缺培养基SD/-Ade/-His/-Leu/-Trp上的得到的大于2 mm的克隆, 采用郭佳岩等[15]的方法进行快速 LacZ基因验证, 8 h内呈现蓝色的初步认定为阳性克隆。挑取阳性克隆少量菌体, 以LD Amplifier为引物5′ LD Amplimer: 5′ -CTATTCGATGATGAAGATAC CCCACCAAACCC-3′ ; 3′ LD Amplimer: 5′ -GTGAA CTTGCGGGGTTTTTCAGTATCTACGATT-3′ , 进行菌落PCR分析以排除重复克隆。将已确定的插入外源片段的阳性克隆送至上海生工生物技术服务公司测序, 在GenBank上比对、分析测序结果。
1.6 AhCaM与AhUbiquitin的互作验证将pGBKT7-AhUbiquitin质粒和pGADT7-AhCaM质粒共转化酵母菌Y2HGold, 涂布于缺失培养基(SD/-Trp/-Leu)上培养, 待菌落长出后接种于SD/- Trp/-Leu/-His/-Ade/X-α -gal培养基, 观察菌落生长情况。
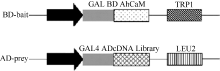
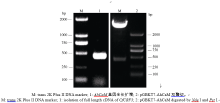
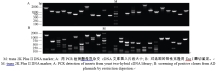
2 结果与分析2.1 诱饵载体的构建及序列测定以花生叶片cDNA为模板, 并用TaKaRa公司的高保真酶扩增目的基因AhCaM, 扩增得到CaM长度为447 bp, 编码149个氨基酸。经NdeI和PstI酶切后与pGBKT7连接, 形成在ADH1启动子驱动下表达的GAL4 BD-AhCaM融合蛋白(图1)。经双酶切鉴定、PCR (图2)和测序分析表明, AhCaM在重组质粒上读码框正确, 序列与文献报道完全一致。AD- prey是在pGADT7上构建的花生cDNA文库(图1)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 BD-bait和AD-prey载体示意图Fig. 1 Schematic diagram of BD-bait and AD-prey |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 BD载体构建及酶切鉴定Fig. 2 Restriction enzyme digestion analysis of the clones pGBKT7-AhCaM |
2.2 诱饵蛋白载体自激活和毒性检测含有诱饵蛋白pGBKT7-AhCaM的转化菌在SD/-Trp培养基上菌落呈白色, 生长良好, 菌落直径> 2 mm (图3), 蓝白斑筛选试验中未变色。在SD/- His-Trp, SD/-Ade/-Trp培养基上未见菌落生长, 且空白对照组也未见菌落生长, 说明诱饵蛋白pGBKT7-AhCaM不能自激活。接种于SD/-Trp/Kan克隆子在30℃振荡培养24 h后, OD600> 0.8, 说明诱饵蛋白无毒性, 可以直接用于酵母双杂交文库筛选。
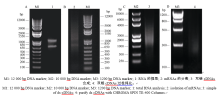
2.3 花生叶片cDNA文库建立提取花生幼苗叶片总RNA, 电泳检测RNA的完整性。显示, 28S rRNA和18S rRNA条带清晰, 说明所提取花生的总RNA完整性好(图4-A), 没有发生降解, 符合建库要求。利用PolyATtract mRNA Isolation System III从总RNA中分离mRNA (图4-B), 并以此mRNA为模板, 用CDS III Primer引物反转录合成cDNA (图4-C), 得到的基因较完整, 序列都是正向的, 比以往制备文库的方法更加完善。将双链cDNA过柱纯化(图4-D), 除去200 bp以下的小片段。通过同源重组把纯化的双链cDNA整合到pGADT7-Rec载体上, 再转化进入酵母Y187中, 得到所需的cDNA文库, 保存于-80℃冰箱。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 pGBKT7-AhCaM自激活检测Fig. 3 Auto-activation test of pGBKT7-AhCaM |
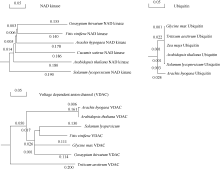
2.4 花生中AhCaM相互作用蛋白的筛选以pGBKT7-AhCaM为诱饵筛选花生叶片cDNAs文库, 将文库质粒转入含有诱饵蛋白表达载体pGBKT7-AhCaM的酵母细胞Y2HGold, 在SD/- Trp/-Leu/-His/-Ade培养板上培养至菌落出现, 重新接种于新的SD/-Trp/-Leu/-His/-Ade/X-α -gal选择培养基, 30℃培养24~36 h, 得到单克隆(图5)。之后用菌落PCR方法初筛(图6-A), 除去500 bp以下的小片段, 再利用酶切方法鉴定(图6-B)。最后选择酶切大小不同的单克隆提取质粒进行核苷酸序列测定, 通过测序及与GenBank数据库同源性比较, 将得到的相同结果视为一个, 并将载体的阅读框与目的基因不同的克隆排除掉, 最终获得NAD激酶、电压依赖性阴离子通道、泛素、根瘤素酶及乙醇脱氢酶5个无重复性克隆, 并从中选择与抗逆相关的重要蛋白NAD激酶(NAD kinase)、电压依赖性阴离子通道(voltage dependent anion channel)及泛素(ubiquitin)进行进化树分析(图7)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 cDNA文库的建立Fig. 4 Construction of a two-hybrid library |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 花生cDNA文库与AhCaM共转化后在SD/-Trp/-Leu/-His/-Ade/X-α -gal四缺板的筛选Fig. 5 CaM interaction proteins screened through co-transformation with bait vector and cDNA prey library on SD/-Trp/-Leu/-His/-Ade/X-α -gal plate |
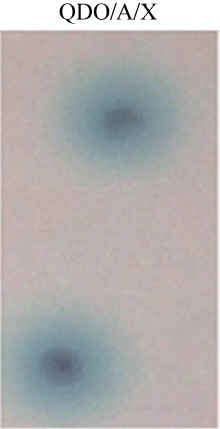
2.5 相互作用酵母体内验证为进一步验证AhCaM与靶蛋白AhUbiquitin的相互作用, 分别将AhUbiquitin/pGADT、AhUbiquitin/ AhCaM、AhCaM/pGBKT7、阴性对照及阳性对照质粒转入酵母菌株Y2HGold, 涂在SD/-Trp-Leu (DDO)和SD/-Trp-Leu-His-Ade (QDO/A/X)的培养基上, 30℃培养3~5 d, 结果表明, 在DDO上阳性克隆都能正常生长(图8), 而在QDO/A/X培养基上筛选, 只有阳性对照、AhCaM与靶蛋白AhUbiquitin同时存在并相互作用时才会长出变蓝的单克隆, 验证了筛选得到阳性克隆的准确性, 同时降低了假阳性的可能性。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 AhCaM互作蛋白的鉴定Fig. 6 Identification of AhCaM-interactive proteins |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 AhCaM互作蛋白进化树分析Fig. 7 Phylogenetic analysis of AhCaM-interactive proteins |
3 讨论2007年孟玉环等[16]首次从花生中分离得到钙调素蛋白, 然而未进一步研究其功能。本实验室初步研究表明, AhCaM参与对花生叶黄素循环途径的调控, 从而有利于逆境胁迫条件下耗散掉过剩能量以保护光系统反应中心[14]; 而且过量表达该基因的转基因烟草植株耐盐性有显著提高(未发表资料), 说明AhCaM蛋白能够在提高植物抗逆性方面发挥作用, 但在花生中CaM提高植物抗逆性的具体分子机制和其他方面的生物学功能还不清楚。酵母双杂交技术是研究蛋白质间相互作用的有效分子生物学方法, 在分析新基因的生物学功能和发现新的作用蛋白质方面有着广泛应用[17, 18]。在本研究中, 我们成功地利用酵母双杂交系统筛选到了与AhCaM蛋白相互作用的5个靶蛋白, 通过对这些靶蛋白的进化及功能分析, 不仅对AhCaM在植物抗逆的分子机制方面有所了解, 还为探索AhCaM蛋白的未知生物学功能提供了新线索。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 酵母双杂交系统验证AhCaM与AhUbiquitin相互作用Fig. 8 Yeast two-hybrid analysis of interaction between AhCaM and AhUbiquitin |
利用美国国立生物技术信息中心数据库(http:// www.ncbi.nlm.nih.gov/BLAST), 对得到的靶蛋白进行结构功能域和同源性分析。结果发现, 筛选到5种与AhCaM互作的蛋白, 包括NAD激酶、电压依赖性阴离子通道、泛素、根瘤素酶及乙醇脱氢酶。其中NAD激酶是已知与钙调素互作的蛋白, 是植物细胞内CaM所作用的重要靶酶之一[19]。该蛋白广泛存在于各种植物细胞内, 是目前所发现的唯一能催化NAD磷酸化生成NADP的酶, 这一过程对细胞内的许多代谢过程有重要的调控作用。其中CaM可以通过NAD激酶来对光合作用起调节作用[20], 因为光反应的最终电子受体正是NAD激酶所催化的反应产物NADP。除此之外, CaM与NAD激酶相互作用在植物发育、抗逆等途径中均起重要作用。电压依赖性阴离子通道(voltage dependent anion channel, VDAC)作为线粒体外膜上分子或离子交换的一种出入通道, 在钙稳态维持和细胞活性调节中起关键作用。大量证据表明, 线粒体Ca2+转运既可影响线粒体基质内Ca2+敏感代谢酶的活性, 调控线粒体能量代谢, 也可通过摄取或释放Ca2+而调控胞内的Ca2+浓度[21]。其中过度表达VDAC-GFP, 可允许Ca2+从内质网释放后, 快速扩散到线粒体内, 增加线粒体基质中Ca2+的浓度[22]。研究报道, 由VDAC本身的功能状态或与ROS、Ca2+、HK、Bcl-2以及谷氨酸、腺嘌呤核苷酸等物质的相互作用可以推测, CaM很可能通过与VDAC间的相互作用调节VDAC的开放、关闭, 在线粒体功能和细胞钙信号之间的相互影响中发挥作用[23]。
植物在逆境条件下, 由于活性氧伤害等原因, 会造成无功能蛋白质的积累增加, 因此逆境条件下加强无功能蛋白质的清除能力对于提高生物的逆境适应能力就显得很重要。在许多情况下, 受损蛋白在各种分子伴侣的协助下可以得到一定程度的修复或重新折叠[24]。但是一旦异常蛋白积累过多, 通过蛋白降解途径及时清除“ 垃圾” , 就成为一种重要的解决方式。已有研究发现这些蛋白质的降解与泛素/26S蛋白酶体通路介导无功能蛋白质的降解关系密切[25]。泛素是一种由76个氨基酸残基组成的小分子量蛋白质, 广泛存在于各种真核生物中。细胞内需要降解的靶蛋白首先在ATP的作用下被泛素标记形成缀合物, 这个过程称为泛素化。泛素化过程循环下去, 目标蛋白就被运输到26S蛋白酶体降解。目前研究较为深入的是Ub/26S蛋白酶体途径参与植物响应干旱胁迫[26]、盐胁迫[27]、热胁迫[28]等逆境过程。除此之外, 植物细胞中光敏素可与泛素结合。植物细胞中Pfr型光敏素的量是严格控制的, 一旦产生就会迅速被降解, 而Ub/26S蛋白酶体途径介导Pfr的降解[25]。这一发现首次表明Ub/26S蛋白酶体途径参与病原体防御[29]。目前, 人们对泛素途径的组成和在生物体内的功能已经有了较深刻的认识。本试验通过酵母双杂交系统将钙调素与泛素联系起来, 并已对这2个蛋白之间的相互作用进行了验证。而对于根瘤素酶(extensin/nodulin protein)和乙醇脱氢酶(alcohol dehydrogenase)的研究目前多集中在人和动物, 植物中的功能研究较少, 有研究表明逆境胁迫可诱导拟南芥中根瘤素酶的表达[30]。
综上所述, 本研究从花生叶片cDNA文库中获得多个与AhCaM相互作用的靶蛋白。通过分析这些靶蛋白的生物学功能, 发现它们均参与植物逆境胁迫的响应。初步提出了AhCaM提高植物抗逆性的可能分子机制, 可以相信, 对AhCaM功能及作用机制的深入研究必将大大推动植物钙信号调控途径在提高花生抗逆机制中的研究与应用, 为改良花生品质, 培育抗逆新品种提供重要理论依据。
4 结论利用酵母双杂交筛选花生叶片中CaM相互作用蛋白, 获得5个初步验证的阳性克隆。测AhCaM基因可能通过与这些蛋白结合, 在维持细胞结构的稳定及抗逆过程中起作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] |
