 , 王景一
, 王景一
* 通讯作者(Corresponding author): 景蕊莲, E-mail: jingruilian@caas.cn, Tel: 010-82105829 第一作者联系方式: E-mail: liqian198812@126.com
收稿日期:2015-03-19 基金:
摘要
关键词:小麦; 脂质转运蛋白; 基因克隆; 非生物胁迫; 耐盐性
Cloning and Functional Analysis of Lipid Transfer Protein Gene TaLTP in Wheat
LI Qian
 , WANG Jing-Yi
, WANG Jing-Yi
Abstract
Keyword:Wheat; TaLTP-s; Gene cloning; Abiotic stress; Salt tolerance
Show Figures
Show Figures








植物脂质转运蛋白(lipid transfer protein, LTP)是一类可溶性的小分子蛋白, 因其能在植物细胞膜之间转运脂类物质而得名。LTP蛋白的N端有一个包含21~29个氨基酸的信号肽, 能够引导蛋白分泌到细胞外参与细胞外亲脂性物质(如角质)的沉积途径[1]。LTP蛋白含有8个半胱氨酸残基(C-Xn-C-Xn-CC-Xn- CXC-Xn-C-Xn-C), 可以形成4个二硫键[2]。体外实验表明, 这4个二硫键形成一个疏水腔, 因而能够结合脂类和一些疏水性物质[3]。不同物种的LTP蛋白一级结构差异较大, 根据其分子量最初将其分为type I (10 kD)和type II (7 kD)两个亚家族[3]。后来在玉米中发现了花药特异性转录基因MZm3-3, 该基因表达的蛋白与nsLTPs同源, 被认为是type III [4]。
LTP蛋白主要存在于植物地上器官的表皮组织中, 具备多种复杂的生物学功能, 主要包括脂类物质转运、角质层蜡质合成[5, 6], 抵御非生物胁迫[7, 8]和病原菌侵害[9], 另外在花药和花粉发育[10, 11]、水分胁迫信号转导[12]过程中也发挥重要作用。例如芝麻SiLTP2与SiLTP4基因受NaCl、甘露醇等胁迫诱导表达[13], 拟南芥中过表达脂质转运蛋白AZI1基因株系的耐盐性显著高于野生型和突变体[8], 过表达辣椒CALTP1的转基因拟南芥抗病、抗盐和抗旱性也显著高于野生型[14]。目前在拟南芥[15]、水稻[16]、棉花[17]中分别检测到15、52和11个LTP基因, 在小麦中鉴定出23个LTP基因[18]。Boutrot等[18]用GUS作为报告基因, 在转基因水稻根、叶、花的维管组织中检测到6个小麦LTP基因启动子活性, 说明LTP在维管组织中发挥一定作用。Jang等[19]从小麦-黑麦易位株系中分离到TaLTP1和TaLTP2基因, Northern blot分析显示其转录水平受NaCl和PEG的诱导。但关于这些基因的具体生物学功能还有待进一步研究。
本研究通过同源克隆得到小麦(Triticum aestivum L.)脂质转运蛋白基因TaLTP-s, 并进行了基因序列比对和染色体定位, 目标基因在小麦细胞中的作用部位和不同器官中的表达特性检测, 在ABA、PEG、NaCl、低温等胁迫处理下目标基因的表达模式分析, 以及转TaLTP-s拟南芥对高浓度盐胁迫的响应分析, 旨在为深入研究TaLTP-s的功能, 揭示脂质转运蛋白在小麦抵抗逆境胁迫中的作用提供依据。
1 材料与方法1.1 植物材料及其培养利用本实验室保存的小麦抗旱品种旱选10号进行基因克隆、原生质体的亚细胞定位和基因表达模式分析等。挑选大小均匀一致的种子置培养皿中, 加入去离子水, 在光照培养箱(20℃、光周期12 h d-1)中待幼苗长至一叶一心时, 分别用16.1% PEG- 6000、250 mmol L-1 NaCl、50 mmol L-1 ABA和4℃进行胁迫处理, 在处理0、0.5、1、1.5、2、3、6、12、24、48和72 h后取幼苗叶片, -80℃保存, 用于目标基因的胁迫表达模式分析。田间种植旱选10号, 开花期取根、叶、小花、花药和雌蕊, -80℃保存, 成熟后取种子, 用于目标基因的组织特异性表达分析。挑选籽粒饱满的小麦种子, 置培养皿中, 加去离子水室温培养, 待幼苗长至一叶一心时, 取幼苗叶片中段进行酶解处理, 制备原生质体进行目标基因的亚细胞定位。
用于基因染色体定位的材料包括本实验室保存的普通小麦的二倍体供体种10份、四倍体材料3份(表1), 以及由中国农业科学院作物科学研究所高丽锋老师提供的192个源于普通小麦品种偃展1号× 内乡188的重组自交系(recombinant inbred line, RIL)。室温条件下水培上述材料, 取幼苗叶片提取DNA。
表1
Table 1
表1(Table 1)
| 表1 供试小麦品种、小麦近缘材料及其来源 Table 1 Wheat varieties and wheat relatives used in this study and their origins |
1.2 目的基因克隆以NCBI数据库(http://www.ncbi.nlm.nih.gov/)的OsDIL(Oryza sativadrought-induced LTP, Os10g0148000)为参考序列, 在小麦A基因组数据库中搜索得到小麦TaLTP候选序列, 利用Primer Premier 5.0软件设计扩增TaLTP全长序列的引物LTP-F和LTP-R, 以及扩增基因编码区的引物LTP-c-F和LTP-c-R (表2)。
表2
Table 2
表2(Table 2)
| 表2 用于qRT-PCR的引物及其序列 Table 2 Primers used in qRT-PCR and their sequences |
用TRIzol试剂盒(TIANGEN, 北京)提取总RNA。以经过处理的小麦幼苗总RNA为模板, 用M-MLV Reverse Transcriptase反转录试剂盒(Invitrogen, 美国)合成第1链cDNA, 以此为模板。利用高保真酶TransStart Fast Pfu DNA polymerase (TRANSGEN, 北京)进行PCR。扩增体系包含5× buffer 3 μ L, dNTP (2.5 μ mol L-1) 1.2 μ L, 模板DNA (50 ng μ L-1) 1 μ L, 正、反向引物(10 μ mol L-1)各0.5 μ L, TransStart Fast Pfu0.3 μ L, 用ddH2O补足15 μ L。反应条件为95℃ 5 min; 95℃ 45 s, 56℃ 45 s, 72℃ 30 s, 36个循环; 72℃ 10 min; 10℃保存。用2%琼脂糖凝胶分离PCR产物。将目的片段回收纯化后, 连接至pEASY-Blunt载体(TRANSGEN, 北京), 转化后挑取阳性克隆, 用BigDye Terminator Kit (ABI)按说明书测序。
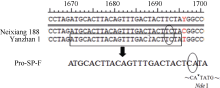
1.3 目的基因引物设计和遗传作图利用RIL群体亲本偃展1号和内乡188中启动子区1696 bp处的碱基差异T/C设计dCAPS (derived cleaved amplified polymorphic sequences)标记引物Pro-SP-F、Pro-SP-R (表2), 其扩增产物220 bp, 含有Nde I酶切位点(图1)。酶切该扩增产物, 检测各株系的基因型, 利用MapMaker3.0遗传作图软件进行目标基因作图。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 dCAPS标记引物设计示意图. 方框内为设计Pro-SP-F引物的原始序列; 椭圆框内为突变碱基: TC→ CA; ▼表示Nde I酶切位点。Fig. 1 Scheme of dCAPS primer design. The sequence in the box is the primer Pro-SP-F. The elliptic boxes indicate mutated bases: TC→ CA.▼is the enzyme cutting site of Nde I. |
1.4 基因结构和序列分析利用DNAStar软件包中Seqman和MegAlign进行基因序列分析、拼接和比对。应用DNAman进行酶切位点的分析和蛋白序列比对分析。采用SignalP 4.0预测信号肽。
1.5 载体构建和亚细胞定位利用Kpn I和Xba I酶切位点将TaLTP-s全长CDS序列(去掉终止密码子)与Psuper-1300-GFP载体融合表达, 构建成35S::TaLTP-s::GFP载体用于亚细胞定位观察和拟南芥的转化。用原生质体转化法将35S::GFP、35S::TaLTP-s::GFP分别转化小麦叶肉细胞原生质体, 室温避光培育12 h后, 在Zeiss LSM700激光共聚焦显微镜下观察细胞的荧光信号。
1.6 目标基因的实时定量RT-PCR检测以小麦Actin(JQ269668.1)为内参基因, 设计实时定量PCR引物(表2)。采用SYBR Premix Ex Taq (Perfect Real-time)试剂盒(TaKaRa, 日本)进行qRT-PCR分析。反应体系20 μ L, 含2× SYBR Premix Ex Taq10.0 μ L, 正、反向引物(5 μ mol L-1)各0.4 μ L, 1/10 cDNA first-strand 1.0 μ L, ROX Reference Dye (50× ) 0.4 μ L, ddH2O 7.8 μ L。在ABI 7900 PCR仪上按如下程序扩增: 95℃ 30 s; 95℃ 5 s, 退火30 s, 40个循环。采用2-Δ Δ Ct法计算目标基因的相对表达量[20]。
1.7 转基因拟南芥及其耐盐性鉴定用构建的载体质粒转化农杆菌GV3101菌株, 侵染拟南芥的花。经潮霉素抗性筛选后获得T1代转基因阳性植株, 单株收取种子并加代, 再经抗性筛选得到T3代纯合转基因株系, 选取2个株系用于耐盐性分析。
将野生型(WT)、转GFP的对照及转基因株系种子用10%次氯酸钠溶液消毒处理后, 分别点播于MS培养基上, 在4℃下春化处理2 d, 然后将培养皿垂直放于人工气候室中培养。从垂直培养8 d的幼苗中取长势一致的幼苗20株, 移至含有250 mmol L-1 NaCl的MS固体培养基上, 培养4 d后, 每隔12 h记录幼苗的绿色子叶数目, 作为幼苗存活率的指标。利用煮沸法测定幼苗相对电导率, 评价细胞膜稳定性(cell membrane stability, CMS)。幼苗垂直培养10 d后, 从每个株系挑选长势一致的幼苗, 取45株移至ddH2O和NaCl (250 mmol L-1)的过饱和滤纸上, 室温处理24 h后测定幼苗电导率, 15株为一个重复, 3次重复。CMS(%) = (1 - 煮前电导率/煮后电导率) × 100。CMS值越大, 细胞膜稳定性越强, 说明受盐胁迫的伤害越小。
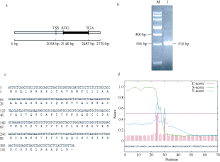
2 结果与分析2.1 目标基因克隆以普通小麦旱选10号基因组DNA为模板, 利用引物对LTP-F/LTP-R扩增TaLTP基因, 测序结果表明其全长序列为2.77 kb, 包含基因区和启动子区(图2-a)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 TaLTP基因结构和序列及TaLTP-s编码氨基酸序列. a:TaLTP基因结构图, TSS表示转录起始位点, ATG和TGA分别表示起始和终止密码子。b: 小麦cDNA中分离的TaLTP, M和1分别表示Marker III和TaLTP的RT-PCR产物。c:TaLTP-s核酸序列及其推导的氨基酸序列。d: TaLTP-s信号肽预测, 红、绿、蓝线分别代表剪切位置分值(C-score)、信号肽分值(S-score)和综合考虑分值(Y-score)。Fig. 2 Structure and sequence of gene TaLTPand amino acids sequence encoded by TaLTP-s. a: scheme of TaLTP structure, in which TSS is the transcription start site, ATG and TAG are the initiation and termination codon respectively. b: TaLTP isolated from wheat cDNA. Lanes “ M” and “ 1” were loaded with Marker III and the RT-PCR product of TaLTP. c: nucleotide sequence and putative amino acids of TaLTP-s. d: signal peptide predicted in TaLTP-s. The red, green and blue lines show cleavage site score (C-score), signal peptide score (S-score) and combined cleavage site score (Y-score), respectively. |
以旱选10号cDNA为模板, 利用引物对LTP-c-F/LTP-c-R扩增目标基因。测序结果表明, 该基因有两种不同的序列, 全长均为510 bp (图2-b), 但开放阅读框分别为357 bp和339 bp, 相似性为95.3%。较长的序列命名为TaLTP-l, 较短的序列被命名为TaLTP-s。本文只对TaLTP-s进行分析。该序列编码112个氨基酸(图2-c), 在NCBI数据库中比对TaLTP-s编码的氨基酸序列, 发现其含有AAI_LTSS结构域, 属于ns-LTP like家族。以旱选10号DNA为模板, 其PCR扩增产物的测序结果表明, TaLTP-s基因没有内含子, 对信号肽预测显示1~25位氨基酸之间有典型的TaLTP信号肽特征(图2-d)。
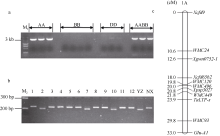
2.2 TaLTP-s基因染色体定位利用引物LTP-F和LTP-R检测小麦二倍体供体种和四倍体小麦的TaLTP-s, 结果只在乌拉尔图小麦(AA)和四倍体材料(AABB)中扩增到目标片段(图3-a), 说明该基因位于小麦A基因组。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 小麦TaLTP-s基因染色体定位. a: 基因组特异性引物LTP-F/LTP-R在小麦二倍体供体种和四倍体小麦中的扩增产物; b: RIL群体中TaLTP-s的分离; c: 小麦TaLTP-s在染色体1A上的定位。M1: Marker III; AA: 乌拉尔图小麦; BB: 拟斯卑尔托山羊草; DD: 粗山羊草; AABB: 四倍体小麦; M2: 100 bp marker; 1~12: RIL群体的12个株系; YZ: 偃展1号; NX: 内乡188。Fig. 3 Chromosome localization of TaLTP-s in wheat. a: PCR product of the genome-specific primer LTP-F/LTP-R in diploid progenitors of common wheat and tetraploid wheat species; b: separation of TaLTP-sin RILs; c: linkage map ofTaLTP-s on wheat chromosome 1A. M1: marker III; AA:Triticum urartu; BB:Aegilops speltoides; DD: Aegilops tauschii; AABB: Triticum polonicum; M2: 100 bp marker; 1-12: 12 lines of RILs; YZ: Yanzhan 1; NX: Neixiang 188. |
扩增产物的测序结果表明, 偃展1号和内乡188在TaLTP-s基因的启动子区存在7个位点的碱基差异(表3), 而编码区序列没有差异。利用Nde I酶切检测RIL群体192个株系的基因型(图3-b), 将TaLTP-s定位于染色体1A上, 位于标记WMC449和WMC93之间, 距离两侧标记的遗传距离分别为2.1 cM和5.9 cM (图3-c)。
表3
Table 3
表3(Table 3)
| 表3 RIL群体双亲中的核苷酸多态性 Table 3 Nucleotide acid polymorphism between parents of the RILs |
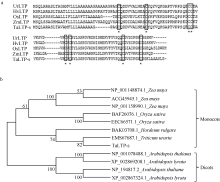
2.3 TaLTP-s氨基酸序列同源性分析将小麦TaLTP-s基因编码的蛋白序列提交到NCBI中进行BLASTP比对, 小麦与乌拉尔图小麦(EMS67687.1)、大麦(BAK03708.1)、水稻(NP_ 003573732.2)、玉米(NP_001158990.1)的LTP氨基酸序列相似性分别为91%、78%、58%和44%。虽然在序列的同源性上差异比较大, 但这几种植物LTP所含的半胱氨酸(C)数量和位置完全相同, 均含有8个半胱氨酸(图4-a)。Boutrot等[16]通过系统进化树分析将水稻和拟南芥的nsLTPs分为9种类型(type), 不同类型可以通过8个半胱氨酸之间的氨基酸数目来区分。本研究得到的小麦TaLTP-s序列中, 8个半胱氨酸之间所含有的氨基酸数目依次为10、16、0、9、1、23和7个, 应归为type VI。目前关于type VI的LTP基因信息和功能报道均较少。构建不同物种脂质转运蛋白序列的进化树, 小麦TaLTP-s与单子叶植物的蛋白序列有很高的相似性, 而与双子叶植物的LTP蛋白序列差异较大(图4-b)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 几种植物LTP序列比(a)对与聚类分析(b). Ur: 乌拉尔图小麦; Hv: 大麦; Os: 水稻; Ta: 小麦; Zm: 玉米; LTP: 脂质转运蛋白。* 代表半胱氨酸所在位置。Fig. 4 Alignment (a) and phylogenetic tree (b) of LTP sequences from several plant species. Ur:Triticum urartu; Hv: Hordeum vulgare; Os: Oryza sativa; Ta: Triticum aestivum; Zm: Zea mays; LTP: lipid transfer protein. * indicates the cysteine residues of LTPs. |
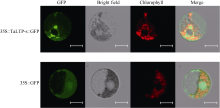
2.4 TaLTP-s亚细胞定位将构建的融合表达载体Psuper-1300-GFP转化小麦原生质体后, 在细胞质和细胞膜中检测到GFP荧光信号(图5), 说明TaLTP-s在细胞质和细胞膜上均有表达。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 TaLTP-s在小麦原生质体中的亚细胞定位Fig. 5 Subcellular localization of TaLTP-s in wheat protoplast cells. Scale bar = 20 μ m. |
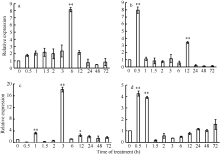
2.5 非胁迫诱导下TaLTP-s的表达模式 在ABA、NaCl、PEG和4℃胁迫条件下, 小麦幼苗TaLTP-s的表达量均显著上升, 反映了小麦脂质转运蛋白对这4种逆境胁迫均有响应。ABA诱导6 h后, 表达量达到最大值(图6-a), 说明TaLTP-s在ABA信号通路中起作用。TaLTP-s对4℃处理较为敏感, 在处理0.5 h的表达量达到最大值, 随后表达量急剧下降, 在12 h时出现第2个表达高峰(图6-b), 说明TaLTP-s可能参与植物的耐冷性反应。在NaCl处理下, TaLTP-s表达量在3 h时达到高峰, 说明TaLTP-s对盐胁迫敏感; 随后的表达量显著下降, 但仍高于对照组(图6-c), 这可能是因为高浓度的NaCl溶液对细胞造成了一定的伤害, 并进一步影响到细胞内基因转录和蛋白质的合成。PEG处理后0.5 h, TaLTP-s表达量最高, 1 h时略有下降, 随后表达量急剧下降(图6-d), 说明TaLTP-s受渗透胁迫诱导表达。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 ABA (a)、4℃低温(b)、NaCl (c)和PEG-6000 (d)胁迫下小麦幼苗中TaLTP-s的表达模式. 以0 h的表达量为标准; 数据为3次独立试验的平均值± SE。* 和* * 分别表示相对表达水平在0.05和0.01概率水平显著升高(t-检验)。Fig. 6 Expression patterns of TaLTP-s in wheat seedling under ABA (a), 4℃ of low temperature (b), NaCl (c), and PEG-6000 (d) stresses. The 0 h expression level is assigned a value of 1. Values are the mean± SE of three biological replicates. * and * * indicate significant increase in relative expression at the 0.05 and 0.01 probability level, respectively (t-test). |
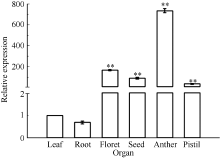
2.6 TaLTP-s组织特异性表达对小麦开花期不同组织、器官中TaLTP-s表达模式的分析表明, 该基因在根、叶、小花和成熟种子中均有表达, 表达量依次为小花> 种子> 叶> 根。进一步分析开花期的花药和雌蕊表明, TaLTP-s基因在花药中的表达量最高, 为同时期叶片的735倍(图7)。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 小麦不同组织中TaLTP-s的表达模式. 以叶的TaLTP-s表达量为标准。数据为3次独立试验的平均值± SE。* * 表示相对表达水平在0.01概率水平显著升高(t-检验)。Fig. 7 Expression patterns of TaLTP-s in different organs in wheat. The leaf expression level of TaLTP-sis assigned a value of 1. Values are the mean± SE of three biological replicates. * * indicates significant increase of relative expression at the 0.01 probability level (t-test). |
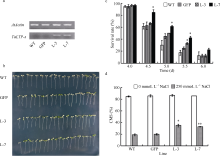
2.7 过表达TaLTP-s转基因拟南芥的耐盐性 2.7.1 盐胁迫下转基因幼苗存活率 通过对转基因株系中TaLTP-s表达量的分析(图8-a), 选取表达量较高的L-3和L-7株系分析基因功能。将在正常MS固体培养基上生长8 d的转基因和野生型拟南芥幼苗移至含有250 mmol L-1 NaCl的MS固体培养基上, 培养4 d后, 部分幼苗子叶开始变白(图8-b)。转基因株系L-7植株子叶的存活率从4.5 d到5.5 d显著高于对照组, 而转基因株系L-3仅在5.5 d时的子叶存活率显著高于对照(图8-c)。试验结果表明, 过表达TaLTP-s转基因拟南芥的耐盐性高于对照。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 盐胁迫处理下TaLTP-s转基因幼苗与野生型的存活率和细胞膜稳定性比较. a: 拟南芥中TaLTP-s的表达; b: 250 mmol L-1 NaCl处理5.5 d的拟南芥; c: 子叶存活率, 数据为3次独立实验的平均值± SE, * 表示转基因株系与野生型在0.05概率水平有显著差异(t-检验); d: 不同浓度NaCl处理的细胞膜稳定性(CMS)比较, 数据为3次独立试验的平均值± SE, * 和* * 分别表示转基因株系与野生型在0.05和0.01概率水平有显著差异(t-检验)。WT: 拟南芥野生型; GFP: 空载体对照; L-3、L-7: 2个TaLTP-s转基因株系。Fig. 8 Comparison of seeding survival and cell membrane stability between TaLTP-splants and wild type under NaCl stress. a: expression of TaLTP-sin Arabidopsis. b: Arabidopsis seedlings treated with 250 mmol L-1 NaCl for 5.5 days. c: survival rate of cotyledon. Values are the mean± SE of three biological replicates. * indicates significant difference between the transgenic line and the wild line at 0.05 probability level (t-test). d: comparison of seeding cell membrane stability (CMS) under different concentrations of NaCl. Values are the mean± SE of three biological replicates. * and * * indicate significant difference between the transgenic line and the wild type at the 0.05 and 0.01 probability levels, respectively (t-test). WT: Arabidopsis wild type; GFP: GFP control; L-3, L-7: two individual TaLTP-s transgenic lines. |
2.7.2 盐胁迫下幼苗细胞膜稳定性 正常条件下培养的各个株系的拟南芥幼苗细胞膜稳定性没有显著差异, 而盐胁迫处理24 h后幼苗细胞膜稳定性都有显著下降, 但过表达TaLTP-s转基因幼苗在盐胁迫处理下细胞膜稳定性仍然显著高于对照株系(图8-d), 说明过表达TaLTP-s转基因幼苗的耐盐胁迫能力高于对照株系。
3 讨论脂质转运蛋白在植物体内普遍存在, DNA印迹表明, 棉花、玉米、水稻等都存在LTP基因的多个拷贝, 并分布于不同染色体上[1]。研究发现LTP家族成员在不同组织器官和不同发育时期的表达模式不尽相同。比如水稻的OsLTP1基因在茎和花中的表达量高于在根和叶中, 而OsLTP3则只在茎和叶中表达[21]。在拟南芥中发现15个LTP基因, 对其中6个成员的表达谱分析表明, 它们在花和叶片中均有表达, 在根中不表达, 而且在拟南芥正发育的幼嫩组织中LTPs的表达量高于在成熟组织及花瓣和萼片的脱落区中[22]。本研究发现, 该基因在花中, 尤其是花药中的表达量显著高于在根和叶中(图7)。在水稻中发现的脂质转运蛋白基因OsDIL, 其在花药中的表达量最高, 过表达该基因的水稻植株在营养生长阶段和生殖生长阶段其抗旱性均比对照组强, 尤其是在生殖生长阶段能够降低干旱胁迫对水稻花粉发育的影响, 从而提高单株产量[23]。本研究克隆得到的小麦TaLTP-s与水稻OsDIL基因有相似的表达模式, 但其功能是否相同还有待进一步的转基因功能验证。利用RIL群体将TaLTP-s定位于1A染色体标记WMC449和WMC93之间, Su等[24]在标记区间Xpsp3027-WMC93检测到不同磷浓度处理条件下控制单株粒数、籽粒产量和生物学产量的多个QTL; Yang等[25]在相邻区间Xpsp3027-Xgwm164检测到控制籽粒饱满度和茎秆可溶性糖含量的QTL。由此推测TaLTP-s基因标记附近聚集着控制穗粒数、单株穗数及籽粒饱满度的QTL。
LTP作为一种防御蛋白, 在植物抗逆和适应不良环境中发挥重要作用。如拟南芥中过表达LTP3基因的转基因株系对干旱和低温胁迫的耐性高于突变体株系[26]。在NaCl和甘露醇胁迫处理下, 水稻中过表达LTP基因株系幼苗的存活率显著高于对照株系[23]。这些研究结果表明, 虽然LTP作用的分子机制尚不明确, 但其受多种环境胁迫诱导表达的结果暗示其在植物抗逆过程中可能具有重要作用。
在盐胁迫和干旱条件下, 植物细胞壁和细胞膜的组成会发生变化[27]。LTP可能参与胁迫处理下细胞损伤的修复, 通过增强细胞壁、细胞膜和角质层结构减少体内水分损失[28]。干旱条件下, 随着烟草体内LTP基因表达量的上升植株叶片蜡质积累量也明显增多, 表明LTP参与了蜡质的积累途径[29]。在胁迫处理下转基因幼苗的耐性高于对照, 且细胞膜的稳定性也优于对照组, 这可能是因为LTP基因的过表达, 细胞膜上LTP活性增强, 促进脂质的运输使植株叶片蜡质积累, 从而提高植株叶片在胁迫条件下的保水能力。
还有报道指出, 拟南芥在低温和干旱胁迫处理下, 转录因子AtMYB96能够结合到AtLTP3基因的启动子区域, 激活目标基因从而提高植株对环境胁迫的抗性[26]。本研究对TaLTP-s基因启动子的分析发现, 其中含有能与MYB家族结合的顺式作用元件(TAACTG) [30, 31]。关于TaLTP-s是否受MYB家族成员的转录激活, 并增加植物叶片的蜡质积累和提高抗逆性, 相关研究正在进行中。
4 结论从小麦抗旱品种旱选10号中克隆到脂质转运蛋白基因TaLTP的2种序列(TaLTP-l和TaLTP-s), 利用RIL群体将TaLTP-s定位于染色体1A。两种TaLTP的蛋白序列均包含8个半胱氨酸残基骨架, 属于nsLTP-like家族。原生质体的亚细胞定位检测到TaLTP-s在细胞膜和细胞质中均有表达。小麦TaLTP-s基因在开花期的小花中表达量最高, 其中在花药的表达量为同期叶片的735倍。小麦TaLTP-s受ABA、低温、高盐和PEG-6000诱导上调表达。过表达TaLTP-s转基因拟南芥耐盐性显著提高, 因此小麦TaLTP-s是一个与高盐等非生物胁迫耐性相关的基因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] |
