 , 张登峰
, 张登峰 , 李永祥, 石云素, 宋燕春, 王天宇, 黎裕
, 李永祥, 石云素, 宋燕春, 王天宇, 黎裕* 通讯作者(Corresponding author): 张登峰, E-mail: zhangdengfeng@caas.cn, Tel: 010-62131196 第一作者联系方式: E-mail: songzhongjian02@163.com
收稿日期:2015-02-06 基金:
摘要
关键词:玉米; 分子伴侣; ZmBiP2; 拟南芥; 逆境胁迫
Cloning of Maize Molecular Chaperone Gene ZmBiP2 and Its Functional Analysis under Abiotic Stress
SONG Zhong-Jian
 , ZHANG Deng-Feng
, ZHANG Deng-Feng , LI Yong-Xiang, SHI Yun-Su, SONG Yan-Chun, WANG Tian-Yu, LI Yu
, LI Yong-Xiang, SHI Yun-Su, SONG Yan-Chun, WANG Tian-Yu, LI YuAbstract
Keyword:Maize; Molecular chaperone; ZmBiP2; Arabidopsis; Abiotic stress
Show Figures
Show Figures












BiP (binding protein)基因编码一类重要的分子伴侣蛋白, 属于HSP70家族[1]。BiP作为分子伴侣, 同进入内质网的未折叠蛋白的疏水氨基酸结合, 防止多肽链不正确的折叠和聚合; 随后, BiP与ATP结合并通过ATP水解释放出结合的多肽; 释放出的多肽迅速发生折叠, 或者同其他蛋白亚基结合, 组装成具有正常功能的蛋白质。另外, 在蛋白质转运到内质网的过程中, BiP可以防止蛋白质变性或断裂[1]。
BiP基因所编码的蛋白不仅参与种子成熟时贮藏蛋白的积累过程, 与贮藏蛋白和淀粉的含量、籽粒的重量密切相关, 而且在植物响应各种非生物胁迫和生物胁迫过程中具有重要作用[2]。植物在逆境胁迫条件下, 内质网内未折叠蛋白明显增多, 当超出内质网的处理能力时, 就会引起内质网胁迫应答反应[3]。在逆境胁迫导致的内质网胁迫响应过程中, BiP会诱发一系列保护机制, 缓解胁迫引起的体内蛋白合成减少、未折叠蛋白增多等症状[4]。例如, 在干旱、高温等逆境胁迫条件下, 随着植物体内质网中非折叠蛋白积累, BiP也会逐渐增多[5]。在菠菜中, BiP基因受冷胁迫诱导上调表达[6]。在豌豆的各组织中, 叶片BiP的含量最高, BiP基因在蛋白水平上受水分胁迫、真菌侵染、昆虫啃咬等外界胁迫环境上调表达[7, 8]。在水稻中研究发现, BiP3基因所编码的蛋白可以通过调节XA21蛋白的稳定性和加工过程, 调控植株对白叶枯病的抗性[9]。转基因研究发现, BiP基因可以提高转基因植株的抗逆性。过量表达大豆中的sBiPD基因, 可以显著提高烟草、大豆转基因植株的耐旱性[10, 11]。由此可见, BiP基因所编码的蛋白在生长、发育和对逆境胁迫响应过程中都具有非常重要的作用。
在植物中, BiP基因家族是一个小的基因家族, 大豆中有4个BiP基因、拟南芥中有3个BiP基因, 烟草中有2个BiP基因。玉米基因组上只有2个BiP基因, 受AZC和衣霉素在转录水平诱导上调表达。AZC是脯氨酸同系物, 衣霉素和AZC都与内质网蛋白折叠信号通路有关, 因此推测玉米中这2个BiP基因所编码的蛋白也可能参与内质网信号通路[12]。由于BiP基因在玉米抗逆性方面的相关研究报道很少, 本研究从玉米自交系旱21中克隆到ZmBiP2基因, 进行序列和表达分析, 进一步构建过表达载体, 转化拟南芥, 以阐明ZmBiP2基因在抗逆中的功能, 为进一步玉米抗逆性分子育种提供指导。
1 材料与方法1.1 试验材料选用玉米自交系旱21, 该自交系创制于美国玉米杂交种78599, 抗旱性强。
1.2 玉米叶片总RNA提取、ZmBiP2基因的克隆及序列特征分析 取玉米苗期叶片100 mg迅速放入液氮速冻, 采用TRIzol法提取总RNA, 用DNase去除其中的DNA。用2 μ L总RNA为模板, 按Invitrogen公司M-MLV反转录试剂盒合成cDNA。根据GenBank中ZmBiP2基因序列, 设计引物F1: 5′ -GGCGAGG AGGAAGAGGGAGAAG-3′ ; R1: 5′ -CAGCCCGTCT ATTGGCAGAGC-3′ 。以cDNA为模板进行PCR扩增, RT-PCR体系为25 μ L, 含ddH2O (18.25 μ L)、10× PCR buffer (2.5 μ L)、10 mmol L-1 dNTPs混合物(2 μ L)、10 mmol L-1F1 (1 μ L)、10 mmol L-1R1 (1 μ L)、5 U μ L-1Taq DNA聚合酶(0.25 μ L)。反应程序为94℃预变性5 min; 94℃变性40 s, 61℃退火30 s (每个循环降1℃), 72℃延伸2 min, 5个循环; 94℃变性40 s, 55℃退火30 s, 72℃延伸2 min, 28个循环。
运用DNAMAN和MEGA软件进行序列比对、ORF翻译和蛋白质基本性质分析。
1.3 玉米ZmBiP2基因的组织表达特异性及诱导表达特性分析 确保实验用枪头、离心管均无RNA酶, 研钵和研棒也被高温处理去除RNA酶。在研钵中倒入液氮后放入三叶一心期的叶片、根, 吐丝期的子房、花丝、穗位叶、茎(第1节)、雄穗、气生根等样品, 研磨均匀; 在TRIzol中加入样品粉末, 漩涡振荡均匀; 加入等体积的氯仿/异戊醇(24∶ 1)抽提2次; 加入0.7倍体积的异丙醇, 离心沉淀。风干后, 加入20 μ L无RNA酶的ddH2O溶解, 采用DNase I去除其中的DNA。通过紫外分光光度仪检测RNA浓度, 琼脂糖凝胶电泳检测RNA完整性, 要求无痕量DNA。
通过荧光定量PCR技术, 研究ZmBiP2基因在玉米不同组织中表达特性。通过qRT-PCR鉴定ZmBiP2的表达水平。以GAPDH基因作为内参基因。数据通过2-Δ Δ CT统计分析, 代表3个独立的重复的平均值。
挑选饱满的玉米种子, 播到营养钵中(装有蛭石和营养土的比例为2∶ 1), 待其长到三叶一心期, 用水小心洗去根上的土和蛭石, 分别浸入含250 mmol L-1 NaCl溶液和350 mmol L-1甘露醇的溶液中, 在溶液中通入氧气。分别在0 h、0.5 h、1 h、3 h、6 h、12 h和24 h取玉米地上部和根。每个时间点做3次重复, 每次重复取5个植株的样品, 混合磨样, 提取RNA。通过实时荧光定量PCR的方法研究逆境胁迫条件下ZmBiP2诱导表达情况。根据ZmBiP2基因cDNA序列设计基因特异引物进行定量PCR实验, 正向引物为F5: 5′ -CAGAAGGCGAGGAGGAAGA G-3′ ; 反向引物为R5: 5′ -ATACGGTTACCCTGGTCA TTGGCGA-3′ 。内参基因为GAPDH, 正向引物为F3: 5′ -CCCTTCATCACCACGGACTAC-3′ ; 反向引物为R3: 5′ -AACCTTCTTGGCACCACCCT-3′ 。
1.4 玉米ZmBiP2基因过表达载体构建及转化拟南芥 设计带有Bgl II和Pml I酶切位点的引物, 上引物: 5′ -TTTAGATCTCATGGATCGGGTTCGCGGAT- 3′ ; 下引物: 5′ -GGTGCTGCTCGACATCTACCGTGC ACTTT-3′ 。以ZmBiP2-PMD18T载体质粒为模板, 进行PCR扩增, 扩增程序为: 95℃ 5 min; 95℃ 30 s, 58℃ 30 s, 72℃ 1 min 50 s, 扩增32个循环; 72℃ 8 min。将扩增产物回收并连接PMD18-T载体进行测序, 选取测序正确的克隆提取质粒, 用Bgl II和Pml I酶切后, 再通过DNA纯化试剂盒回收, 通过T4 DNA连接酶将回收产物和pCAMBIA3301双酶切片段连接, 得到pCAMBIA3301-ZmBiP2植物重组表达载体。
将构建好的植物表达载体转化农杆菌感受态细胞GV3101, 选取PCR鉴定阳性克隆, 采用蘸花侵染法转化拟南芥(哥伦比亚野生型), 出苗后喷施0.1%的PPT除草剂, 筛选阳性转基因株系, 经PCR鉴定后收获单株, 将T2代转基因种子在含有除草剂的平板上进行3∶ 1分离比鉴定, 得到100%抗除草剂的T3代转基因种子, 作为纯合转基因株系用于进一步的表型鉴定。
1.5 ZmBiP2过表达转基因株系耐盐碱鉴定萌发期耐盐碱处理后, 将灭好菌的转基因及野生型(对照)拟南芥种子经0.5%次氯酸钠和75%乙醇灭菌, 播于含不同浓度甘露醇(0、300、350、400 mmol L-1)和NaCl (0、125、150、175 mmol L-1)的MS固体培养基上, 4℃春化3 d, 移至22℃、长日照条件下萌发, 生长至第3天统计萌发率(以长出主根为准)。统计萌发率时每个处理4次重复, 每个株系每个重复至少点播40粒种子。
苗期耐盐碱处理后, 将转基因及野生型(对照)拟南芥种子经5%次氯酸钠和75%乙醇灭菌, 播到MS固体培养基上, 4℃春化3 d, 移至22℃、长日照条件下生长7 d; 将其幼苗移到含有蛭石∶ 营养土 = 1∶ 1的营养钵中。在正常生长条件下(16 h光照/8 h黑暗, 22℃), 用300 mmol L-1 NaCl灌溉, 生长3周, 确保托盘内浇灌同等浓度的NaCl溶液, 每隔2 d浇灌1次, 1周后观察生长情况。
2 结果与分析2.1 玉米ZmBiP2基因的克隆及序列分析 以抗旱玉米品种旱21的cDNA为模板, 以F1和R1引物扩增得到2 kb左右的片段, ORF长度为1989 bp, 序列与B73参考基因序列一致 (U58209.1)。该基因编码一个663个氨基酸的蛋白, 等电点(pI)为5.16, 分子量为73 098.82。
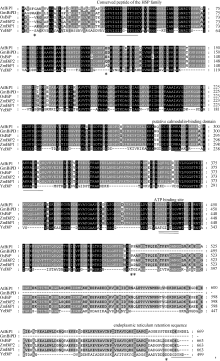
利用ZmBiP2蛋白序列, 应用NCBI中BlastP程序比对GenBank数据库, 从拟南芥、水稻、大豆等植物中查找到多个同源的Bip, 表明Bip普遍存在于高等植物中。将来源于这些物种的Bip进行多序列比对, 结果见图1。ZmBiP2蛋白具有明显的保守结构域。其中第34位到第46位氨基酸之间的蛋白序列为TVIGIDLGTTYSC保守结构域, 这是热激蛋白HSP家族成员共有的保守序列, 与胁迫诱导有关[13, 14, 15]。第430位到第438位之间的氨基酸序列是LGIETVGGV, 是ATP结合位点[16]。虽然这两个保守结构域都是分子伴侣蛋白的特征, 但它们在BiP中行使的功能仍不十分清楚。此外, 第225位到第245位之间的氨基酸序列为NRALGKLRRECERAKRALSSQ, 可能是连接钙调蛋白的结构域[17]。在BiP的C末端以HDEL氨基酸序列结尾, 这段序列是内质网滞留序列[18, 19]。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 ZmBiP2氨基酸序列与其他同源序列的比对结果Fig. 1 Alignment of the amino acid sequences of ZmBiP2 and homologues in other organisms. AtBiP1 (GenBank ID: Q9LKR3), GmBiPD (GenBank ID: Q9ATB8), OsBiP (GenBank ID: O24182), YeBiP (GenBank ID: M31006). |
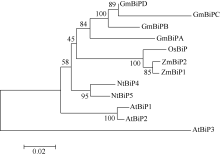
进化树分析显示, ZmBiP1、ZmBiP2序列相似性最高。玉米BiP与水稻BiP的亲缘关系最近, 与拟南芥BiP的亲缘关系最远(图2)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 植物BiP家族蛋白的进化树分析Fig. 2 Phylogenetic analysis based on putative amino acid sequences of plant BiP family protein |
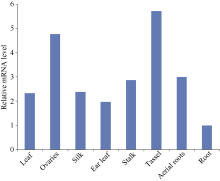
2.2 玉米ZmBiP2基因的表达分析 以荧光定量PCR技术检测ZmBiP2基因在幼叶、幼根, 吐丝期的子房、花丝、穗位叶、茎(第1节)、雄穗、气生根中的表达情况。结果如图3所示, ZmBiP2基因在各个组织中都有表达, 但在三叶一心期的幼根中的表达量最低, 在雄穗、子房中的表达量最高。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 ZmBiP2基因在玉米旱21不同组织中的表达模式. ZmBiP2在根中的表达水平被定为1。Fig. 3 Expression patterns of the ZmBiP2 genes in various tissues of maize Han 21. Expression level of ZmBiP2 in root was set to 1. |
BiP在植物的逆境胁迫过程中具有重要作用, 为进一步研究ZmBiP2基因在逆境胁迫条件下的表达模式, 在玉米旱21植株长到三叶一心期, 进行了盐、甘露醇的胁迫处理, 检测ZmBiP2基因对非生物逆境在转录水平上的响应。结果如图4所示: 在盐处理条件下, ZmBiP2基因在地上部分的表达量逐渐上升, 3 h达到最大值, 为对照(0 h)的6倍左右, 此后, 该基因的表达量逐渐下降, 达到正常水平, 与对照一致; ZmBiP2基因在地下部分的表达量逐渐下降, 在盐处理3 h达到最低值, 随后逐渐上升趋于正常水平, 与对照表达量一致。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 实时荧光定量PCR法分析旱21品种在不同处理条件下ZmBiP2基因的表达情况Fig. 4 qRT-PCR analysis of expression level of ZmBiP2 gene in Han 21 under different treatments |
在甘露醇处理条件下, ZmBiP2基因在地上部分的表达量在处理的0~1 h之间呈上升趋势, 在第1 h达到最大值, 为对照(0 h)的4倍左右, 之后表达量下调, 最后与对照趋于一致; ZmBiP2基因在地下部分的表达量在处理的0~0.5 h之间呈上升趋势, 在第0.5 h达到最大值, 约为对照(0 h)的2倍左右, 之后其表达量逐渐下降。
2.3 ZmBiP2转基因拟南芥抗逆性鉴定为了进一步鉴定ZmBiP2基因的功能, 通过浸花法得到11株转基因拟南芥植株, 选择表型一致的株系进行抗逆性鉴定。
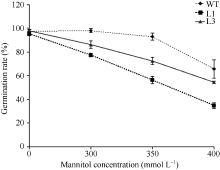
2.3.1 转基因拟南芥萌发期对甘露醇敏感 种子萌发期是鉴定植物对逆境胁迫响应的关键时期。在胁迫处理下, 与正常生长状态相比, 植物一般表现萌发延迟、生长发育迟缓等现象。为了鉴定ZmBiP2基因在植物萌发期的抗逆性, 将转基因拟南芥和野生型拟南芥种子灭菌后, 点播在正常MS培养基、含300、350和400 mmol L-1甘露醇的MS培养基上, 春化3 d后, 放在正常生长条件下萌发。结果如图5和图6所示, 在正常MS培养基条件下, 野生型和转基因株系间萌发率没有明显的差异, 而在3个甘露醇浓度胁迫环境下, L1、L3和L5三个转基因植株均比野生型植株的萌发率低, 表现对甘露醇敏感。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 ZmBiP2过表达转基因植株与野生型拟南芥的萌发率比较. 处理第8天的转基因植株与野生型植株在含有0、300、350和400 mmol L-1甘露醇的MS平板下的表型。L1、L3和L5代表不同的转基因株系。Fig. 5 Comparison of germination rates between ZmBiP2 transgenic plants and WT. Comparison of germination rates between ZmBiP2 transgenic plants and WT on various MS plates containing of treatment 300, 350, and 400 mmol L-1 mannitol in 8 days. L1, L3, and L5 represent different transgenic lines. |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 L1、L3转基因株系和野生型植株在不同浓度甘露醇胁迫处理5 d的萌发率比较Fig. 6 Comparison of the germination rates between transgenic lines (L1 and L3) and WT with various concentrations of mannitol. The germination rates were calculated in five days of treatment. |
统计分析结果显示在3个浓度的甘露醇胁迫下, 转基因株系和野生型植株的萌发率随着甘露醇浓度的上升而下降; 并且L1、L3转基因株系的萌发率都比野生型株系低(图6)。
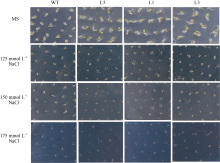
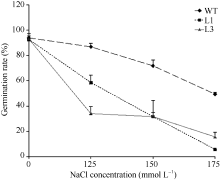
2.3.2 转基因拟南芥萌发期对盐敏感 将野生型和转基因株系点播在含不同浓度NaCl的MS培养基上, 鉴定转基因株系的耐盐碱能力。结果同图7和图8所示, 转基因植株与野生型植株在MS培养基上萌发、生长和发育基本一致。而在125、150和175 mmol L-1 NaCl的MS平板上处理第4天后, 转基因植株均比野生型植株的萌发率低, 表现对盐敏感。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 ZmBiP2过表达转基因植株与野生型拟南芥在盐胁迫处理下的萌发率比较. 比较转基因植株与野生型植株在含有0、125、150和175 mmol L-1 NaCl的MS平板上处理第4天的萌发率。L1、L3和L5代表不同的转基因株系。Fig. 7 Comparison of germination rates between ZmBiP2 transgenic plants and WT under NaCl treatment. Comparison of germination rates between ZmBiP2 transgenic plants and WT on various MS plates containing 0, 125, 150, 175 mmol L-1 NaCl in four days of treatment. L1, L3, and L5 represent different transgenic lines. |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 L1、L3转基因株系和野生型植株在不同浓度盐胁迫处理4 d的萌发率比较Fig. 8 Comparison of the germination rates between transgenic lines (L1 and L3) and WT with various concentrations of NaCl. The germination rates were calculated in 4 days of treatment |
2.3.3 转基因拟南芥在苗期对盐敏感 在拟南芥生长至25 d时, 用300 mmol L-1NaCl进行处理, 2周后观察转基因株系和野生型株系的生长情况。结果同图9所示, 正常浇水环境下转基因植株和野生型拟南芥生长情况一致; 而在盐处理条件下, 野生型植株叶片萎缩, 但大部分植株仍保持绿色, L1、L3转基因株系叶片褪绿变白, 与野生型植株相比对盐胁迫更加敏感, 表明过表达ZmBiP2基因降低了转基因拟南芥的耐盐性。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 苗期阶段转基因和野生型拟南芥的表型. (A) 正常条件下转基因和野生型拟南芥的表型; (B) 300 mmol L-1NaCl处理1周后转基因植株和野生型拟南芥表型Fig. 9 Performance of transgenic and WT Arabidopsis plants at seedling stage. (A) Phenotype of transgenic and wild-type Arabidopsis under normal conditions; (B) Phenotype of transgenic plants and wild-type Arabidopsis after one week of 300 mmol L-1 NaCl treatment |
3 讨论BiP广泛存在于动植物的内质网中, 是一个典型的分子伴侣, 辅助蛋白折叠或将不正确折叠蛋白运输到细胞外降解。在动植物的逆境胁迫响应过程中具有重要作用。研究结果表明, ZmBiP2基因在玉米的子房和雄穗中表达量最高, 因此ZmBiP2蛋白很可能在玉米种子成熟时贮藏蛋白的积累过程中具有重要作用。在盐胁迫和甘露醇等逆境胁迫过程中ZmBiP2基因在地上部分组织中上调表达。这与大豆中的BiP基因受水分胁迫诱导在蛋白水平上调表达相一致[8]。因此BiP基因在植物的逆境胁迫响应过程中可能具有重要作用。
本研究还发现ZmBiP2基因在拟南芥中过量表达, 转基因植株对甘露醇、盐等逆境胁迫相对野生型更加敏感。而前人研究结果显示大豆sBiPD基因在烟草植株中过表达能提高其耐旱性[10]。大豆sBiPD基因在大豆和烟草中过量表达, 可以降低干旱条件下叶片的失水速率, 减轻干旱对叶片的损伤, 延迟叶片的衰老, 从而提高转基因植株的耐旱性[20]。
对ZmBiP2基因与sBiPD基因的研究结果完全不同, 这很可能与BiP本身的特性相关。比如OsBiP1基因在水稻中的过量表达相对于野生型在籽粒重量、淀粉含量上分别下降了约60%和78%。OsBiP1基因在水稻中的抑制表达株系相对于野生型在籽粒重量、淀粉含量上也分别下降了约60%和78%。当OsBiP1基因转基因株系中的OsBiP1蛋白含量较野生型植株适量增加时, 可以显著提高转基因株系籽粒的贮藏蛋白含量[21]。因此, ZmBiP2基因过量表达导致拟南芥植株对逆境胁迫比较敏感。BiP不仅是单一的分子伴侣, 还是内质网质量控制过程中的重要逆境感应蛋白。当Bip含量过低时, 一些未折叠或错误折叠的蛋白不能被及时修复, 引起内质网胁迫, 导致植物体受到伤害。另外, Bip含量过高可能导致其形成自聚集的蛋白体而失去正常的功能从而引起内质网胁迫。如Wakasa等[21]研究结果显示, 在发育的胚乳中过高或过低的OsBip1蛋白都可以诱导与内质网胁迫响应相关的基因表达, 同时也可以诱导与细胞程式化死亡相关基因的表达。因此转基因株系内质网上BiP含量过高、过低可能都不利于植物抗逆性的提高。而保持一定的含量可能有利于生物体对逆境胁迫的响应, 提高生物的抗逆性。这仍然需要进一步的实验验证。
4 结论从玉米抗旱自交系旱21中克隆得到了分子伴侣ZmBiP2基因。ZmBiP2基因在玉米的叶、子房、花丝、穗位叶、茎、穗、气生根和根中均有表达, 其中在雄穗和子房中表达量最高; 在玉米三叶一心期的地上部分, ZmBiP2基因受甘露醇、NaCl胁迫处理时表现上调表达; 在拟南芥中过表达ZmBiP2基因, 转基因株系表现对甘露醇、盐胁迫敏感。推测在植物响应非生物胁迫的过程中, 过量表达的ZmBiP2蛋白可能发挥负调节蛋白的功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] |
