
* 通讯作者(Corresponding author): 郭旺珍, E-mail:moelab@njau.edu.cn 收稿日期:2013-09-24 基金:本研究由国家自然科学基金项目(31171590)资助。
摘要以棉花幼嫩子叶为材料, 分析影响棉花叶肉原生质体分离及目标基因转化的主要因素, 以棉花叶肉原生质体为受体, 建立了稳定、高效的目标基因瞬时表达与鉴定体系。技术体系包括, 选择自然生长12 d的棉花幼嫩子叶为材料, 混合1.5%纤维素酶、0.4%离析酶、0.5 mol L-1甘露醇、20 mmol L-1KCl、20 mmol L-1MES、0.1 mol L-1CaCl2和1.0 g L-1BSA, 在28℃黑暗条件下振荡酶解8 h, 可游离出浓度达1.0×106 mL-1以上的纯净棉花叶肉原生质体。利用该方法将棉花锌指蛋白基因
关键词:棉花; 原生质体; PEG介导; 转化; 目标基因; 瞬时表达
Isolation of Mesophyll Protoplast and Establishment of Gene Transient Expression System in Cotton
LI Ni-Na, DING Lin-Yun, ZHANG Zhi-Yuan, GUO Wang-Zhen

AbstractThis paper aimed to set up a stable and efficient transient expression system based on cotton mesophyll protoplasts produced from cotyledon. We analyzed the key factors related to isolating effectively cotton mesophyll protoplasts and used it as a vehicle to express transfected genes for functional studies. The optimized techniques are as follows: (1) the healthy 12-day-old cotyledon grown naturally was selected to isolate cotton protoplasts; (2) the digestion system contained 1.5% cellulose, 0.4% macerozyme, 0.5 mol L-1 mannitol, 20 mmol L-1 KCl, 20 mmol L-1 MES, 0.1 mol L-1 CaCl2, and 1.0 g L-1 BSA; and (3) the digestion was conducted in the dark under 28℃ for 8 h with gentle shaking. The protoplast yield was higher than 1.0 × 106 mL-1. Using this system, we integrated a cotton zinc finger protein gene (
Keyword:Cotton; Protoplast; PEG-mediated; Transformation; Target genes; Transient expression
Show Figures
Show Figures















基因瞬时表达系统具有检测快速、通量高等特点, 结合报告基因的使用, 该技术已被广泛用于目标基因表达、蛋白亚细胞定位、启动子及蛋白活性检测、蛋白与蛋白互作等基因功能分析研究[ 1, 2]。为了使基因的表达产物正确折叠、修饰并精确定位在相应的亚细胞结构上, 受体细胞的选择非常关键[ 3]。烟草BY-2 (Bright Yellow-2)细胞, 洋葱表皮细胞均被作为受体材料, 成功用于功能基因的瞬时表达分析[ 4, 5]。特别是洋葱表皮细胞, 由于其细胞大、无色素, 容易观察与转化, 通过农杆菌介导法转化该类细胞, 已明确多个目标基因的亚细胞定位信息[ 6]。然而, 由于洋葱表皮细胞没有叶绿体, 会使在叶绿体中表达的基因错误表达在细胞的其他位置, 造成研究结果的假阳性。相比于上述受体细胞, 利用原生质体进行瞬时表达分析可大大增加研究的准确性。目前, 已在拟南芥[ 7]、烟草[ 8]、小麦[ 9]、水稻[ 10, 11]等作物中建立基于原生质体瞬时表达遗传转化体系, 并广泛用于目标基因表达分析。
棉花是世界性重要的经济作物。随着棉花基因组序列信息释放, 大量棉花重要基因的功能特征需进一步鉴定。最近, 二倍体雷蒙德氏棉种基因组序列已分布[ 12, 13], 利用这些序列信息, 建立基于棉花原生质体的基因瞬时表达体系, 将加速棉花功能基因组学研究进程, 快速获得目标性状的候选功能基因。然而, 到目前为止, 关于利用棉花原生质体遗传转化开展目的基因功能验证的报道还较少。本文运用酶解法游离与纯化棉花叶肉原生质体, 系统分析影响分离与目标基因转化的因素, 建立了以棉花原生质体为受体, PEG介导的遗传转化体系和目标基因瞬时表达检测技术, 为高通量开展棉花候选基因的功能分析奠定基础。
1 材料与方法1.1 试验材料1.1.1 植物材料 选取陆地棉遗传标准系( Gossypium hirsutum L. acc. TM-1)饱满的种子播种于蛭石与营养土质量比为2∶1的土壤中, 置光照培养箱自然生长(28℃, 12 h光培养/12 h暗培养) 2周左右, 选取完全伸展子叶作为提取棉花原生质体的外植体材料。
1.1.2 质粒载体 含有绿色荧光蛋白基因的植物表达载体pJIT166-GFP (4700 bp), 表达框由花椰菜花叶病毒(CaMV) 35S启动子、绿色荧光蛋白(GFP)基因、胭脂碱合成酶终止子(NOS)构成, 由南京农业大学生命科学学院王心宇博士构建并惠赠, 本实验室繁殖保存。在大肠杆菌DH5α菌株中扩增质粒, 大量提取纯化制备质粒DNA, 以电泳鉴定。利用One Drop OD-1000+(NanoDrop Thermo, USA)测定质粒DNA的纯度和浓度, OD260/OD280=1.6~1.8, DNA浓度为1 µg µL-1, -20℃保存备用。
1.1.3 试验试剂 纤维素酶Cellulase Onzuka R10 (Yakult, Japan)、离析酶Mecerozyme Onozuka R10 (Yakult, Japan)、甘露醇(Sigma)、MES (Sigma); PEG-4000等主要国产生化试剂均购于南京奥斌生物科技有限公司。
1.2 外植体的制备分别选取自然生长8、10、12和14 d的棉花幼苗子叶, 进行高质量原生质体最佳外植体生长周期筛选。每个试验设置3个重复, 分别统计原生质体的数量与活性。
1.3 棉花原生质体游离与纯化配制含有1.5%纤维素酶、0.4%离析酶、0.5 mol L-1甘露醇、20 mmol L-1KCl、20 mmol L-1MES、 0.1 mol L-1CaCl2、1.0 g L-1BSA的混合酶液10 mL, 经0.45 μm纤维素微孔滤膜过滤待用。选取生长健壮的棉花子叶, 平展于培养皿中, 用单面保险刀切割叶片, 令其宽度为0.5~1.0 mm左右。将约1.0 g叶片细丝与酶液充分混合, 28℃避光, 20转min-1轻摇5~10 h。使叶肉完全酶解, 叶片只剩表皮, 至酶解混合液呈现绿色为止。
酶解终止后, 加入等体积的W5溶液(4 mmol L-1 MES、154 mmol L-1 NaCl、125 mmol L-1CaCl2、5 mmol L-1KCl, pH 5.7)轻柔冲洗酶解混合液, 用枪头吸取混合液至孔径为30 μm的尼龙网过滤至 50 mL离心管中, 100× g离心2 min。弃上清液, 加入W5溶液2 mL轻轻悬浮, 冰上放置30 min沉淀原生质体。
1.4 棉花叶肉原生质体的产量与活性检测用0.1 mm血球记数板统计棉花原生质体数, 用0.02%荧光素双醋酸(FAD)测定原生质体活力。收集2 mL分离纯化后的原生质体悬浮液, 取10 μL, 滴在载玻片上, 加盖18 mm × 18 mm的盖玻片, 在10倍物镜下镜检。原生质体数(mL-1) = 80小格内细胞个数/(80×400×104×稀释倍数)。取浓度0.02% FDA溶液(FDA母液: 5 mg L-1FDA丙酮) 1滴, 加1滴原生质体悬浮液慢慢混合均匀, 室温静止5~10 min。取混合液滴于载玻片上, 在荧光显微镜(Leica, DM IRB, Germany)下检查, 荧光激发光波长为450~ 490 nm, 发射波长250 nm。此时, 活力高的原生质体具有黄绿色荧光。用Leica DFE300FX采集图片, 统计每一视野中具有活性的原生质体数及总原生质体数。共取2~3滴, 观察视野10~20个, 计算原生质体存活率(%)。原生质体活力=发黄绿色荧光的原生质体数/观察的原生质体总数×100%。
1.5 目标基因瞬时表达载体构建pJIT166-GFP质粒载体中含有绿色荧光蛋白, 在真核细胞中高水平表达。将本实验室克隆的1个ORF全长为1005 bp的棉花锌指蛋白基因 GhZFP2[ 14], 采用Primer Premier 5.0软件(Premier, Canada)设计两端带有 XbaI和 BamH I酶切接头的引物(F: 5°-GCTCTAGAATGGCTTTAGAAGCTCTCAA-3°; R: 5°-GCGGGATCCATTTGTTTCGTTGACTTG-3°), 将目的基因片段转入pJIT166-GFP中, 插入位置在35S-P (启动子)与Nos-T (终止子)之间, 构建融合蛋白表达载体pJIT166-GhZFP2-GFP。
1.6 遗传转化将沉淀后原生质体重悬浮于MMG (0.4 mol L-1甘露醇、15 mmol L-1 MgCl2、4 mmol L-1 MES, pH 5.7), 浓度稀释至2.0×105 mL-1。将浓度为1 μg μL-1质粒DNA 15 μL加入2 mL离心管, 与200 μL原生质体-MMG悬混液混合, 轻弹管底混匀, 室温放置5~10 min。加入40% PEG-4000 (0.2 mol L-1甘露醇、100 mmol L-1 CaCl2, pH 8.0) 220 μL, 轻弹管底混匀, 室温放置15 min。用W5溶液880 μL重新悬浮, 轻弹管底混匀, 转化终止。100× g离心2 min, 弃上清液。加入WI (0.5 mol L-1甘露醇、4 mmol L-1 MES、20 mmol L-1 KCl) 1 mL重悬浮, 并转移至经BSA预冲洗过的培养皿中, 24℃过夜培养。共转化原生质体, 以激光共聚焦显微镜(Leica, TCS SP2, Germany)观察鉴定。
2 结果与分析2.1 制备棉花叶肉原生质体体系的优化借鉴拟南芥已建立的叶片原生质体分离及遗传转化标准方法[ 15], 制备棉花叶肉原生质体, 获得活力达75%左右的原生质体。为了进一步提高棉花原生质体的产量和质量, 针对棉花叶片特点, 对外植体培养时间、渗透压大小、酶解时间等不同处理进行优化, 使原生质体数量达到1.0×106个mL-1以上, 活力由75%提高到90%以上, 而且大小一致, 状态良好。
2.1.1 叶龄对棉花原生质体分离的影响 在保持渗透压和酶解时间一定的前提下, 选用不同叶龄的棉花幼苗获得的原生质体得率存在显著差异。培养8 d的棉花子叶, 产生极少量的原生质体, 且细胞比较小; 当幼苗培养时间达到10 d时, 获得的原生质体大小合适, 且产量显著增加。同时在合适的渗透压下, 细胞碎片少, 获得有活性的细胞数逐步上升; 培养12 d获得原生质体的数量和活性达到最高。随着培养时间延长, 原生质体存活率开始下降(图1)。综合上述分析, 棉花自然培养12 d的幼嫩子叶为最佳外植体材料, 能获得纯净、有活性原生质体量1.0×106 mL-1以上。
2.1.2 渗透压对棉花原生质体分离的影响 渗透压过高会造成原生质体胀裂, 降低产量。选取生长状态相近, 培养12 d的棉花子叶, 酶解8 h, 调节不同甘露醇浓度梯度, 筛选制备原生质体的最佳渗透压。结果表明, 随着甘露醇浓度增大到0.4 mol L-1, 棉花原生质体的得率逐步增加(图2-a); 甘露醇浓度为0.5 mol L-1时, 获得原生质体的数量较多, 且大小基本一致(图2-b); 当甘露醇浓度达到0.6 mol L-1, 原生质体的活性开始下降, 原生质体量也逐渐减少(图2-c); 当甘露醇浓度达到0.8 mol L-1, 仅获得极少量棉花叶肉原生质体(图2-d)。因此, 不同渗透压处理下原生质体得率存在差异, 0.5 mol L-1甘露醇浓度下获得的原生质体数量和活力均显著高于其在0.4、0.6 mol L-1渗透压下的得率(图3)。综上所述, 酶解液中最适的甘露醇浓度为0.5 mol L-1。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 不同叶龄下原生质体细胞的产量不同的大写字母表示样本之间存在极显著差异。Fig. 1 Protoplast yield when sampling cotyledon leaves in different developmental stagesDifferent capital letters mean the significant difference at the 0.01 probability level among samples. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 不同渗透压下对原生质体细胞的活性影响Fig. 2 Protoplast activity under different mannitol concentrationa: 0.4 mol L-1; b: 0.5 mol L-1; c: 0.6 mol L-1; d: 0.8 mol L-1. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 不同渗透压下对原生质体细胞的产量影响不同的大写字母表示样本之间存在极显著差异。Fig. 3 Protoplast yield under different mannitol concentrationDifferent capital letters mean the significant difference at the 0.01 probability level among samples. |
2.1.3 不同酶解时间对棉花原生质体分离的影响
叶龄一致的外植体, 在一定渗透压下, 不同的酶解时间对原生质体的产量有明显影响。随着酶解时间延长, 棉花叶片细丝切口处会分离出原生质体(图4-a), 酶解5 h后游离出原生质体数量已逐渐增多(图4-b)。酶解8~9 h时, 酶液的酶解效率达到最高, 原生质体的数量达到1.0×106 mL-1以上, 产量显著高于酶解5~6 h的结果(图4-c)。酶解时间超过9 h后, 因最初游离出的原生质体会随着时间延长而破裂, 细胞碎片增多, 原生质体的得率开始下降(图4-d)。随着酶解时间增加, 棉花叶片原生质体的活性变化也呈现抛物线趋势。酶解初期受影响不大, 酶解时间延长至8 h达到活力最高峰, 随后开始下降至50%以下(图5)。综上所述, 棉花叶片最适酶解条件为黑暗轻柔振荡培养8 h。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 不同酶解时间对原生质体细胞的产量影响Fig. 4 Protoplast yield with different enzymolysis timea: 5 h; b: 6 h; c: 8 h; d: 9 h. |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 不同酶解时间对原生质体细胞的活性影响不同的大写字母表示样本之间存在极显著差异。Fig. 5 Protoplast activity at different enzymolysis timeDifferent capital letters mean the significant difference at the 0.01 probability level among samples. |
2.2 分离高质量棉花叶肉原生质体细胞体系的建立综合分析影响棉花叶肉原生质体制备的主要因素, 建立了分离棉花叶肉原生质体的优化体系。酶液组合为1.5%纤维素酶、0.4%离析酶、0.5 mol L-1甘露醇、20 mmol L-1 KCl、20 mmol L-1 MES、0.1 mol L-1CaCl2和1.0 g L-1BSA, 酶解8 h。实验流程为: 自然生长12 d的棉花健壮植株为一叶一心期(图6-a),取其幼嫩子叶作为外植体(图6-b), 切割叶片到足够纤细且均匀, 酶解约1.0 g叶片量, 使棉花叶片细丝充分接触酶解混合液(图6-c)。酶液进入受体组织后破碎细胞, 充分消化叶肉组织释放原生质体(图6-d)。对棉花叶片原生质体进行沉淀和纯化, 消除分离过程中产生的破裂细胞和未酶解碎片(图6-e), 获得明显的原生质体分层带(图6-f)。基于上述流程, 获得的棉花叶片原生质体大, 碎片少, 量多, 活性强(图6-g)。原生质体达1.0×106 mL-1以上, 其数量和活性完全满足进一步遗传转化研究。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 棉花叶片原生质体的分离与纯化a: 自然生长12 d的棉花植株; b: 棉花子叶; c: 酶解前物理处理后的棉花叶片; d: 酶解结束后酶解混合液; e: 重悬浮原生质体; f: 沉淀后原生质体(箭头所示); g: 物镜下的镜检原生质体(×10)。Fig. 6 Isolation and purification of cotton mesophyll protoplasta: Healthy 12-day-old cotton plant; b: Cotton cotyledon for protoplast isolation; c. Cotton leaves after physical cutting; d. Mixed solution after enzymatic digestion; e: Resuspension of cotton protoplast; f: Precipitation of cotton protoplast (marked with arrow); g: The purified mesophyll protoplast (×10). |
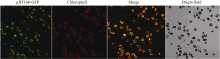
2.3 棉花原生质体的遗传转化将制备好的棉花叶肉原生质体与pJIT166-GFP载体质粒DNA, 在24℃条件下共培养12~16 h, 检测棉花原生质体中绿色荧光蛋白的表达丰度。经激光共聚焦显微镜扫描检测, 视野中遍布含绿色荧光信号的原生质体细胞(图7)。进一步与红色自发荧光的叶绿体信号叠加, 原生质体显示叠加部分的黄色荧光和未叠加部分的绿色荧光。说明带有GFP荧光蛋白的质粒DNA可高通量转入棉花原生质体, 并使GFP荧光蛋白稳定表达。
进一步利用构建的转录因子 GhZFP2:GFP融合载体, 进行目标基因的原生质体表达研究。以pJIT166-GFP质粒载体为对照, 将含有目标基因和报告基因的融合表达载体与空载体的质粒DNA分别转入棉花原生质体细胞, 通过荧光检测观察到空载体质粒DNA转化棉花原生质体后, 其细胞核、细胞质和细胞膜等部位均有明显荧光信号, 而转化 GhZFP2:GFP融合载体质粒DNA仅在原生质体细胞核上具有明显的绿色荧光信号。利用棉花叶肉原生质体进行目标基因亚细胞定位, 结果显示, 与空载体对照相比, 转录因子 GhZFP2编码产物被定位于植物细胞的细胞核上行使功能(图8)。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 pJIT166-GFP载体转化棉花原生质pJIT166-GFP: GFP荧光; Chlorophyll: 叶绿体自发荧光; Merge: 自发荧光与GFP荧光叠加; Bright field: 明场下细胞状态。Fig. 7 Cotton protoplast transformed by using pJIT166-GFP vectorpJIT166-GFP: transformed cells with GFP fluorescence; Chlorophyll: autofluorescence of chloroplast; Merge: overlapping between autofluorescence and GFP fluorescence; Bright field: cotton protoplast cells in bright field. |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 35S:GFP与35S:ZFP2:GFP质粒DNA在棉花原生质体细胞瞬时表达GFP: GFP荧光; Chlorophyll: 叶绿体自发荧光; Merge: 自发荧光与GFP荧光叠加; Bright field: 明场下细胞状态; 35S:GFP:GFP空载体; 35S:ZFP2: GFP: 带有ZFP2目的基因的质粒。Fig. 8 Transient expression of plasmid DNAs of 35S:GFP and 35S:ZFP2:GFP in cotton protoplastGFP: transformed cells with GFP fluorescence; Chlorophyll: autofluorescence of chloroplast; Merge: overlapping between autofluorescence and GFP fluorescence; Bright field: cotton protoplast cells in bright field; 35S:GFP: GFP empty vector; 35S:ZFP2: GFP: plasmid with ZFP2 target gene. |
3 讨论3.1 高质量作物原生质体获得与应用在植物细胞内瞬时表达目标基因可快速、高效
地分析其可能功能。它与基因重排、病毒诱导基因沉默和RNA干扰等新兴技术一起, 在植物功能基因组研究中扮演非常重要的角色[ 3]。原生质体是植物细胞脱去细胞壁的裸露细胞, 以原生质体为受体转化目标基因并使之表达, 在阐明功能基因在细胞内的定位和生物学机制等研究中发挥重要作用[ 16]。
原生质体的分离研究始于20世纪60至70年代。Cocking[ 17]以及Nagata和Takebe[ 18]分别报道用酶解法从番茄根尖与烟草叶片中分离得到大量有活性、稳定的原生质体。以拟南芥为代表的大多数植物都建立了有效的原生质体瞬时表达体系, 可以多角度分析细胞内外源基因的表达特征及可能行使的功能[ 19]。通过与根癌农杆菌共培养, 周颖等[ 20]将 z108基因整合到烟草原生质体的核基因组中, 建立了普通烟草的瞬间表达转化体系。Yang等[ 21]建立了简单、高效的水稻绿色组织原生质体瞬时表达体系, 并用于蛋白免疫及蛋白互作研究。
棉花是重要的经济作物, 开展原生质体的分离与应用研究较早。在原生质体培养、体细胞融合以及植株再生等方面已取得较好研究进展[ 22, 23, 24]。前人已将棉花原生质体从愈伤组织[ 25]、子叶[ 26]、悬浮细胞[ 27]等组织中成功分离, 但分离棉花原生质体存在植板率低、不同基因型对棉花原生质体的得率和活性影响差异较大等问题[ 28]。利用棉花原生质体进行目标基因瞬时表达, 开展功能研究的报道也较少。基于烟草、拟南芥等原生质体瞬时表达系统进行棉花基因功能研究, 存在异源系统中蛋白表达异常, 假阳性定位等弊端。因此, 建立棉花原生质体培养技术, 利用棉花原生质体研究其目标基因可能行使功能, 将更科学和准确。在本研究中, 我们建立的棉花高效原生质体分离与纯化技术体系, 既可用于棉花功能基因的表达与亚细胞定位研究, 又能直观分析目标启动子的活性, 蛋白与蛋白间的互作等。结合RNA干扰等技术, 将为棉花功能基因组学研究提供更为广阔的前景。
3.2 高质量棉花原生质体的制备获得植物高质量原生质体, 需要优化酶液组合与酶解浓度、酶解时间和酶解渗透压等几个关键因素[ 29]。本文采用酶解法制备棉花叶肉的原生质体, 对上述因素进行优化分析, 获得了高质量棉花原生质体。
自然生长的幼嫩外植体是游离原生质体的最佳选择。植物叶片生理状态和生长周期对原生质体的产量有一定影响。利用生长3~4周的拟南芥幼苗第5~7片真叶提取原生质体, 其产量和活性达到最佳水平[ 15]。本试验利用棉花叶片作为外植体分离原生质体, 选用生长12 d左右, 生长状态良好的棉花子叶提取原生质体, 获得了1.0×106 mL-1以上的原生质体数量, 能满足多次转化后续实验。
酶的种类和浓度的选择应根据植物材料来源和生理状态而定, 应针对不同的外植体材料选择合适酶液组合[ 30]。目前, 分离植物叶片原生质体, 最快、效果最佳的是酶解法, 多采用纤维素酶和离析酶组合。叶肉原生质体分离的最佳酶液组合对于水稻为纤维素酶2.0%和离析酶0.7%; 对于玉米、小麦叶均为纤维素酶1.5%和离析酶0.5%[ 9]; 对于烟草为1.0%纤维素酶和0.5%离析酶, 配合0.5 mol L-1甘露醇渗透压更可获得理想纯净的原生质体[ 31]。以拟南芥子叶为外植体分离原生质体, 其酶液组合为1.5%纤维素酶和0.4%离析酶[ 32]。棉花原生质体细胞分离已有较多研究。李仁敬等[ 26]利用4.0%纤维素酶, 0.4%果胶酶, 酶解6 h分离出棉花子叶叶肉原生质体。Sun等[ 33]利用3.0%纤维素酶, 0.5%半纤维素酶, 1.5%果胶酶, 酶解20 h, 获得棉花高质量的原生质体, 其活力达到90%。近年来, 棉花原生质体提取的方法进一步得到改良。汪静儿等[ 28]运用纤维素酶3.0%、离析酶1.0%, 酶解20~24 h获得棉花悬浮细胞高质量原生质体。付莉莉等[ 24]采用1.5%纤维素酶, 1.0%离析酶和2.0%半纤维素酶组合, 酶解12~14 h, 成功分离棉花悬浮细胞系原生质体, 并实现体细胞融合培养。最近, Gao等[ 34]利用棉花子叶作外植体, 使用1.5%纤维素酶和0.4%离析酶组合, 酶解3~12 h, 成功分离棉花原生质体并进行了基因瞬时表达分析。本研究采用1.5%纤维素酶和0.4%离析酶组合, 酶解6~8 h, 进行棉花叶肉原生质体分离, 缩短了棉花叶片的酶解时间, 获得高质量的棉花叶肉原生质体。该流程可彻底去除细胞壁纤维素残留物, 降低酶液产生的毒害作用对叶肉细胞原生质体的损伤, 加快了实验进程。
在适当的渗透压下, 植物原生质体可保持完整的形态。在建立模式作物拟南芥叶肉原生质体分离体系时, 选择0.4 mol L-1甘露醇为最适渗透压环境, 获得了高效的拟南芥原生质体, 并成功进行基因瞬时表达研究[ 35]。拟南芥与棉花叶片相比较厚实, 叶脉组织较多, 需要更高的渗透压维持细胞稳定性。前人在对不同来源的棉花叶片进行原生质体分离时, 选用0.6 mol L-1甘露醇, 获得的绝大部分原生质体呈现饱满的鲜绿色[ 26]。我们的研究发现, 当甘露醇浓度在0.5 mol L-1时, 棉花原生质体不会吸水膨胀, 细胞碎片少。如果低于0.5 mol L-1, 棉花原生质体会因部分失水变瘪。而过高的渗透压则导致细胞过分吸水膨胀而破裂, 细胞碎片和亚原生质体增多, 直接影响有效原生质体细胞的产量。
针对棉花叶片的生理特性, 调整其他可控因素进一步获得棉花原生质体分离的优化体系。为了充分酶解棉花叶肉细胞, 对酶解液进行45℃水浴预处理10 min, 增加酶液活性, 充分破碎植物细胞壁且缩短酶解时间, 减少细胞碎片的产生, 从而提高原生质体的产量。棉花子叶的宽度和均一性亦是影响酶解时间和效率的重要因素之一, 相比于模式植物拟南芥, 棉花叶片叶肉组织较多, 叶片较厚, 切取子叶宽度足够纤细, 会缩短酶解时间, 减少细胞毒害造成的细胞破碎和亚细胞数量, 有利于获得高产量和大小均匀的原生质体。解离后的棉花原生质体极易受渗透压变化的影响而导致质膜破裂, 影响转化效率, 因此在原生质体的制备过程中, 添加 125 mol L-1 CaCl2酶解液, 可起到较好的稳定质膜、减少破损的作用, 有利于原生质体的转化。
3.3 利用棉花原生质体高效表达目标基因在目标基因瞬时表达研究中, 借助细胞融合剂诱导原生质体摄取外源DNA, 无种属特异性, 可诱导不同来源原生质体的融合与转化。以PEG介导的原生质体转化法是一种成熟的植物细胞瞬间表达技术, 已广泛应用[ 36, 37]。Kirschner等[ 38]利用PEG介导的烟草叶肉细胞原生质体瞬间表达系统, 结合瞬间表达产物的免疫印迹、免疫荧光技术和电镜技术, 研究了热胁迫诱导条件下两种类型的异源热激蛋白多聚化、凝集形成热胁迫颗粒过程中相互作用及诱导前后产物亚细胞定位的变化。黄瑾等[ 39]利用PEG介导外源基因转化甘蓝型油菜叶肉原生质体, 建立了稳定高效的油菜瞬时表达系统。
在原生质体转化过程中, PEG浓度、质粒DNA浓度、原生质体数量是影响转化效率的关键因素。在PEG处理过程中, 由于细胞质浓度不均匀或细胞体积过小, 特别是新生细胞胞质脆弱, 容易使原生质体破碎。因此在原生质体细胞PEG转化过程中, 受体原生质体的质量和活性, 以及细胞渗透压环境的稳定性是转化成功的决定性因素。随着PEG浓度升高, 转化效率逐渐增加, 转化的细胞数增多。但是, 过高的PEG浓度会影响细胞稳定性, 对细胞产生一定的毒害作用, 导致细胞碎片增多, 破碎的细胞量增加。利用PEG法转化原生质体时, PEG分子量与来源非常重要[ 35], 不同作物原生质体转化所要求的PEG浓度亦不同。研究表明, 拟南芥叶肉细胞PEG- 4000介导的最适浓度为20%[ 35]; 转化水稻栽培品种的愈伤组织原生质体, 其最适浓度为40% PEG- 6000[ 40]; 转化烟草叶片原生质为40% PEG-4000[ 8]。本研究中, 我们获得转化棉花叶肉原生质体PEG- 4000介导的最适浓度为40%。为了确保目的基因成功转化原生质体, 质粒DNA浓度过高或过低都不能有效瞬时表达目的蛋白。梁大伟等[ 35]建立拟南芥瞬时表达体系, 将20 μg质粒DNA转化2.0×104个拟南芥原生质体, 获得最佳的转化效率。在本研究中, 将质粒DNA浓度稀释至15 µg, 棉花原生质体浓度为2.0×105 mL-1, 获得高转化率的原生质体, 成功转化目的基因。
为了更好利用原生质体研究基因的相关功能特征, 其他与原生质体转化效率有关的实验条件也需综合考虑。当酶解植物细胞壁后, 随着培养时间的增加, 原生质体RNase酶活性异常升高, 加入抗氧化剂BSA可降低RNase酶活, 保持原生质体活力。为了提高质粒DNA转化效率, 加入MES维持转化体系的pH值; 加入CaCl2以稳定质膜、减少破损; 将转化后的棉花原生质体转移至经BSA冲洗过的培养皿中, 24℃过夜培养, 均对提高转化率起到促进作用。
4 结论建立了棉花叶肉原生质体的分离与目标基因瞬时表达鉴定体系。选择自然生长12 d的棉花幼嫩子叶为外植体, 在1.5%纤维素酶和0.4%离析酶液组合, 0.5 mol L-1渗透压下, 28℃黑暗振荡消化8 h, 获得大小均匀、产量达1.0×106 mL-1、活力达90%以上的棉花原生质体。通过40% PEG-4000介导15 µg目的质粒DNA转化2.0×105mL-1棉花原生质体, 24℃过夜培养, 获得高转化率的原生质体, 并将转录因子GhZFP2蛋白清晰定位在细胞核上。利用该体系, 可大规模开展棉花关键基因功能验证分析, 提高棉花目标性状关键基因发掘效率并有效用于育种研究。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| 1 | |
| 2 | |
| 3 | |
| 4 | |
| 5 | |
| 6 | |
| 7 | |
| 8 | |
| 9 | |
| 10 | |
| 11 | |
| 12 | |
| 13 | |
| 14 | |
| 15 | |
| 16 | |
| 17 | |
| 18 | |
| 19 | |
| 20 | |
| 21 | |
| 22 | |
| 23 | |
| 24 | |
| 25 | |
| 26 | |
| 27 | |
| 28 | |
| 29 | |
| 30 | |
| 31 | |
| 32 | |
| 33 | |
| 34 | |
| 35 | |
| 36 | |
| 37 | |
| 38 | |
| 39 | |
| 40 |
