 , 王鲁
, 王鲁
* 通讯作者(Corresponding author): 郭卫东, E-mail:gwd@zjni.com 收稿日期:2013-09-08 基金:本研究由国家自然科学基金项目(31100228), 浙江省自然科学基金项目(Y3110218), 浙江省#cod#x0201c;重中之重#cod#x0201d;学科#cod#x0201c;现代农业生物技术与作物病害防控#cod#x0201d;开放基金(ZC323012042)和浙江师范大学博士启动基金(ZC304010042)资助。
摘要为探讨反义寡聚核苷酸抑制(antisense oligodeoxynucleotides inhibition)技术在植物材料上的应用, 以已知功能的
关键词:反义寡聚核苷酸抑制; NtGNL1; 离体培养; 花粉管; 囊泡运输; 膜流
Comparison and Analysis of Effects of Antisense Oligodeoxynucleotide Inhibition of
LIAO Fang-Lei
 , WANG Lu
, WANG Lu
第一作者联系方式: E-mail:fangleiliao@126.com
AbstractTo develop the antisense oligonucleotide inhibition technology in plant materials, we used the known-function-gene
Keyword:Antisense oligonucleotide inhibition; NtGNL1; in vitro culture systems; Pollen tube; Endosome trafficking; Membrane trafficking
Show Figures
Show Figures










反义寡聚核苷酸抑制也称为反义ODN抑制(antisense oligod eoxynucleotid inhibition)。该技术能够高效抑制正常基因的表达, 常用于动物系统或核酸治疗系统[ 1, 2, 3]。推测反义ODN通过依赖于RNA酶H活性的mRNA降解或形成DNA核酸三链复合物(triplex)来抑制转录和翻译[ 4]。与RNAi转基因技术相比, 反义ODN能够抑制正常基因的表达, 虽具有暂时性, 但专一性较强[ 5]。在反义核苷酸的两端加上硫代磷酸脂化修饰(phosphorothioate), 抑制效率和专一性将增加[ 6, 7]。植物细胞具有细胞壁, 反义ODN穿越质膜进入细胞的难度很大。1994年Estruch等[ 8]利用钙离子的沉淀技术在玉米的花粉管中导入反义ODN, 效率很低。在带正电荷的磷脂脂质体的包裹下, 小片段的ODN进入非洲百合花( Agapanthus umbellatus)的花粉管, 由于脂质体的毒性很大, 抑制效果很难被量化[ 9]。摘下大麦叶片插入装有反义ODN的试管, ODN能够直接被大麦吸收, 并抑制目标基因的表达, 但这以破坏植物组织的完整结构为代价[ 10]。反义ODN参与植物细胞的功能基因分析, 需要找到一种适合的应用体系。
ARF-GEFs (guanine-nucleotide exchange factors for ADP-ribosylation factor GTPases)家族在所有真核生物的膜流运输中是必不可少的。它促进GDP的剥落并引进GTP, 使ARF获得活性, 指引其与膜融合[ 11], 8个ARF-EF家族中, GBF (golgi-specific BFA resistance factor)是植物ARF-GEF的标志性亚家族。植物的GBF蛋白在膜流中执行各自保守的功能。 NtGNL1 ( Nicotiana tabacum GNOM- ike1)是烟草GBF的新成员, 该基因与拟南芥 GNL1亲缘关系最近。 NtGNL1基因在烟草的生命周期中广泛表达, 在利用RNAi技术抑制 NtGNL1表达的转基因植株中, 发现其早期胚胎细胞分裂不同步, 胚胎发育不对称, 根毛生长速度明显慢于野生型植株, 且花粉萌发和生长受到抑制[ 12]。对花粉管的细胞学观察还发现, 转基因植株的花粉管尖端的细胞内吞作用、内含体与多泡体之间的囊泡转运出现紊乱[ 13]。
本文将以已知大致功能的 NtGNL1为反义ODN抑制目标, 在烟草的胚珠体外培养系统、种子萌发系统以及花粉离体萌发系统中, 加入针对 NtGNL1基因设计的反义ODN(两端加入硫代磷酸化修饰), 以期探索反义ODN的作用特点, 并进一步分析 NtGNL1在植物囊泡运输中的作用。
1 材料与方法1.1 反义ODN及其对照序列的设计根据 NtGNL1基因序列设计反义ODN序列, 为HPLC级别(TaKaRa合成), 选用其中的ON4作为后续试验。试验中随机选择4R-4R3序列(4R, 5'-TCTCACACGCGACC GGGTCTCC-3'; 4R1, 5'-CTCACACGCGACCGGGTC-3'; 4R2, 5'-GCTGCGACCTGCCACAGC-3'; 4R3, 5'-CCGTGA CCTGCACGACGC-3')作为对照序列。预试验中确定为稳定有效的反义ODN序列, 在其5'端和3'端进行磷酸硫代修饰(ON4, 5'-C(S)T(S)G(S)GGCCAGCGCAC(S)A(S)C(S)-3') (标记由TaKaRa完成), 该反义ODN序列能够特异地抑制烟草花粉管中 NtGNL1的表达[ 14]。本文结果部分提到的对照, 是从上述4R-4R3对照序列中随机选取的。
1.2 植物材料的培养与观察野生型烟草SR1的培养条件为26℃, 16 h光照, 8 h黑暗。试验材料早期胚珠、种子和花粉均来自培养的野生型烟草。
1.2.1 胚珠离体培养 对受精后的烟草子房, 以75%的医用酒精表面灭菌, 4%的次氯酸钠(NaClO)溶液浸泡 10 min, 无菌水清洗3次, 每次5 min。刮取胚珠并于13%的甘露醇(2 mL)中清洗一次, 2 mL培养基清洗2次, 将胚珠接种到培养基中(MS, 6%蔗糖, 不附加激素, pH调至5.8, 0.25 µm微孔滤膜过滤灭菌), 每1.5 mL培养基中接种100~150个胚珠[ 15]。在培养基中添加反义ODN至终浓度为5 μmol L-1, 培养胚珠30 d, 每10 d观察一次。
1.2.2 胚胎的透明观察 采用二步酶解法分离二胞原胚。对小球型及其以后时期的胚胎分离, 采取平头玻棒研磨, 在显微镜下将分离的胚胎用微吸针吸出并清洗。
用先经卡诺氏液固定, 后用霍氏透明剂透明的胚珠观察球形胚及更晚期的胚。用镊子和解剖针剥离胎座上的胚珠, 无菌水清洗一次, 再加入卡诺氏固定剂(无水乙醇与冰醋酸以3∶1的体积比混合)固定。室温处理3 h, 无菌水清洗, 取胚珠铺展于载玻片上, 稍干燥后滴加改良霍氏透明剂(7.5 g阿拉伯树胶、100 g水合氯醛、5 mL甘油和60 mL双蒸水混合后过夜溶解), 15 min后封片, 透明过夜后在干涉差显微镜下观察。
1.2.3 种子的液体培养 野生型烟草种子经表面消毒后, 在MS液体培养基中培养, 其中含5 μmol L-1反义ODN, 培养箱28℃暗培养2 d。后转移到光照培养箱28℃每天光照16 h培养, 7 d后测量统计反义ODN处理的种子的萌发率。
1.2.4 反义ODN处理体外培养的花粉并染色观察 采集成熟花粉在花粉培养基中培养, 加入反义ODN至终浓度为5 μmol L-1, 28℃暗培养。烟草花粉的体外萌发培养基配方为5 µmol L-1 CaCl2、5 µmol L-1 Ca(NO3)2、1 mmol L-1 Mg(SO4)2、0.01% H3BO3、18%蔗糖, pH 6.5~7.0[ 16]。
取培养3 h对照和处理的花粉, 加入FM4-64染液至终浓度为2~4 μmol L-1。封片, 在倒置显微镜(Leica)下获取FM4-64染色的花粉管图像, 并用MetaMorph软件(Universal Imaging Corporation Inc.)的序列抓拍功能, 以0.5 s的间隔时间取图, 跟踪观察花粉管的囊泡运输。
1.3 花粉管中膜流相关基因的半定量分析从野生型和经反义ODN处理的体外萌发花粉管中提取mRNA (TRIreagent), 反转录成cDNA (SuperScript III)。选择5个膜流相关基因(其引物序列如表1), 进行半定量RT-PCR分析。
表1
Table 1
表1(Table 1)
| 表1 膜流相关基因的引物 Table 1 Primers designed from the genes related to membrane trafficking |
1.4 数据处理用Metamorph采集数字图象, 软件Adobe Photoshop CS4作图像排版。采用Microsoft Excel 2003软件统计分析试验数据。
2 结果与分析2.1 反义ODN对胚胎发生和种子萌发率的影响在胚珠的体外萌发系统中施加反义ODN, 观察反义ODN的抑制效果。经过30 d连续观察, 发现反义ODN对胚珠的生长影响不显著(图1-A, B)。经反义ODN处理的胚珠外部形态(颜色、外形、体积等)与对照组没有观察到明显差别。对培养期的胚珠进行不同时期的胚胎分离, 结果表明, 处理组的胚胎中, 胚胎发育时期没有明显的滞后现象。对早期(二胞前后)的胚珠提取mRNA, 发现 NtGNL1的表达有所下降, 但在晚期中观察不到(图片未展示)。在小球型胚(图1-C)之后的转化期, 偶见不对称发育的胚 (图1-D), 和一些胚胎细胞隆起于胚表面的胚(图1-E), 这部分发育不正常的胚的比例并不高。在体外培养的胚珠中分离到的鱼雷期胚, 显示大部分的胚胎形态正常(图1-F)。然而, 在针对 NtGNL1的RNAi转基因中, 早期胚胎异常[ 12]。上述结果表明, 在烟草胚珠的体外培养体系中, 反义ODN抑制的效果不明显。
将不同序列的反义ODN应用于液体培养的烟草种子, 发现针对 NtGNL1设计的反义ODN引物, 在培养基中加入5 μmol L-1引物ON4和ON6后观察到种子萌发的明显迟缓。同时, 萌发率以及萌发后的根生长速度均下降(图 2), 而其余的反义ODN片段并没有影响种子的萌发。这一现象类似于 NtGNL1的RNAi转基因植株的表型[ 12]。在ON4、ON6处理组萌发出的幼苗中提取mRNA, 发现
NtGNL1的表达都有所下降(图3), 但将幼苗进一步移栽至土壤中, 一周后检测, NtGNL1并未下调(图3)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 ON4在胚珠离体培养中的应用A: 对照; B: ON4处理的胚珠。ON4处理4 d之后取图。C, D, E, F: 反义ODN处理的胚珠中的胚胎形态。D: 胚胎发育不对称;E: 胚胎细胞隆起; F: 正常形态。Bar=20 μmFig. 1 Application of ON4 to the in vitro cultured ovulesA: control; B: ON4 treatment. Pictures were taken after four days in the ON4 treatment. Bar=200 μm。C, D, E, and F are the embryos morphology in the ovules in the ON4 treatment. D: asymmetrical embryo; E: part embryonic cells bulged from the embryo; F: normal phenotype under the ON4 treatment. Bar=20 μm. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 反义ODN (5 μmol L-1)降低种子的萌发率种子培养10 d后取图。ON4和ON6的种子萌发率较低。Fig. 2 Antisense ODN (5 μmol L-1) reduced the seed germination ratePictures were taken after the seeds cultured for 10 days. The seed germination rate is very low both in ON4 and ON6 medium. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 反义ODN (5 μmol L-1)在短期内抑制 NtGNL1基因的mRNA表达种子与反义ODN共培养7 d后, 目标基因的表达在ON4和ON6的处理下有不同程度的下调; 种子萌发后转到土壤中7 d, 目标基因的表达并无影响。Fig. 3 Effect of antisense ODN treatment on NtGNL1 mRNA expressionThe mRNA expression of NtGNL1 was down regulated after the seeds were co-cultured with antisense ODN for seven days, while the mRNA expression was not influenced when those germinated seeds were transplanted to the soil for seven days. |
在胚珠体外培养和种子萌发培养基中, 在特定的反义ODN处理下(ON4和ON6), 偶引起早期胚胎表型异常, 种子萌发延迟, 但其作用不能持续。目标基因mRNA的表达在短时间内下降, 但之后逐渐恢复。推测可能是反义ODN在进入珠被和种皮时, 遇到多层细胞的阻碍[ 17]。也有极大可能是反义ODN虽有少量进入, 但逐渐被细胞内的内切酶消化, 难有持续作用。因此, 在不同培养体系中以反义ODN处理相对有效的作用时间, 可以达到抑制目标基因表达的目的。
2.2 反义ODN抑制对花粉管囊泡分布和运输方向的影响使用反义ODN的有效片段ON4、ON6处理体外萌发的花粉管, 发现目标基因的mRNA水平下调, 并且花粉管的生长受到抑制, 出现一些不正常的表型, 比如弯曲、折叠等[ 14]。所有表型都类似于 NtGNL1的RNAi转基因植株的花粉管。这些证明反义ODN抑制在花粉管培养的8 h左右[ 14], 对目标基因的抑制是非常有效的。
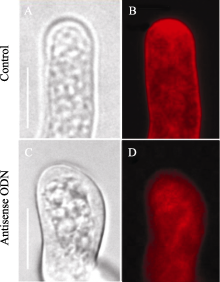
利用内吞标记染料FM4-64对ON4组花粉管囊泡跟踪观察发现, FM4-64在花粉管尖端的分布模式发生了很明显的改变。在对照组花粉管的尖端, FM4-64定位的囊泡在几分钟之内, 可以形成一个倒锥形或者又叫倒喷泉的模型[ 20], 即尖端的V型区域内聚集着大量的内吞囊泡(图4-A, B)。但在反义ODN处理的花粉管中, 大部分尖端的V型区一直没有出现, 亚尖端区域反而形成了聚集的囊泡(图4-C, D)。这些表型和我们在 NtGNL1的RNAi植株的花粉管中观察到的非常类似[ 13], 也证明反义ODN在花粉中的反义抑制的有效性。
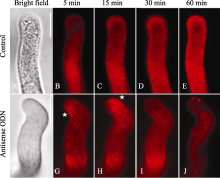
在ON4的处理组中, 跟踪观察FM4-64在不同时间内的定位, 可以显示囊泡的变化。在野生型的花粉管中, 囊泡随着时间的延长将有不同的分布, 起初是在膜周, 渐渐荧光增强转向花粉管内的细胞器。然而在一定时间内 (60 min), 囊泡在花粉管的尖端区域沿膜的分布明显(图5-A, B, C, D)。而在反义ODN处理的花粉管中, 弯折花粉管的囊泡分布在尖端边缘(图5-G, H), 甚至覆盖了花粉管的接近亚尖端的区域, 而并没有在尖端的中心出现(图5-J); 可以看出这些尖端的亮团比较大, 可能是囊泡已经发生了部分的聚集(图5-J)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 FM4-64染色显示花粉管的囊泡分布A, B: 对照; C, D: ON4处理。A, C: 明视野图; B, D: 荧光显微镜下的FM4-64染色。Bar=10 μm。以上图片取自体外萌发3 h的花粉管, 并被ON43 h后。Fig. 4 Pollen tube vesicle distribution by FM4-64 stainingA and B: pollen tube in the control medium; C and D: pollen tube under the treatment of ON4. Bar=10 μm. A and B: bright field pictures;B and D: FM4-64 staining pictures under fluorescence microscope. Pictures were taken after the pollen tubes cultured for three hours and in the ON4 treatment for three hours. |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 FM4-64染色显示囊泡运输随时间的变化第一行是对照, 第二行是ON4处理。A, F: 明视野图; B~E, G~J: FM4-64的染色在不同时间的图像。星号表示囊泡聚集集中的位置。Bar=10 μm, 以上图片取自体外萌发3 h的花粉。Fig. 5 Changes of vesicle trafficking with time-variation by FM4-64 stainingThe upper parts are controls. The lower parts are the ON4 treatments. A and F: bright field images. B-E and G-J: FM4-64 staining images at different time. Stars indicate the locations of concentration of the vesicles aggregation. Bar=10 μm. Pictures were taken after the pollen tubes germinated for three hours. |
在反义ODN处理的花粉管中, 对花粉管的FM4-64染色和显微缩时观察发现, 囊泡运输的方向和分布方式都发生了改变, 推测花粉管囊泡运输的分布和方向都受到 NtGNL1的调控。
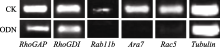
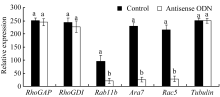
2.3 反义ODN抑制对花粉管膜流相关基因表达的影响 NtGNL1的下调表达可能影响内膜系统的囊泡运输过程, 因此对5个膜流相关基因的表达进行半定量检测, 以推测囊泡运输的哪一条途径受到影响。结果发现, 部分基因的表达量有少量下调(图6), 如 RhoGAP和 RhoGDI, 但并非显著性下调。 Rab11b、 Ara7和 Rac5的下调为显著性下调(图7), 这3个基因在囊泡运输过程中都发挥着相对独立的重要作用, 是囊泡运输不同节点的关键基因。 Rac5调控微丝的形态, 它在ODN处理后的表达抑制, 表明囊泡运输也影响微丝骨架的建成。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 相关基因半定量检测电泳图相关基因的mRNA取自体外萌发同时ON4 (5 μmol L-1)处理3 h后的花粉管。Fig. 6 Semi-quantitative detection for related genesThe mRNA of related genes were taken from pollen tubes germinated in vitro under the ON4 (5 μmol L-1) treatment for three hours. |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 相关基因mRNA变化量比较统计图根据图6的像素计算获得, 柱形上的不同字母代表处理组与对照组之间差异显著( P<0.05)。Fig. 7 Comparison of related gene mRNA expressionThe statistical chart is calculated according to the pixel of the Fig. 6. Band superscripted by different letters are significantly different between the controls and treatment groups ( P<0.05). |
3 讨论3.1 针对 NtGNL1的反义ODN序列设计 应根据 NtGNL1基因的mRNA设计长度适中的反义ODN序列, 序列太长不易被细胞吸收, 太短会降低序列的特异性。利用Oligo软件预测反义ODN片段的二级结构, 在GenBank搜索每条设计好的序列, 避免误伤其他基因。同时, 为了保证反义ODN序列能够有效地渗透进供试材料, 而不被细胞内的核酸酶消化, 应对设计的反义ODN序列进行了磷酸硫代化修饰[ 21]。另外为排除外源核酸引起的细胞毒性, 在本试验中, 设计了多重对照(不同的ODN序列)来减少系统本身的副作用。
3.2 反义ODN适用于花粉的离体萌发系统反义ODN进入细胞的机制还不很明确, 在其他植物系统中, 为解决反义ODN进入植物细胞壁的问题, 不得不借用一些转运系统如脂质体协助, 或者直接破坏植物组织的结构, 以利于植物细胞直接吸收[ 18]。最近, 有在植物叶绿体中应用反义ODN成功的例子, 也借助了仪器的导入[ 19]。有研究认为细胞直接的内吞作用和受体介导的内吞在反义ODN渗透进入细胞的过程中起了一定作用。也有资料显示细胞表面存在能够结合反义ODN的受体蛋白, 这也可能是反义ODN能够更高效地进入细胞的原因[ 22]。相比胚珠和外皮种子, 花粉管的细胞为单层, 且一直处于胞吞胞吐的活跃状态, 更容易接受外源信号的刺激。
植物细胞壁存在非通透性, 它与反义ODN都带有负电荷, 使得反义ODN进入植物细胞存在天然障碍。也有研究认为单糖或多糖能够促进裸露的反义ODN进入细胞[ 18]。在本试验中, 胚珠、种子, 花粉的培养基中都有蔗糖, 在花粉体外培养系统中, 培养基含有大量的糖(20%), 这可能是促进反义ODN进入花粉管的原因。同时, 观察到在反义ODN处理花粉管8 h后抑制效果不再明显, 推测可能是反义ODN片段被花粉管内的酶消化或本身在执行功能时被消耗[ 14]。因此, 反义ODN的直接共培养适用于花粉离体萌发这一类短时间的培养体系, 而不适用于离体胚珠培养这样一类时间长、反义ODN又难以渗透的体系。当然, 反义ODN可以作为一种瞬时转基因的方法来研究单基因功能, 前提是必须在预试验中确定反义ODN作用的有效时间。
3.3 反义ODN验证了 NtGNL1通过囊泡运输调控花粉管细胞的生长方向 囊泡运输是由多个基因调控的复杂过程, 本研究通过反义ODN抑制 NtGNL1后, 确定 Rab11b、Ara7和 Rac5基因的表达量明显下调。
Rab11b基因存在于尖端胞质中, 可能调控尖端倒锥形结构中囊泡的循环, 即循环内含体。花粉管的极性生长集中在花粉管的尖端区域, 为尖端生长提供物质基础的大细胞器的分布往往远离尖端。囊泡运输在花粉管的极性生长过程中转运物质, 为尖端生长提供物质基础[ 23]。 Rab11b基因的表达抑制或失能突变将引起尖端的囊泡循环受阻, 切断花粉管极性生长的物质供应, 引起花粉管弯曲生长。在本实验中, 反义ODN抑制处理的花粉管中, 确实出现了弯曲生长的表型[ 14]。
Ara7可能定位于早期囊泡或晚期囊泡中, 决定多泡体和高尔基体之间的运输[ 24]。多泡体起源于高尔基体, 并以分泌泡的形式将高尔基体合成的物质运送至细胞壁[ 25]。因此, Ara7可能通过调节细胞壁的生长调节花粉管的极性生长。前期工作发现 Ara7与 NtGNL1是部分共定位的[ 13]。因此, 反义ODN抑制影响 Ara7的表达也是可能的。
Rac5主要是调节微丝骨架的方向, 囊泡沿着固定的微丝骨架定向运输是细胞极性生长的基础[ 26]。在花粉管的生长中, 肌动蛋白组装成微丝纤维, 构成微丝骨架。微丝骨架即膜泡运输的轨道, 蛋白质、脂类等装载于膜泡中沿着微丝轨道特异地运送到生长点[ 27]。 Rac5表达量下调将引起微丝的不正常生长, 导致囊泡不能够正确定位到生长点, 阻碍花粉管的极性生长, 会出现花粉管生长缓慢, 也和本试验中的反义抑制出现的拟表型类似[ 28]。
这3个基因表达量的下调都能显著影响囊泡运输, 进而影响花粉管的极性生长。在花粉管的极性生长过程中, NtGNL1可能通过调控囊泡运输的多个节点, 间接地调控花粉管的极性生长。
被 NtGNL1影响的3个基因, 主要定位于植物细胞的后高尔基体转运途径, 或与囊泡转运有密切关系的微丝骨架上。因此, 进一步验证了 NtGNL1在植物后高尔基体转运中的重要作用, 但不能确认是依赖网格蛋白还是非依赖网格蛋白的内吞途径。微丝骨架与植物细胞后高尔基体转运的关系, 还需要更多研究来解释。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| 1 | |
| 2 | |
| 3 | |
| 4 | |
| 5 | |
| 6 | |
| 7 | |
| 8 | |
| 9 | |
| 10 | |
| 11 | |
| 12 | |
| 13 | |
| 14 | |
| 15 | |
| 16 | |
| 17 | |
| 18 | |
| 19 | |
| 20 | |
| 21 | |
| 22 | |
| 23 | |
| 24 | |
| 25 | |
| 26 | |
| 27 | |
| 28 |
