黄莘, 丁涛, 黄非, 白林含


四川大学生命科学学院, 生物资源与生态环境教育部重点实验室, 四川 成都 610065
收稿日期:2017-11-07;修回日期:2017-12-30;网络出版日期:2018-01-24
基金项目:国家自然科学基金(30970043)
*通信作者:白林含, Tel:+86-28-85410036, Fax:+86-28-85460487, E-mail:bailinhan@scu.edu.cn
摘要:[目的]原核表达某些需辅因子的外源蛋白时往往酶活偏低,为提高酶活和减少外加辅因子的成本,我们尝试在大肠杆菌中表达外源过氧化氢-过氧化物酶的同时提高大肠杆菌中与该酶辅因子相关的合成代谢。[方法]本研究克隆了中度嗜盐菌Halomonas elongata DSM2581的过氧化氢-过氧化物酶CAT-POD(catalase-peroxidase)编码基因katG的ORF,构建原核表达载体pET28a-katG,实现了CAT-POD在大肠杆菌中的重组表达。由于CAT-POD活性依赖其活性中心血红素,而血卟啉是血红素的骨架,通过构建原核表达载体pUC19-tac-hemA,将编码5-氨基乙酰丙酸合成酶的hemA基因在大肠杆菌中过量表达,提高卟啉的含量,从而提高重组蛋白CAT-POD的酶活。[结果]最终的CAT酶活达到了377 U/mL,为对照组的7.5倍。[结论]本研究为工业生产高活性CAT-POD提供了有效的方案,也为体外重组表达含辅因子的蛋白提供可借鉴的思路。
关键词: 中度嗜盐菌 过氧化物酶CAT-POD 原核表达 卟啉代谢
Effect of porphyrin metabolism pathway modification of Escherichia coli on recombinant catalase-peroxidase activity
Shen Huang, Tao Ding, Fei Huang, Linhan Bai


Key Laboratory of Bio-resources and Eco-environment, Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610065, Sichuan Province, China
Received 7 November 2017; Revised 30 December 2017; Published online 24 January 2018
*Corresponding author: Linhan Bai, Tel:+86-28-85410036, Fax:+86-28-85460487, E-mail:bailinhan@scu.edu.cn
Supported by the National Natural Science Foundation of China (30970043)
Abstract: [Objective]The cofactor-required prokaryotic expressions of extrinsic protein often show low activity. To improve the enzyme activity and reduce the cost of adding cofactors, we tried to express CAT-POD in Escherichia coli and promote the related synthetic metabolism of enzymes cofactors.[Methods]We cloned katG, the CAT-POD coding gene of Halomonas elongata DSM2581, and constructed it into the prokaryotic expression vector pet28a-katG, to achieve the recombinant expression of CAT-POD in E. coli. Additionally, CAT-POD's activity depends on its active centre, heme. And hematoporphyrin is the main structure of the heme. We cloned hemA, a gene coding 5-amino levulinic acid synthetase, and constructed it into the prokaryotic expression vector pUC19-tac-hemA. By overexpressing hemA, we raised the content of the porphyrin in E. coli, and improved the enzyme activity of recombinant protein CAT-POD.[Results]Ultimately, the CAT enzyme activity of katG reached 377 U/mL, 7.5 times of the control group.[Conclusion]This study provided an effective method for the industrial production of high-active CAT-POD, and a reference for the expression of protein that contains prosthetic group.
Key words: moderately halophilic catalase-peroxidase prokaryotic expression porphyrin metabolism
为大量表达目的蛋白,将外源基因导入生物反应器中表达,是现在理想的方法。目前投入生产使用的表达系统中有大肠杆菌表达系统、链霉菌表达系统、枯草芽孢杆菌表达系统、酵母表达系统、昆虫细胞表达系统和哺乳动物细胞表达系统等[1]。
大肠杆菌等原核表达系统,投入使用最早,也最为成熟,它们生长快、培养简单、基因背景和表达特征清楚、外源蛋白表达量高、价格低廉,有着不可替代的优越性,也存在着转录后加工机制不完善导致表达产物活性低等不足。在近年来的研究报道中显示共表达分子伴侣或辅助酶等基因来提升目的蛋白的活性是一条可行的策略。Jia等[2]在大肠杆菌中表达类人类胶原蛋白(HLC,human-like collagen)时,共表达了GroEL团(也称HSP60,heat shock protein 60),一方面促进HLC正确折叠,另一方面还增加了HLC的转录水平,从而提升了32.4%可溶性HLC的产量;Wu等[3]表达脂肪酶LipA时,共表达分子伴侣LipB辅助其重折叠,将脂肪酶LipA的活性由1300 U/L提升到8500 U/L;本实验室也在表达脂肪酶LipA时,共表达分子伴侣LipB获得了更高的可溶性及酶活[4];在表达人类铜锌超氧化物歧化酶(hSOD1,human Cu/Zn superoxide dismutase)时,其活性中心铜离子是其异源表达活性的瓶颈,Eiamphungporn等[5]通过共表达转铜伴侣蛋白(hCCS,human copper chaperone)增加了hSOD 13倍的酶活;Fan等[6]共表达分别编码肉碱脱水酶和肉碱脱水酶因子合成酶的基因caiB和caiE,提升肉碱脱水酶的活性2.3倍。
过氧化物酶POD (peroxidases, EC number 1.11.1.x)在各种生物中广泛存在,它是一类以过氧化物为底物,催化过氧化物发生氧化反应的一大酶类,主要功能是消除体内自由基伤害。POD种类繁多,在生产和生活中的应用非常广泛。Halomonas elongate中所属的Class Ⅰ过氧化物酶超家族中具有双官能团的过氧化氢-过氧化物酶CAT-POD,不仅有着极强的过氧化氢酶活性[7],还有着广泛的过氧物酶活性[8-9]。本研究将其编码基因katG克隆,并在大肠杆菌中重组表达。
由于该酶以血红素为活性中心,而卟啉是组成血红素的骨架。大肠杆菌虽然本身具有卟啉的合成途径[10],但卟啉产量不能满足过表达外源蛋白的翻译后修饰的需要,造成酶活性低下。本研究拟同时表达5-氨基乙酰丙酸(ALA,5-aminolevulinic acid)合成酶[11],通过积累卟啉的前体ALA来增加卟啉的产量,从而提高重组蛋白CAT-POD的酶活。免除后添加辅因子,为工业生产重组CAT-POD降低成本,也为体外重组表达含辅基的蛋白提供可借鉴的思路。
1 材料和方法 1.1 材料
1.1.1 菌株与质粒: 菌株Halomonas elongata DSM2581来自浙江大学嗜极微生物研究所,沙门氏菌Salmonella enterica subsp.由四川大学王红宁教授提供,E. coli JM109、E. coli BL21(DE3)和质粒pET28-a、pUC-19由实验室保藏。
1.1.2 培养基: 嗜盐菌培养基(g/L):蛋白胨10,酵母粉5,NaCl 75,KCl 5,pH调至8.0;LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 5。培养基中氨苄青霉素的终浓度为100 ng/mL,卡那霉素的终浓度为50 ng/mL。
1.1.3 试剂: EX Taq DNA Polymerase,T4 DNA连接酶,限制性内切酶等购自TaKaRa公司;氨苄青霉素,卡那霉素,IPTG,ABTS等试剂购自奥克生物公司;
1.1.4 引物: 由生工生物工程(上海)股份有限公司合成,详见表 1。测序由擎科生物完成。
表 1. 实验所用到的引物 Table 1. Primers in the experiment
| Primers | Sequence (5′→3′) | Function |
| HE-katG-F | CTCGAGTCAGGCGAGATCGAAGCG (XhoⅠ) | katG clone and verfication |
| HE-katG-R | GAGCTCATGGGCGAACAACAGAATTCC (SacⅠ) | katG clone and verfication |
| M13 F | CGCCAGGGTTTTCCCAGTCACGAC | hemA verfication |
| M13 R | AGCGGATAACAATTTCACACAGGA | hemA verfication |
| hemA F | ATGACCAAGAAGCTTTTAGCACTCGGTATCAAC | hemA clone |
| hemA R | AAATCTAGACTACTCCAGCCCGAGGCTGTCGCGCAGA | hemA clone |
| Tac overⅠ | CTGAGAATTCGAGCTGTTGACAATTAATCATCGGCTCGTATAATG | Overlap PCR |
| Tac over Ⅱ | CTGTTTCCTGTGTGAAATTGTTATCCGCTCACAATTCCACACATTATA CGAGCCGATGA | Overlap PCR |
| Tac over Ⅲ | ATTTCACACAGGAAACAGAATACTATGACCAAGAAGCTTTTAG | Overlap PCR |
表选项
1.2 表达载体pET28a-katG的构建及验证 提取Halomonas elongata的基因组DNA,利用引物HE-katG-F (含XhoⅠ位点)和HE-katG-R (含SacⅠ位点)扩增出katG片段,用限制性内切酶SacⅠ和XhoⅠ酶切并连接到相同酶切处理的pET-28a上,转化大肠杆菌E. coli JM109,在含有50 ng/mL卡那霉素的培养基上培养过夜,挑取阳性单克隆,抽提质粒进行测序验证,确保其没有错配,得到重组质粒pET28a-katG,SacⅠ和XhoⅠ双酶切验证阳性克隆子。
1.3 转化及诱导表达 将获得的重组质粒pET28a-katG转化至CaCl2处理后的感受态细胞E. coli BL21中,得到重组菌E. coli BL21 (pET28a-katG),在含有50 ng/mL卡那霉素的培养基上培养过夜,挑取单菌落在37 ℃ LB液体培养基中培养过夜后,加入IPTG至0.5 mol/L,30 ℃诱导表达8 h。
1.4 表达载体pUC19-tac-hemA的构建及验证 提取Salmonella enterica subsp.的基因组DNA,利用引物hemA F和hemA R扩增出hemA片段;使用Tac overⅠ、Tac over Ⅱ、Tac over Ⅲ和hemA R为引物,进行overlamp PCR,添加tac启动子(trp启动子和lac启动子杂合组成),连接tac启动子到hemA序列的上游。用T4连接酶连接到T载体上,转化至大肠杆菌E. coli JM109,在含有100 ng/mL氨苄青霉素的培养基上培养过夜,挑取阳性单克隆,抽提质粒进行测序验证,确保其没有错配,用限制性内切酶XbaⅠ和EcoRⅠ酶切处理重组的T载体并连接到相同酶切处理的pUC19上,最终得到重组质粒pUC19-tac-hemA,XbaⅠ和EcoRⅠ双酶切验证阳性克隆子。
1.5 转化及诱导表达 离心重组菌E. coli BL21 (pET28a-katG),使用CaCl2溶液在4 ℃下处理重组菌E. coli BL21 (pET28a-katG) 48 h,加入重组质粒pUC19- tac-hemA混匀热激,重组质粒转化至E. coli BL21 (pET28a-katG)中,在含有100 ng/mL氨苄青霉素和50 ng/mL卡那霉素的培养基上培养过夜,挑取阳性单克隆,得到重组菌E. coli BL21 (katG- hemA),挑取单菌落在37 ℃ LB液体培养基中培养过夜后,加入IPTG至0.5 mol/L,30 ℃诱导表达8 h。
1.6 粗酶活性的测定[12-13] 重组菌株E. coli BL21 (pET28a-katG)和E. coli BL21 (katG-hemA)经过IPTG 30 ℃诱导12 h后,对菌液进行超声破碎离心获取上清。
CAT酶活测定:按照公式(1)进行。反应体系3 mL,1.9 mL水+1.0 mL过氧化氢+0.1 mL酶液,分别在反应30、60、90、120 s时加入1 mL钼酸铵+1 mL NaCl,测量OD405下的吸光度。
 | 公式(1) |
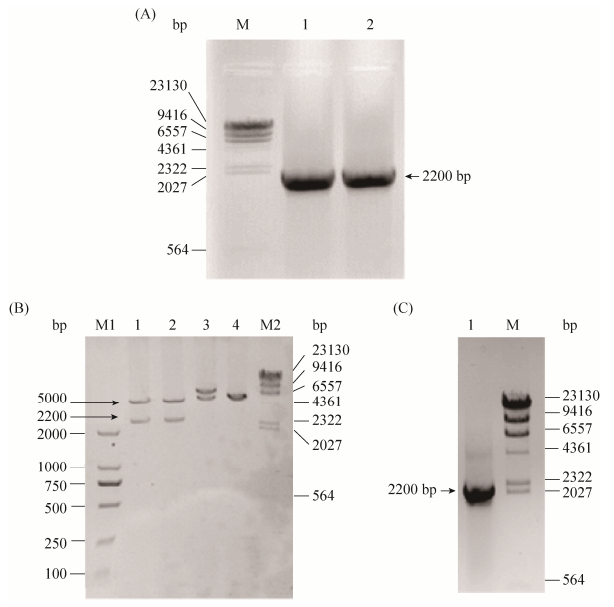
POD酶活测定:按照公式(2)进行。反应体系3 mL,1.9 mL水+0.1 mL酶液+1.0 mL稀释后的ABTS+,其中ABTS+由ABTS溶液和K2S2O8在常温下避光反应生成。体系中的酶会还原ABTS+,随着反应的进行OD416下分光值变化。
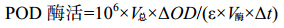 | 公式(2) |
2 结果和分析 2.1 pET28a-katG表达载体的构建 以Halomonas elongata的基因组为模板,用引物HE-katG-F、HE-katG-R扩增获得目的基因katG的ORF,PCR产物经1%琼脂糖凝胶电泳在2200 bp左右有清晰条带,与预测大小一致(图 1-A),经测序验证无错配碱基;将获得的katG片段连接到pET-28a上得到重组质粒pET28a-katG,经SacⅠ和XhoⅠ双酶切验证,结果如图 1-B,可见一个5000 bp和一个2200 bp左右的片段,上方为pET28a,下方为katG;再将重组质粒pET28a-katG使用引物HE-katG-F和HE-katG-R进行PCR验证,结果如图 1-C,2200 bp处有清晰条带。通过双酶切和PCR验证确定表达质粒pET28a-katG构建成功。
 |
| 图 1 pET28a-katG表达载体构建与验证 Figure 1 Construction and identification of pET28a-katG expression vectors. A: katG PCR result, M: isλ-Hind Ⅲ; lanes 1, 2 is product of katG PCR. B: enzyme digestion of pET28a-katG by SacⅠ and XhoⅠ, M1: DL2000; M2: λ-Hind Ⅲ; lanes 1–4: enzyme digestion results; lanes 1, 2: positive clones; lanes 3, 4: false positive. C: PCR identification of pET28a-katG, M: λ-Hind Ⅲ; lane 1: positive clone. |
| 图选项 |
2.2 katG重组蛋白表达 重组菌株E. coli BL21 (pET28a-katG)经过IPTG 30 ℃诱导8 h,超声破碎收集胞内蛋白,SDS-PAGE分析。如图 2,在上清液得到95 kDa左右大小的目的蛋白,说明成功将Halomonas elongata DSM2581中katG基因引入大肠杆菌BL21中,同时为可溶表达。
 |
| 图 2 katG重组蛋白SDS-PAGE电泳图 Figure 2 The SDS-PAGE of katG recombine protein. M: protein maker; lane 1, 2: the supernatant and precipitation of recombine E. coli respectively after IPTG induction; lane 3, 4: the supernatant and precipitation of recombine E. coli respectively without IPTG induction respectively. |
| 图选项 |
2.3 表达载体pUC19-tac-hemA的构建 以Salmonella enterica subsp.基因组DNA为模板,hemA F和hemA R为正反向引物,进行PCR扩增,得到单一1200 bp左右的目的片段,测序验证为hemA的ORF序列1194 bp,如图 3-A。胶回收后备用,进行下一步重叠PCR。
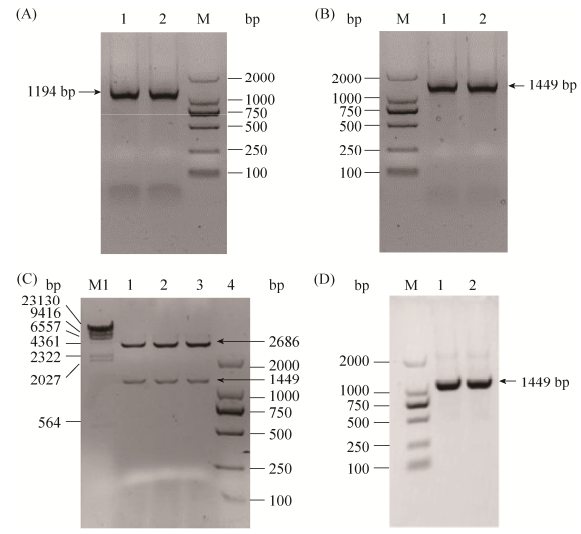 |
| 图 3 pUC19-tac-hemA表达载体构建与验证 Figure 3 Construction and identification of pUC19-tac-hemA expression vectors. A: hemA PCR result, lane M: DL2000; lanes 1, 2: hemA. B: hemA overlamp PCR result, lane M: DL2000; lanes 1, 2: tac-hemA. C: enzyme digestion of pUC19-tac-hemA by Xba Ⅰ and EcoR Ⅰ, M1: λ-Hind Ⅲ; M2: DL2000; lanes 1–3: enzyme digestion positive results. D: PCR identification of pUC19-tac-hemA, M: DL2000; lanes 1, 2: positive clones. |
| 图选项 |
以hemA PCR产物为模板,Tac overⅠ、Tac over Ⅱ、Tac over Ⅲ和hemA R为引物,进行重叠PCR,如图 3-B,获得了比hemA片段增加了约250 bp的片段,经测序验证,255 bp的tac启动子成功加在hemA基因前,得到tac-hemA片段,可以用于下一步实验。
将tac-hemA片段连接到载体pUC19上,得到pUC19-tac-hemA,将连接后质粒转化到BL21(DE3)中。提取阳性克隆子质粒,经XbaⅠ、EcoRⅠ双酶切验证,结果如图 3-C,泳道1–3为pUC19-tac-hemA的酶切结果,可以看到大小约为2600 bp和1400 bp的片段,分别为pUC19和tac-hemA。
使用引物M13 F和M13 R对pUC19-tac-hemA进行PCR验证,得到结果如图 3-D,可以看到泳道1和2均有1400 bp左右的片段,为tac-hemA的大小。
2.4 双质粒转化株的验证 以双抗筛选后的阳性菌株为模板,进行双重PCR,分别验证katG和hemA是否均存在于双质粒菌株中。从图 4-A泳道2中可以看出,双抗筛选后的单菌,通过PCR能够同时得到大于2000 bp和1400 bp左右的条带,经测序验证为别为katG基因和hemA基因,说明成功筛选到双质粒阳性重组菌株E. coli BL21 (katG-hemA)。
 |
| 图 4 双质粒转化株的验证 Figure 4 Identification of E. coli BL21 (katG-hemA). A: PCR identification of E. coli BL21(katG-hemA), M: DL2000; lane 1: E. coli BL21(pET28a-katG) control; lane 2: E. coli BL21(katG-hemA). B: expression of hemA in Escherichia coli, tube 1: E. coli that after IPTG induction; tube 2: the recombinant strain E. coli BL21(katG-hemA) after IPGT induction overnight; tube 3: the recombinant strain E. coli BL21(katG-hemA) without IPGT induction. |
| 图选项 |
卟啉由于其共振结构,在溶液中显红棕色,重组菌株E. coli BL21 (katG-hemA)中可以看到明显的显色。如图 4-B所示,重组菌株E. coli BL21 (katG-hemA)在IPGT过夜诱导后,积累卟啉,溶液呈红棕色(图 4-B),而试管1 (图 4-B)是普通的加入IPTG的大肠杆菌,试管3 (图 4-B)则是未加入IPTG的重组菌株E. coli BL21 (katG-hemA),都未显现出红棕色,说明hemA在大肠杆菌中成功异源表达,同时具有一定的酶活性。
2.5 酶活的测定 重组菌株E. coli BL21 (pET28a-katG)和E. coli BL21 (katG-hemA)经过IPTG 30 ℃诱导8 h后,对菌液进行超声破碎离心获取上清。在含有过氧化氢和ABTS+的体系中反应来分别测量其CAT和POD酶活。CAT酶活反应中吸光度测定结果见表 2,POD酶活反应中吸光度测定结果见表 3。
表 2. CAT酶活测定的吸光度结果 Table 2. The absorbency result of catalase activity (OD405) (D≤±0.005)
| t/s | Control | pET28a | pET28a-katG | katG-hemA |
| 30 | 0.41852 | 0.44703 | 0.13429 | 0.13677 |
| 60 | 0.40733 | 0.40616 | 0.06672 | 0.07280 |
| 90 | 0.39512 | 0.37438 | 0.05868 | 0.01791 |
| 120 | 0.38610 | 0.35340 | 0.01805 | 0.01637 |
表选项
表 3. POD酶活测定的吸光度结果 Table 3. The absorbency result of peroxidase activity (OD416) (D≤±0.005)
| t/s | Control | pET28a | pET28a-katG | katG-hemA |
| 30 | 0.16024 | 0.12310 | 0.17466 | 0.15188 |
| 60 | 0.11998 | 0.08986 | 0.14312 | 0.12739 |
| 90 | 0.11010 | 0.07361 | 0.11760 | 0.10720 |
| 120 | 0.07939 | 0.05023 | 0.10715 | 0.09747 |
| 150 | 0.07399 | 0.03741 | 0.09978 | 0.08740 |
| 180 | 0.06062 | 0.03659 | 0.08417 | 0.07753 |
表选项
经过酶活计算公式计算,空载菌、E. coli BL21 (pET28a-katG)和E. coli BL21 (katG-hemA)的CAT酶活大小分别为50.5、164.0、377.0 U/mL,POD酶活大小分别为43、44、58 U/mL。
3 讨论 由于反应条件的限制,自然界中大部分酶在工业生产中并不能很好地发挥其活性,而极端微生物胞内的酶可以在极端的物理化学条件下保持酶活性。研究极端微生物的酶并进行原核表达生产,可以为工业生产提供大量的适宜反应条件的极端酶,例如,用于PCR反应的耐高温DNA聚合酶、洗涤剂中添加的耐碱蛋白酶[14]和碱性纤维酶[15],以及嗜盐菌中的胞外木聚糖酶[16]。同时,在极端环境下,生物体所受到胁迫在体内常以氧自由基ROS的形式表示出来,极端微生物的降解ROS的抗氧化酶系值得我们研究。
从酶活的结果来看,卟啉的过表达提升了katG的酶活,尤其大大提升了其CAT酶活。平行测定空载菌、E. coli BL21 (pET28a-katG)和E. coli BL21 (katG-hemA)粗酶液的CAT和POD活性,CAT酶活大小分别为50.5、164.0、377.0 U/mL,POD酶活大小分别为43、44、58 U/mL。可见,重组菌的CAT酶活由对照组的3.3倍提升到了7.5倍。而POD酶活虽有提升,但并不明显。由于katG是一种拥有POD结构的过氧化氢酶,主要显示其CAT活性,其天然的POD底物也仍存疑,所以这里并没有使用常见的愈创木酚法来测量其POD酶活,而是选择了ABTS法来测粗酶液总的氧化还原能力,通过和空载菌的对比来获得POD酶活的变化。所以探索katG的天然底物以得到更显著的POD酶活测量方法,扩宽目的蛋白katG的应用范围,是未来需要研究的内容。
对比近年对过氧化氢-过氧化物酶katG的研究,一般都是关于其还原机制和酶结构的研究,关于异源表达的报道几乎没有。在大肠杆菌野生菌株中,katG的CAT酶活约为50 U/mL[17],与本文对空载菌CAT粗酶活的检测结果相近;在结核杆菌中,katG的CAT酶活约为66.8 U/mL[18],远小于本文在大肠杆菌中表达的katG酶活;而目前工业上过氧化氢酶的主要来源牛肝过氧化氢酶的酶活约为45.4–77.4 U/mL[19],而本文异源表达蛋白的CAT酶活结果分别为164 U/mL和377 U/mL,远高于其他常见菌株和工业用牛肝过氧化氢酶,可见异源表达嗜盐菌Halomonas elongata的CAT-POD酶katG在工业上的应用前景是值得期待的。
血红素的主要结构是一个带三价铁的卟啉环,是超氧化物歧化酶SOD、肌红蛋白和绝大多数过氧化物酶POD、过氧化氢酶CAT的活性中心。CAT还会基于血卟啉活性中心形成MYW (Met-Tyr-Trp)结构,对其过氧化氢酶活性有提升作用[20]。过量表达katG目的蛋白使得宿主正常代谢的血红素相对不足,影响酶活。为了弥补这一辅助因子的缺失,我们额外表达一个可以提高卟啉的合成蛋白,从而提高了POD-CAT的活性。在本文中,所使用的卟啉的代谢途径的改造可以推广到表达POD、SOD、CAT、肌红蛋白等各类需要卟啉作为活性中心的外源蛋白上。
References
| [1] | Anné J, Maldonado B, van Impe J, van Mellaert L, Bernaerts K. Recombinant protein production and streptomycetes. Journal of Biotechnology, 2012, 158(4): 159-167. DOI:10.1016/j.jbiotec.2011.06.028 |
| [2] | Jia QL, Luo YE, Fan DD, Ma P, Ma XX, Xue WJ. The different roles of chaperone teams on over-expression of human-like collagen in recombinant Escherichia coli. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(6): 2843-2850. DOI:10.1016/j.jtice.2014.08.020 |
| [3] | Wu XP, You PY, Su EZ, Xu JJ, Gao B, Wei DZ. In vivo functional expression of a screened P. aeruginosa chaperone-dependent lipase in E. coli. BMC Biotechnology, 2012, 12: 58. DOI:10.1186/1472-6750-12-58 |
| [4] | Bai FW, Yan W, Zhang SJ, Yu D, Bai LH. Immobilized lipase of reconstructed oil bodies and its potential application in biodiesel production. Fuel, 2014, 128: 340-346. DOI:10.1016/j.fuel.2014.03.033 |
| [5] | Eiamphungporn W, Yainoy S, Prachayasittikul V. Enhancement of solubility and specific activity of a Cu/Zn superoxide dismutase by co-expression with a copper chaperone in Escherichia coli. Iranian Journal of Biotechnology, 2016, 14(4): 243-249. DOI:10.15171/ijb.1465 |
| [6] | Fan LQ, Yuan QS, Wu XF. Coexpression of caiB and caiE with two plasmids in E. coli. Acta Biochimica et Biophysica Sinica, 2002, 34(1): 104-108. |
| [7] | Njuma OJ, Ndontsa EN, Goodwin DC. Catalase in peroxidase clothing:interdependent cooperation of two cofactors in the catalytic versatility of KatG. Archives of Biochemistry and Biophysics, 2014, 544: 27-39. DOI:10.1016/j.abb.2013.11.007 |
| [8] | Jakopitsch C, Regelsberger G, Furtmüller PG, Rüker F, Peschek GA. Catalase-peroxidase from Synechocystis is capable of chlorination and bromination reactions. Biochemical and Biophysical Research Communications, 2001, 287(3): 682-687. DOI:10.1006/bbrc.2001.5616 |
| [9] | Regelsberger G, Jakopitsch C, Engleder M, Rüker F, Peschek GA, Obinger C. Spectral and kinetic studies of the oxidation of monosubstituted phenols and anilines by recombinant Synechocystis catalase-peroxidase compound Ⅰ. Biochemistry, 1999, 38(32): 10480-10488. DOI:10.1021/bi990886n |
| [10] | Li FF, Wang Y, Gong K, Wang Q, Liang QF, Qi QS. Constitutive expression of RyhB regulates the heme biosynthesis pathway and increases the 5-aminolevulinic acid accumulation in Escherichia coli. FEMS Microbiology Letters, 2014, 350(2): 209-215. DOI:10.1111/fml.2014.350.issue-2 |
| [11] | 康振. 大肠杆菌系统改造及琥珀酸和5-氨基乙酰丙酸合成途径的构建. 山东大学博士学位论文, 2011. |
| [12] | Chai XS, Hou QX, Luo Q, Zhu JY. Rapid determination of hydrogen peroxide in the wood pulp bleaching streams by a dual-wavelength spectroscopic method. Analytica Chimica Acta, 2004, 507(2): 281-284. DOI:10.1016/j.aca.2003.11.036 |
| [13] | Kang WY, Wang JM. In vitro antioxidant properties and in vivo lowering blood lipid of Forsythia suspense leaves. Medicinal Chemistry Research, 2010, 19(7): 617-628. DOI:10.1007/s00044-009-9217-5 |
| [14] | Ibrahim ASS, Al-Salamah AA, El-Badawi YB, El-Tayeb MA, Antranikian G. Detergent-, solvent-and salt-compatible thermoactive alkaline serine protease from halotolerant alkaliphilic Bacillus sp. NPST-AK15:purification and characterization. Extremophiles, 2015, 19(5): 961-971. DOI:10.1007/s00792-015-0771-0 |
| [15] | Shikata S, Saeki K, Okoshi H, Yoshimatsu T, Ozaki K, Kawai S, Ito S. Alkaline cellulases for laundry detergents:production by alkalophilic strains of Bacillus and some properties of the crude enzymes. Agricultural and Biological Chemistry, 1990, 54(1): 91-96. |
| [16] | Chang SY, Guo YL, Wu B, He BF. Extracellular expression of alkali tolerant xylanase from Bacillus subtilis Lucky9 in E. coli and application for xylooligosaccharides production from agro-industrial waste. International Journal of Biological Macromolecules, 2017, 96: 249-256. DOI:10.1016/j.ijbiomac.2016.11.032 |
| [17] | Zhang L, Alfano JR, Becker DF. Proline metabolism increases katG expression and oxidative stress resistance in Escherichia coli. Journal of Bacteriology, 2015, 197(3): 431-440. DOI:10.1128/JB.02282-14 |
| [18] | Rintiswati N, Wibawa T, Asmara W, Soebono H. Effect of oxidative stress on AhpC activity and virulence in katG Ser315 Thr Mycobacterium tuberculosis mutant. Indonesian Journal of Biotechnology, 2011, 16(2): 100-110. |
| [19] | Karadag H, Ozhan F. Effect of cyprodinil and fludioxonil pesticides on bovine liver catalase activity. Biotechnology & Biotechnological Equipment, 2015, 29(1): 40-44. |
| [20] | Gasselhuber B, Graf MH, Jakopitsch C, Zamocky M, Nicolussi A, Furtmüller PG, Oostenbrink C, Carpena X, Obinger C. Interaction with the redox cofactor MYW and functional role of a mobile arginine in eukaryotic catalase-peroxidase. Biochemistry, 2016, 55(25): 3528-3541. DOI:10.1021/acs.biochem.6b00436 |
