王泽政1, 张利华1, 张满琪1, 胡世元2, 李莉2, 沈微1, 樊游1, 陈献忠1


1.江南大学生物工程学院, 工业生物技术教育部重点实验室, 江苏 无锡 214122;
2.赢创(上海)投资管理有限公司, 上海 201108
收稿日期:2017-11-18;修回日期:2018-01-10;网络出版日期:2018-01-24
基金项目:江苏省自然科学基金(BK20171138);国家“863计划”(2013AA102101-5)
*通信作者:陈献忠, Tel/Fax:+86-510-85918122;E-mail:xzchen@jiangnan.edu.cn
摘要:[目的]热带假丝酵母是发酵法生产二元酸的重要工业菌株,具有较高的ω-氧化活性。脂肪醛脱氢酶在ω-氧化途径中起重要作用,催化脂肪醛生成脂肪酸,但其具体催化功能及对细胞生理影响还未被系统研究。本文通过删除脂肪醛脱氢酶基因CtAld1和CtAld2鉴定了其在ω-氧化途径中的功能。[方法]通过基因组信息挖掘获得热带假丝酵母脂肪醛脱氢酶基因CtAld1和CtAld2序列,在此基础上,通过同源重组敲除CtAld1和CtAld2基因。考察突变株的生长和胞内脂肪醛脱氢酶活性变化,并评价CtAld1和CtAld2基因敲除对细胞二元酸合成能力的影响。[结果]分别获得了热带假丝酵母突变株XZX-1(ΔCtAld1/ΔCtAld1)、XZX-2(ΔCtAld2/ΔCtAld2)和XZX-12(ΔCtAld1/ΔCtAld1,ΔCtAld2/ΔCtAld2)。在以十二烷为唯一碳源的培养基中,敲除CtAld2基因显著抑制细胞的生长,胞内脂肪醛脱氢酶活性降低为出发菌株的30%;敲除CtAld1基因尽管会使细胞损失一部分醛脱氢酶活性,但能够一定程度地提升细胞在十二烷中的生长性能。敲除CtAld1或CtAld2会降低菌株二元酸产量,组合敲除CtAld1和CtAld2严重削弱菌株十二碳二元酸的合成能力。[结论]CtAld2对热带假丝酵母细胞的生长和十二碳二元酸的合成具有重要作用,缺失CtAld1或CtAld2基因降低细胞的二元酸合成能力。CtAld1和CtAld2可作为热带假丝酵母ω-氧化途径代谢工程改造的潜在靶点。
关键词: 热带假丝酵母 脂肪醛脱氢酶 基因敲除 十二碳二元酸
Functional identification of fatty aldehyde dehydrogenase genes CtAld1 and CtAld2 from Candida tropicalis
Zezheng Wang1, Lihua Zhang1, Manqi Zhang1, Shiyuan Hu2, Li Li2, Wei Shen1, You Fan1, Xianzhong Chen1


1.Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2.Evonik(Shanghai) Investment Management Co. Ltd., Shanghai 201108, China
Received 18 November 2017; Revised 10 January 2018; Published online 24 January 2018
*Corresponding author: Chen Xianzhong, Tel/Fax:+86-510-85918122;E-mail:xzchen@jiangnan.edu.cn
Supported by the Natural Science Foundation of Jiangsu Province (BK20171138) and by the National High Technology Research and Development Program of China (863 program)(2013AA102101-5)
Abstract: [Objective]Candida tropicalis has become an important industrial strain to produce dicarboxylic acids due to its high ω-oxidation activity. Fatty aldehyde dehydrogenases (FALDHs) play important roles in the ω-oxidation pathway, converting fatty aldehydes to fatty acids. However, FALDHs characterization and their roles in the synthesis of dibasic acids have not been studied in depth. Therefore, we cloned two genes CtAld1 and CtAld2 encoding FALDHs and evaluated their function in cell phenotype, enzyme activity and dicarboxylic acids accumulation.[Methods]We screened two genes of CtAld1 and CtAld2 through genome mining and sequence alignment. Based on sequence analysis, we deleted CtAld1 and CtAld2 either separately or accumulatively by homologous recombination method, and generated various mutants. The effect of deletion of CtAld1 and CtAld2 on cell growth, FALDH activity and dodecanedioic acid (DCA12) production were evaluated and compared.[Results]XZX-1 (ΔCtAld1/ΔCtAld1), XZX-2 (ΔCtAld2/ΔCtAld2) and XZX-12 (ΔCtAld1/ΔCtAld1, ΔCtAld2/ΔCtAld2) were obtained. When using dodecane as sole carbon source, deletion of CtAld2 gene significantly inhibited cell growth, and the intracellular FALDH activity was only 30% of the parental strain. Deleting CtAld1 had a slight promotion of cell growth, however intracellular FALDH activity was decreased to some extent. Furthermore, simultaneous deletion of CtAld1 and CtAld2 significantly impaired the cell growth performance and decreased FALDH activity, thus causing a distinct lower DCA12 yield compared to the wild type strain.[Conclusion]The deletion of CtAld1 in C. tropicalis could reduce the yield of DCA12. And CtAld2 plays an important role in the growth on dodecane and production of DCA12. To our knowledge, they could be recruited as target genes for metabolic engineering of ω-oxidation pathway in C. tropicalis.
Key words: Candida tropicalis fatty aldehyde dehydrogenase gene disruption dodecanedioic acid
热带假丝酵母(Candida tropicalis)是一种具有重要工业应用价值的非常规酵母,可以吸收长链烷烃并将其转化为脂肪酸用以生长和繁殖[1]。热带假丝酵母转化烷烃为二元酸的过程主要通过ω-氧化完成,细胞色素P450单加氧酶(CYP)、脂肪醇氧化酶(FAO)、脂肪醇脱氢酶(ADH)和脂肪醛脱氢酶(FALDH)参与了相关反应(图 1)。烷烃(或脂肪酸)被细胞吸收后,末端甲基在细胞色素P450单加氧酶催化下被氧化而生成脂肪醇,随后在脂肪醇氧化酶(或脂肪醇脱氢酶)和脂肪醛脱氢酶的相继作用下生成单羧酸(或二元酸),最终或分泌到胞外,或以脂质的形式储藏在细胞中[2],或通过β-氧化途径分解为细胞生长与繁殖提供物质和能量。β-氧化途径阻断的热带假丝酵母能够高效地积累重要化工原料长链二元酸[3]。
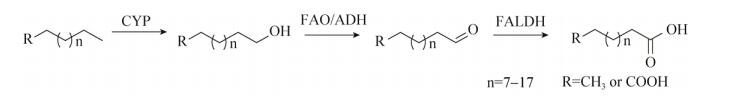 |
| 图 1 热带假丝酵母的ω-氧化途径 Figure 1 ω-oxidation pathway of Candida tropicalis. |
| 图选项 |
增强ω-氧化是提升热带假丝酵母菌株产酸能力的一种策略,目前已有许多针对细胞色素P450单加氧酶和脂肪醇氧化酶基因的研究。CYP被认为是ω-氧化途径中的限速酶,Craft等用不同链长度的烷烃或脂肪酸对热带假丝酵母CYP基因转录进行诱导,通过比较mRNA丰度,发现CYP52A13在10个前期克隆的CYP基因中转录水平最高[4],可作为菌株ω-氧化途径改造的候选基因。Eirich等克隆了热带假丝酵母中的FAO1和FAO2 (FAO2a和FAO2b)基因,在大肠杆菌中实现了异源表达,并研究了相应酶的酶学性质[5]。已有研究证实热带假丝酵母中脂肪醛脱氢酶活性的存在[6],但针对具体蛋白以及相关基因都未有进一步的深入研究。
哺乳动物脂肪醛脱氢酶ALDH3A2和其直系同源的HFD1 (来自酿酒酵母)可以氧化十六烯醛为十六烯酸[7]。参考上述两种蛋白的氨基酸序列信息,Iwama等在解脂耶氏酵母(Yarrowia lipolytica)基因组中挖掘出4个可能编码脂肪醛脱氢酶的基因(HFD1、HFD2、HFD3和HFD4),敲除这4个基因的解脂耶氏酵母菌株不能利用12–18碳的烷烃生长,而异源表达HFD1、HFD2和HFD4基因可以明显提高大肠杆菌对十二醛和十四醛的氧化能力[7]。本文通过对热带假丝酵母的基因组信息进行挖掘,克隆出2对可能与长链脂肪醛代谢相关的基因CtAld1和CtAld2,初步研究它们在热带假丝酵母烷烃代谢和二元酸生产中的作用。
1 材料和方法 1.1 材料
1.1.1 菌株和质粒: 大肠杆菌JM109,用于质粒构建,由江南大学高校工业微生物资源与信息中心保藏;热带假丝酵母XZX,本研究室通过诱变热带假丝酵母ATCC 20336所得[8];热带假丝酵母03菌株(肉毒碱酰基转移酶基因CAT双敲菌株)和质粒Tm-gda324-URA3由本实验室保藏[9];pMD19-T (Simple)载体,用于基因克隆,购自TaKaRa公司;
1.1.2 主要酶和试剂: 限制性内切酶、DNA Ligation Kit和DNA聚合酶等购自TaKaRa公司;PCR引物由苏州泓迅生物科技股份有限公司合成(表 1);酵母氮基(YNB)、氨苄青霉素钠和5-氟乳清酸(5-FOA)购自生工生物工程(上海)股份有限公司;十二烷、月桂酸甲酯、4-羟乙基哌嗪乙磺酸(HEPES)和β-烟酰胺腺嘌呤二核苷酸(NAD+)钠盐购自Sigma公司;十二醛购自阿拉丁试剂公司;其他试剂均为国产分析纯。
表 1. 本研究中使用的引物 Table 1. Primers used in this study
| Primers | Sequences (5′→3′) | Restriction sites |
| Ald1-1F | ATGAGTAAGTCATACAAGTTGCCA | |
| Ald1-1R | CTACAAAGAGGCACCAATAAAATC | |
| ReAld1-1F | TGCACTGCAGTCTGGACATGGTGCCTACCACGGA | Xba Ⅰ |
| ReAld1-1R | CTAGTCTAGACAGCAGCATTGGCAGCAGCGGC | Pst Ⅰ |
| Ald1-2F | AAGCAAAGCCAACTCCTA | |
| Ald1-2R | AGATGTATTCAGCCAACG | |
| ReAld1-2F | CTAGTCTAGAGAGGGACGTTATCGAGAA | Xba Ⅰ |
| ReAld1-2R | TGCACTGCAGACACACGGTGGAAATCTT | Pst Ⅰ |
| YZAld1R | CGATCTTATGAACTAGCTCTACA | |
| Ald2-1F | CTATTGCTTATTAGTGATGAACT | |
| Ald2-1R | ATGTCCCCACCATCTAAATT | |
| ReAld2-1F | CTAGTCTAGACAACTCATTCAAGCCACCC | Xba Ⅰ |
| ReAld2-1R | TGCACTGCAGGCCAGCTCGACCAGATCTT | Pst Ⅰ |
| Ald2-2F | GAACCGCTGGTGAAGATGT | |
| Ald2-2R | ATGTCGAGCTTGCATGAGT | |
| ReAld2-2F | CTAGTCTAGAGGTCGTCTCAGGAATACCACCATCG | Xba Ⅰ |
| ReAld2-2R | TGCACTGCAGGAATTCTACCCTAACTTGACCAAAGACACCA | Pst Ⅰ |
| YZAld2R | CACAAGCAAGAAGATCACCAA | |
| The underlined are restriction enzyme cutting sites. | ||
表选项
1.1.3 主要培养基: (1) LB培养基(g/L):酵母粉5,蛋白胨10,氯化钠10。(2) MM培养基(g/L):YNB 6.7,硫酸铵10,葡萄糖20。(3) SM培养基:MM培养基中加入0.006% (W/V)尿嘧啶。(4) 5-FOA培养基:于SM培养基中添加0.2% (W/V) 5-FOA。(5) C+培养基(g/L):YNB 6.7,硫酸铵10,尿嘧啶0.06,另根据不同需求,灭菌后添加20 mL十二烷或月桂酸甲酯。(6)发酵培养基(g/L):YNB 6.7,酵母粉3,硫酸铵3,磷酸氢二钾1,磷酸二氢钾1,葡萄糖75。固体培养基另加入20 g/L琼脂。
1.2 醛脱氢酶氨基酸序列分析 参照文献[7]从National Center for Biotechnology Information (NCBI)数据库查找解脂耶氏酵母脂肪醛脱氢酶HFD1、HFD2、HFD3和HFD4以及酿酒酵母ScHFD1的氨基酸序列。根据基因组注释从热带假丝酵母ATCC20336基因组序列(前期测序并注释,尚未公开)中获得潜在的脂肪醛脱氢酶氨基酸序列。用NCBI中的Constraint-based Multiple Alignment Tool对热带假丝酵母潜在脂肪醛脱氢酶序列和上述已知脂肪醛脱氢酶的序列进行比对,在此基础上选择Fast Minimum Evolution方法绘制进化树,Max Seq Difference选定为0.75,Distance选定为Grishin (protein);氨基酸序列相似性分析用DNAMAN软件中的两序列比对功能完成。
1.3 敲除质粒的构建 基因敲除策略参照文献[10]。以CtAld1基因的敲除质粒的构建为例,如图 2所示,根据预测的醛脱氢酶基因的序列设计引物Ald11F和Ald11R,以热带假丝酵母ATCC 20336基因组DNA为模板,PCR扩增得到醛脱氢酶基因,通过TA克隆连接到pMD19-T (Simple)上,所得质粒命名为Ts-CtAld11;以Ts-CtAld11质粒为模板,设计引物ReAld11F和ReAld11R,反向PCR获得携带同源臂的载体片段CtAld11U-Ts-CtAld11D,同时分别在两端引入酶切位点Pst Ⅰ和Xba Ⅰ,将得到的片段和和质粒Tm-gda324-URA3用上述两种酶消化,纯化CtAld11U-Ts-CtAld11D片段和gda324-URA3片段,最后将这2个片段连接,获得CtAld1敲除质粒Ts-CtAld11-gda324-URA3。以该质粒为模板,Ald11F和Ald11R为引物进行PCR可获得CtAld1的敲除盒片段。第2个CtAld1基因敲除质粒选用CtAld1内侧基因序列构成同源臂,构建基因敲除质粒Ts-CtAld12-gda324-URA3。CtAld2基因敲除质粒Ts-CtAld21-gda324-URA3和Ts-CtAld22-gda324- URA3的构建流程与上述过程类似。
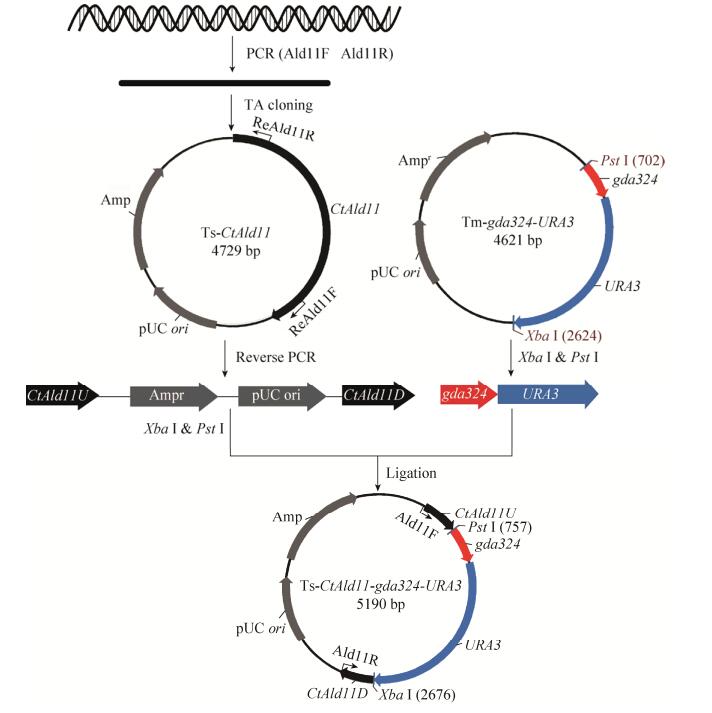 |
| 图 2 敲除质粒Ts-CtAld11-gda324-URA3的构建 Figure 2 Construction of CtAld1 disruption plasmid Ts-CtAld11-gda324-URA3. |
| 图选项 |
1.4 热带假丝酵母脂肪醛脱氢酶基因的敲除 热带假丝酵母转化方法参照文献[9]。本研究以尿嘧啶缺陷型菌株XZX为出发菌株,转化敲除盒片段,实现目的基因的敲除;以URA3基因为标记基因,用不含尿嘧啶的MM培养基筛选转化子,提取转化子基因组并通过PCR鉴定转化子基因型。得到阳性转化子后,在5-FOA培养基平板上筛选消去标记基因URA3的菌株,以便循环利用URA3基因作为筛选标记进行基因的连续敲除。
1.5 脂肪醛脱氢酶酶活力测定 脂肪醛脱氢酶酶活测定方法在参考文献[7]基础上有所改动。菌株单菌落用SM培养基在30 ℃和200 r/min条件下培养36 h后,转接到新鲜的SM培养基,以2% (V/V)终浓度的量添加十二烷,培养20 h。取4 mL菌液离心收集细胞,用PBS缓冲液洗2次后,悬浮在缓冲液(25 mmol/L HEPES,100 mmol/L KCl,10%甘油,1 mmol/L二硫苏糖醇,用5 mol/L NaOH溶液调节pH至7.3)中,加入0.45–0.50 mm直径的玻璃珠后超声波破碎,每分钟不间歇超声30 s,共30 min。破碎液在4 ℃下1000×g离心10 min,离心2次。取上清液,加入终浓度为1% (V/V)吐温80,冰上放置20 min后,在4 ℃下13000×g离心10 min。上清液作为粗酶液用于酶活测定,粗酶液中总蛋白量用Bradford法测定。
十二醛以终浓度1 mmol/L的量与M缓冲液[25 mmol/L HEPES,100 mmol/L甘氨酸,0.25% (V/V)吐温80,用5 mol/L NaOH调节pH至7.3]混合,室温下超声处理1 min。取140 μL该混合液、10 μL粗酶液和50 μL 4 mmol/L NAD+ (用M-buffer配制)溶液混合,30 ℃保温反应45 min。于340 nm处测吸光值。NADH的消光系数为6.22 L/mmol,1个酶活单位(U)定义为每分钟催化生成1 μmol的NADH的酶量。
1.6 基因敲除菌株生长评价 菌株单菌落用SM培养基培养36 h后,取适量种子液转接到SM培养基中,控制初始OD600在0.10–0.15间,之后每8 h取样测OD600。
菌株单菌落用SM培养基培养36 h后,取适量菌液接种到SM培养基中,加入终浓度为2% (V/V)的月桂酸甲酯或十二烷,培养36 h后,取适量菌液离心收集菌体,水洗1次后用无菌水重悬,将重悬后的菌液接种到C+培养基中,控制初始OD600在0.10–0.15间,之后每24 h取样测OD600。
1.7 菌株二元酸发酵 发酵实验流程参考文献[11]。从甘油管中接种200 μL菌液至SM培养基,并添加2% (V/V)十二烷,30 ℃、200 r/min培养48 h后,按10%接种量转接至发酵培养基中,发酵开始。60 h将发酵液pH调至6.0左右,72 h将pH调至7.2左右,之后每隔12 h调pH至7.2左右,每24 h补糖1次。72 h和120 h补加十二烷2% (V/V)。发酵周期165 h。发酵液中二元酸浓度用0.05 mol/L氢氧化钠溶液滴定测定[12]。
2 结果和分析 2.1 热带假丝酵母长链脂肪醛脱氢酶基因序列分析 对热带假丝酵母ATCC 20336菌株全基因组序列进行分析,发现其中5对等位基因可能编码醛脱氢酶,将其命名为CtAld1、CtAld2、CtAld3、CtAld4和CtAld5,它们分别编码668、545、501、167和478个氨基酸。热带假丝酵母代谢烷烃途径与解脂耶氏酵母相似,为挖掘与长链烷烃氧化相关的脂肪醛脱氢酶基因,参考解脂耶氏酵母醛脱氢酶HFD1 (519个氨基酸残基组成,简写为519 aa)、HFD2 (521 aa)、HFD3 (533 aa)和HFD4 (529 aa)的氨基酸序列,以及酿酒酵母ScHFD1 (532 aa)的氨基酸序列,构建进化树如图 3所示,CtAld1和CtAld2与已知的脂肪醛脱氢酶亲缘关系较近。经比对发现CtAld1与HFD1相似度达到45% (225 aa/ 500 aa,表示序列比对覆盖了500个氨基酸残基,其中225个相同),CtAld2与HFD4相似度达到44.60% (227 aa/509 aa)。
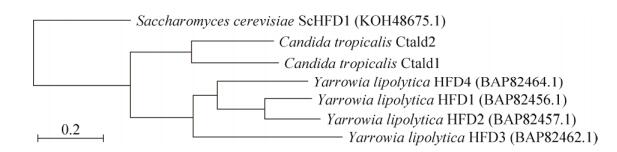 |
| 图 3 来自酿酒酵母、解脂耶氏酵母和热带假丝酵母的醛脱氢酶蛋白的进化树 Figure 3 Phylogenetic tree among the putative fatty aldehyde dehydrogenase proteins in Candida tropicalis and the fatty aldehyde dehydrogenase proteins in other strains including Saccharomyces cerevisiae and Yarrowia lipolytica. The accession numbers of each protein sequences from NCBI are given in brackets. |
| 图选项 |
选择CtAld1、CtAld2、HFD1和HFD4这4个蛋白进行结构域分析(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),发现它们均含有ALDH_ F14-YMR110C保守结构域(NCBI登录号cd07135)。综上,CtAld1和CtAld2基因在热带假丝酵母ATCC 20336中可能编码脂肪醛脱氢酶,影响热带假丝酵母产二元酸的能力。
2.2 脂肪醛脱氢酶基因的敲除 构建了CtAld1和CtAld2两对基因的敲除盒质粒,分别命名为Ts-CtAld11-gda324-URA3、Ts-CtAld12-gda324-URA3、Ts-CtAld21-gda324-URA3和Ts-CtAld22-gda324-URA3。用Pst Ⅰ和Xba Ⅰ双酶切验证显示质粒构建正确(图 4-C)。
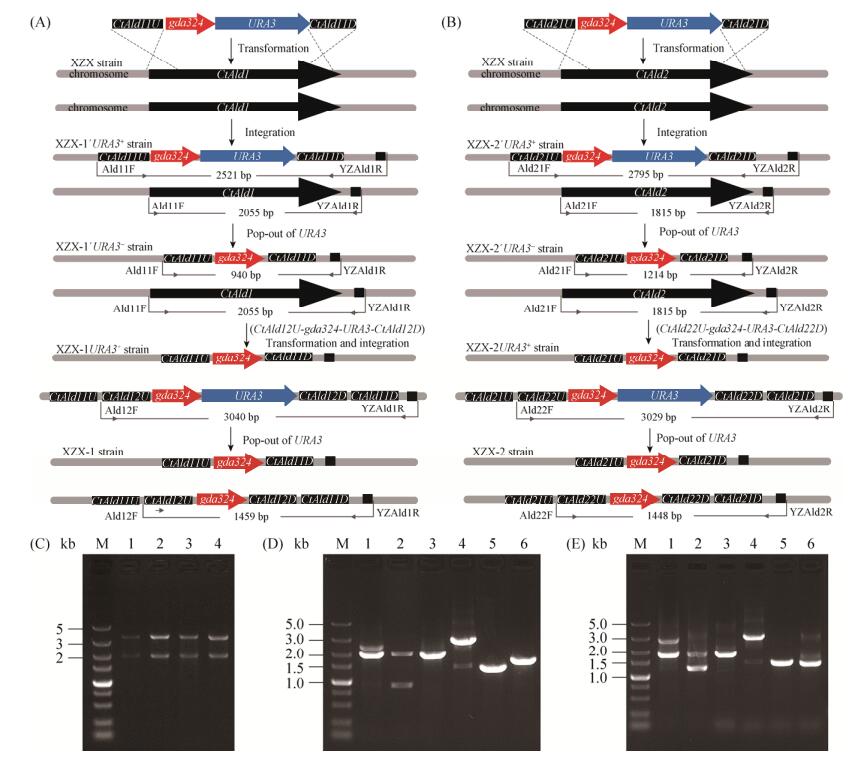 |
| 图 4 脂肪醛脱氢酶基因敲除菌株的构建 Figure 4 Disruption of the CtAld1 or CtAld2 genes in C. tropicalis. A: Scheme of CtAld1 disruption in C. tropicalis and confirmation using PCR. B: Scheme of CtAld2 disruption in C. tropicalis and confirmation using PCR. C: Identification of gene disruption plasmids by restriction endonuclease Pst I and Xba I. Lane M: 5 kb ladder DNA marker; lane 1–4: Ts-CtAld11-gda324-URA3, Ts-CtAld12-gda324-URA3, Ts-CtAld21-gda324-URA3 and Ts-CtAld22-gda324-URA3, respectively. D: Confirmation of CtAld1 disruption in C. tropicalis. The specific size of individual PCR products was shown in Figure 4-A. M: 5 kb ladder DNA marker; lane 1–3: the PCR product using primers Ald11F and YZAld1R, XZX-1′URA3+, XZX-1′URA3– and C. tropicalis XZX as template, respectively; lane 4–6: the PCR product using primers Ald12F and YZAld1R, XZX-1URA3+, XZX-1 and C. tropicalis XZX as template, respectively. E: Confirmation of CtAld2 disruption in C. tropicalis. The specific size of individual PCR products was shown in Figure 4-B. M: 5 kb ladder DNA marker; lane 1–3: the PCR product using primers Ald21F and YZAld2R, XZX-2′URA3+, XZX-2′URA3– and C. tropicalis XZX as template, respectively; lane 4–6: the PCR product using primers Ald22F and YZAld2R, XZX-2URA3+, XZX-2 and C. tropicalis XZX as template, respectively. |
| 图选项 |
基因敲除流程如图 4-A和4-B。以上述敲除盒质粒为模板,用相应的同源臂引物PCR扩增出敲除盒转化热带假丝酵母菌株,长出转化子后,用上游同源臂引物和下游同源臂外侧引物对转化子进行验证(图 4-D,4-E)。最终在热带假丝酵母XZX中实现了CtAld1和CtAld2的敲除,构建了XZX-1 (ura3/ura3 ctald1::gda324/ctald1::gda324CtAld2/ CtAld2)、XZX-2 (ura3/ura3CtAld1/CtAld1 ctald2:: gda324/ctald2::gda324)、XZX-12 (ura3/ura3 ctald1:: gda324/ctald1::gda324 ctald2::gda324/ctald2::gda324)等菌株。
2.3 脂肪醛脱氢酶基因缺失对菌株生长的影响 通过对比出发菌株和基因敲除菌株在不同碳源中的生长状态,初步分析CtAld1和CtAld2基因的特点,结果如图 5所示。在葡萄糖为唯一碳源的培养基中基因敲除菌株(XZX-1、XZX-2和XZX-12菌株)生物量均能够在86 h左右达到较大值,生长状态与出发菌株XZX一致(图 5-A);以十二烷为唯一碳源时,基因敲除菌株和出发菌株延滞期均较长,但96 h后菌株间生长差异逐渐显现并扩大:XZX-1逐渐超过出发菌株XZX,而XZX-2菌株和XZX-12菌株的生长都受到严重抑制,生长144 h时OD600未能达到1,其中XZX-12生长更为缓慢(图 5-B);以月桂酸甲酯为唯一碳源时,所有菌株都能够正常生长,OD600在172 h可达到7左右(图 5-C)。总之,以葡萄糖和月桂酸甲酯为碳源时,基因敲除菌株和出发菌株均能够正常生长,而以十二烷为碳源时,脂肪醛脱氢酶基因的敲除对菌株生长的影响显著。
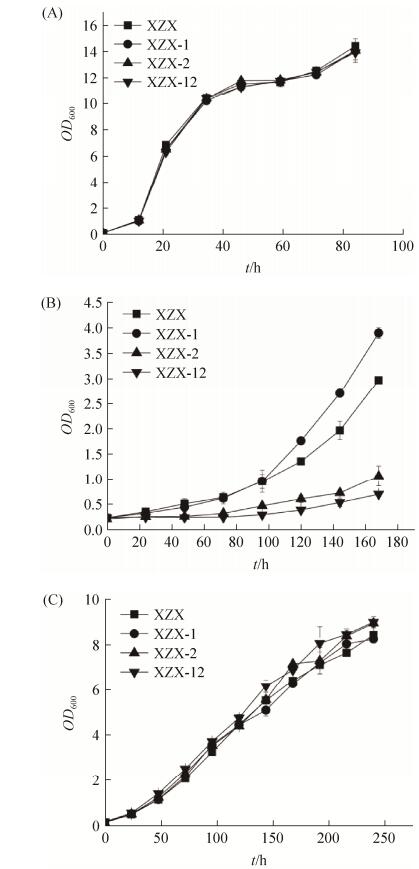 |
| 图 5 CtAld1和CtAld2基因敲除对热带假丝酵母生长的影响 Figure 5 Effect of CtAld1 and CtAld2 disruption on cell growth in different carbon source. A: Glucose as sole carbon source; B: Dodecane as sole carbon source; C: Methyl laurate as sole carbon source. |
| 图选项 |
2.4 脂肪醛脱氢酶基因缺失对菌株十二醛脱氢酶酶活的影响 用十二醛为底物测试XZX、XZX-1、XZX-2和XZX-12菌株的醛脱氢酶活力,比较不同基因敲除菌株的酶活力。发现CtAld2敲除后的菌株XZX-2的醛脱氢酶活性损失严重,比酶活仅为XZX的28.4%;CtAld1的缺失对菌株十二醛脱氢酶的活力影响较小,比酶活较XZX菌株仅降低了14.1%;联合敲除CtAld1和CtAld2基因后,菌株XZX-12中的脂肪醛脱氢酶的活力较XZX-2进一步下降,比酶活仅为出发菌株的20.0%,表明CtAld2基因在热带假丝酵母的十二碳烷烃代谢过程中至关重要,CtAld1基因次之。由此看来,CtAld1和CtAld2可能催化十二醛的氧化(图 6)。
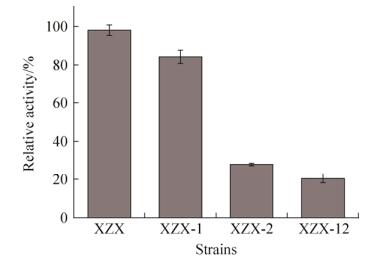 |
| 图 6 CtAld1和CtAld2基因敲除对热带假丝酵母十二醛脱氢酶比酶活的影响 Figure 6 Effect of CtAld1 and CtAld2 disruption on FALDH activity in C. tropicalis. Specific FALDH activity of C. tropicalis XZX as 100%. |
| 图选项 |
2.5 脂肪醛脱氢酶基因缺失对菌株长链二元酸生产能力的影响 本研究出发菌株XZX的二元酸积累的能力较弱[13],为进一步分析CtAld1和CtAld2对热带假丝酵母合成长链二元酸的影响,在肉毒碱酰基转移酶(CAT)基因缺失的热带假丝酵母03菌株中敲除CtAld1和CtAld2,并利用得到的菌株进行二元酸发酵。研究发现敲除CtAld1或CtAld2基因均不利于二元酸的积累,其中CtAld2敲除后对菌株积累二元酸的负影响较CtAld1大;两对基因同时缺失时,菌株产酸能力急剧下降,发酵165 h后二元酸的积累量仅为03菌株的30%左右(图 7)。
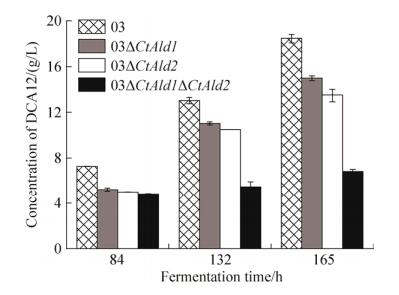 |
| 图 7 CtAld1和CtAld2基因敲除对热带假丝酵母二元酸生产的影响 Figure 7 Effect of CtAld1 and CtAld2 disruption on dodecanedioic acid (DCA12) production in C. tropicalis. |
| 图选项 |
3 讨论 脂肪醛脱氢酶在热带假丝酵母的二元酸生产过程中催化中间产物脂肪醛转化为脂肪酸,生成目的产物的同时避免了醛类对细胞造成伤害。目前以二元酸生产为中心对热带假丝酵母改造的研究热点主要集中在ω-氧化中羟基化反应的增强以及β-氧化通路的阻断[3, 14],关于脂肪醛脱氢酶的研究并不多。为更加深入地了解热带假丝酵母烷烃代谢机制,本文对热带假丝酵母ATCC 20336中脂肪醛脱氢酶基因进行了初步的功能评价。
热带假丝酵母利用烷烃作为唯一碳源进行生长时,先将其氧化为脂肪酸,再通过β-氧化途径分解为乙酰-CoA或丙酰-CoA加以利用,若途径中缺失脂肪醛脱氢酶,势必会影响菌体的生长繁殖。但当月桂酸甲酯为碳源时,热带假丝酵母只需将其水解为脂肪酸,不依赖于特异的醛脱氢酶氧化。本文中,CtAld1和CtAld2的缺失均不影响菌株利用葡萄糖和月桂酸甲酯生长,而CtAld2敲除后菌株利用十二烷生长的能力受到大幅度抑制。相反,CtAld1的敲除促进了细胞在十二烷的生长,这与预期结果有所不同。分析CtAld1氨基酸序列(https://ihg.gsf.de/ihg/mitoprot.html),发现CtAld1 N端44个氨基酸残基组成的肽段可能引导CtAld1在细胞的线粒体中聚集[15],部分预测参数见表 2。
表 2. CtAld1亚细胞定位预测参数 Table 2. Prediction for CtAld1 subcellular localization
| Computed parameters | Values |
| Analyzed regions | 47 |
| Cleavage site | 45 |
| Cleaved sequence | MSKSYKLPKSSISPIVKGKTSAKSSKSSKTPSPPPSGSPPTSRI |
| Probability of export to mitochondria | 0.8048 |
表选项
有研究表明,位于线粒体中的脂肪醛脱氢酶参与合成的脂肪酸主要用于脂质的合成,位于过氧化物酶体的脂肪醛脱氢酶参与合成的脂肪酸主要通过β-氧化途径为细胞生长提供能源和碳源[2, 16]。CtAld1可能位于线粒体中,其参与合成的脂肪酸用于合成脂质,将CtAld1基因敲除后,减少了脂质积累,增加了β-氧化途径中脂肪酸的流量,使得菌株生长代谢得更快。单独敲除CtAld1和CtAld2基因特别是CtAld2基因后会降低菌株十二醛脱氢酶的酶活力和十二碳二元酸产量;联合敲除CtAld1和CtAld2后二元酸产量进一步降低,仅为对照菌株的30%左右。综上所述,CtAld1和CtAld2尤其是后者在热带假丝酵母十二碳二元酸的生产途径中具有重要作用,这两对基因可作为热带假丝酵母生产二元酸或脂肪醛衍生物代谢工程改造的潜在靶点。
References
| [1] | Liu SC, Jiao P, Cao ZA. Metabolism and β-oxidation of alkane-utilizing Candida tropicalis. Acta Microbiologica Sinica, 2002, 42(1): 125-128. (in Chinese) 刘树臣, 焦鹏, 曹竹安. 热带假丝酵母代谢烷烃过程中的β-氧化和代谢调控. 微生物学报, 2002, 42(1): 125-128. |
| [2] | Yamada T, Nawa H, Kawamoto S, Tanaka A, Fukui S. Subcellular localization of long-chain alcohol dehydrogenase and aldehyde dehydrogenase in n-alkane-grown Candida tropicalis. Archives of Microbiology, 1980, 128(2): 145-151. DOI:10.1007/BF00406151 |
| [3] | Picataggio S, Rohrer T, Deanda K, Lanning D, Reynolds R, Mielenz J, Eirich LD. Metabolic engineering of Candida tropicalis for the production of long-chain dicarboxylic acids. Nature Biotechnology, 1992, 10(8): 894-898. DOI:10.1038/nbt0892-894 |
| [4] | Craft DL, Madduri KM, Eshoo M, Wilson CR. Identification and characterization of the CYP52 family of Candida tropicalis ATCC 20336, important for the conversion of fatty acids and alkanes to α, ω-dicarboxylic acids. Applied and Environmental Microbiology, 2003, 69(10): 5983-5991. DOI:10.1128/AEM.69.10.5983-5991.2003 |
| [5] | Eirich LD, Craft DL, Steinberg L, Asif A, Eschenfeldt WH, Stols L, Donnelly MI, Wilson CR. Cloning and characterization of three fatty alcohol oxidase genes from Candida tropicalis strain ATCC 20336. Applied and Environmental Microbiology, 2004, 70(8): 4872-4879. DOI:10.1128/AEM.70.8.4872-4879.2004 |
| [6] | Ueda M, Tanaka A. Long-chain alcohol dehydrogenase of Candida yeast. Methods in Enzymology, 1990, 188: 171-175. DOI:10.1016/0076-6879(90)88030-E |
| [7] | Iwama R, Kobayashi S, Ohta A, Horiuchi H, Fukuda R. Fatty aldehyde dehydrogenase multigene family involved in the assimilation of n-alkanes in Yarrowia lipolytica. Journal of Biological Chemistry, 2014, 289(48): 33275-33286. DOI:10.1074/jbc.M114.596890 |
| [8] | Xiang Z, Chen XZ, Zhang LH, Shen W, Fan Y, Lu ML. Development of a genetic transformation system for Candida tropicalis based on a reusable selection marker of URA3 gene. Hereditas, 2014, 36(10): 1053-1061. (in Chinese) 项峥, 陈献忠, 张利华, 沈微, 樊游, 陆茂林. 利用可重复使用的URA3标记基因建立热带假丝酵母基因敲除系统. 遗传, 2014, 36(10): 1053-1061. |
| [9] | Zhang LH, Chen XZ, Chen Z, Wang ZZ, Jiang S, Li L, P?tter M, Shen W, Fan Y. Development of an efficient genetic manipulation strategy for sequential gene disruption and expression of different heterologous GFP genes in Candida tropicalis. Applied Microbiology and Biotechnology, 2016, 100(22): 9567-9580. DOI:10.1007/s00253-016-7762-7 |
| [10] | Wilson RB, Davis D, Enloe BM, Mitchell AP. A recyclable Candida albicans URA3 cassette for PCR product-directed gene disruptions. Yeast, 2000, 16(1): 65-70. DOI:10.1002/(ISSN)1097-0061 |
| [11] | Zhang LH. Development of the genetic manipulation system for Candida tropicalis and its application in dicarboxylic acid production. Master Dissertation of Jiangnan University, 2016. (in Chinese) 张利华. 热带假丝酵母遗传操作系统的建立及在二元酸合成中的应用. 江南大学硕士学位论文, 2016. |
| [12] | Liu SC, Li C, Fang XC, Cao ZA. Optimal pH control strategy for high-level production of long-chain α, ω-dicarboxylic acid by Candida tropicalis. Enzyme and Microbial Technology, 2004, 34(1): 73-77. DOI:10.1016/j.enzmictec.2003.09.001 |
| [13] | Cao ZA, Gao H, Liu M, Jiao P. Engineering the acetyl-CoA transportation system of Candida tropicalis enhances the production of dicarboxylic acid. Biotechnology Journal, 2006, 1(1): 68-74. DOI:10.1002/(ISSN)1860-7314 |
| [14] | Laplaza J, Beardslee T, Eirich D, Picataggio S. Biological methods for preparing a fatty dicarboxylic acid. The United States: WO2014100461A2. 26 June 2014. |
| [15] | Claros MG, Vincens P. Computational method to predict mitochondrially imported proteins and their targeting sequences. European Journal of Biochemistry, 1996, 241(3): 779-786. DOI:10.1111/ejb.1996.241.issue-3 |
| [16] | Tanaka A, Osumi M, Fukui S. Peroxisomes of alkane-grown yeast fundamental and practical aspects. Annals of the New York Academy of Sciences, 1982, 386: 183-199. DOI:10.1111/nyas.1982.386.issue-1 |
