李雪晴, 张嘉仕, 崔堂兵


华南理工大学生物科学与工程学院, 广东 广州 510006
收稿日期:2017-07-15;修回日期:2017-12-24;网络出版日期:2018-01-15
*通信作者:崔堂兵, E-mail:fetbcui@scut.edu.cn
摘要:[目的]构建蜡样芽胞杆菌(Bacillus cereus)ccpA缺失菌株,并初步探索ccpA基因对其碳代谢及氨肽酶生产的影响。[方法]利用温敏型质粒pKSV7构建蜡样芽胞杆菌CZ ccpA基因缺失突变株CZΔccpA,通过回补菌株对敲除株表型进行验证;不同碳源发酵对比菌株碳代谢的变化,进行氨肽酶发酵优化。[结果]成功构建ccpA缺失菌株CZΔccpA与回补菌株CZ1,三株菌在LB培养基中生长无差异;在柠檬酸钠以及甘露低聚糖为碳源时,菌株的代谢产生明显变化;以D-木糖为单一碳源时,氨肽酶的产量提高48.25%。[结论]CZccpA基因对柠檬酸钠、甘露低聚糖、D-木糖为单一碳源时的代谢可能具有调控作用,ccpA基因缺失可以提高蜡样芽胞杆菌CZ的氨肽酶产量。
关键词: 蜡样芽胞杆菌 基因敲除 分解代谢物控制蛋白A 氨肽酶
Effect of ccpA gene on the production of aminopeptidase in Bacillus cereus
Xueqing Li, Jiashi Zhang, Tangbing Cui


School of Biological Science and Bioengineering, South China University of Technology, Guangzhou 510006, Guangdong Province, China
Received 15 July 2017; Revised 24 December 2017; Published online 15 January 2018
*Corresponding author: Tangbing Cui, E-mail: fetbcui@scut.edu.cn
Abstract: [Objective]We constructed Bacillus cereus CZ ccpA deletion strains to explore its effect on carbon metabolism and aminopeptidase production.[Methods]Through homologous recombination mediated by the temperature-sensitive plasmid pKSV7, we acquired the mutant strain CZΔccpA successfully. We also constructed ccpA gene revertant strain CZ1 for phenotypic validation of knockout strains. We compared the metabolic differences of three strains cultured with different carbon source and optimized aminopeptidase fermentation conditions.[Results]The ccpA deletion strain CZΔccpA and the revertant strain CZ1 were successfully constructed. There was no difference in the growth of the three strains in LB medium. When fermented with sodium citrate or mannan oligosaccharides as a single carbon source, the CZΔccpA showed significant metabolic differences from the CZ and CZ1. Besides, the activity of aminopeptidase increased by 48.25 percent when D-xylose was used as the sole carbon source.[Conclusion]Bacillus cereus CZ ccpA gene affects the production of aminopeptidase by regulating the carbon metabolism process and we can raise aminopeptidase production by ccpA gene knockout.
Key words: Bacillus cereus gene deletion mutants catabolite control protein A aminopeptidase
由ccpA基因编码的分解代谢物控制蛋白A (catabolite control protein A,CcpA)是B. subtilis等低GC含量的革兰氏阳性菌中碳代谢的中心调节物,属于LacI/GalR转录调控因子家族,参与约250个基因的调控表达,且该调节既可以是正向调控也可以是逆向调控[1-2]。
CcpA可以介导细胞的碳分解代谢物阻遏(carbon catabolite repression,CCR)[3]效应:当葡萄糖等速效碳源存在时,胞内高浓度的ATP与无机磷酸比例(ATP/Pi)、果糖-1, 6-二磷酸(FBP)及葡萄糖-6-磷酸(G-6-P)会激活HPrK/P(Hpr kinase/phosphoesterase)激酶活性,将HPr (histidine-phosphoryl protein)的丝氨酸残基磷酸化为P-(Ser)-HPr,CcpA在共阻遏物P-(Ser)-HPr的协助下与目的基因的分解代谢反应元件(catabolite responsive element,Cre)位点结合,阻碍非速效碳源的利用[4];最近还发现了新位点Crevar[5],也有些被调控基因未发现结合位点,如alsSD操纵子(编码α-乙酰乳酸合成酶基因AlsS和α-乙酰乳酸脱羧酶基因AlsD)[6],显示了CcpA调控的多样性及精细性。CcpA具有多效性功能,不仅参与CCR效应,还参与中心碳、氮代谢的调控以及生物被膜的形成等。
氨肽酶是一类从多肽链或蛋白质N端选择性切除氨基酸残基,产生游离氨基酸的外切蛋白酶,可用于食品[7]、医疗[8]、生物技术[9]等行业,前景广阔。但由于国内氨肽酶研究起步较晚,几乎没有商业化氨肽酶产生,对氨肽酶的理化性质及应用研究仍处于初始阶段,氨肽酶的调控机制研究也鲜有报道。蜡样芽胞杆菌CZ是实验室自筛野生株,可以产生高活性的胞外氨肽酶,这在目前研究中还比较少见。我们在蜡样芽胞杆菌CZ进行发酵优化[10]时发现在发酵培养基中添加一定浓度谷氨酸,氨肽酶产量可以提高66.67%,而加入相同浓度的谷氨酰胺,它会在代谢过程中逐渐被转化为谷氨酸,产量则提高140%,由于CcpA对谷氨酸合成的促进作用,以及它在碳氮代谢中起到的重要作用,我们尝试对该菌株进行ccpA基因的敲除与回补,试图研究ccpA与氨肽酶调控之间的联系,并进一步提高氨肽酶产量。
1 材料和方法 1.1 材料与试剂
1.1.1 菌株和质粒: 蜡样芽胞杆菌CZ (Bacillus cereus CZ) (实验室自筛野生菌)、大肠杆菌Trans1-T1菌株(北京全式金生物技术有限公司)、JM110 (实验室保存);质粒pKSV7 (实验室保存)、pEASY-Blunt (北京全式金生物技术有限公司)。
1.1.2 培养基: TSB、TSA培养基(杭州微生物试剂有限公司);LB培养基(广东环凯微生物科技有限公司)。Cm LB:含氯霉素5 μg/mL的LB培养基;Amp LB:含有氨苄青霉素50 μg/mL的LB培养基;发酵培养基:D-木糖40 g/L,MgSO4 1 g/L,酵母浸粉10 g/L,尿素15 g/L,K2HPO4 2 g/L,并在第12小时添加5 g/L (NH4)2SO4。
1.1.3 主要试剂: 限制性内切酶、DNA Marker、Prime STAR HS DNA聚合酶、T4连接酶等[TaKaRa(日本)],Hepes (Sigma公司);基因组提取试剂盒[天根生化科技(北京)有限公司],质粒抽提试剂盒(广州艾基生物技术有限公司),琼脂糖凝胶DNA回收试剂盒[宝生物工程(大连)有限公司];溶菌酶、氯霉素(Cm)等其他生物试剂(广州华奇盛生物科技有限公司)。
1.1.4 仪器设备: PCR仪Thermo Fisher scientific公司,电转仪Bio-Rad公司,离心机Eppendorf公司。
1.2 引物设计与测序 根据CZ菌株16S rDNA的测序结果,与NCBI数据库比对,以GenBank公布的蜡样芽胞杆菌ATCC 14579菌株基因序列为模板设计引物,完成了CZ ccpA及其上下游序列的测序。根据质粒pKSV7及ccpA基因序列设计了引物A-F、A-R,B-F、B-R,其他引物根据CZ ccpA及其上下游序列的测序结果设计。
本研究所有引物合成及测序工作均由广州艾基生物技术有限公司完成。引物具体序列见表 1。
表 1. 本研究所使用的引物 Table 1. Primers used in this study
| Primer name | Sequence (5′→3′) |
| ccpA-F | CACGATGAACGTAACAATCTATGA |
| ccpA-R | ACTCAGGTTACTTCGTTGAATCTCT |
| ccpA-UF | CGGGTCTATCAGCAACGATTGAAG |
| ccpA-UR | GCGAGATACGGTAGCCATTGAAAC |
| ccpA-DF | GCTCTGTTATCTTACCTCACCGT |
| ccpA-DR | GTAGGCTAACTTCATCCAAACAAT |
| UP-Hind Ⅲ | CTAAGCTTCTACAGGGCGACGTGACCTT |
| UP-R | GAGCTTTTTTATACCTCATCGCACACTCCT |
| DOWN-F | GTGCGATGAGGTATAAAAAAGCTCAC |
| DOWN-EcoR Ⅰ | CAGAATTCACGAAACGATGGTAGAGGGA |
| A-F | AGGGTTTTCCCAGTCACGA |
| A-R | AACTCTTTCTCTTTGTTTTGGTCAG |
| B-F | ACCTCACCGTATCCAATTTAGAGAT |
| B-R | AACTTCACACAGGAAACAGCTATGA |
| ΔccpA-F | ATTTTATGTGAACGAGGTATT |
| ΔccpA -R | AACAAGGAATAGCCCCATCT |
| CZ1-F | TATTTTATGTGAACGAGGTATT |
| CZ1-R | CGTAATTATCCAAAGAACGATCATC |
| M13R | CAGGAAACAGCTATGAC |
| M13F | GTAAAACGACGTCCAGT |
表选项
1.2.1 基因组DNA的提取: 收集1.5–2.0 mL过夜培养的蜡样芽孢杆菌CZ,使用20 mg/mL溶菌酶破壁消化30 min后,按照细菌DNA小提试剂盒指导抽提,–20 ℃冻存。
1.2.2 ccpA基因及其上下游片段的获取: 以CZ基因组DNA为模板,以ccpA-F以及ccpA-R为模板扩增ccpA基因片段,反应条件:98 ℃ 3 min;98 ℃ 10 s,54 ℃ 15 s,72 ℃ 1 min,共30循环;最后72 ℃ 10 min。连接至pEASY-Blunt克隆载体,并转化Trans1-T1感受态,筛选单克隆,送至公司测序。
按照同样方法,获得ccpA上下游序列。利用NCBI进行序列分析。
1.3 蜡样芽胞杆菌CZccpA基因敲除突变株的构建
1.3.1 敲除质粒pKSV7-UD的构建: 首先以引物UP-Hind Ⅲ/UP-R以及DOWN-F/DOWN-EcoRⅠ分别扩增ccpA上下游同源臂,利用重叠PCR[11]进行同源臂拼接,拼接后的同源臂经EcoRⅠ与Hind Ⅲ双酶切后连接至pKSV7,转JM110去甲基化,测序后抽提高浓度质粒保存于–20 ℃备用。
1.3.2 pKSV7-UD质粒的电转化与突变菌株的筛选: 在Turgeon N[12],Peng D[13]等方法基础上进行条件摸索。将敲除载体pKSV7-UD以电转化方式转入CZ感受态细胞中,转化子在42 ℃ Cm LB培养基培养12 h,并转接19次,每12 h转接1次(下同),使其发生第1次单交换,质粒重组到基因组;30 ℃ LB培养基转接3–4次,最后42 ℃ LB培养基转接30次,使其发生第2次单交换并丢失质粒。此过程可能发生同源重组,同源臂替换了原本的基因序列,获得ccpA缺失菌株,也可能恢复为野生型(图 1-A);稀释105–107涂LB平板,并以此为母板挑单菌落分别点在Cm平板与LB平板相同位置,在Cm平板不生长,LB平板上生长的单菌落即为疑似缺失突变株,扩大培养后接种到Cm LB平板以及Cm LB液体培养基中,排除假阳性。
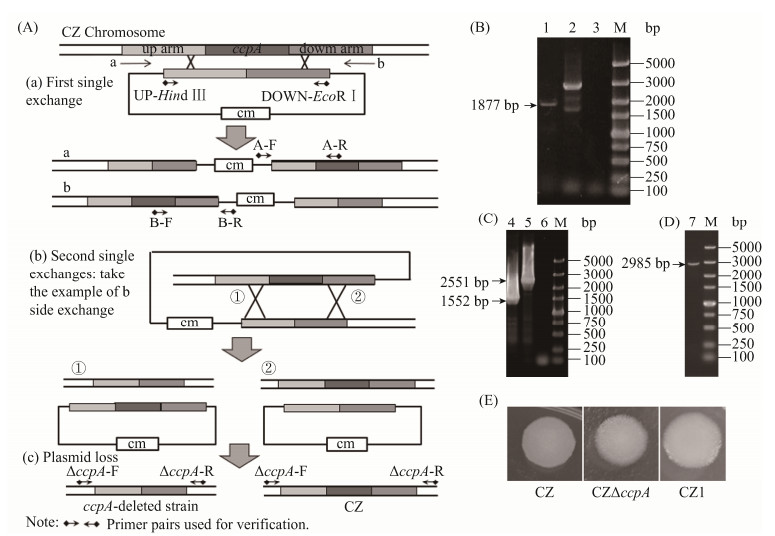 |
| 图 1 敲除及回补菌株验证 Figure 1 Verification of ccpA mutation and complementation. All ccpA gene was deleted. A: gene knockout principle of ccpA. B: PCR amplification result using primers ccpA-F/R of ccpA knockout strain. lane 1, ccpA knockout strain; lane 2, negative control using CZ genome; lane 3, blank control, without DNA. C: PCR confirmation using primers UP-Hind Ⅲ, DOWN-EcoR Ⅰ of complementation strain. Lane 4, CZΔccpA; lane 5, complementation strain CZ1; lane 6, blank control, without DNA. D: PCR confirmation using primers CZ1-F/R of complementation strain. Lane 7: CZ1; M, DL5000 marker. E: Morphology of strains CZ, CZΔccpA and CZ1. |
| 图选项 |
确定无Cm抗性的克隆子,提基因组后用引物对ΔccpA-F、ΔccpA-R进行鉴定,若得到2876 bp条带则为恢复野生株,若得到1877 bp条带则为缺失突变株CZΔccpA,测序确认。
1.4 蜡样芽胞杆菌ccpA基因敲除回补株的构建 以CZ基因组为模板,使用UP-Hind Ⅲ、DOWN-EcoRⅠ引物对扩增ccpA及其上下游序列共2551 bp,双酶切后连接pKSV7并转化至JM110细胞,获得敲除回补载体pKSV7-ccpA,用CZΔccpA缺失突变株突变制备感受态并进行转化筛选,方法同上。使用UP-Hind Ⅲ,DOWN-EcoRⅠ以及CZ1-F、CZ1-R双引物回补验证,并送测序确认。
1.5 细菌的发酵特性及产酶优化
1.5.1 细菌生长曲线的测定: 将野生型菌株CZ、缺失突变株CZΔccpA、回补株CZ1平板划线培养,分别挑取单菌落接种于LB培养基,37 ℃振荡培养12–14 h后,转接至新鲜LB液体培养基,使初始OD600为0.35左右。每隔1 h测定1次OD600,平台期后每隔12 h测定1次,记录细菌生长情况。每个实验组3个平行。
1.5.2 氮源浓度对生长及产酶的影响: 探索ccpA基因缺失是否影响菌株氮代谢及产酶量。以尿素为氮源,浓度分别为2、8、10、15、20 g/L进行发酵,测定OD600及酶活,确定最佳氮源浓度。
1.5.3 ccpA缺失对碳源代谢影响以及最佳发酵碳源的确定: 以1.5%尿素为氮源,使用D-木糖、L-阿拉伯糖、D-甘露糖、D-葡萄糖等9种碳源以4%浓度进行发酵,连续测定发酵过程生物量变化、pH变化以及氨肽酶酶活。
1.5.4 D-木糖浓度对氨肽酶产量的影响: 以1.5%尿素为氮源,使用1%、2%、3%、4%、5%、6%、7%、8%浓度D-木糖为单一碳源,其他成分不变进行发酵。重复3次,测定氨肽酶酶活。
1.5.5 定时取样试验: 使用4% D-木糖为碳源,1.5%尿素为氮源,其他成分不变,进行发酵,每隔12 h取样测定酶活。
1.5.6 氨肽酶酶活测定方法[14]: 取适量发酵液,5000 r/min、4 ℃离心10 min,弃沉淀,保存上清液测定酶活。取上清50 μL,加入600 μL pH 9.0的50 mmol/L Tris-HCI缓冲液,58 ℃预热5 min,加入50 μL 26 mmol/L LNA (L-Leucine-p-nitroanilide)溶液,对照组加等量蒸馏水,58 ℃水浴反应10 min后立即冰浴5 min结束反应。
酶活定义:在最适条件下,将每分钟生成1 μg p-NA (p-nitroaniline)所消耗的酶量定义为1个酶活单位。
2 结果和分析 2.1 CZΔccpA及CZ1菌株筛选 基因敲除原理见图 1-A,将质粒pKSV7-UD转入CZ感受态后,经过2次单交换,挑取单克隆3168株,获得25个疑似阳性克隆,使用ΔccpA-F、ΔccpA-R引物对扩增验证并送测序后鉴定有17株为敲除菌株(图 1-B),同源重组率约为0.54%。
ccpA回补原理与敲除原理相同,将回补载体pKSV7-ccpA转入CZΔccpA感受态细胞并诱导重组后,使用引物对UP-Hind Ⅲ、DOWN-EcoRⅠ进行PCR扩增,回补株获得2551 bp条带,CZΔccpA扩增出1552 bp条带,而单交换菌株及转化株会同时扩增出这两条带(图 1-C);挑选只有2551 bp条带的菌株,再使用CZ1-F、CZ1-R验证,若扩增出2985 bp条带则是正确回补了ccpA基因的菌株CZ1(图 1-D),测序做最后验证。回补平板上选取800株进行筛选,获得3株回补株,重组率约为0.38%。
2.2 CZ、CZ△ccpA、CZ1生长曲线测定 按照1.5.1所述方法测定3株菌的生长曲线。从适应期到进入平台期,菌株的生长代谢较快,1 h测定1次,如图 2-A。该菌株的适应期为0–1 h,1–12 h为指数生长期,之后进入平台期(图 2-B)。在该图中,第1次取样时菌株处在指数生长期,而第2次取样时已经进入衰亡期,所以该图中没有体现出平台期。将图 2-A与2-B结合来看,3株菌在LB培养基中整个生长时期都没有明显差异,ccpA基因缺失对菌株生长活力基本无影响。
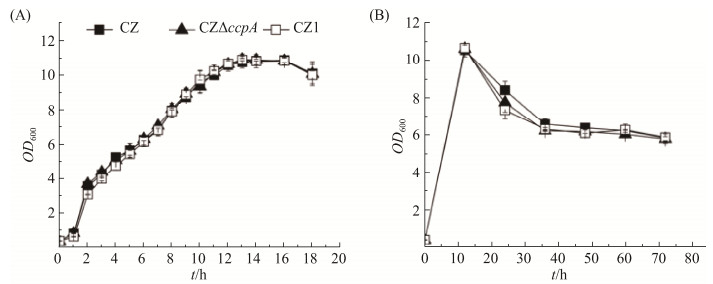 |
| 图 2 三株菌的生长曲线图 Figure 2 Growth curve of three strains. Data are shown as means±SD. A: the growth curve of 18 hours, measured every hour; B: the growth curve of 72 hours, measured every 12 hours. |
| 图选项 |
2.3 氮源对菌株发酵的影响
2.3.1 氮源浓度对菌株生物量的影响: 对ccpA基因进行敲除后,前期以蛋白胨为氮源进行发酵,3株菌在生长及发酵过程中无明显差异,结合实验室前期工作经验[10],该实验更换了成分简单明晰的尿素为氮源,并在摸索尿素添加浓度的过程中发现(图 3):固定碳源浓度为4%,当氮源浓度为0.2%–0.8%时,3株菌均在发酵36 h时达到最大生物量,但回补株CZ1的最大生物量始终低于同氮源浓度培养下的野生型CZ,由于回补株与野生型在基因与培养方式上完全相同,所以推测这与两次电击对回补株造成的损伤有关。0.2%尿素培养时,野生型CZ与缺失突变株CZΔccpA差异不明显;0.5%尿素时,野生型CZ的生长受到一定抑制,最大生物量只能达到15.36,而敲除株生长被促进,最大生物量达到19.22;0.8%尿素培养时,野生型与回补株生长被进一步抑制,而缺失突变株生物量与0.5%尿素培养时没有明显区别。说明CcpA参与了氮代谢的调控,ccpA缺失一定程度上解除了高浓度氮源对菌株生长代谢的抑制,这对于促进菌体生长、获得较大生物量有一定积极作用。
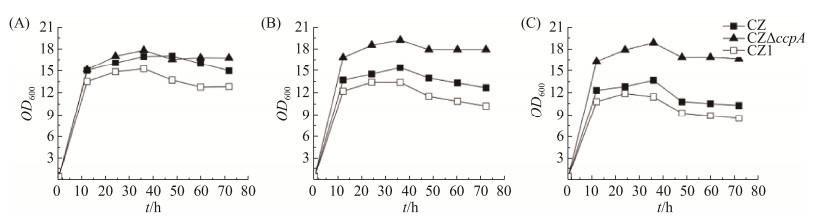 |
| 图 3 不同浓度氮源对菌体生物量的影响 Figure 3 Effects on biomass of different concentrations of nitrogen sources. A: 0.2% concentration of urea; B: 0.5% concentration of urea; C: 0.8% concentration of urea. |
| 图选项 |
2.3.2 氮源浓度对菌株产酶的影响: 测定了不同浓度尿素发酵时氨肽酶活,确定发酵的最佳尿素浓度为1.5%,超过该浓度,产酶下降。使用较高浓度尿素发酵时,更能体现ccpA缺失对氨肽酶发酵的优势,即0.5%–2.0%尿素浓度下,浓度越高,缺失突变株CZ△ccpA与野生型、回补株在同一氮源浓度下的酶活差异越大(图 4)。
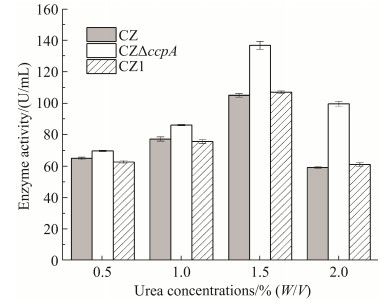 |
| 图 4 不同浓度尿素的发酵结果 Figure 4 Fermentation result with different concentrations of urea. Data are shown as means±SD. |
| 图选项 |
2.4 碳源对菌株发酵的影响
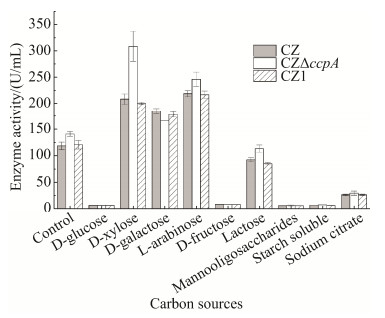
2.4.1 不同碳源发酵时的生物量、pH以及酶活测定[15]: 使用9种碳源以4%浓度进行发酵,在96 h内连续测定发酵过程中生物量、pH变化(图 5)并进行酶活测定(图 6)。
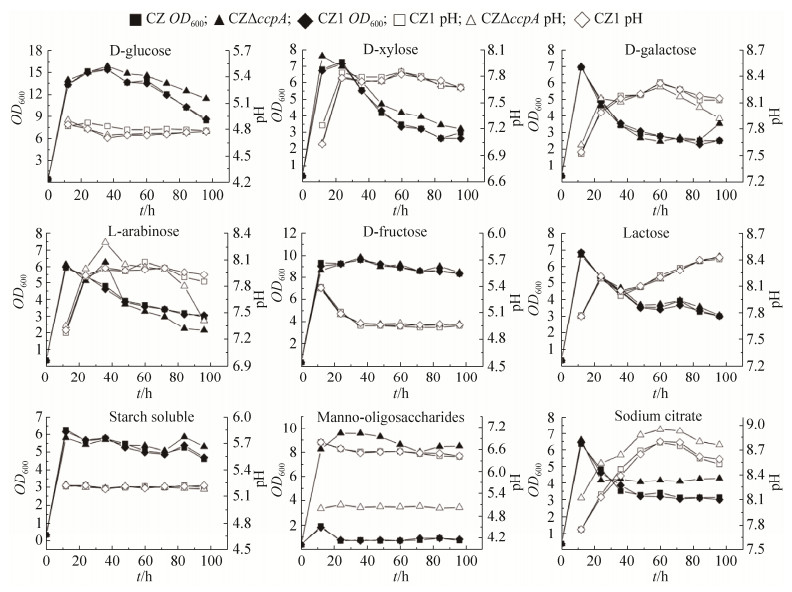 |
| 图 5 不同碳源发酵的生物量及pH变化 Figure 5 Biomass and pH changes in different carbon sources during fermentation. |
| 图选项 |
 |
| 图 6 不同碳源发酵产酶情况 Figure 6 Enzyme production fermented with different carbon sources. Data are shown as means±SD. |
| 图选项 |
细菌利用不同碳源,会激活不同的代谢途径和生理活动,同时产生不同的代谢产物,因而比较同一菌株在不同碳源下的发酵情况会有较大pH、生物量、酶活等的差异,为了研究ccpA缺失带来的影响,我们重点分析同一碳源下野生型、缺失突变株与回补株之间的差异。
ccpA缺失后,菌株利用柠檬酸钠、甘露低聚糖的代谢过程出现了明显变化。当以甘露低聚糖为碳源进行发酵时,野生型CZ及回补株CZ1在OD600达到2.0左右迅速死亡,而缺失突变株CZΔccpA则正常生长,可能是野生型CZ及回补株CZ1在利用甘露低聚糖的过程产生了某些对菌株生长不利的毒力因子造成的,已经有文献报道CcpA蛋白可以直接激活毒性基因的表达[16]。以柠檬酸钠为碳源进行发酵,缺失突变株CZΔccpA的pH始终比野生型CZ、回补株CZ1高0.3左右,且36 h后CZΔccpA生物量显著高于CZ、CZ1。由于柠檬酸钠代谢主要依靠TCA循环,推断ccpA缺失影响了菌株的TCA循环过程,Kim等[17]和Asai等[18]的研究表明ccpA缺失会提高TCA循环的表达量。此外,EMP与TCA通量的改变会影响碳溢流通量,引起乳酸等代谢废物改变,从而造成pH变化[15],这也解释了为什么柠檬酸钠发酵时pH改变;此外,以D-木糖以及L-阿拉伯糖为碳源发酵时,缺失突变株的pH及生物量在衰亡期与野生型及回补株也产生了差异,这与dVM Van[19]、Schmiedel等[20]的研究结果一致:木糖、阿拉伯糖操纵子受到CcpA的调控作用,抑或该菌株的磷酸戊糖途径受到CcpA调控。由该图还可看出ccpA缺失对于延缓菌株衰亡速度、延长菌株发酵时间具有一定积极作用。
以不添加碳源作为对照,实验组为4%碳源浓度,发酵84 h (图 6)发现:使用D-木糖、L-阿拉伯糖及D-半乳糖为碳源进行发酵可以促进氨肽酶生产,柠檬酸钠为碳源则抑制产酶;D-果糖、D-葡萄糖、乳糖、甘露低聚糖、可溶性淀粉发酵则几乎不产酶,该产酶发酵条件表明,氨肽酶CZ所产的氨肽酶是诱导酶。诱导酶的合成受到环境中诱导物与基因的双重控制,所以即使某些碳源发酵时生物量很高(图 5),但不存在诱导物(直接碳源或代谢物),也不产生氨肽酶。在促进产酶的碳源中,以D-木糖及L-阿拉伯糖为碳源时,ccpA基因缺失促进产酶,其中D-木糖的促进作用更为显著,比野生型酶活提高48.25%,可达308.80±28.44 U/mL但当以D-半乳糖发酵时,ccpA缺失则不利于氨肽酶的产生;另外结合图 5结果发现,发酵液pH在7.5–7.8时更有利于氨肽酶的产生,pH过低或过高都会对氨肽酶生产产生不利影响。
2.4.2 D-木糖浓度对氨肽酶产量的影响: 使用1%–8% D-木糖发酵培养基发酵72 h,三株菌均以4% D-木糖发酵时产酶最高,5% D-木糖发酵产酶量急剧下降,当碳源浓度达到8%,菌株不能生长;对比同碳源浓度时三株菌产酶发现,当D-木糖浓度在1%–6%之间时,缺失突变株产酶均高于野生型与回补菌株,当D-木糖浓度达到7%时,ccpA缺失与同碳源浓度的野生株相比已经不具有产酶优势(图 7)。综上,利用缺失突变株CZΔccpA以4% D-木糖为碳源最适宜氨肽酶发酵。
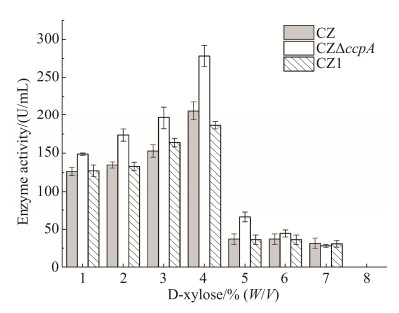 |
| 图 7 不同浓度D-木糖发酵酶活测定 Figure 7 The enzyme activity of CZ, CZΔccpA and CZ1 with different concentrations of D-xylose. Data are shown as means±SD. |
| 图选项 |
2.4.3 不同发酵时间对氨肽酶产量的影响: 使用4% D-木糖、1.5%尿素进行发酵,野生型CZ酶活在发酵48 h达到最大后缓慢下降;而CZΔccpA菌株酶活在48 h后仍然缓慢增长,直至84 h时达到最大酶活304.32±5.27 U/mL (图 8)。
 |
| 图 8 不同发酵时间酶活测定 Figure 8 The enzyme activity of CZ, CZΔccpA and CZ1 in different time. Data are shown as means±SD. |
| 图选项 |
3 讨论 很多食品的加工以往通过理化方法去除苦味或者使用添加剂掩盖苦味,而氨肽酶水解去除苦味不仅高效,作用条件温和,且可以改善风味,提高营养价值[21]。在国外已经可以利用乳酸菌等生产氨肽酶,而氨肽酶的国产化应用几乎为零,多使用NOVO公司的风味酶Flavorzyme进行研究,它是氨肽酶与蛋白酶的复合物,广泛用于蛋白水解实验中,价格昂贵。魏亚娟[22]对一株野生菌进行发酵优化,使氨肽酶酶活达到3685.6 U/mL,这是国内氨肽酶酶活最高的研究报道。而国内其他关于氨肽酶的研究,酶活多为1–300 U/mL,还远达不到工业生产的标准,所以研究氨肽酶产生的调控机制、设法提高氨肽酶产量、降低其生产成本是非常有必要的。
利用基因重组敲除蜡样芽胞杆菌CZ ccpA基因,得到ccpA缺陷的蜡样芽胞杆菌CZΔccpA,为进一步研究ccpA与氨肽酶调控机制之间的关系奠定了基础。蜡样芽胞杆菌CcpA对菌株EMP与TCA途径有调控作用[19],有研究表明CcpA激活EMP途径,降低TCA通量[17-19];调控氮代谢,提高菌株对高浓度氮源的耐受力。另外优化了CZΔccpA的发酵条件:以4% D-木糖为单一碳源,使用1.5%尿素为氮源,发酵84 h,缺失突变株酶活可达337.24 U/mL。由于CZ菌株氨肽酶基因中没有明显的Cre[23]或Crevar[5]位点,我们推测CcpA通过影响碳氮代谢影响氨肽酶产生(图 9)。在谷胱甘肽通路中,谷氨酸是氨肽酶催化的间接底物,直接底物是L-半胱氨酰甘氨酸,它只能由谷胱甘肽代谢生成,高浓度谷氨酸可能促进谷胱甘肽正向生产。另一方面,谷氨酸是γ-谷氨酰转肽酶催化的产物,谷氨酸浓度过高可能抑制γ-谷氨酰转肽酶的活性,使氨肽酶底物L-半胱氨酰甘氨酸的量不足,所以谷氨酸浓度或者谷氨酸与L-半胱氨酰甘氨酸之间的浓度比对氨肽酶可能存在某种反馈调节,在谷氨酸或者他们之间的比值维持合理水平时,氨肽酶的产量会更高。谷氨酸的生物合成是连接碳代谢及氮代谢的纽带,参与谷氨酸生物合成的谷氨酸合成酶由gltAB操纵子编码,ccpA缺失会造成gltAB操纵子表达量不足,使得谷氨酸含量降低[1],在ccpA缺失菌发酵培养基中以非PTS糖类为碳源会诱导gltAB操纵子表达,而PTS糖类碳源则不会[2],我们推测ccpA缺失后,加入非PTS碳源(D-木糖、L-阿拉伯糖)使得谷氨酸与L-半胱氨酸谷氨酸的量维持了一个合理的水平,从而促进了氨肽酶的产生,这也解释了图 6中使用D-木糖、L-阿拉伯糖与乳糖发酵时缺失突变株酶活高于野生型,D-半乳糖发酵则为野生型酶活较高的原因。由于ccpA与氨肽酶调控机制之间的研究尚无报道,以上推论还需要进一步展开研究。该研究为野生型菌株改造、提高氨肽酶产量提供了一种新思路。
 |
| 图 9 谷胱甘肽代谢通路图(部分) Figure 9 Glutathione metabolic pathway map (partial). The map based on the glutathione metabolic process in the KEGG database. |
| 图选项 |
References
| [1] | Moreno MS, Schneider BL, Maile RR, Weyler W, Saier Jr MH. Catabolite repression mediated by the CcpA protein in Bacillus subtilis:novel modes of regulation revealed by whole-genome analyses. Molecular Microbiology, 2001, 39(5): 1366-1381. DOI:10.1111/j.1365-2958.2001.02328.x |
| [2] | Wacker I, Ludwig H, Reif I, Blencke HM, Detsch C, Stülke J. The regulatory link between carbon and nitrogen metabolism in bacillus subtilis:regulation of the gltAB operon by the catabolite control protein CcpA. Microbiology, 2003, 149(Pt 10): 3001-3009. |
| [3] | G?rke B, Stülke J. Carbon catabolite repression in bacteria:many ways to make the most out of nutrients. Nature Reviews Microbiology, 2008, 6(8): 613-624. DOI:10.1038/nrmicro1932 |
| [4] | Shivers RP, Dineen SS, Sonenshein AL. Positive regulation of Bacillus subtilis ackA by CodY and CcpA:establishing a potential hierarchy in carbon flow. Molecular Microbiology, 2006, 62(3): 811-822. DOI:10.1111/mmi.2006.62.issue-3 |
| [5] | Yang Y, Zhang L, Huang H, Yang C, Yang S, Gu Y, Jiang W. A flexible binding site architecture provides new insights into CcpA global regulation in Gram-positive bacteria. mBio, 2017, 8(1): e02004-16. |
| [6] | Turinsky AJ, Moir-Blais TR, Grundy FJ, Henkin TM. Bacillus subtilis ccpA gene mutants specifically defective in activation of acetoin biosynthesis. Journal of Bacteriology, 2000, 182(19): 5611-5614. DOI:10.1128/JB.182.19.5611-5614.2000 |
| [7] | Fu J. Research progress of exopeptidases in foods. Food Science, 2013, 34(7): 349-354. (in Chinese) 付静. 食品外肽酶的研究进展. 食品科学, 2013, 34(7): 349-354. DOI:10.7506/spkx1002-6630-201307074 |
| [8] | Gao YD. Types of leucine aminopeptidase and clinical application. International Journal of Laboratory Medicine, 2010, 31(12): 1408-1410. (in Chinese) 高应东. 亮氨酸氨肽酶的种类及临床应用. 国际检验医学杂志, 2010, 31(12): 1408-1410. DOI:10.3969/j.issn.1673-4130.2010.12.032 |
| [9] | Waditee-Sirisattha R, Hattori A, Shibato J, Rakwal R, Sirisattha S, Takabe T, Tsujimoto M. Role of the Arabidopsis leucine aminopeptidase 2. Plant Signaling & Behavior, 2011, 6(10): 1581-1583. |
| [10] | 张金虎. 蜡状芽孢杆菌CZ发酵生产氨肽酶的过程调控. 华南理工大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1014151374.htm |
| [11] | Heckman KL, Pease LR. Gene splicing and mutagenesis by PCR-driven overlap extension. Nature Protocols, 2007, 2(4): 924-932. DOI:10.1038/nprot.2007.132 |
| [12] | Turgeon N, Laflamme C, Ho J, Duchaine C. Elaboration of an electroporation protocol for Bacillus cereus ATCC 14579. Journal of Microbiological Methods, 2006, 67(3): 543-548. DOI:10.1016/j.mimet.2006.05.005 |
| [13] | Peng D, Luo Y, Guo S, Zeng H, Ju S, Yu Z, Sun M. Elaboration of an electroporation protocol for large plasmids and wild-type strains of Bacillus thuringiensis. Journal of Applied Microbiology, 2009, 106(6): 1849-1858. DOI:10.1111/jam.2009.106.issue-6 |
| [14] | Lin LL, Hsu WH, Wu CP, Chi MC, Chou WM, Hu HY. A thermostable leucine aminopeptidase from Bacillus kaustophilus CCRC 11223. Extremophiles, 2004, 8(1): 79-87. DOI:10.1007/s00792-003-0364-1 |
| [15] | Ying M, Ban R. Knockout of the ccpA gene in Bacillus subtilis and influence on riboflavin production. Acta Microbiologica Sinica, 2006, 46(1): 23-27. (in Chinese) 应明, 班睿. 枯草芽孢杆菌ccpA基因敲除及对其核黄素产量的影响. 微生物学报, 2006, 46(1): 23-27. |
| [16] | Poncet S, Milohanic E, Mazé A, Nait Abdallah J, Aké F, Larribe M, Deghmane AE, Taha MK, Dozot M, De Bolle X, Letesson JJ, Deutscher J. Correlations between carbon metabolism and virulence in bacteria. Contributions to Microbiology, 2009, 16: 88-102. DOI:10.1159/000219374 |
| [17] | Kim HJ, Roux A, Sonenshein AL. Direct and indirect roles of CcpA in regulation of Bacillus subtilis Krebs cycle genes. Molecular Microbiology, 2002, 45(1): 179-190. DOI:10.1046/j.1365-2958.2002.03003.x |
| [18] | Asai K, Baik SH, Kasahara Y, Moriya S, Ogasawara N. Regulation of the transport system for C4-dicarboxylic acids in Bacillus subtilis. Microbiology, 2000, 146(Pt 2): 263-271. |
| [19] | van der Voort M, Kuipers OP, Buist G, de vos WM, Abee T. Assessment of CcpA-mediated catabolite control of gene expression in Bacillus cereus ATCC 14579. BMC Microbiology, 2008, 8: 62. DOI:10.1186/1471-2180-8-62 |
| [20] | Schmiedel D, Hillen W. Contributions of XylR, CcpA and cre to diauxic growth of Bacillus megaterium and to xylose isomerase expression in the presence of glucose and xylose. Molecular and General Genetics MGG, 1996, 250(3): 259-266. |
| [21] | Barry CM, O'Cuinn G, Harrington D, O'Callaghan DM, Fitzgerald RJ. Debittering of a tryptic digest of bovine β-casein using porcine kidney general aminopeptidase and X-prolydipeptidyl aminopeptidase from Lactococcus lactis subsp. cremoris AM2. Journal of Food Science, 2000, 65(7): 1145-1150. DOI:10.1111/jfds.2000.65.issue-7 |
| [22] | Wei YJ. Optimizations of the fermentative condition and application of aminopeptidase by Bacillus subtilis Zj016. Master Dissertation of Jiangnan University, 2008. (in Chinese) 魏亚娟. 细菌氨肽酶的产酶条件优化及应用研究. 江南大学硕士学位论文, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10295-2009013410.htm |
| [23] | Lorca GL, Chung YJ, Barabote RD, Weyler W, Schilling CH, Saier MH Jr. Catabolite repression and activation in Bacillus subtilis:dependency on CcpA, HPr, and HprK. Journal of Bacteriology, 2005, 187(22): 7826-7839. DOI:10.1128/JB.187.22.7826-7839.2005 |
