梅承, 范硕, 杨红


华中师范大学生命科学学院昆虫所, 遗传调控与整合生物学湖北省重点实验室, 湖北 武汉 430079
收稿日期:2018-04-01;修回日期:2018-04-23;网络出版日期:2018-04-27
基金项目:国家自然科学基金(31670004,31370055,31170004,30970001)
作者简介:杨红, 理学博士, 华中师范大学生命科学学院教授。中国昆虫学会理事, 中国昆虫学会昆虫微生物组学专委会主任, 中国微生物学会环境微生物专委会委员, 湖北省微生物学会常务理事。2001-2003年在德国康斯坦茨大学生物系联合培养, 做博士论文研究工作, 2004年获华中师范大学理学博士学位。2006-2008年在加拿大生物技术研究所从事博士后研究。主要研究领域为木食性白蚁与其肠道微生物的共生机制及环境有害化合物和有机废弃物的微生物降解与转化等。主持和参与国家及省部级项目多项。利用分子生态学技术、组学技术和分离培养等技术阐明了肠道共生微生物在白蚁纤维素降解、氮代谢等方面的重要功能。相关研究成果发表于Environmental Microbiology、Applied and Environmental Microbiology、Microbial Ecology等学术期刊。任Applied and Environmental Biotechnology杂志编委, Applied and Environmental Microbiology、Frontiers in Microbiology等期刊的审稿专家
*通信作者:杨红, Tel/Fax:+86-27-67868198, E-mail:hyang@mail.ccnu.edu.cn
摘要:昆虫肠道作为一种特殊生境,生存着多种多样的共生微生物,并且肠道内的很多微生物与自然界其他生境的微生物种类显著不同。基于对纯培养微生物的研究,科学家们发现,肠道微生物与昆虫营养、生长发育及免疫等功能密切相关。因此,分离培养是发现微生物新种类、新基因和新功能的基础。然而,自然界可培养的微生物大约只占总数的1%。为了能够对更多的微生物进行分离和培养,近二十年来,微生物学家们发展了诸多新的培养技术和策略并利用它们从昆虫肠道分离出了很多新的难培养微生物。这些新的微生物种类极大地丰富了我们对肠道共生微生物生理作用与功能的认识。以此为基础,本文综述了昆虫肠道微生物分离培养的策略及研究进展,并对未来该领域的发展进行了展望。
关键词: 昆虫 肠道共生微生物 分离培养 策略
The strategies of isolation of insect gut microorganisms
Cheng Mei, Shuo Fan, Hong Yang


Hubei Key Laboratory of Genetic Regulation and Integrative Biology, Institute of Entomology, School of Life Sciences, Central China Normal University, Wuhan 430079, Hubei Province, China
Received 1 April 2018; Revised 23 April 2018; Published online 27 April 2018
*Corresponding author: Hong Yang, Tel/Fax:+86-27-67868198, E-mail:hyang@mail.ccnu.edu.cn
Supported by the National Natural Science Foundation of China (31670004, 31370055, 31170004, 30970001)
Abstract: Insects are the most diverse and abundant group of animals in nature. They are highly adaptive and play important roles in various ecological environments. As a special microbial niche, the intestinal tracts of insects offer habitats for diverse symbiotic microorganisms, many of which are different from those originated from the other environments. Studies based on pure cultures show that the symbiotic microbes are associated with insect nutrition, development and immunity, etc. Therefore, isolation pure cultures are the basis for the discovery of new microorganisms, new genes and new functions. However, up to now, only about 1% of microorganisms in nature are cultivable. To solve this problem, microbiologists have put great efforts to develop many new culture techniques and strategies during the past two decades. With the use of these new strategies, many uncultured microbes have been successfully isolated, which greatly enriched our understanding of the physiological functions of symbiotic microorganisms. In this paper we reviewed the latest advances of the novel strategies used for the cultivation of symbiotic microorganisms in insect guts, as well as the future perspective of this field.
Key words: insects intestinal symbiotic microorganisms cultivation strategy
昆虫是自然界种类最为丰富、数量最大的一类动物,已知种类达一百多万种,它们能在多种生态环境中生存和繁衍,并且能够快速适应多变的环境条件,在生态系统中发挥着重要的作用。昆虫的外骨骼、肠道、血体腔乃至细胞内都分布着很多微生物。据统计,微生物的总量能够占到昆虫生物量的1%-10%,是昆虫身体不可或缺的重要组成部分[1],其中肠道内微生物的种类和数量最多。近年来的研究发现,肠道共生微生物在昆虫的食物消化和营养利用、生长发育和生殖调控及抵御病原物和有害物质的过程中发挥着重要的作用。例如,很多微生物被前中肠分泌的酶消化为昆虫提供了营养;木食性白蚁和蟑螂后肠的共生微生物帮助宿主固氮、转化含氮废弃物尿酸为可利用的氮源,参与纤维素的降解等[2];按蚊肠道内的肠杆菌产生的活性氧能够抑制疟原虫的动合子发育为卵囊,从而降低了按蚊传播疾病的可能性[3]。不同昆虫肠道微生物的种类和数量差异极大,很多昆虫肠道微生物的种类和数量都很丰富,其中很多微生物与自然界其他生境中的微生物都不同,迄今为止,只有极少数肠道微生物的功能得到了阐释。
虽然近年来高通量测序技术的快速发展促进了对生态环境中未知微生物种群的鉴定和认识,但对微生物生理功能和生态作用的解析还是有赖于传统的分离和培养技术。迄今为止,由于分离培养技术的局限,自然界可培养的微生物大约只占总数的1%,99%的微生物尚不能培养,因此,也称它们为难培养微生物。据统计,应用传统的培养技术在不同生境中可培养微生物的比率是:海水中约为0.001%-0.100%,淡水中约为0.25%,土壤中约为0.3%,活性污泥中约为1%-15%[4-5]。究其原因,主要是人们对不同微生物的特性认识不足,传统的培养方法和技术无法满足微生物在自然生态条件下对环境因子、营养要素、物种间相互作用等方面的要求[6],尤其是对与动植物之间具有复杂共生关系的微生物的认识则更加困难[7]。由于对共生机制认识不足,无法模拟共生环境的自然因素,因而导致很多微生物很难被分离培养出来。近二十年来,得益于微生物学家们建立和发展的很多新的培养技术和策略并应用于昆虫共生微生物的培养,才成功分离出了很多难培养微生物。这些有益的尝试极大地促进了人们对昆虫共生微生物生理功能及其与宿主互作关系的研究。
1 昆虫肠道栖息的主要微生物类群 昆虫肠道主要由前肠、中肠和后肠3个部分构成。绝大多数昆虫,如鳞翅目、双翅目、膜翅目、半翅目等食物消化主要在中肠进行,但有些种类如蜚蠊目的白蚁中肠细长,后肠膨大,食物消化主要场所为后肠[8]。昆虫肠道的理化特性及不同部位的微生态条件对微生物群落组成有很大影响。大多数昆虫肠道接近中性,但鳞翅目昆虫中肠则为碱性(pH 11-12),蚊幼虫中肠后部也为碱性。土食性或木食性高等白蚁肠道的理化性质比较复杂,肠道不同部位pH、氢氧浓度和氧化还原电位均不同[1-2]。一般来说,微生物种群随肠道纵向微生态环境的不同而分布各异[1]。昆虫肠道内栖息的微生物对肠道生理条件影响也很大。例如,甲虫Pachnoda ephippiata肠道细菌发酵产生乙酸、甲酸和乳酸等,对微生态环境中的pH产生了直接影响[9]。
不同昆虫肠道内微生物的种类、数量、分布及功能等均不同。很多昆虫肠道内细菌的种类多且具有可变性,其来源可能与栖息地环境及摄取的食物有关。与微生物之间形成典型共生关系的昆虫,如白蚁和木食性蟑螂,同属不同种类的昆虫肠道微生物的种群结构十分相似[10]。昆虫肠道微生物包括细菌、古菌、原生生物、真菌等。一般昆虫肠道内均栖息着细菌。常见细菌有变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)、放线菌(Actinomycetes)、螺旋体(Spirochetes)、和疣微菌(Verrucomicrobia)等[11]。在以木材及其碎屑为食的白蚁和甲虫等肠道内发现有不同种类的古菌和真菌,而木食性白蚁和蟑螂肠道内还有多种多样的原生动物(图 1)。
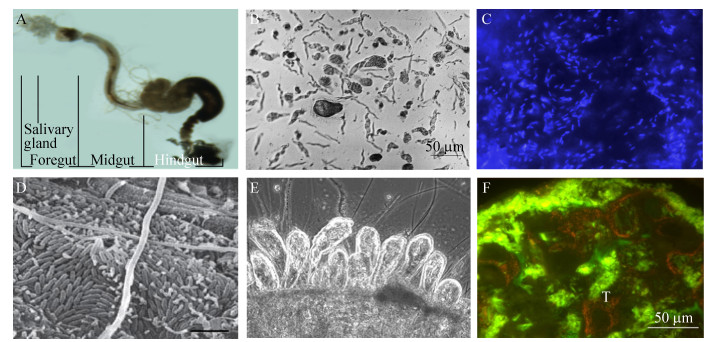 |
| 图 1 低等木食性白蚁肠道及其共生微生物 Figure 1 The gut of wood-feeding lower termites and their symbiotic microorganisms. A: The gut of Reticulitermes chinensis; B: Flagellates in the hindgut fluid of R. chinensis; C: Methanogens attached to the hindgut epithelium of R. chinensis; D: Bacteria on the hindgut wall of R. flaviceps[12]; E: Pyrsonympha vertens and long chain bacteria attached to the hindgut wall of R. santonensis; F: Hindgut section of R. santonensis. Green signals, bacteria hybridized with Probe EUB338 that targets all bacteria; Orange signals, Elusimicrobia hybridized with specific probes. |
| 图选项 |
应用多种培养技术和手段,研究者们已经从昆虫肠道分离出部分共生菌并对其功能进行了探讨。变形菌是昆虫肠道细菌中最大的一个门类,其中肠杆菌、柠檬酸杆菌、粘质沙雷氏菌、假单胞菌和伯克氏菌等从很多昆虫肠道里均被分离出来[1, 13]。拟杆菌也是昆虫肠道常见的分离菌。从多种昆虫肠道人们分离到了厚壁菌门的乳球菌、链球菌、乳杆菌、芽胞杆菌、梭菌等。从白蚁、蚂蚁、蝗虫、美洲大蠊等昆虫肠道均有分离出放线菌门链霉菌的报道[2, 14]。这些共生细菌在昆虫的营养、发育、免疫等方面发挥了重要作用。尽管如此,迄今为止,绝大多数昆虫肠道共生菌还没有被分离出来,尤其是螺旋体门和疣微菌门等门类的细菌。不断发展新的培养技术和策略,是研究昆虫肠道共生微生物的重要途径。
2 目前主要采用的分离培养方法 传统的微生物分离方法主要有平板划线法以及稀释涂布法,二者的原理相似,都是在对菌液进行稀释之后,通过连续划线或是平板涂布的方法,使菌细胞分开,最后在平板上形成单个菌落。根据所分离微生物的种类,可以选择不同的培养基。如常用的LB培养基和TSB培养基等细菌培养基,马铃薯葡萄糖培养基和麦芽汁培养基等真菌培养基。采用传统培养方法,人们从家蚕、蜜蜂和果蝇等昆虫肠道分离培养出了很多微生物[1]。在不同培养条件下,能利用培养基中营养物质的微生物生长速度很快,因而很容易被分离纯化出来。而原始接种物中不能有效利用培养基营养物质的微生物生长速度很慢,因而很难得到分离。难培养微生物也被称之为未培养微生物(uncultured microorganisms),指在实验室未能获得培养生长的微生物[5]。20世纪末以来,科学家们尝试建立了一些新的培养技术和策略,使不同环境中很多未培养微生物被成功地分离出来,其中一些技术和策略被成功应用于昆虫肠道微生物的分离培养。
2.1 稀释培养法 传统的微生物分离培养基一般营养丰富,很多寡营养且生长慢的微生物在培养中受到抑制,比如海洋环境中含量丰富的寡营养微生物。应用稀释培养法(dilution culture)即稀释的寡营养培养基或将海水中的微生物稀释至痕量进行培养,大大增加了这些微生物的可培养几率[15-16]。常用的寡营养培养基是将常规培养基进行稀释,如1/10 LB培养基、1/10 TSB培养基等。也有些寡营养培养基是重新设计的、营养成分含量较低的培养基,如AM-4培养基、MM-4培养基[17]、R2A培养基[18]等,由于培养基中所含的营养物质不足以支持富营养细菌大量且快速地增殖,导致快速生长的细菌到一定程度即由于营养不足而几乎停止生长,从而使部分生长较慢的寡营养细菌得以生长起来,并在平板上形成单菌落。使用寡营养培养基分离细菌一般要求培养较长时间,比如半个月甚至更长的时间,以便生长缓慢的细菌能够形成单菌落。
田贞华等用1/10 LB培养基对家蚕肠道细菌进行分离,发现从稀释培养基上分离得到几种普通培养基上无法分离到的细菌类群,更能反映出家蚕肠道菌群的多样性[19]。陈文用1/5 LB培养基、1/3 TSB培养基和MM-4培养基等从黑胸散白蚁(Reticulitermes chinensis)肠道中分离出了17个属的细菌,其中异常球菌(Deinococcus)和Gryllotalpicola属的细菌均首次从白蚁中分离出来,有4个菌株已鉴定为细菌新种[20-22]。与常规培养基相比,寡营养培养基从白蚁肠道中分离出的细菌多样性更高,新种更多[23]。应用寡营养培养基,Yang等从象白蚁Nasutitermes sp.、须白蚁Hospitalitermes sp.和尖唇散白蚁(Reticulitermes aculabialis)等白蚁肠道分离鉴定出多株共生细菌新种[24-26]。
2.2 选择培养法 选择培养法是根据不同微生物对营养、理化条件等需求的差异设计培养基或培养条件,以达到筛选分离某一类微生物的目的。利用不同的选择培养基可以从自然生态环境中富集筛选出特定的微生物,联合使用多种培养基可以提高分离培养微生物的多样性。选择培养基是指根据某种微生物的特殊营养要求或其对某化学、物理因素的抗性而设计的培养基。其功能是富集环境样品混合菌群中的某一类菌,使其变成优势菌,从而提高该类菌的筛选效率。比如,常用于筛选和分离放线菌的高氏一号培养基。
白蚁、蟑螂和甲虫等昆虫中有很多种类是木食性的。利用以纤维素、木糖等为唯一碳源的选择培养基人们从这些昆虫肠道分离出了多种纤维素、半纤维素降解菌。在厌氧条件下,Hethener等以纤维素为唯一碳源从象白蚁Nasutitermes lujae肠道分离出一株细菌——白蚁梭菌(Clostridium termitidis),该菌能有效降解纤维素[27]。以羧甲基纤维素、甘蔗渣碎屑和微晶纤维素为底物,Manfredi等从鳞翅目昆虫草地贪夜蛾(Spodoptera frugiperda)和一种甘蔗螟虫Diatraea saccharalis、鞘翅目昆虫幼虫蛴螬和白蚁体内分离到233株纤维素降解菌,其中梭菌门的芽孢杆菌(Bacillus)、类芽孢杆菌(Paenibacillus)等占明显优势[28]。利用分离酵母的培养基酵母膏-麦芽膏琼脂培养基(yeast extract-malt extract agar) Hui等、Ren、Liu等从鞘翅目昆虫幼虫蛴螬和成虫肠道内分离到Wickerhamomyces属、Candida baotianmanensis和Wickerhamiella属酵母菌[29-31];Wang等从双叉犀金龟(Allomyrina dichotoma)成虫分离到一株能够发酵木糖的酵母菌新种Spathaspora allomyrinae sp. nov.[32]。利用含有D-木糖或木聚糖的酵母氮源液体培养基(liquid yeast nitrogen base,YNB),Ali等从黑胸散白蚁肠道分离到18种酵母菌,其中7株为新种。这些酵母菌能够发酵D-木糖,有些酵母菌具有较高的木聚糖降解活性[33]。
根据NCBI数据库中微生物分类的信息,结合对德国微生物菌种保藏中心DSMZ中18049株纯菌的3335种培养基的分析,Oberhardt等建立了一个根据未培养微生物16S rRNA序列的系统发育分析预测最佳培养基的平台,KOMODO (Known Media Database)[34],该分析平台的建立对针对性地选择培养基分离环境中已知种类的微生物具有积极的意义。
3 改进的分离培养方法和策略 3.1 先富集后筛选
3.1.1 利用培养基富集: 富集培养法指利用特定培养基和培养条件使混合微生物菌群中某种或某类特定微生物比例激增从而分离目标微生物的培养方法。在选择培养基中加入能够抑制其他微生物生长繁殖的因子也可以促进目标微生物的分离。针对共生细菌的特征先富集培养,再筛选,有利于分离到一些难培养的共生菌。
在厌氧条件下Paul等用不含氮源的AM5培养基(Headspace:N2-CO2 (80:20 [V/V]))从高等白蚁Cubitermes ugandensis和马陆Anadenobolus sp.肠道分别富集到一个能产甲烷的混合菌群,菌群中古菌热原体(Thermoplasmatales)含量很高。尽管最终没有分离纯化出单一的热原体菌株,通过对混合菌群中热原体16S rRNA基因和产甲烷菌mcrA 基因的系统发育分析和比较,揭示了在象白蚁肠道中存在的热原体是一类新的产甲烷古菌,命名为甲烷原体(Methanoplasmatales),这类甲烷菌是古菌中能够产甲烷的第7个目[35]。在黑翅土白蚁(Odontotermes formosanus)、黄翅大白蚁(Macrotermes barneyi)和象白蚁Nasutitermes sp.等高等白蚁肠道内均发现有很多热原体古菌[36],其功能一直不明确。该研究首次证实了热原体的产甲烷活性,阐明了这类共生古菌的功能,具有重要的理论意义。
在很多研究中,人们往往可以从肠道微生物的富集培养中进一步分离筛选到一些难培养的微生物。例如,李丹红等以滤纸为唯一碳源在好氧条件下从象白蚁Nasutitermes sp.肠道富集到一个能高效降解纤维素的混合菌群,进一步优化培养基之后从该菌群中成功分离到一株能够降解纤维素的类芽胞杆菌[37]。
3.1.2 利用昆虫富集: 在自然条件下,昆虫由于受到农药、抗生素等有害化合物的选择压力而产生抗性。一些能够降解农药、抗生素等有害化合物的共生细菌随之在肠道中得到富集。Almeida等从5龄抗性草地贪夜蛾肠道分离到能够降解高效氯氟氰菊酯、溴氰菊酯、毒死蜱、多杀菌素和氯芬奴隆的细菌[38]。杨军等用聚乙烯(PE)塑料喂食印度古螟(Plodia interpunctell)幼虫,在PE塑料被幼虫取食之后,对幼虫进行解剖,以PE塑料为唯一碳源,从肠液中筛选出了两株能够降解PE塑料的细菌,肠杆菌Enterobacter asburiae YT1和芽胞杆菌Bacillus sp. YP1[39]。这项研究首次发现自然界存在着能够降解聚乙烯塑料的微生物,为全球白色污染的治理带来了希望。
3.2 模拟肠道微生境 昆虫肠道从前到后不同微生境(microniche)的生理条件如pH、氢氧分压和氧化还原电位等均有差异。以氧分压为例,前肠和后肠的直肠氧分压较高,而中肠和后肠前部氧分压较低,很多微生境为厌氧状态,因此,昆虫肠道内栖息着大量的厌氧和兼性厌氧微生物。根据昆虫肠道微生境的特点,在好氧、严格厌氧和不同氧分压条件下培养肠道微生物,可以大大增加分离多种共生微生物的几率。
以木食性白蚁为例,木食性白蚁膨大的后肠是木质纤维素降解的主要部位,分布着大量的厌氧和兼性厌氧微生物。在严格厌氧条件下,Yamin从Zootermopsis属湿木白蚁肠液中分离出鞭毛虫Trichomitopsis termopsidis,证明鞭毛虫能够降解纤维素产生乙酸、二氧化碳和氢[40]。Leadbetter等从黄肢散白蚁(Reticulitermes flavipes)和湿木白蚁Z. angusticollis后肠分别分离出了甲烷菌和螺旋体[41-42],阐明了这两类重要的肠道共生菌对白蚁代谢中间产物氢和二氧化碳的转化和利用机制。
Fang等在好氧和厌氧条件下分别从黑胸散白蚁肠道分离共生菌,所得到的细菌类群明显不同。好氧条件下分离的优势菌是芽胞杆菌、乳球菌(Lactococcus)和Dyella属细菌,而厌氧条件下分离的优势菌是肠杆菌(Enterobacter)、柠檬酸杆菌(Citrobacter)和乳球菌等[23]。K?hler对象白蚁Nasutitermes corniger的研究发现,其前肠、中肠和后肠P1区-P5区理化条件有明显差异[43]。针对象白蚁肠道微生境的理化条件,杨书燕设计不同pH的培养基在厌氧条件下从海南象白蚁(Nasutitermes hainanensis)肠道不同部位分离到属于16个属的共生细菌342株。其中,从前肠和中肠分离到的优势共生菌为乳球菌,从P3区分离的优势共生菌为梭菌(Clostridium)和纤维单胞菌(Cellulomonas),从P4区分离的优势共生菌为梭菌和芽胞杆菌[44],与在厌氧条件下用一种培养基从该白蚁全肠匀浆液分离的细菌相比,种类大大增加,且获得了几株新菌。
3.3 整合多种技术 对于难培养的昆虫肠道共生微生物,整合使用多种技术进行分离筛选是值得尝试的一种策略。Stevenson等将分子生物学技术引入到传统细菌分离培养过程中,从土壤和白蚁肠道中分离出了一些新的未培养微生物。他们首先将稀释的土壤样品和白蚁肠液接种于寡营养培养基琼脂平板,在微氧条件下培养30 d,以抑制富营养菌和好氧菌的生长。待单菌落长出后,将其转移至96孔细胞培养板,同时以群特异性引物对菌落细胞进行16S rRNA基因扩增,以初步鉴定菌落中细菌的种类,然后根据鉴定结果针对性地设计培养条件,将感兴趣的细菌分离纯化出来[45]。这种新的培养策略可以有目的地筛选环境中的特定微生物,具有很大的应用潜力。利用该策略,他们首次成功地从黄肢散白蚁肠道分离到了4株疣微菌,进一步研究表明疣微菌很可能参与了白蚁的固氮作用[46]。
在大多数昆虫肠道内共生菌的种类很多,形态、大小及生理生态特性相差很大。针对共生细菌的形态特征,可以用物理方法将它们初步分开,再进行筛选,这种策略也有利于分离到一些难培养的共生菌。例如,在木食性白蚁、蟑螂及一些甲虫肠道内分布着的迷踪菌(Elusimicrobia),是这些昆虫肠道内的一种优势共生菌,形态为细纺锤形、细杆状、球状或不定形,直径为0.17- 0.30 μm,其功能一直不明确。根据其形态大小,Geisinger用0.22 μm滤膜对甲虫Pachnoda ephippiata肠液匀浆进行过滤,从滤液中成功分离到首株迷踪菌菌株Elusimicrobium minutum并对其基因组进行了分析[47-48]。用同样的策略,Zheng首次从桑特散白蚁肠液中分离到了一株迷踪菌Endomicrobia proavitum,研究表明该菌具有Ⅳ型固氮酶,在无氨的培养基中可以固氮[49]。
4 展望 昆虫不仅在自然界发挥着多种多样的作用,而且与人类生活和生产活动密切相关。越来越多的证据显示肠道共生微生物对昆虫的生命活动起着重要的作用,其中许多微生物具有其他环境微生物所不具备的特殊功能。因此,对昆虫肠道微生物分离培养策略的研究显得格外重要。除了上述总结的培养方法,还有一些很好的技术和策略可以进行尝试。比如,基于单细胞培养技术原理发展而来的液滴微流控技术(droplet microfluidics)[50],该技术能够将环境中微生物个体分离开来,用不同的培养基进行高通量培养,大大提高了环境样品中未培养细菌的可培养几率,在土壤、海水、深海沉积物和人肠道等环境微生物分离培养方面得到广泛应用[51-54]。2016年,Jiang等在该技术基础上建立了一种微流控划线平板法(microfluidic streak plate,MSP),使液滴微流控技术可以在普通的琼脂平板上应用,而不需要复杂的芯片设备,大大降低了使用成本[55],并成功地从富含多环芳烃(PAH)的土壤中分离到了许多未培养微生物,包括一株能降解奈蒽的芽生球菌(Blastococcus)新种。此外,将分离培养技术与宏基因组技术结合起来,根据对特定环境中微生物组的宏基因组测序结果,针对已知种类的微生物利用KOMODO平台或已有文献分析、选择合适的培养基和培养条件,可以导向性地分离目标微生物,提高分离培养的效率。
综上所述,未来可以尝试和建立更多新的分离方法及策略用于昆虫肠道微生物的培养,以期在难培养肠道共生微生物的分离方面取得突破。在此基础上深入研究昆虫肠道微生物的生理功能及其与宿主的互作机制,充分利用共生微生物调控昆虫的生长发育和代谢、免疫等重要生命过程,以提高资源昆虫的经济效益和卫生及农林害虫的防治效果。
References
| [1] | Douglas AE. Multiorganismal insects:Diversity and function of resident microorganisms. Annual Review of Entomology, 2015, 60(1): 17-34. DOI:10.1146/annurev-ento-010814-020822 |
| [2] | Brune A. Symbiotic digestion of lignocellulose in termite guts. Nature Reviews Microbiology, 2014, 12(3): 168-180. DOI:10.1038/nrmicro3182 |
| [3] | Cirimotich CM, Dong YM, Clayton AM, Sandiford SL, Souza-Neto JA, Mulenga M, Dimopoulos G. Natural microbe-mediated refractoriness to Plasmodium infection in Anopheles gambiae. Science, 2011, 332(6031): 855-858. DOI:10.1126/science.1201618 |
| [4] | Rappé MS, Giovannoni SJ. The uncultured microbial majority. Annual Review of Microbiology, 2003, 57: 369-394. DOI:10.1146/annurev.micro.57.030502.090759 |
| [5] | Wang BJ, Liu SJ. Perspectives on the cultivability of environmental microorganisms. Microbiology China, 2013, 40(1): 6-17. (in Chinese) 王保军, 刘双江. 环境微生物培养新技术的研究进展. 微生物学通报, 2013, 40(1): 6-17. |
| [6] | Yuan ZH, Wang J, Yang WJ, Wu YY. Progress in cultivation research on soil microbes. Acta Pedologica Sinica, 2014, 51(6): 1183-1191. (in Chinese) 袁志辉, 王健, 杨文蛟, 吴永尧. 土壤微生物分离新技术的研究进展. 土壤学报, 2014, 51(6): 1183-1191. |
| [7] | West SA, Diggle SP, Buckling A, Gardner A, Griffin AS. The social lives of microbes. Annual Review of Ecology, Evolution, and Systematics, 2007, 38: 53-77. DOI:10.1146/annurev.ecolsys.38.091206.095740 |
| [8] | Engel P, Moran NA. The gut microbiota of insects-diversity in structure and function. FEMS Microbiology Reviews, 2013, 37(5): 699-735. DOI:10.1111/1574-6976.12025 |
| [9] | Lemke T, Stingl U, Egert M, Friedrich MW, Brune A. Physicochemical conditions and microbial activities in the highly alkaline gut of the humus-feeding larva of Pachnoda ephippiata (Coleoptera:Scarabaeidae). Applied and Environmental Microbiology, 2003, 69(11): 6650-6658. DOI:10.1128/AEM.69.11.6650-6658.2003 |
| [10] | Li DH, Wang Y, Yang H. Gut microbiome of wood-feeding termites. Acta Microbiologica Sinica, 2017, 57(6): 876-884. (in Chinese) 李丹红, 王誉, 杨红. 高效降解木质纤维素的白蚁肠道微生物组. 微生物学报, 2017, 57(6): 876-884. |
| [11] | Colman DR, Toolson EC, Takacs-Vesbach CD. Do diet and taxonomy influence insect gut bacterial communities?. Molecular Ecology, 2012, 21(20): 5124-5137. DOI:10.1111/mec.2012.21.issue-20 |
| [12] | Brune A. Symbionts aiding digestion//Resh VH, Cardé RT. Encyclopedia of Insects. New York: Academic Press, 2003: 1102-1107. |
| [13] | Xiang H, Huang YP. Symbiosis between gut microbiota and insects. Chinese Bulletin of Entomology, 2008, 45(5): 687-693. (in Chinese) 相辉, 黄勇平. 肠道微生物与昆虫的共生关系. 昆虫知识, 2008, 45(5): 687-693. DOI:10.7679/j.issn.2095-1353.2008.149 |
| [14] | Fang X, Shen J, Wang YJ, Chen ZL, Zhu JY, Jin XB. Isolation and identification of endophytic actinomycetes from medical insects (Periplaneta americana). Journal of Pathogen Biology, 2016, 11(6): 550-553, 565. (in Chinese) 方霞, 沈娟, 王影姣, 陈至里, 朱家勇, 金小宝. 药用昆虫美洲大蠊内生放线菌的分离和鉴定. 中国病原生物学杂志, 2016, 11(6): 550-553, 565. |
| [15] | Schut F, de Vries EJ, Gottschal JC, Robertson BR, Harder W, Prins RA, Button DK. Isolation of typical marine bacteria by dilution culture:growth, maintenance, and characteristics of isolates under laboratory conditions. Applied and Environmental Microbiology, 1993, 59(7): 2150-2160. |
| [16] | Cho JC, Giovannoni SJ. Cultivation and growth characteristics of a diverse group of oligotrophic marine Gammaproteobacteria. Applied and Environmental Microbiology, 2004, 70(1): 432-440. DOI:10.1128/AEM.70.1.432-440.2004 |
| [17] | Brune A, Miambi E, Breznak JA. Roles of oxygen and the intestinal microflora in the metabolism of lignin-derived phenylpropanoids and other monoaromatic compounds by termites. Applied and Environmental Microbiology, 1995, 61(7): 2688-2695. |
| [18] | Reasoner DJ, Geldreich EE. A new medium for the enumeration and subculture of bacteria from potable water. Applied and Environmental Microbiology, 1985, 49(1): 1-7. |
| [19] | Tian ZH, Hui LF, Ke T, Kan YC, Wen ZZ. Molecular analysis of the bacteria community composition in silkworm midgut. Science of Sericulture, 2007, 33(4): 592-595. (in Chinese) 田贞华, 惠立丰, 柯涛, 阚云超, 文桢中. 家蚕肠道细菌种群结构分析. 蚕业科学, 2007, 33(4): 592-595. |
| [20] | 陈文. 黑胸散白蚁肠道内可培养的好氧与兼性厌氧共生细菌的多样性研究及共生鞭毛虫的系统发育分析. 华中师范大学博士学位论文, 2011. |
| [21] | Chen W, Wang B, Hong H, Yang H, Liu SJ. Deinococcus reticulitermitis sp. nov., isolated from a termite gut. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(1): 78-83. DOI:10.1099/ijs.0.026567-0 |
| [22] | Fang H, Lv W, Huang Z, Liu SJ, Yang H. Gryllotalpicola reticulitermitis sp. nov., isolated from a termite gut. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(1): 85-89. |
| [23] | Fang H, Chen W, Wang BJ, Li XJ, Liu SJ, Yang H. Cultivation and characterization of symbiotic bacteria from the gut of Reticulitermes chinensis. Applied Environmental Biotechnology, 2016, 1(1): 3-12. DOI:10.18063/AEB.2016.01.004 |
| [24] | Yang SY, Zheng Y, Huang Z, Wang XM, Yang H. Lactococcus nasutitermitis sp. nov. isolated from a termite gut.. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(1): 518-522. DOI:10.1099/ijsem.0.000743 |
| [25] | Wang XM, Ma SC, Yang SY, Peng R, Zheng Y, Yang H. Paenibacillus nasutitermitis sp. nov., isolated from a termite gut. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(2): 901-905. DOI:10.1099/ijsem.0.000807 |
| [26] | Zhao Y, Wang Y, Li DH, Deng Y, Yang H. Chryseobacterium reticulitermitis sp. nov., isolated from the gut of Reticulitermes aculabialis. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(6): 1698-1702. DOI:10.1099/ijsem.0.001848 |
| [27] | Hethener P, Brauman A, Garcia JL. Clostridium termitidis sp. nov., a cellulolytic bacterium from the gut of the wood-feeding termite, Nasutitermes lujae. Systematic and Applied Microbiology, 1992, 15(1): 52-58. DOI:10.1016/S0723-2020(11)80138-4 |
| [28] | Manfredi AP, Perotti NI, Martínez MA. Cellulose degrading bacteria isolated from industrial samples and the gut of native insects from Northwest of Argentina. Journal of Basic Microbiology, 2015, 55(12): 1384-1393. DOI:10.1002/jobm.v55.12 |
| [29] | Hui FL, Chen L, Chu XY, Niu QH, Ke T. Wickerhamomyces mori sp. nov., an anamorphic yeast species found in the guts of wood-boring insect larvae. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(3): 1174-1178. |
| [30] | Ren YC, Xu LL, Zhang L, Hui FL. Candida baotianmanensis sp. nov. and Candida pseudoviswanathii sp. nov., two ascosporic yeast species isolated from the gut of beetles. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(10): 3580-3585. DOI:10.1099/ijsem.0.000460 |
| [31] | Liu XJ, Wang Y, Ren YC, Hui FL. Wickerhamiella brachini f.a., sp. nov., Wickerhamiella pterostichi f.a., sp. nov. and Wickerhamiella qilinensis f.a., sp. nov., three yeast species isolated from insects. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(10): 3995-4001. DOI:10.1099/ijsem.0.001300 |
| [32] | Wang Y, Ren YC, Zhang ZT, Ke T, Hui FL. Spathaspora allomyrinae sp. nov., a D-xylose-fermenting yeast species isolated from a scarabeid beetle Allomyrina dichotoma. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(5): 2008-2012. DOI:10.1099/ijsem.0.000979 |
| [33] | Ali SS, Wu J, Xie RR, Zhou F, Sun JZ, Huang M. Screening and characterizing of xylanolytic and xylose-fermenting yeasts isolated from the wood-feeding termite, Reticulitermes chinensis. PLoS ONE, 2017, 12(7): e0181141. DOI:10.1371/journal.pone.0181141 |
| [34] | Oberhardt MA, Zarecki R, Gronow S, Lang E, Klenk HP, Gophna U, Ruppin E. Harnessing the landscape of microbial culture media to predict new organism-media pairings. Nature Communications, 2015, 6: 8493. DOI:10.1038/ncomms9493 |
| [35] | Paul K, Nonoh JO, Mikulski L, Brune A. "Methanoplasmatales, " Thermoplasmatales-related archaea in termite guts and other environments, are the seventh order of methanogens. Applied and Environmental Microbiology, 2012, 78(23): 8245-8253. DOI:10.1128/AEM.02193-12 |
| [36] | Shi Y, Huang Z, Han S, Fan S, Yang H. Phylogenetic diversity of Archaea in the intestinal tract of termites from different lineages. Journal of Basic Microbiology, 2015, 55(8): 1021-1028. DOI:10.1002/jobm.v55.8 |
| [37] | Li DH, Xu R, Zhang KD, Zhu CM, Li FL, Yang H. Isolation and characterization of a cellulose-degrading bacterial consortium from the gut of Nasutitermes sp. Biotic Resources, 2017, 39(4): 272-278. (in Chinese) 李丹红, 徐荣, 张坤迪, 朱崇梅, 李福利, 杨红. 象白蚁肠道中一个纤维素降解菌群的分离和特性研究. 生物资源, 2017, 39(4): 272-278. |
| [38] | Almeida LG, Moraes LAB, Trigo JR, Omoto C, C?nsoli FL. The gut microbiota of insecticide-resistant insects houses insecticide-degrading bacteria:A potential source for biotechnological Exploitation. PLoS ONE, 2017, 12(3): e0174754. DOI:10.1371/journal.pone.0174754 |
| [39] | Yang J, Yang Y, Wu WM, Zhao J, Jiang L. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [40] | Yamin MA. Axenic cultivation of the cellulolytic flagellate Trichomitopsis termopsidis (Cleveland) from the termite Zootermopsis. The Journal of Protozoology, 1978, 25(4): 535-538. DOI:10.1111/jeu.1978.25.issue-4 |
| [41] | Leadbetter JR, Breznak JA. Physiological ecology of Methanobrevibacter cuticularis sp. nov. and Methanobrevibacter curvatus sp. nov., isolated from the hindgut of the termite Reticulitermes flavipes. Applied and Environmental Microbiology, 1996, 62(10): 3620-3631. |
| [42] | Leadbetter JR, Schmidt TM, Graber JR, Breznak JA. Acetogenesis from H2 plus CO2 by Spirochetes from termite guts. Science, 1999, 283(5402): 686-689. DOI:10.1126/science.283.5402.686 |
| [43] | K?hler T, Dietrich C, Scheffrahn RH, Brune A. High-resolution analysis of gut environment and bacterial microbiota reveals functional compartmentation of the gut in wood-feeding higher termites (Nasutitermes spp.). Applied and Environmental Microbiology, 2012, 78(13): 4691-4701. DOI:10.1128/AEM.00683-12 |
| [44] | 杨书燕. 海南象白蚁肠道不同部位可培养厌氧及兼性厌氧菌多样性分析与两株乳球菌的鉴定. 华中师范大学硕士学位论文, 2016. |
| [45] | Stevenson BS, Eichorst SA, Wertz JT, Schmidt TM, Breznak JA. New strategies for cultivation and detection of previously uncultured microbes. Applied and Environmental Microbiology, 2004, 70(8): 4748-4755. DOI:10.1128/AEM.70.8.4748-4755.2004 |
| [46] | Wertz JT, Kim E, Breznak JA, Schmidt TM, Rodrigues JLM. Genomic and physiological characterization of the Verrucomicrobia isolate Diplosphaera colitermitum gen. nov., sp. nov., reveals microaerophily and nitrogen fixation genes. Applied and Environmental Microbiology, 2012, 78(5): 1544-1555. DOI:10.1128/AEM.06466-11 |
| [47] | Geissinger O, Herlemann DPR, M?rschel E, Maier UG, Brune A. The Ultramicrobacterium "Elusimicrobium minutum" gen. nov., sp. nov., the first cultivated representative of the Termite Group 1 phylum. Applied and Environmental Microbiology, 2009, 78(9): 2831-2840. |
| [48] | Herlemann DPR, Geissinger O, Ikeda-Ohtsubo W, Kunin V, Sun H, Lapidus A, Hugenholtz P, Brune A. Genomic analysis of "Elusimicrobium minutum", the first cultivated representative of the phylum "Elusimicrobia" (formerly termite group 1). Applied and Environmental Microbiology, 2009, 75(9): 2841-2849. DOI:10.1128/AEM.02698-08 |
| [49] | Zheng H, Dietrich C, Radek R, Brune A. Endomicrobium proavitum, the first isolate of Endomicrobia class. nov. (phylum Elusimicrobia)-an ultramicrobacterium with an unusual cell cycle that fixes nitrogen with a Group Ⅳ nitrogenase. Environmental Microbiology, 2016, 18(1): 191-204. DOI:10.1111/emi.2016.18.issue-1 |
| [50] | Joensson HN, Andersson Svahn H. Droplet microfluidics-a tool for single-cell analysis. Angewandte Chemie International Edition, 2012, 51(49): 12176-12192. DOI:10.1002/anie.v51.49 |
| [51] | Martin K, Henkel T, Baier V, Grodrian A, Sch?n T, Roth M, K?hler MJ, Metze J. Generation of larger numbers of separated microbial populations by cultivation in segmented-flow microdevices. Lab on a Chip, 2003, 3(3): 202-207. DOI:10.1039/B301258C |
| [52] | Liu WS, Kim HJ, Lucchetta EM, Du WB, Ismagilov RF. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a Chip, 2009, 9(15): 2153-2162. DOI:10.1039/b904958d |
| [53] | Ma L, Kim J, Hatzenpichler R, Karymov MA, Hubert N, Hanan IM, Chang EB, Ismagilov RF. Gene-targeted microfluidic cultivation validated by isolation of a gut bacterium listed in Human Microbiome Project's Most Wanted taxa. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(27): 9768-9773. DOI:10.1073/pnas.1404753111 |
| [54] | Leung K, Zahn H, Leaver T, Konwar KM, Hanson NW, Page AP, Lo CC, Chain PS, Hallam SJ, Hansen CL. A programmable droplet-based microfluidic device applied to multiparameter analysis of single microbes and microbial communities. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(20): 7665-7670. DOI:10.1073/pnas.1106752109 |
| [55] | Jiang CY, Dong LB, Zhao JK, Hu XF, Shen CH, Qiao YX, Zhang XY, Wang YP, Ismagilov RF, Liu SJ, Du WB. High-throughput single-cell cultivation on microfluidic streak plates. Applied and Environmental Microbiology, 2016, 82(7): 2210-2218. DOI:10.1128/AEM.03588-15 |
