徐晓1, 孙飞飞1, 尹彩萍1,2, 王滢1, 张应烙1,2


1.浙江师范大学化学与生命科学学院, 浙江 金华 321004;
2.安徽农业大学生命科学学院, 安徽 合肥 230036
收稿日期:2018-01-11;修回日期:2018-03-21;网络出版日期:2018-03-28
基金项目:国家自然科学基金(31770007);浙江省自然科学基金(LY17C010002);浙江省大学生科技创新活动计划资助项目(2017R404021)
作者简介:张应烙, 1976年2月生, 博士, 安徽农业大学皖江********, 博士生导师, 中国昆虫学会昆虫微生物组专业委员会委员。主要从事昆虫共生菌及其活性代谢产物研究, 先后主持国家自然科学基金3项, 省部级项目8项; 以第一或通讯作者在国内外刊物上发表论文40余篇, 其中SCI论文18篇, 主要论文发表在Journal of the American Chemical Society、Angewandte Chemie International Edition、Bioresource Technology、Food Chemistry、Journal of Agricultural and Food Chemistry等主流杂志上; 获授权发明专利9项
*通信作者:张应烙, Tel:+86-551-65786129, E-mail:zhangyl@ahau.edu.cn
摘要:微生物与昆虫的共生是一种普遍现象,昆虫种类繁多,与昆虫共生的微生物也多种多样。昆虫共生菌是活性次生代谢产物的重要来源。本文对自2008年以来已报道的177个昆虫共生菌的次级代谢产物进行了统计和分析,结果表明:61.6%的化合物为新天然产物(生物碱类新化合物最多),其中,约75%的新化合物来源于昆虫共生真菌,25%来源于细菌;醌酮类化合物是昆虫共生菌源天然产物的主要结构类型,占23.2%;47.5%的化合物具有显著的抗肿瘤、抗菌、除草和抗氧化等生物活性,且化合物中的主要活性类型是抗菌和抗肿瘤活性,活性范围覆盖面最广的结构类型是生物碱类。以上结果表明昆虫共生菌的次级代谢产物是先导性化合物的重要来源且具有丰富的生物活性类型。本文以天然产物的结构分类为切入点,结合其研究菌株来源、生物活性等进行综述,旨在为充分挖掘昆虫共生菌次级代谢产物提供重要参考。
关键词: 昆虫共生菌 次生代谢产物 结构类型 生物活性
Research progress in the secondary metabolites of insect symbionts
Xiao Xu1, Feifei Sun1, Caiping Yin1,2, Ying Wang1, Yinglao Zhang1,2


1.College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, Zhejiang Province, China;
2.School of Life Sciences, Anhui Agricultural University, Hefei 230036, Anhui Province, China
Received 11 January 2018; Revised 21 March 2018; Published online 28 March 2018
*Corresponding author: Yinglao Zhang, Tel:+86-551-65786129, E-mail:zhangyl@ahau.edu.cn
Supported by the National Natural Science Foundation of China (31770007); by the Zhejiang Provincial Natural Science Foundation of China (LY17C010002) and by the Projects Funded by Scientific and Technological Innovation Activities for Zhejiang Undergraduate (2017R404021)
Abstract: It is a common phenomenon of the symbiosis between microorganisms and insects. There are many different kinds of insects on Earth, and the insect symbionts are also very diverse. In this paper, we summarize and analyze 177 secondary metabolites originated from different insects that have been reported from 2008. The results show that, 61.6% of the compounds produced by insect symbionts are new metabolites, in which the alkaloids are the most abundant. About 75% compounds with unprecedented structure derived from fungi, whereas those from bacteria account for about 25%; the quinones and polyketides are the main structure type accounting for about 23.2% of the compounds produced by insect symbionts; about 47.5% of which displayed significant bioactivities such as antitumor, antimicrobial, herbicidal, antioxidant activity, etc. The main biological type is antibacterial and antitumor properties, in the meantime, the alkaloids possess the widest range of biological activity among all compounds. The results elucidate that the compounds produced by insect symbionts are an important source of leading compounds and have diverse biological types. Based on the structure classification of natural products as the entry points, combined with the sources and bioactivities, the paper aimed to provide important information for fully exerting the insect symbionts' secondary metabolites.
Key words: insect symbiont secondary metabolites structure type biological activity
昆虫无处不在,数量惊人,生活习性多样。目前有超过100万种的昆虫已被报道,可见其物种具有丰富的多样性。微生物与昆虫共生是自然界中普遍存在的一种现象,多种多样的昆虫共生菌已经引起了越来越多科学家们的关注[1]。昆虫共生菌主要分为细胞外共生菌和细胞内共生菌两大类[2]。当前科学家们研究的大多是细胞外共生菌中的肠道微生物菌群。昆虫肠道微生物菌群的种类、数量及其产生的生物活性物质因昆虫的生存环境、取食特性及其他生物学特性等的不同而异。有研究表明,在自然界中有近乎一半的昆虫为植食性昆虫(白蚁、蝗虫等),该类型昆虫觅食种类多而杂,这就加大了摄取潜在致病型菌群的可能性,在这种情况下,植食性昆虫不仅耐微生物感染且衍生出具有“勃勃生机”的微生物菌群[3]。相对比而言,腐食性昆虫(蜣螂等)的肠道微生物菌群比植食性昆虫的菌群还要丰富[4]。
上述丰富的昆虫共生菌以其栖息环境的特殊性以及与宿主具有良好的协调互作关系,已被证明是活性次级代谢产物的多产者[5-7],昆虫共生菌的次级代谢产物具有潜在的医疗价值、新颖的分子结构和复杂的生物合成路径等[8]。近年来尽管有越来越多的研究者对昆虫共生菌群的次级代谢产物做出了深入研究,但是关于该方面的研究进展尚未见详细的归纳和分析。本文借鉴近年来国内外关于昆虫共生菌代谢产物的研究成果,根据天然产物化学结构的不同,将其分为6大类,分别为多肽类、萜类、醌酮类、内酯类、生物碱类、其他类化合物,结合其研究菌株来源、生物活性等进行综述,旨在为充分挖掘昆虫共生菌次级代谢产物的研究提供重要参考。
1 昆虫共生菌次级代谢产物的研究 1.1 多肽类化合物 多肽类化合物是α-氨基酸经脱水缩合作用得到的一类重要的普遍天然产物,亲脂性强,宜采用低极性或中等极性的有机溶剂提取,具有抗肿瘤、消炎、抗菌等多种生物活性。哈佛大学医学院Clardy课题组的Wyche等[9]首次从真菌Hymenochaete rubiginosa中分离到一株链霉菌属的放线菌(Streptomyces sp. CLI2509),并从该放线菌的次级代谢产物中发现了一个非比寻常的缩氨酸肽类化合物Tryptorubin A (1)(图 1),同时发现南方松甲虫共生放线菌(Streptomyces sp. SPB78)也能产生该化合物。该课题组的Blodgett等[10]在南方松甲虫共生链霉菌属放线菌的次级代谢产物中也发现两个未曾报道过的抗生素家庭成员Frontalamides A和B (2-3)。Dong-Chan Oh韩国****所在的实验室Park等[11]在三开蜣螂(Copris tripartitus)即屎壳郎的共生链霉菌属放线菌代谢物中分离获得一个新骨架的环丁烷型——三环内酰胺类化合物Tripartilactam (4),活性测试表明该化合物可作为Na+/K+ ATP酶的通道抑制剂(半数抑制浓度IC50为16.6 μg/mL);该课题组研究人员Soohyun Um[12]等亦从屎壳郎肠道杆菌属的次级代谢产物中分离得到新的分支环状肽类化合物Coprisamides A和B (5-6),实验表明这2个化合物在醌还原酶诱导实验中展示出强烈的活性作用。Oh等2011年[13]还在黄蜂共生链霉菌属放线菌的代谢产物中分离到一个之前未曾报道过的多烯烃大环内酰胺类化合物Sceliphrolactam (7),该化合物对白色念珠菌(Candida albicans)的生长表现出很好的抑制活性,IC50为8.3 μmol/L。南京大学的Xiao等[14]在蝗虫共生放线菌Amycolatopsis sp. HCa4的次级代谢物中分离到5个新的内酰胺类化合物(8-12),其中化合物9、11对耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus)表现出强烈的抑制活性。法国Langenfeld等[15]在一株昆虫病原真菌Beauveria felina代谢物中分离纯化获得一个新的环缩肽类化合物(13),该化合物对害虫的防治具有很好的功效,可以有效地杀死有害昆虫Sitophilus spp.,其半数致死量(LD50)值为10 μg/mL。德国Hans Kno?ll研究所Guo等[16]基于真菌-真菌配对与HRMS去重复化的策略在白蚁共生真菌Pseudoxylaria sp. X802中分离得到6个新的环状四肽类化合物Pseudoxylallemycins A?F (14-19),研究发现化合物15-17拥有一个罕见的丙二烯化学可合成修饰基团,该基团与化合物的合成修饰有关;化合物14-17对革兰氏阴性菌——绿脓杆菌(Pseudomonas aeruginosa)的生长具有抑制作用,对人类静脉血管内皮细胞与K-562细胞具有抗肿瘤活性。德国Muller[17]等从西方意大利蜜蜂(Apis mellifera)致病型共生芽孢杆菌Paenibacillus larvae的次级代谢产物中分离到9个非核糖体的多肽类化合物(20-28),进一步研究发现其次级代谢产物对蜜蜂幼虫腐臭病的治疗可提供很大的帮助,并对革兰氏阳性细菌生长有抑制作用,特别是化合物24-27具有开发为新型药物的潜能。美国Krasnoff等[18]在一株昆虫病原绿僵菌的次级代谢物中分离到2个结构新颖的肽类化合物(29-30),进一步实验表明,这2个化合物均表现出抗癌活性。Beemelmanns等[8]基于生物活性定向引导的代谢组学分析,通过LC-MS、HPLC等在白蚁共生放线菌Amycolatopsis sp. M39代谢产物中发现4个结构新颖的糖基化的内酰胺类化合物——macrotermycins A?D (31-34),活性测试发现,化合物31、33对人类致病菌金黄色葡萄球菌具有抗菌活性,而且该化合物对白蚁蚁巢的外来寄生真菌的生长具有很好的抑制性。哈佛医学院Carr等[19]在白蚁共生链霉菌的代谢物中分离到一个多肽类化合物(35)。Umeyama等[20]在一株昆虫病原菌(Cordyceps cardinalis)的萃取物中分离纯化到2个对椎体虫生长具有抑制作用的酰胺类化合物(36-37)。
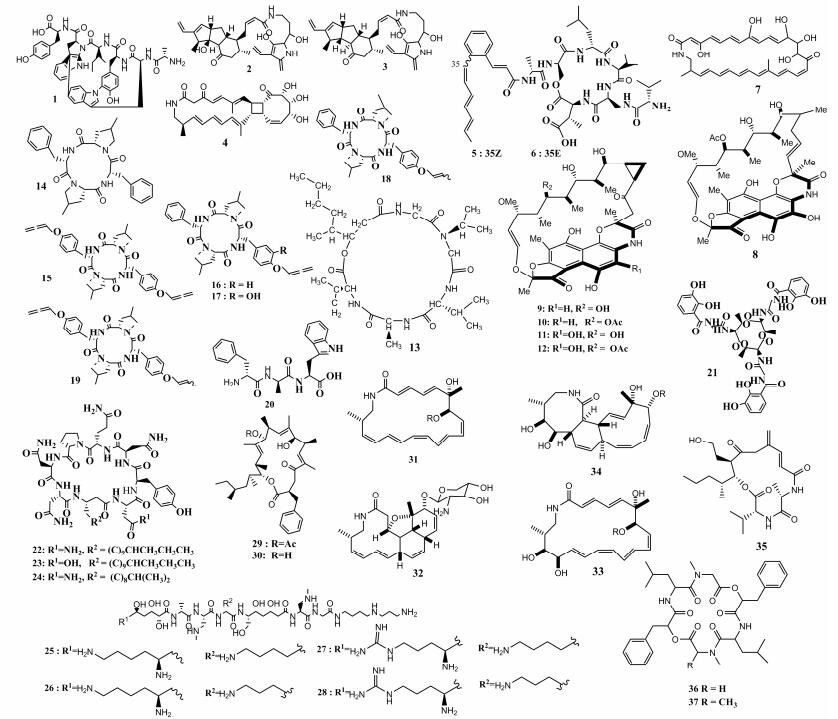 |
| 图 1 多肽类化合物1-37的结构示意图 Figure 1 Structure diagram of polycyclic peptide compounds 1-37. |
| 图选项 |
1.2 萜类化合物 萜类化合物作为天然产物中数量最多的一种,展示了不同的结构类型和有趣的生物活性特征。该类化合物是由(C5H8)n通式及其衍生降解物以各种形式存在的异戊烯类天然产物,具有抗肿瘤、抗菌、抗寄生虫等生物活性[21]。尽管大部分的萜类化合物是从植物源分离出来的,但是也有一部分化合物经常从昆虫共生菌的次级代谢产物中分离得到。中国科学院微生物研究所Chen等[22-23]从一株昆虫致病菌——拟盾壳霉属真菌(Paraconiothyrium hawaiiense)次级代谢产物中分离得到7个结构新颖的萜类化合物(38-44)(图 2),其中化合物38对人类肿瘤细胞系A549、T24、HeLa,HCT116和MCF-7均具有显著的生长抑制活性,化合物41对人类肿瘤细胞系T24也具有强烈的抑制活性,其IC50值为9.32 μmol/mL。中国科学院微生物研究所Yuan等[24]在昆虫共生真菌的代谢产物中分离纯化得到1个含有新六环骨架的botryane-倍半萜型代谢产物Hypocrolide A (45),该化合物的框架结构经单晶X-射线衍射得到。日本静冈大学Kobori等[25]对蜜环虫共生菌蜜环菌属Armillaria sp.的培养基代谢产物进行分离,再经波谱数据分析获得2个新颖的和7个已知的倍半萜类化合物(46-54)。活性研究显示,所有化合物均对植物的生长表现出抑制作用,化合物51和54还能抑制灰盖鬼伞菌(Coprinopsis cinerea)与毛柄金钱菌(Flammulina velutipes)菌丝的生长。
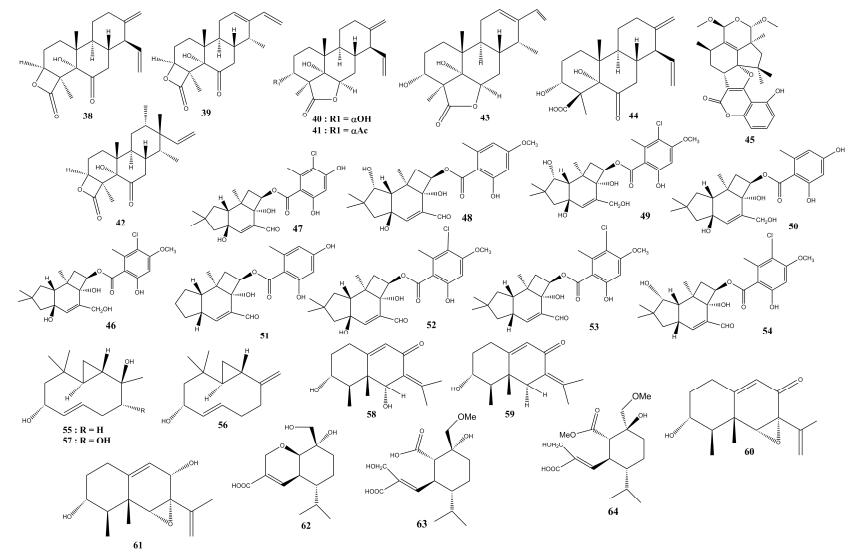 |
| 图 2 萜类化合物38-64的结构示意图 Figure 2 Structure diagram of terpenoid compounds 38-64. |
| 图选项 |
粪菌是指一类将动物粪便作为食物并进行大量繁殖的菌株。有****指出,当前此生物菌群作为活性天然产物的来源研究成果丰硕,但远远不够全面。Dinith R. Jayanetti等[26]在食粪虫共生菌Hypocopra rostrata次级代谢产物中分离纯化获得3个新的含环丙烷和环癸烯单位的倍半萜类化合物(55-57),化合物55与57对致病的金黄色葡萄球菌的生长有中等抑制活性。墨西哥Valle等[27]也从一株食粪虫青霉属共生真菌Penicillium sp. G1-a14代谢物中分离得到1个新的艾里莫芬烷型的倍半萜化合物3R, 6R-二羟基-9, 7(11)-二亚乙基三胺-8-氧化艾里莫芬烷(58)和3个该化合物的结构类似物(59-61),其中化合物59和60对籽粒苋(Amaranthus hypochondriacus) (IC50均为0.17 mmol/mL)和稗草(Echinochloa crusgalli) (IC50为0.17、0.30 mmol/mL)的根部生长具有显著的抑制作用。中国科学院微生物研究所Yan等[28]在白蚁巢子囊菌门真菌Xylaria sp.固体培养物中分离到3个新倍半萜类化合物(62-64),但生物活性未见报道。
1.3 醌酮类化合物 醌酮类化合物是指分子结构中含有不饱和的环二酮结构或存在易转变为这种结构的天然醌类化合物和含羧酸基团的小分子在聚酮合酶的催化作用下,通过多次克莱森重排得到的聚酮类化合物[29]。本文作者张应烙等[30-31]在大刀螳螂肠道共生菌(Daldinia eschscholzii)的次级代谢物中分离到7个新聚酮类化合物(65-71)(图 3),其中dalesconol A-B (65-66) 2个化合物含独特的碳骨架结构,且部分消旋。活性试验表明,这2个具对映异构体的化合物(65-66)在小鼠脾脏细胞增殖实验中起到免疫抑制作用,且活性上没有显著差异(IC50值在0.16-0.58 μg/mL之间);所有化合物都是非细胞毒性物质,具有开发为新颖治疗药物的潜力。该作者2012年又在白蚁共生放线菌的代谢物中分离到2个可以显著抑制植物致病菌水稻稻瘟病菌(Magnapothe oryzae)和苹果腐烂病菌(Valsa mali)的聚酮类化合物(72-73),其有望开发为新型农用杀菌剂[32]。
 |
| 图 3 醌酮类化合物65-105的结构示意图 Figure 3 Structure diagram of quinine and polyketides compounds 65-105. |
| 图选项 |
Freinkman等[33]在蚂蚁共生真菌Bionectria sp.的代谢物中分离到一个新聚酮类化合物bionectriol A (74),但未见相关活性报道。美国哈佛医学院Kim等[34]****采用活性跟踪的方法从南非洲大白蚁巢穴的一株链霉菌共生菌株M56的次级代谢产物中分离得到9个化合物(75-83),其中包括1个不同寻常的格尔德霉素类似物、安莎霉素类聚酮化合物Natalamycin A,活性试验结果表明,所分离到的化合物对致病真菌Pseudoxylaria X802都具有抗真菌活性。韩国****Kang等[35]在南非大白蚁(Macrotermes natalensis)的表面分离到一株链霉菌属菌株RB1,并从该菌的代谢产物中分离纯化到3个新的黄酮苷类化合物—termisoflavones A?C(84-86)和8个已知的黄酮类化合物(87-94);所有化合物均未表现出显著的抗菌活性,但当以顺铂(Cisplatin,CP)剂量为25 μmol/L浓度进行测试时,化合物89和94可显著减少其对肾功能细胞的损伤。美国****Park等[36]对昆虫病原菌Photorhabdus luminescens TT01的次级代谢产物进行了研究,从中分离纯化到1个新的含苯丙烷结构的氨基对苯醌类化合物(95),活性测试表明其对枯草芽孢杆菌(Bacillus subtilis)和酿酒酵母菌(Saccharomyces cerevisiae)具有抗菌活性。
本文作者张应烙等[37]在中华螽斯的共生镰刀属真菌Fusarium proliferatum的乙酸乙酯萃取物中发现一个新聚酮类化合物(96)和4个已知聚酮类化合物(97-100);活性研究显示,化合物96和99可以显著抑制杂草的生长;化合物97和98对病原细菌枯草芽孢杆菌的生长具有很好的抑制作用。2017年张应烙等[38]又在蜻蜓肠道共生真菌的代谢物中发现聚酮类化合物(101-103);活性测试发现,100-101对植物多种病原真菌的生长具有一定的抑制效果,101可很好抑制杂草的生长,其代谢物有望开发为杀菌剂和除草剂。此外,张应烙等[39]还从蜻蜓共生菌代谢物中分离到聚酮类化合物(104-105),其中化合物105对杨树溃疡病菌(Dothiorella gregaria)的生长具有中等强度的抑制效果。
1.4 内酯类化合物 内酯类化合物是指分子结构中存在羧基与羟基反应的酯基,并经环化作用形成的化合物,具有显著抗炎抗肿瘤、抗菌等活性[40]。本文作者张应烙等[41]在棉蝗(Chondracris rosee)的肠道共生真菌HC02(Pestalotiopsis sp.)的培养代谢物中分离到2个结构新颖的γ-内酯类化合物(106-107)和1个已知的内酯类化合物(108) (图 4),化合物106和107可以显著地抑制稗草的根部生长,抑制的IC50值分别为1.85×10-4、2.50×10-4 mol/L,与阳性对照活性相当。哈佛医学院van Arnam等[42]在两个相邻的蚂蚁蚁巢相关菌中分离得到一个不同寻常的具有抗真菌活性的多烯大环内酯类化合物selvamicin (109),该化合物的结构类似于临床上一种重要的抗真菌制霉菌素A1和两性霉素B,它独特的结构特征在于在第15位糖基化位点上存在一个阴离子型的6-脱氧甘露糖基和其对位上有一个不同寻常的4-O-甲基洋地黄毒糖;活性测试表明,该化合物对白色念珠菌、酿酒酵母菌、烟曲霉菌(Aspergillus fumigatus)均具有很好的抑菌活性,最低抑菌浓度(MIC)均为23 μmol/L。韩国天然产物研究所Shin等[43]对江华弓背蚁(Camponotus japonicus)木蚁的蚁后共生菌进行了研究,从其中一株共生菌株Deinococcus sp.次级代谢产物中发现4个新的氨基化的糖酯类化合物deinococcucins A?D (110-113),其中化合物110和113对小鼠Hepa-1c1c7细胞的醌还原酶具有显著的诱导作用。Li等[44]在与蟋蟀肠道共生的曲霉属真菌(A. iizukae)的代谢物中分离到4个新的芳香族的丁烯酸内酯类化合物(114-117)和3个已知内酯类化合物(118-120),其中化合物118具有显著的抗氧化活性。Horikawa等[45]在蚜虫共生菌Cryptomyzus sp.的代谢产物中分离到4个不饱和的δ-内酯类化合物(121-124),活性结果显示化合物(121-124)对人类白血病细胞表现出较好的细胞毒性作用。
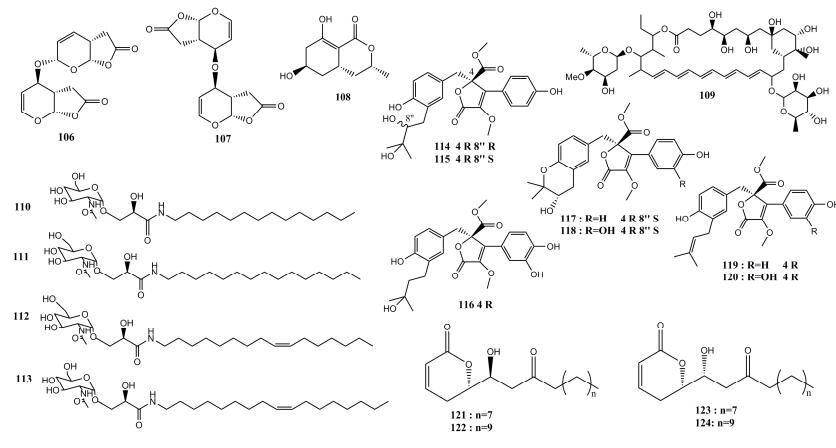 |
| 图 4 内脂类化合物106-124的结构示意图 Figure 4 Structure diagram of lactone compounds 106-124. |
| 图选项 |
1.5 生物碱类化合物 生物碱类化合物是广泛存在于自然界、具有复杂化学结构的一类含氮有机天然产物,具有抗肝炎、抗菌、杀虫等生物活性。韩国****Um等[46]在昆虫纲鞘翅目动物三开蜣螂的肠道共生放线菌中分离纯化得到2个化合物,结合多种色谱技术,这2个化合物被确定为首次发现的天然的具有萘醌-羟吲哚结构的生物碱类化合物Coprisidins A (125)和B (126) (图 5),对得到的化合物进一步研究发现,化合物125对Na+/K+泵的ATP酶具有抑制活性,化合物126对还原型辅酶NAD(P)H—醌氧化还原酶活性具有一定的诱导活性。南京大学Bi等[47]在黑翅土白蚁(Odontotermes formosanus)的共生放线菌高阳链霉菌发酵液的乙酸乙酯萃取物中分离纯化到一个新的生物碱类化合物(127),活性实验分析表明,该化合物对大肠杆菌(Escherichia coli)、金黄色葡萄球菌、白色念珠菌等致病菌具有微弱的抗菌活性。同济医学院Chen等[48-50]在陆生节肢动物普通卷甲虫(Armadillidium vulgare)的共生菌Chaetomium globosum TW1-1的甲醇提取物中分离到21个前所未有的生物碱类化合物(128-148),其中化合物(128-129)包含一个新的碳骨架结构;研究者进一步对化合物130-148的活性进行了研究,发现化合物137、147、148对5种人体癌细胞株(骨髓白血病细胞、肝癌细胞、肺癌细胞、乳腺癌细胞、结肠癌细胞)均表现出显著的细胞毒性作用,其中化合物137的IC50值在3.31-9.83 μmol/L范围之内,化合物147和148的IC50值在14.45-30.42 μmol/L范围之内。Bunyapaiboonsri等[51]对鳞翅目昆虫致病真菌细脚棒束孢(Isaria tenuipes)真菌进行了深入研究,从该菌的次级代谢产物中分离到4个新生物碱类化合物(149-152),活性测试表明,化合物(149-152)表现出一定的抗疟疾活性和抗癌活性。
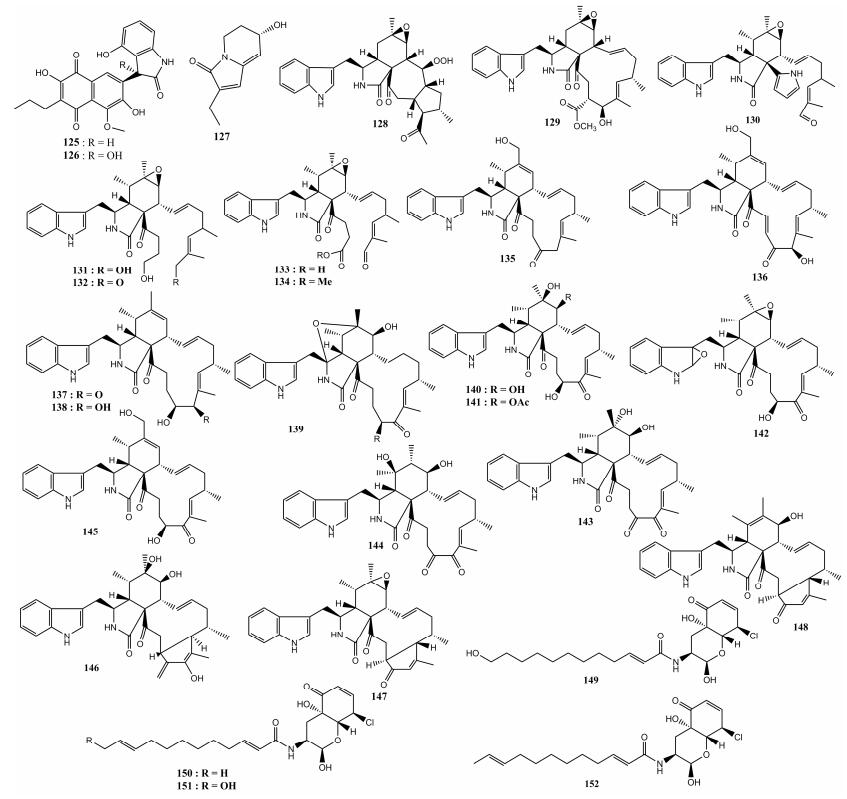 |
| 图 5 生物碱类化合物125-152的结构示意图 Figure 5 Structure diagram of alkaloids compounds 125-152. |
| 图选项 |
1.6 其他类化合物 北京药理学研究所某国家重点实验室Ren等[52]从昆虫Serrataspis sp.共生真菌肉座菌属(Hypocrea sp.)的固体培养物中发现6个结构新颖的醚类二聚体复合物hypocriols A?F (153-158) (图 6),活性试验表明,该系列化合物对人类4种肿瘤细胞系均表现出一定的抗增殖的作用。法国Nirma等[53]对象白蚁Nasutitermes corniger巢穴的一株共生真菌的活性次级产物进行了研究,结合多种分离方法,分离到了3个酸类化合物Ilicicolinic acids A、C、D (159-161)和1个ilicicolinal (162),活性测定实验显示,159-161化合物对红色毛藓菌(Trichophyton rubrum SNB-TR1)和大肠杆菌具有很好的抗菌活性。南京大学Ma等[54]在一株与蝗虫共生放线菌(Amycolatopsis sp. HCa4)的代谢物中分离到2个结构新颖的烯二炔类化合物(163-164),活性测试数据显示,化合物163对乳腺癌细胞具有选择性的细胞毒性作用。
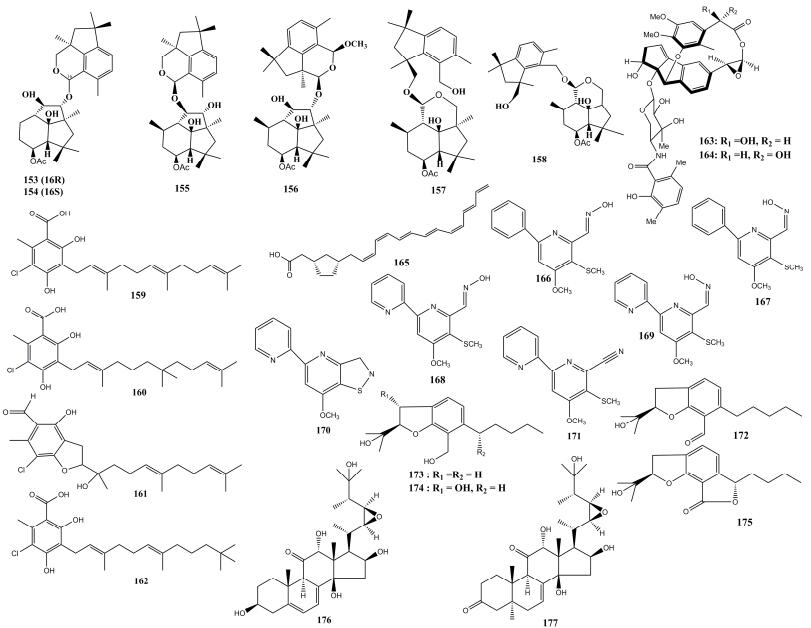 |
| 图 6 其它类化合物153-177的结构示意图 Figure 6 Structure diagram of others compounds 153-177. |
| 图选项 |
Oh等[55]在南方松甲虫的共生放线菌的代谢产物中分离到1个多烯过氧化物Mycangimycin (165),该化合物对酿酒酵母菌和白色念珠菌都有一定的抗菌活性;该****所在课题组的Kim等[56]在蜣螂共生放线菌的代谢物中分离到2个新吡啶类化合物(166-167)和4个已知吡啶类化合物(168-171),活性研究显示,化合物166、167、170、171具有显著的神经保护作用。
日本Asai等通过表观遗传学修饰(在培养基中添加辛二酰双羟肟酸和组蛋白脱乙酰酶两种抑制剂)的方法,从1株昆虫病原真菌Cordyceps annullata的代谢产物中分离纯化到4个新奇的苯并呋喃类化合物(172-175)[57];该****同样采用表观遗传学修饰的方法对另一株昆虫致病球束梗孢属真菌的代谢产物进行分离,得到2个新的被高度氧化的麦角固醇类化合物(176-177)[58]。
2 结论和展望 本文主要对自2008年以来已报道的177个昆虫共生菌来源的次级代谢产物进行了综述。这些次级代谢产物数量繁多,含有多肽类、萜类、生物碱类、醌类和聚酮类等多样的结构类型,显示出抗菌、抗氧化、抗肿瘤、除草、抗疟疾等生物活性,是发现先导性化合物和新型药物的重要来源。
(1) 就昆虫共生菌的菌株类型来源来说,在所产生的109个新化合物中,绝大多数的化合物菌株类型来源为昆虫共生真菌(82个),其次为细菌(27个)。
(2) 就化合物的结构类型来说,如图 7所示,昆虫共生菌的次生代谢物中化合物最多的类型为醌酮类化合物(41个),其次为多肽类化合物(37个)。就菌株来源而言,醌酮类化合物的发现并没有倾向于某一种植食性昆虫共生菌类型;多肽类化合物在植食性昆虫共生菌中发现频率稍高。
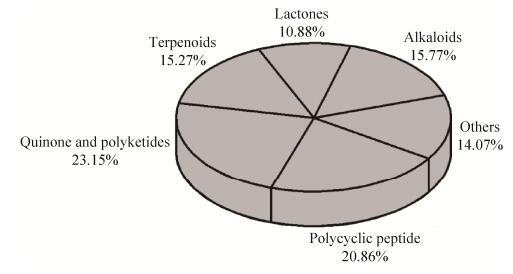 |
| 图 7 昆虫共生菌的次级代谢产物的结构分类 Figure 7 Structural categories of secondary metabolites derived from insect symbionts. |
| 图选项 |
(3) 就化合物的生物活性来说,有84个化合物具有抗菌、抗肿瘤、抗疟疾、除草、对醌氧化还原酶活性的诱导活性以及Na+/K+泵ATP酶的抑制活性等。抗菌(56个)和抗肿瘤(56个)为主要的生物活性类型。
结合本文所统计的研究成果与现阶段的研究进展来看,可着重加强对昆虫共生细菌(尤其是一些鲜为人知的稀有放线菌种属)的天然活性产物的研究,并有目的地加强对内酯类和生物碱类等发现概率较少化合物的研究,增强发现新天然产物的概率;其次适当加强活性类型研究较少的化合物研究,譬如抗疟疾、除草等,以拓展生物活性研究领域。
昆虫共生菌的次级代谢产物具有极为重要的研究价值,但如何大力加强对昆虫共生菌这一特境微生物的研究来发现具有显著治疗功效的新型药物,需要研究者们不断探索和创新。未来的研究可以注重以下3个方面:一是拓宽昆虫种类研究范围,寻找更多能够产生天然活性产物的共生菌资源;二是对于已经分离到的新型天然产物,深入研究它们的合成机理、作用机制、生物活性以及进一步运用表观遗传学修饰发现新型化合物[59-60];三是对已分离到的活性显著的新天然产物的共生菌进行遗传改造或发酵工艺改良,以增加其产量,提高其应用性。
综上所述,昆虫共生菌的次级代谢产物产量丰富,结构新颖、活性多样,但是当前对该方面的研究仍不够全面,因此致力于该方向的大力研究可为新型药物的开发提供重要信息。
References
| [1] | Shao YQ, Chen BS, Sun C, Ishida K, Hertweck C, Boland W. Symbiont-derived antimicrobials contribute to the control of the lepidopteran gut microbiota. Cell Chemical Biology, 2017, 24(1): 66-75. DOI:10.1016/j.chembiol.2016.11.015 |
| [2] | Basset Y, Cizek L, Cuenoud P, Didham RK, Guilhaumon F, Missa O, Novotny V, Odegaard F, Roslin T, Schmidl J, Tishechkin AK, Winchester NN, Roubik DW, Aberlenc HP, Bail J, Barrios H, Bridle JR, Castano-Meneses G, Corbara B, Curletti G, Duarte da Rocha W, de Bakker D, Delabie JHC, Dejean A, Fagan LL, Floren A, Kitching RL, Medianero E, Miller SE, Gama de Oliveira E, Orivel J, Pollet M, Rapp M, Ribeiro SP, Roisin Y, Schmidt JB, Sorensen L, Leponce M. Arthropod diversity in a tropical forest. Science, 2012, 338(6113): 1481-1484. DOI:10.1126/science.1226727 |
| [3] | Wang SB, Qu S. Insect symbionts and their potential application in pest and vector-borne disease control. Bulletin of Chinese Academy of Sciences, 2017, 32(8): 863-872. (in Chinese) 王四宝, 曲爽. 昆虫共生菌及其在病虫害防控中的应用前景. 中国科学院院刊, 2017, 32(8): 863-872. |
| [4] | Colman DR, Toolson EC, Takacs-Vesbach CD. Do diet and taxonomy influence insect gut bacterial communities?. Molecular Ecology, 2012, 21(20): 5124-5137. DOI:10.1111/mec.2012.21.issue-20 |
| [5] | Van Arnam EB, Currie CR, Clardy J. Defense contracts:molecular protection in insect-microbe symbioses. Chemical Society Reviews, 2018, 47(57): 1638-1651. |
| [6] | Beemelmanns C, Guo H, Rischer M, Poulsen M. Natural products from microbes associated with insects. Beilstein Journal of Organic Chemistry, 2016, 12: 314-327. DOI:10.3762/bjoc.12.34 |
| [7] | Ramadhar TR, Beemelmanns C, Currie CR, Clardy J. Bacterial symbionts in agricultural systems provide a strategic source for antibiotic discovery. Journal of Antibiotics, 2014, 67(1): 53-58. DOI:10.1038/ja.2013.77 |
| [8] | Beemelmanns C, Ramadhar TR, Kim KH, Klassen JL, Cao SG, Wyche TP, Hou YP, Poulsen M, Bugni TS, Currie CR, Clardy J. Macrotermycins A-D, glycosylated macrolactams from a termite-associated Amycolatopsis sp. M39. Organic Letters, 2017, 19(5): 1000-1003. DOI:10.1021/acs.orglett.6b03831 |
| [9] | Wyche TP, Ruzzini AC, Schwab L, Currie CR, Clardy J. Tryptorubin A:A polycyclic peptide from a fungus-derived Streptomycete. Journal of the American Chemical Society, 2017, 139(37): 12899-12902. DOI:10.1021/jacs.7b06176 |
| [10] | Blodgett JAV, Oh DC, Cao S, Currie CR, Kolter R, Clardy J. Common biosynthetic origins for polycyclic tetramate macrolactams from phylogenetically diverse bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(26): 11692-11697. DOI:10.1073/pnas.1001513107 |
| [11] | Park SH, Moon K, Bang HS, Kim SH, Kim DG, Oh KB, Shin J, Oh DC. Tripartilactam, a cyclobutane-bearing tricyclic lactam from a Streptomyces sp. in a Dung Beetle's Brood Ball. Organic Letters, 2012, 14(5): 1258-1261. DOI:10.1021/ol300108z |
| [12] | Um S, Park SH, Kim J, Park HJ, Ko K, Bang HS, Lee SK, Shon J, Oh DC. Coprisamides A and B, new branched cyclic peptides from a gut bacterium of the dung beetle Copris tripartitus. Organic Letters, 2015, 17(5): 1272-1275. DOI:10.1021/acs.orglett.5b00249 |
| [13] | Oh DC, Poulsen M, Currie CR, Clardy J. Sceliphrolactam, a polyene macrocyclic lactam from a wasp-associated Streptomyces sp.. Organic Letters, 2011, 13(4): 752-755. DOI:10.1021/ol102991d |
| [14] | Xiao YS, Zhang B, Zhang M, Guo ZK, Deng XZ, Shi J, Li W, Jiao RH, Tan RX, Ge HM. Rifamorpholines A-E, potential antibiotics from locust-associated actinobacteria Amycolatopsis sp. Hca4. Organic & Biomolecular Chemistry, 2017, 15(18): 3909-3916. |
| [15] | Langenfeld A, Blond A, Gueye S, Herson P, Nay B, Dupont J, Prado S. Insecticidal cyclodepsipeptides from Beauveria felina. Journal of Natural Products, 2011, 74(4): 825-830. DOI:10.1021/np100890n |
| [16] | Guo HJ, Kreuzenbeck NB, Otani S, Garcia-Altares M, Dahse HM, Weigel C, Aanen DK, Hertweck C, Poulsen M, Beemelmanns C. Pseudoxylallemycins A-F, cyclic tetrapeptides with rare allenyl modifications isolated from Pseudoxylaria sp. X802:a competitor of fungus-growing termite cultivars. Organic Letters, 2016, 18(14): 3338-3341. DOI:10.1021/acs.orglett.6b01437 |
| [17] | Müller S, Garcia-Gonzalez E, Genersch E, Süssmuth RD. Involvement of secondary metabolites in the pathogenesis of the American foulbrood of honey bees caused by Paenibacillus larvae. Natural Product Reports, 2015, 32(6): 765-778. DOI:10.1039/C4NP00158C |
| [18] | Krasnoff SB, Englich U, Miller PG, Shuler ML, Glahn RP, Donzelli BGG, Gibson DM. Metacridamides A and B, macrocycles from conidia of the entomopathogenic fungus Metarhizium acridum. Journal of Natural Products, 2012, 75(2): 175-180. DOI:10.1021/np2007044 |
| [19] | Carr G, Poulsen M, Klassen JL, Hou YP, Wyche TP, Bugni TS, Currie CR, Clardy J. Microtermolides A and B from termite-associated Streptomyces sp. and structural revision of vinylamycin. Organic Letters, 2012, 14(11): 2822-2825. DOI:10.1021/ol301043p |
| [20] | Umeyama A, Takahashi K, Grudniewska A, Shimizu M, Hayashi S, Kato M, Okamoto Y, Suenaga M, Ban S, Kumada T, Ishiyama A, Iwatsuki M, Otoguro K, ōmura S, Hashimoto T. In vitro antitrypanosomal activity of the cyclodepsipeptides, cardinalisamides A-C, from the insect pathogenic fungus Cordyceps cardinalis NBRC 103832. The Journal of Antibiotics, 2014, 67(2): 163-166. DOI:10.1038/ja.2013.93 |
| [21] | Fu QJ, Li MC. Research progress in marine and their biological activities. Chinese Journal of Marine Drugs, 2009(6): 52-58. (in Chinese) 付青姐, 李明春. 海洋萜类化合物及其生物活性研究进展. 中国海洋药物, 2009(6): 52-58. |
| [22] | Chen SX, Zhang Y, Niu SB, Liu XZ, Che YS. Cytotoxic cleistanthane and cassane diterpenoids from the entomogenous fungus Paraconiothyrium hawaiiense. Journal of Natural Products, 2014, 77(6): 1513-1518. DOI:10.1021/np500302e |
| [23] | Chen SX, Zhang Y, Zhao C, Ren FX, Liu XZ, Che YS. Hawaiinolides E-G, cytotoxic cassane and cleistanthane diterpenoids from the entomogenous fungus Paraconiothyrium hawaiiense. Fitoterapia, 2014, 99: 236-242. DOI:10.1016/j.fitote.2014.09.021 |
| [24] | Yuan YF, Feng Y, Ren FX, Niu SB, Liu XZ, Che YS. A botryane metabolite with a new hexacyclic skeleton from an entomogenous fungus Hypocrea sp.. Organic Letters, 2013, 15(23): 6050-6053. DOI:10.1021/ol402953k |
| [25] | Kobori H, Sekiya A, Suzuki T, Choi JH, Hirai H, Kawagishi H. Bioactive sesquiterpene aryl esters from the culture broth of Armillaria sp.. Journal of Natural Products, 2015, 78(1): 163-167. DOI:10.1021/np500322t |
| [26] | Jayanetti DR, Yue Q, Bills GF, Gloer JB. Hypocoprins A-C:new sesquiterpenoids from the coprophilous fungus Hypocopra rostrata. Journal of Natural Products, 2015, 78(3): 396-401. DOI:10.1021/np5007718 |
| [27] | del Valle P, Figueroa M, Mata R. Phytotoxic eremophilane sesquiterpenes from the coprophilous fungus Penicillium sp. G1-a14. Journal of Natural Products, 2015, 78(2): 339-342. DOI:10.1021/np5009224 |
| [28] | Yan S, Li SF, Wu W, Zhao F, Bao L, Ding R, Gao H, Wen HA, Song FH, Liu HW. Terpenoid and phenolic metabolites from the fungus xylaria sp. associated with termite nests. Chemistry & Biodiversity, 2011, 8(9): 1689-1700. |
| [29] | Qiu L, Wang HG, Feng BM. Research progress on polyketides with antitumor activities from marine actinomycetes. Journal of Shenyang Pharmaceutical University, 2012(4): 325-330. (in Chinese) 邱琳, 王惠国, 冯宝民. 海洋放线菌中具有抗肿瘤活性聚酮类化合物的研究进展. 沈阳药科大学学报, 2012(4): 325-330. |
| [30] | Zhang YL, Ge HM, Zhao W, Dong H, Xu Q, Li SH, Li J, Zhang J, Song YC, Tan RX. Unprecedented immunosuppressive polyketides from Daldinia eschscholzii, a mantis-associated fungus. Angewandte Chemie International Edition, 2008, 47(31): 5823-5826. DOI:10.1002/anie.v47:31 |
| [31] | Zhang YL, Zhang J, Jiang N, Lu YH, Wang L, Xu SH, Wang W, Zhang GF, Xu Q, Ge HM, Ma J, Song YC, Tan RX. Immunosuppressive polyketides from mantis-associated Daldinia eschscholzii. Journal of the American Chemical Society, 2011, 133(15): 5931-5940. DOI:10.1021/ja110932p |
| [32] | Zhang YL, Li S, Jiang DH, Kong LC, Zhang PH, Xu JD. Antifungal activities of metabolites produced by a termite-associated Streptomyces canus BYB02. Journal of Agricultural & Food Chemistry, 2013, 61(7): 1521-1524. |
| [33] | Freinkman E, Oh DC, Scott JJ, Currie CR, Clardy J. Bionectriol A, a polyketide glycoside from the fungus Bionectria sp. associated with the fungus-growing ant, Apterostigma dentigerum. Tetrahedron Letters, 2009, 50(49): 6834-6837. DOI:10.1016/j.tetlet.2009.09.120 |
| [34] | Kim KH, Ramadhar TR, Beemelmanns C, Cao SG, Poulsen M, Currie CR, Clardy J. Natalamycin A, an ansamycin from a termite-associated Streptomyces sp.. Chemical Science, 2014, 5(11): 4333-4338. DOI:10.1039/C4SC01136H |
| [35] | Kang RH, Lee D, Benndorf R, Jung WH, Beemelmanns C, Kang KS, Kim KH. Termisoflavones A-C, isoflavonoid glycosides from termite-associated Streptomyces sp. RB1. Journal of Natural Products, 2016, 79(12): 3072-3078. DOI:10.1021/acs.jnatprod.6b00738 |
| [36] | Park HB, Crawford JM. Lumiquinone A, an α-aminomalonate-derived aminobenzoquinone from Photorhabdus luminescens. Journal of Natural Products, 2015, 78(6): 1437-1441. DOI:10.1021/np500974f |
| [37] | Li S, Shao MW, Lu YH, Kong LC, Jiang DH, Zhang YL. Phytotoxic and antibacterial metabolites from Fusarium proliferatum ZS07 isolated from the gut of long-horned grasshoppers. Journal of Agricultural & Food Chemistry, 2014, 62(36): 8997-9001. |
| [38] | Lu YH, Jin LP, Kong LC, Zhang YL. Phytotoxic, antifungal and immunosuppressive metabolites from Aspergillus terreus QT122 isolated from the gut of dragonfly. Current Microbiology, 2017, 74(1): 84-89. DOI:10.1007/s00284-016-1157-y |
| [39] | Xu X, Lu YH, Zhang YL. Isolation and identification of bioactive secondary metabolites produced by strain QTYC38, a fungus isolated from the gut of Pantala flavescens larvae. Acta Microbiologica Sinica, 2017, 57(12): 1797-1805. (in Chinese) 徐晓, 卢贻会, 张应烙. 黄蜻幼虫肠道分离菌QTYC38活性代谢产物的分离和鉴定. 微生物学报, 2017, 57(12): 1797-1805. |
| [40] | 陈浩. 1β-hydroxyalantolactone的全合成探索和α-山道年结构修饰及衍生物抗炎抗肿瘤活性研究. 苏州大学硕士学位论文, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D506750 |
| [41] | Zhang YL, Ge HM, Li F, Song YC, Tan RX. New phytotoxic metabolites from Pestalotiopsis sp. HC02, a fungus residing in Chondracris rosee gut. Chemistry & Biodiversity, 2008, 5(11): 2402-2407. |
| [42] | Van Arnam EB, Ruzzini AC, Sit CS, Horn H, Pinto-Tomás AA, Currie CR, Clardy J. Selvamicin, an atypical antifungal polyene from two alternative genomic contexts. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(46): 12940-12945. DOI:10.1073/pnas.1613285113 |
| [43] | Shin B, Park SH, Kim BY, Jo SI, Lee SK, Shin J, Oh DC. Deinococcucins A?D, aminoglycolipids from Deinococcus sp., a gut bacterium of the carpenter ant Camponotus japonicus. Journal of Natural Products, 2017, 80(11): 2910-2916. DOI:10.1021/acs.jnatprod.7b00426 |
| [44] | Li LJ, Li TX, Kong LY, Yang MH. Antioxidant aromatic butenolides from an insect-associated Aspergillus iizukae. Phytochemistry Letters, 2016, 16: 134-140. DOI:10.1016/j.phytol.2016.03.014 |
| [45] | Horikawa M, Inai M, Oguri Y, Kuroda E, Tanaka M, Suzuki S, Ito T, Takahashi S, Kaku H, Tsunoda T. Isolation and total syntheses of cytotoxic cryptolactones A1, A2, B1, and B2:α, β-unsaturated δ-lactones from a Cryptomyzus sp. aphid. Journal of Natural Products, 2014, 77(11): 2459-2464. DOI:10.1021/np500542x |
| [46] | Um S, Bach DH, Shin B, Ahn CH, Kim CH, Bang HS, Oh KB, Lee SK, Shin J, Oh DC. Naphthoquinone-oxindole alkaloids, coprisidins A and B, from a gut-associated bacterium in the dung beetle, Copris tripartitus. Organic Letters, 2016, 18(22): 5792-5795. DOI:10.1021/acs.orglett.6b02555 |
| [47] | Bi SF, Guo ZK, Jiang N, Jiao RH, Ge HM, Tan RX. New alkaloid from Streptomyces koyangensis residing in Odontotermes formosanus. Journal of Asian Natural Products Research, 2013, 15(4): 422-425. DOI:10.1080/10286020.2013.767246 |
| [48] | Chen CM, Zhu HC, Li XN, Yang J, Wang JP, Li GT, Li Y, Tong QY, Yao GM, Luo ZW, Xue YB, Zhang YH. Armochaeglobines A and B, two new indole-based alkaloids from the arthropod-derived fungus Chaetomium globosum. Organic Letters, 2015, 17(3): 644-647. DOI:10.1021/ol503666b |
| [49] | Chen CM, Wang JP, Liu JJ, Zhu HC, Sun B, Wang J, Zhang JW, Luo ZW, Yao GM, Xue YB, Zhang YH. Armochaetoglobins A-J:cytochalasan alkaloids from Chaetomium globosum TW1-1, a fungus derived from the terrestrial arthropod Armadillidium vulgare. Journal of Natural Products, 2015, 78(6): 1193-1201. DOI:10.1021/np500626x |
| [50] | Chen CM, Tong QY, Zhu HC, Tan DD, Zhang JW, Xue YB, Yao GM, Luo ZW, Wang JP, Wang YY, Zhang YH. Nine new cytochalasan alkaloids from Chaetomium globosum TW1-1(Ascomycota, Sordariales). Scientific Reports, 2016, 6: 18711. DOI:10.1038/srep18711 |
| [51] | Bunyapaiboonsri T, Yoiprommarat S, Srisanoh U, Choowong W, Tasanathai K, Hywel-Jones NL, Luangsa-ard JJ, Isaka M. Isariotins G-J from cultures of the Lepidoptera pathogenic fungus Isaria tenuipes. Phytochemistry Letters, 2011, 4(3): 283-286. DOI:10.1016/j.phytol.2011.04.018 |
| [52] | Ren FX, Zhu SM, Wang B, Li L, Liu XZ, Su RB, Chen YS. Hypocriols A-F, heterodimeric botryane ethers from Hypocrea sp. an insect-associated fungus. Journal of Natural Products, 2016, 79(7): 1848-1856. DOI:10.1021/acs.jnatprod.6b00394 |
| [53] | Nirma C, Eparvier V, Stien D. Antibacterial ilicicolinic acids C and D and ilicicolinal from Neonectria discophora SNB-CN63 isolated from a termite nest. Journal of Natural Products, 2015, 78(1): 159-162. DOI:10.1021/np500080m |
| [54] | Ma SY, Xiao YS, Zhang B, Shao FL, Guo ZK, Zhang JJ, Jiao RH, Sun Y, Xu Q, Tan RX, Ge HM. Amycolamycins A and B, two enediyne-derived compounds from a locust-associated actinomycete. Organic Letters, 2017, 19(22): 6208-6211. DOI:10.1021/acs.orglett.7b03113 |
| [55] | Oh DC, Scott JJ, Currie CR, Clardy J. Mycangimycin, A polyene peroxide from a mutualist Streptomyces sp.. Organic Letters, 2009, 11(3): 633-636. DOI:10.1021/ol802709x |
| [56] | Kim SH, Ko H, Bang HS, Park SH, Kim DG, Kwon HC, Kim SY, Shin J, Oh DC. Coprismycins A and B, neuroprotective phenylpyridines from the dung beetle-associated bacterium, Streptomyces sp.. Bioorganic & Medicinal Chemistry Letters, 2011, 21(19): 5715-5718. |
| [57] | Asai T, Luo D, Obara Y, Taniguchi T, Monde K, Yamashita K, Oshima Y. Dihydrobenzofurans as cannabinoid receptor ligands from Cordyceps annullata, an entomopathogenic fungus cultivated in the presence of an HDAC inhibitor. Tetrahedron Letters, 2012, 53(17): 2239-2243. DOI:10.1016/j.tetlet.2012.02.088 |
| [58] | Asai T, Chung YM, Sakurai H, Ozeki T, Chang FR, Wu YC, Yamashita K, Oshima Y. Highly oxidized ergosterols and isariotin analogs from an entomopathogenic fungus, Gibellula formosana, cultivated in the presence of epigenetic modifying agents. Tetrahedron, 2012, 68(29): 5817-5823. DOI:10.1016/j.tet.2012.05.020 |
| [59] | Zhang AH, Liu W, Jiang N, Wang XL, Wang G, Xu Q, Tan RX. Sequestration of guest intermediates by dalesconol bioassembly lines in Daldinia eschscholzii. Organic Letters, 2017, 19(8): 2142-2145. DOI:10.1021/acs.orglett.7b00786 |
| [60] | Zhang AH, Tan R, Jiang N, Yusupu K, Wang G, Wang XL, Tan RX. Selesconol, a fungal polyketide that induces stem cell differentiation. Organic Letters, 2016, 18(21): 5488-5491. DOI:10.1021/acs.orglett.6b02688 |
