陈小强1,2, 陈德局2

 , 朱育菁2, 陈燕萍2, 张海峰2, 刘波2
, 朱育菁2, 陈燕萍2, 张海峰2, 刘波2

1.福建农林大学生命科学学院, 福建 福州 350002;
2.福建省农业科学院农业生物资源研究所, 福建 福州 350003
收稿日期:2017-12-05;修回日期:2018-01-25;网络出版日期:2018-03-14
基金项目:福建省农业科学院科技创新团队PI项目(2016PI43);福建省自然科学基金(2017J01049);福建省省属公益项目(2016R1017-6);福建省农科院英才计划(YC2016-14);福建省农科院博士基金(2015BS-5)
*通信作者:陈德局, E-mail:chendeju@163.com
刘波, Tel/Fax:+86-591-87882571, E-mail:fzliubo@163.com
摘要:[目的]由青枯雷尔氏菌(Ralstonia solanacearum)引起的植物青枯病是一种毁灭性土传病害。胞外多糖(extracellular polysaccharides,EPS)是青枯雷尔氏菌关键的致病因子之一。通过构建胞外多糖缺失突变株,研究胞外多糖在青枯病致病中的作用。[方法]从青枯雷尔氏菌FJAT-91的基因组中克隆出胞外多糖合成结构基因epsD同源臂,克隆至自杀性质粒pK18mobsacB,再将庆大霉素抗性基因(Gm)插入同源臂中间,获得重组质粒pK18-epsD。将重组质粒转化至青枯雷尔氏菌FJAT-91感受态细胞中,通过同源重组敲除epsD基因,获得EPS合成缺失的突变株FJAT-91ΔepsD。研究突变株与野生菌株在菌落形态、胞外多糖合成、运动能力、定殖能力的差异性。[结果]突变菌株FJAT-91ΔepsD与出发菌株FJAT-91相比:胞外多糖产量显著减少,生长较慢;泳动能力(swimming motility)和群集运动能力(swarming motility)显著降低;在番茄苗根部和茎部的定殖能力显著降低;弱化指数(AI)为0.905,鉴定为无致病力菌株。[结论]胞外多糖在青枯雷尔氏菌的致病中起着关键的作用,本课题研究成果为开发植物疫苗提供了优良的材料与研究基础。
关键词: 青枯雷尔氏菌 胞外多糖 epsD 青枯病
Construction and characterization of extracellular polysaccharide deletion mutant of Ralstonia solanacearum
Xiaoqiang Chen1,2, Deju Chen2

 , Yujing Zhu2, Yanping Chen2, Haifeng Zhang2, Bo Liu2
, Yujing Zhu2, Yanping Chen2, Haifeng Zhang2, Bo Liu2

1.College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China;
2.Agricultural Bio-resources Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, Fujian Province, China
Received 5 December 2017; Revised 25 January 2018; Published online 14 March 2018
*Corresponding author: Deju Chen, E-mail: chendeju@163.com
Bo Liu, Tel/Fax:+86-591-87882571, E-mail: fzliubo@163.com
Supported by the Science and Technology Innovation Team PI Project of FAAS (2016PI43), by the Natural Science Foundation of Fujian Province (2017J01049), by the Provincial Public Welfare Projects in Fujian (2016R1017-6), by the Talents Program of FAAS (YC2016-14) and by the Dr. Fund of FAAS (2015BS-5)
Abstract: [Objective]Bacterial wilt is a soil-borne disease caused by Ralstonia solanacearum. Extracellular polysaccharides are one of the key pathogenic factors of R. solanacearum. The physiological functions of extracellular polysaccharides on the pathogenesis of bacterial wilt were studied by constructing a mutant with synthesis of extracellular polysaccharides deficiency.[Methods]First, we cloned the homologous arm of epsD from the genome of R. solanacearum FJAT-91, then inserted into suicide plasmid pK18mobsacB. Second, the Gm gene was inserted into homologous arm to obtain recombinant plasmid pK18-epsD. Third, the recombinant plasmid was transformed into R. solanacearum FJAT-91 competent cells. The epsD gene deletion mutant was constructed by homologous recombination. Finally, we detected the differences of the biological characteristics of mutant strains and wild-type strains.[Results]Compared with the wild-type strains, the mutant strains showed different features. The mutant showed: grew slowly and decreased the yield of extracellular polysaccharides; significantly reduced the abilities of swimming motility and swarming motility; significantly decreased the colonization ability in roots and stems of tomato; had the Attenuation Index (AI) with 0.905 and the avirulence to tomato which indicated a nonpathogenic strain.[Conclusion]These results suggested that extracellular polysaccharides played the key role in pathogenicity of R. solanacearum. This research provides excellent materials and research foundation for the development of plant vaccines.
Key words: Ralstonia solanacearum extracellular polysaccharide epsD bacterial wilt
植物青枯病是由青枯雷尔氏菌引起的一种毁灭性土传病害[1]。青枯雷尔氏菌可侵染50多个科的数百种植物,包括重要的经济作物如番茄、马铃薯、茄子、花生等。青枯雷尔氏菌有多种毒力因子,其中主要包括效应分子蛋白、细胞壁降解酶以及胞外多糖(EPS)[2]。青枯雷尔氏菌侵染宿主后大量繁殖,合成的EPS可堵塞植物维管束,阻碍水分的运输从而直接导致植物萎蔫[3];有研究表明,EPS可掩盖细胞表面可被宿主识别的特征,逃避宿主的抗菌免疫防御从而保护青枯雷尔氏菌[4];青枯雷尔氏菌在导管处合成大量EPS,促进形成群体优势而形成生物膜并逃避宿主识别[5];青枯雷尔氏菌产生EPS能增加其运动能力,从而有助于提升其侵染宿主的能力及在宿主体内的定殖能力[6],胞外多糖(EPS)成为青枯雷尔氏菌致病的关键因子。
青枯雷尔氏菌胞外多糖(EPS)生物合成途径的许多蛋白质是由16 kb的eps操纵子编码的,eps操纵子上的任何基因突变都会阻碍EPS的产生。eps操纵子包含12个以上基因,它的转录由1个启动子控制,需要10个调节基因的产物和3种以上不同的信号相互作用才能完全激活[7]。胞外多糖的合成基因形成eps操纵子,由调控基因和合成基因组成,调控基因与合成基因在基因组的位点不相邻,为合成基因的反式调控因子[8]。目前,在青枯雷尔氏菌中胞外多糖合成的结构基因为7个,分别为epsA、epsP、epsB、epsC、epsD、epsE、epsF,胞外多糖合成缺失突变株有助于对其致病机理的研究。
微生物胞外多糖合成缺失突变株的研究有过报道,Richard等(1999)发现在乳酸乳球菌(Lactococcuslactis)中,epsD编码将葡萄糖与脂质载体连接的葡萄糖基转移酶,epsE或epsF编码将半乳糖与脂质连接的半乳糖基转移酶,通过β-1, 4糖苷键将葡萄糖与半乳糖缩合形成乳糖。将epsD敲除后,突变株的胞外多糖产量为0.5 mg/L,显著低于野生型的113 mg/L[9]。Assavasirijinda等(2016)将芽孢杆菌(Bacillus sp. N16-5) epsD敲除后,其胞外多糖产量为0.62 g/L,低于野生型的2.21 g/L,发酵液粘度从25.84 MPa·s降低至5.84 MPa·s[10]。曹文瑞(2011)将纤维堆囊菌(Sorangium cellulosum GSUV3-205) epsD敲除后,突变株生长缓慢,代时延长,合成次级代谢产物埃博霉素的能力减弱[11]。青枯雷尔氏菌胞外多糖合成基因epsD缺失突变株构建未见报道,作者试图构建epsD缺失突变体,进一步研究其致病机理。
本研究通过同源重组对三磷酸核苷-N-乙酰- D-半乳糖胺醛酸脱氢酶(NDP-N-acetyl- D-galactosaminuronic acid dehydrogenase,epsD)进行突变,获得EPS合成缺失突变株,研究EPS对突变株与野生株在胞外多糖合成、运动能力、定殖能力以及致病性的影响。实验结果表明EPS与青枯雷尔氏菌的运动能力、定殖能力、致病力密切相关,为以EPS合成途径为靶标开发高效的青枯病植物疫苗提供理论依据。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒和培养条件: 供试菌株为强致病力青枯雷尔氏菌FJAT-91,实验室保存。其他菌株和质粒见表 1。
表 1. 实验所用菌株和质粒 Table 1. Bacterial strains and plasmids used in this study
| Strains and plasmids | Characteristics | Sources |
| Strains | ||
| E. coli DH5α | SupE4ΔlacU169ψ80lacZM15hsdR17 | This Lab |
| FJAT-91ΔepsD | epsD deletion mutation of FJAT-91 | This work |
| FJAT-91HepsD | epsD reverse mutation | This work |
| Plasmids | ||
| pBRR1MCS-5 | Gmr | The Institute of Plant Protection, Chinese Academy of Agricultural Sciences |
| pK18mobsacB | pK18mob containing the sacB gene, Kanr | The Institute of Plant Protection, Chinese Academy of Agricultural Sciences |
| pK-epsD | pK18mobsacB based vector, carrying epsD gene, Kanr | This work |
表选项
青枯雷尔氏菌用TTC或SPA培养基培养,大肠杆菌用LB培养基培养。TTC固体培养基(g/L):蛋白胨10、水解酪蛋白1、葡萄糖5、2, 3, 5-氯化三苯基四氮唑0.5,琼脂15,pH 7.4。SPA液体培养基(g/L):蛋白胨5、蔗糖20、KH2PO40.5、MgSO40.25,pH 7.4。LB液体培养基(g/L):胰蛋白胨10、酵母提取物5、氯化钠10,pH 7.0,固体培养基添加15 g琼脂。抗生素使用量根据需要加入:卡那霉素(Kan) 30 μg/mL、庆大霉素(Gm) 20 μg/mL。
1.1.2 引物: 本研究所需的核苷酸引物列于表 2,由铂尚生物技术(上海)有限公司合成,并已根据实验需要在引物两端添加合适的酶切位点和保护碱基。
表 2. 本研究中所用到的引物 Table 2. Primers used in this study
| Primer | Primer sequence (5'→ 3') | Enzyme |
| P1 | AAAGAATTCTGAACGACGACTCCGCCTA | EcoR Ⅰ |
| P2 | TTTGGATCCGTGGATTCCAGCACCACCAG | BamH Ⅰ |
| Gm F | AAAGGATCCGACGCACACCGTGGAAACGG | BamH Ⅰ |
| Gm R | TTTGCATGCGCGGCGTTGTAGCAATTTAC | Sph Ⅰ |
| P3 | TTTGCATGCCGATGCCAAGCCGCACTAT | Sph Ⅰ |
| P4 | TTTAAGCTTGCCCGTCGCCAGGAACAGG | Hind Ⅲ |
| P5 | AAAGAATTCTGAACCGAGAGCAACCGAC | EcoR Ⅰ |
| P6 | CCCTGCTGATGCGGGAA | |
| P7 | CGCAGCGGCCGGACCTG | |
| P8 | TTTAAGCTTGCCCGTCGCCAGGAACAGG | Hind Ⅲ |
| P9 | CCCTGCTGATGCGGGAA | |
| Underline sequences are cleavage site of restriction enzyme. Dotted line sequences are mutation site. | ||
表选项
1.1.3 试剂与仪器: 高纯度质粒小提试剂盒(DP103)、琼脂糖凝胶回收试剂盒(DP209)、DNA Marker购自天根生化科技有限公司;卡那霉素(KANA)购于Sigma;限制性内切酶EcoR Ⅰ、BamH Ⅰ、Sph Ⅰ、Hind Ⅲ,T4 DNA ligase购自TaKaRa。96孔全自动梯度PCR扩增仪(Applied Biosystems),ST 16R离心机(Thermo Scientific),DYY-6C型电泳仪(北京市六一仪器厂),凝胶成像仪(BIORAD)。
1.2 epsD缺失突变株构建 重组质粒的构建参照马婷婷等(2014)的方法并加以改进[12]。以FJAT-91总DNA为模板,P1、P2为引物扩增epsD基因上游臂,P3、P4为引物扩增epsD基因下游臂。以pBRR1MCS-5质粒为模板,Gm F/Gm R为引物扩增抗性基因片段。上游片段、抗性基因片段、下游片段分别用EcoR Ⅰ/ BamH Ⅰ、BamH Ⅰ/Sph Ⅰ、Sph Ⅰ/Hind Ⅲ双酶切,将得到的片段与经过双酶切的自杀性质粒pk18mobscaB连接,利用CaCl2法转到E. coli DH5α感受态细胞中,通过抗性筛选、PCR扩增、酶切验证获得重组质粒pK-epsD。
青枯雷尔氏菌感受态的制备参照车建美等(2008)的方法[13]。挑取青枯雷尔氏菌FJAT-91单菌落于SPA液体培养基中,30 ℃、170 r/min振荡培养过夜,按照1:100接种到SPA培养基中,振荡培养,取OD600为0.5的菌液,冰水浴30 min,于4 ℃、6000 r/min离心5 min,去离子水洗4次,去上清,菌体用1 mL无菌水悬浮即为青枯雷尔氏菌感受态细胞。取10 μL重组质粒pK-epsD与100 μL青枯雷尔氏菌感受态细胞混合,电击条件为2.0 kV、25 μF和400 Ω,电击结束后,迅速将SPA液体培养基加入到感受态中,30 ℃、170 r/min振荡培养24 h后,进行筛选。(1)初筛:将转化后的菌液涂布于含卡那霉素和庆大霉素的TTC固体培养基上,30 ℃培养,待长出菌落后,提取细菌基因组DNA,用P1/P4引物扩增鉴定。(2)复筛:挑取鉴定正确的单菌落于SPA液体培养基,培养过夜,涂布于含有10%蔗糖和庆大霉素的TTC固体培养基上,30 ℃培养,待长出菌落后,筛选双重组子。(3)第3次筛选:挑取上步的单菌落分别转移至含有庆大霉素、卡那霉素和10%蔗糖的TTC平板上进行筛选。最终筛选出对卡那霉素和蔗糖敏感对庆大霉素具有抗性的菌落,提取细菌基因组DNA,用P1/P4引物扩增鉴定。突变株用终浓度为20%的甘油于–80 ℃保存,命名为FJAT-91ΔepsD。
1.3 回复突变构建 采用重叠延伸PCR(OE-PCR)的方法来扩增含有突变位点(TCG→AGT,均为丝氨酸密码子)的epsD基因片段。epsD基因片段、自杀性质粒pk18mobscaB经EcoR Ⅰ/Hind Ⅲ酶切后连接,转化至E. coli DH5α感受态细胞中,通过抗性筛选、PCR扩增、酶切验证获得重组质粒pK-HepsD。感受态制备及电转化条件同1.2。经三步筛选法获得回复突变株,用终浓度为20%的甘油于–80 ℃保存,命名为FJAT-91HepsD。
1.4 青枯雷尔氏菌弱化指数测定 为考察FJAT-91ΔepsD突变菌株致病性变化,引入弱化指数,测定方法参照刘波等(2004)的方法[14]。弱化指数(attenuation index,AI)为菌落的红斑直径与菌落直径的比值,弱化指数小于0.65为强致病力菌株,弱化指数介于0.65至0.75为过渡型菌株,弱化指数大于0.75为无致病力菌株。将青枯雷尔氏菌出发菌株FJAT-91和突变株FJAT-91ΔepsD培养在TTC培养基上,其菌落形态为中间红色边缘白色,对其红斑直径及菌落直径进行测定,计算其弱化指数。
1.5 青枯雷尔氏菌生长曲线测定 为考察FJAT-91ΔepsD突变菌株生长能力,采用菌落培养方法,分别挑取FJAT-91、FJAT-91ΔepsD单菌落于SPA培养基中,30 ℃、170 r/min振荡培养过夜,培养至OD600为0.5,按照1:100接种到SPA培养基,30 ℃、170 r/min振荡培养,每隔3 h取样测OD600值,对浓度大的菌悬液用未接种的SPA液体培养基适当稀释后测定,使其OD为0.1–0.8,稀释后测得的OD值乘稀释倍数,即为培养液实际的OD值。以培养时间为横坐标,OD值为纵坐标绘制生长曲线。研究EPS合成对青枯雷尔氏菌生长影响,测定青枯雷尔氏菌出发菌株FJAT-91以及突变菌株FJAT-91ΔepsD突变株生物量、生长速度差异。
1.6 青枯雷尔氏菌运动性检测 为考察FJAT-91ΔepsD突变菌株运动能力,采用不同浓度琼脂培养基测定青枯雷尔氏菌运动能力,检测方法参照Liu等(2016)的方法[15]。将FJAT-91、FJAT-91ΔepsD分别接种于SPA培养基中,30 ℃、170 r/min振荡培养,培养至OD600为0.5,用移液枪吸取0.5 μL菌液分别接种于含0.3%及0.5%琼脂的TTC-半固体培养基,于30 ℃培养箱中平置培养,观察待测菌的运动情况。培养24 h待菌在培养基上有明显的菌圈后,每隔12 h测量菌圈的直径。琼脂含量0.3%用于检测细菌的泳动能力(swimming motility),琼脂含量0.5%用于检测细菌的群集运动能力(swarming motility)。
1.7 青枯雷尔氏菌致病性生物测定 为考察FJAT-91ΔepsD突变菌株的致病性变化,采用番茄苗接菌发病生物测定,青枯雷尔氏菌生物测定参照车建美等(2011)的方法[16]。用约1×107 CFU/mL的青枯雷尔氏菌菌液灌根番茄盆栽苗,每盆灌根100 mL菌液,每个处理12株,重复3次,对照采用相同量的水代替菌液。将番茄植株置于30 ℃,相对湿度60%–70%的条件下培养,从第2天开始统计番茄植株发病的数量。
1.8 青枯雷尔氏菌定殖能力测定 为考察FJAT-91ΔepsD突变菌株的定殖能力,检测青枯雷尔氏菌在番茄根部以及茎部的定殖数量,测定方法参照刘波等(2007)的方法[17]。接种后6、12、24、48、96、144 h采集番茄植株的根部以及茎部,先用无菌水清洗干净,再置于75%酒精中浸泡1–3 min,然后用无菌水冲洗3次,放入无菌的离心管中,加入1 mL无菌水研磨成匀浆。匀浆液用梯度稀释法稀释至适宜浓度,涂布于TTC平板上,3次重复。
2 结果和分析 2.1 青枯雷尔氏菌epsD缺失突变株的构建 青枯雷尔氏菌重组质粒构建线路如图 1所示。将epsD基因上游片段(up)和下游片段(down),以及庆大霉素抗性基因(Gm),按照up-Gm-down的顺序构建至pk18mobscaB载体中,获得重组自杀质粒(pK18-epsD)。将重组质粒电击导入青枯雷尔氏菌FJAT-91感受态细胞中,经过3重筛选,获得EPS合成缺失的突变株FJAT-91ΔepsD。重组质粒用EcoR Ⅰ单酶切及EcoR Ⅰ、Hind Ⅲ双酶切进行酶切验证,结果如图 2-A。EcoR Ⅰ单酶切后质粒仅在7650 bp左右有一条带,EcoR Ⅰ、Hind Ⅲ双酶切后得到一条1950 bp左右的酶切片段及5700 bp的载体片段,与预期片段大小一致。突变株用P1/P4及Gm F/ Gm R为引物进行PCR验证,结果如图 2-B。用P1/P4扩增epsD片段,重组质粒与突变株扩增片段大小为1950 bp,FJAT-91扩增片段大小为1624 bp,与预期结果一致;用Gm F/ Gm R扩增Gm片段,重组质粒与突变株扩增片段大小为855 bp,FJAT-91无条带,与预期结果一致。回复突变株用P5/P9为引物进行PCR验证及测序验证,结果如图 3-B。重组质粒与回复突变株扩增片段大小为460 bp,FJAT-91、FJAT-91ΔepsD扩增不出条带,与预期结果一致。
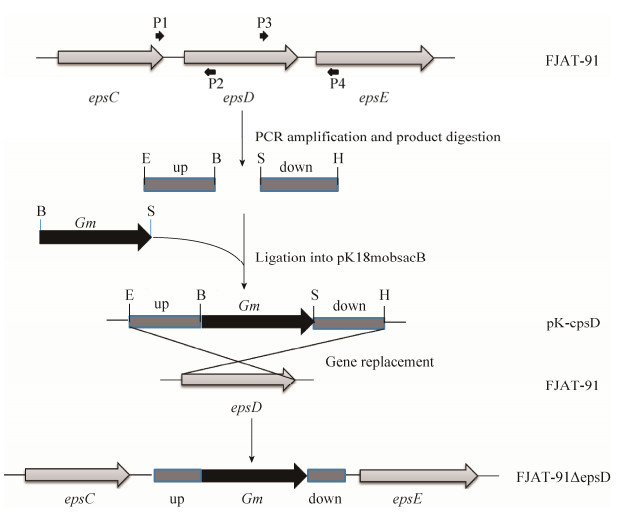 |
| 图 1 突变株构建路线图 Figure 1 Route of mutant construction. Restriction enzyme cutting site, E: EcoR Ⅰ; B: BamH Ⅰ; S: Sph Ⅰ; H: Hind Ⅲ. |
| 图选项 |
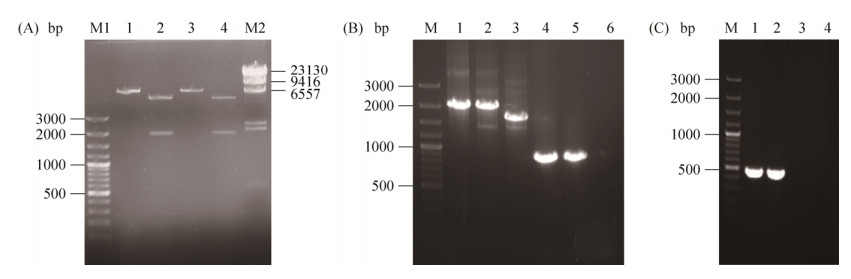 |
| 图 2 重组载体、epsD缺失突变株及回复突变株的验证 Figure 2 Identification of recombination vector, epsD mutant and reverse mutation. A: Identification of recombination vector. M1, M2: marker; lane 1, 3: EcoR Ⅰ single restriction enzyme digestion of recombinant vector; lane 2, 4: EcoR Ⅰ, Hind Ⅲ double restriction enzyme digestion of recombinant vector. B: Identification of epsD mutant. M: marker; lane 1: recombinant vector epsD amplification fragment; lane 2: mutant epsD amplification fragment; lane 3: FJAT-91 epsD amplification fragment; lane 4: recombinant vector Gm amplification fragment; lane 5: mutant Gm amplification fragment; lane 6: FJAT-91 Gm amplification fragment. C: Identification of epsD reverse mutation. M: marker; lane 1: recombinant vector pK18-HepsD; lane 2: FJAT-91HepsD; lane 3: FJAT-91; lane 4: FJAT-91ΔepsD. |
| 图选项 |
 |
| 图 3 青枯雷尔氏菌FJAT-91、FJAT-91ΔepsD、FJAT-91HepsD在TTC平板上的菌落形态 Figure 3 The colony of FJAT-91, FJAT-91ΔepsD and FJAT-91HepsD on the TTC medium. |
| 图选项 |
2.2 青枯雷尔氏菌epsD缺失突变株弱化指数变化 实验结果见图 3。构建青枯雷尔氏菌epsD缺失突变株后,其弱化指数发生变化。青枯雷尔氏菌FJAT-91在TTC培养基上的菌落中间红斑较小,颜色为淡红色,周围白边较大,且流动性很强,弱化指数(AI)为0.615,鉴定为强致病性菌株;青枯雷尔氏菌FJAT-91ΔepsD突变株在TTC培养基上的菌落中间红斑较大,颜色为暗红色,周围白边很窄即胞外多糖产量显著下降,无流动性与FJAT-91的菌落形态具有显著差异,弱化指数(AI)为0.905,鉴定为无致病力菌株。构建的青枯雷尔氏菌epsD缺失突变株较出发菌株弱化指数提高了47.15%。回复突变株FJAT-91HepsD菌落形态与原始菌株FJAT-91相同。
2.3 青枯雷尔氏菌epsD缺失突变株致病力变化 实验结果见表 3和图 4。FJAT-91灌根接种后第5天有一株番茄开始出现萎焉症状,表现为顶端叶片先萎焉下垂,后下部叶萎,中部叶片最后凋萎,最后整株番茄萎焉下垂。第10天,12株中有11株已发病,发病率为91.7%;青枯雷尔氏菌突变株FJAT-91ΔepsD以及水灌根接种10 d后未出现植株萎焉症状,继续观察至30 d均未发病,发病率为0。青枯雷尔氏菌回复突变株FJAT-91HepsD致病力恢复,番茄发病率为75%。番茄盆栽苗生测结果与弱化指数(AI)结果相符,表明突变株FJAT-91ΔepsD为无致病力突变株,EPS缺失会导致青枯雷尔氏菌的致病力丧失。
表 3. 番茄盆栽苗发病数量统计 Table 3. The number of tomato disease
| Time/d | FJAT-91 | FJAT-91ΔepsD | FJAT-91HepsD | CK |
| 1 | 0 | 0 | 0 | 0 |
| 2 | 0 | 0 | 0 | 0 |
| 3 | 0 | 0 | 0 | 0 |
| 4 | 0 | 0 | 0 | 0 |
| 5 | 1 | 0 | 0 | 0 |
| 6 | 3 | 0 | 2 | 0 |
| 7 | 4 | 0 | 3 | 0 |
| 8 | 7 | 0 | 6 | 0 |
| 9 | 8 | 0 | 8 | 0 |
| 10 | 11 | 0 | 9 | 0 |
表选项
 |
| 图 4 青枯雷尔氏菌FJAT-91、FJAT-91ΔepsD、FJAT-91HepsD灌根接种10 d后番茄盆栽苗的病征 Figure 4 Wilt of tomato soaked by FJAT-91, FJAT-91ΔepsD and FJAT-91HepsD at the 10 day. |
| 图选项 |
2.4 青枯雷尔氏菌epsD缺失突变株生长速率变化 实验结果见图 5。出发菌株FJAT-91与突变菌株FJAT-91ΔepsD进入对数期和平稳期的时间相同。突变菌株FJAT-91ΔepsD早期生长速率较慢,进入对数生长期后生长速率逐渐增大,最终进入平稳期后生物量与出发菌株FJAT-91无显著差异,但是突变株在各个时期的生物量均小于出发菌株,如出发菌株FJAT-91和突变菌株FJAT-91ΔepsD在21 h的OD600值分别为4.204、2.397,突变菌株生物量仅为出发菌株的57%;42 h的OD600值分别为7.788、7.296,突变菌株生物量为出发菌株的94%。说明胞外多糖的缺失会导致青枯雷尔氏菌的生长变慢。
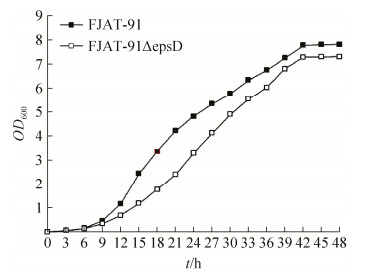 |
| 图 5 FJAT-91和FJAT-91ΔepsD生长曲线 Figure 5 Growth curve of FJAT-91 and FJAT-91ΔepsD. |
| 图选项 |
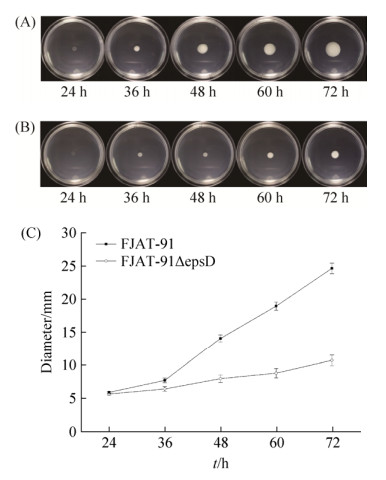
2.5 青枯雷尔氏菌epsD缺失突变株运动能力变化 实验结果见图 6、图 7。泳动能力(swimming motility):24 h时出发菌株FJAT-91与突变菌株FJAT-91ΔepsD的菌落直径无显著差异,分别为6.1 mm和5.9 mm;36 h时出发菌株FJAT-91与突变菌株FJAT-91ΔepsD开始出现差异,分别为8.9 mm、7.0 mm。从24 h到72 h FJAT-91的菌落直径从6.1 mm增长到35.9 mm增长了29.8 mm,而FJAT-91ΔepsD的菌落直径从5.9 mm增长到12.3 mm增长了6.4 mm (图 6)。
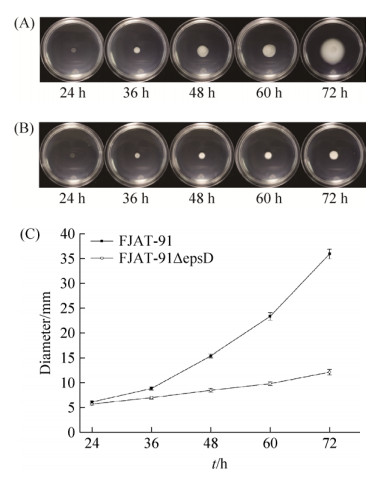 |
| 图 6 FJAT-91及FJAT-91ΔepsD不同时间在0.3%琼脂培养基上泳动能力 Figure 6 The swimming motility of FJAT-91 and FJAT-91ΔepsD at different time. A: the colony of FJAT-91 on the TTC- medium at different time; B: the colony of FJAT-91ΔepsD on the TTC-medium at different time; C: the colony diameter of FJAT-91 and FJAT-91ΔepsD at different time. Vertical bars represent the mean±SE (n=3). |
| 图选项 |
 |
| 图 7 FJAT-91及FJAT-91ΔepsD不同时间在0.5%琼脂培养基上的群集运动能力 Figure 7 The swarming motility of FJAT-91 and FJAT-91ΔepsD at different time. A: the colony of FJAT-91 on the TTC- medium at different time; B: the colony of FJAT-91ΔepsD on the TTC-medium at different time; C: the colony diameter of FJAT-91 and FJAT-91ΔepsD at different time. Vertical bars represent the mean±SE (n=3). |
| 图选项 |
群集运动能力(swarming motility):36 h内出发菌株FJAT-91和突变菌株FJAT-91ΔepsD的菌落直径增长缓慢,36 h后FJAT-91的菌落直径增长速度较快并与FJAT-91ΔepsD的菌落直径形成显著差异。从24 h到72 h FJAT-91的菌落直径从5.8 mm增长到24.7 mm增长了18.9 mm,而FJAT-91ΔepsD的菌落直径从5.7 mm增长到10.8 mm增长了5.1 mm (图 7)。表明EPS在青枯雷尔氏菌运动性中起着重要的作用,EPS的减少可使其运动能力减弱。
2.6 青枯雷尔氏菌epsD缺失突变株定殖能力变化 实验结果见图 8。在灌根接种144 h内,出发菌株FJAT-91及突变菌株FJAT-91ΔepsD在番茄根部(图 8-A)及茎部(图 8-B)的数量均呈现上升的趋势。6、12 h时FJAT-91与FJAT-91ΔepsD在番茄根部和茎部的定殖量无显著差异,如6 h时FJAT-91、FJAT-91ΔepsD在根部的定殖量分别为6.67×106、6.43×106 CFU/g,FJAT-91、FJAT-91ΔepsD在茎部的定殖量分别为3.14×105、2.99×105 CFU/g。24 h时,FJAT-91、FJAT-91ΔepsD在根部的定殖量分别为5.61×106、3.93×106 CFU/g;FJAT-91、FJAT-91ΔepsD在茎部的定殖量分别为1.04×106、7.40×105 CFU/g,两者开始出现差异。总体趋势为FJAT-91无论是在番茄根部还是在番茄茎中的定殖数量均大于FJAT-91ΔepsD,且在144 h (FJAT-91处理番茄植株已出现萎焉症状)时差异最为显著,此时FJAT-91在番茄根部的数量为3.37×109 CFU/g,而FJAT-91ΔepsD在番茄根部的数量仅为4.01×108 CFU/g,FJAT-91的定殖量为FJAT-91ΔepsD的8.4倍;FJAT-91在番茄茎中的数量为2.16×109 CFU/g,FJAT-91ΔepsD在番茄茎中的数量仅为5.70×107 CFU/g,FJAT-91的定殖量为FJAT-91ΔepsD的37.9倍。表明青枯雷尔氏菌胞外多糖缺失使其在番茄根部、茎部的定殖数量减少,EPS的缺失对青枯雷尔氏菌FJAT-91在茎部比根部定殖能力影响更加显著,定殖能力的降低是突变株丧失致病力或致病性减弱的原因。
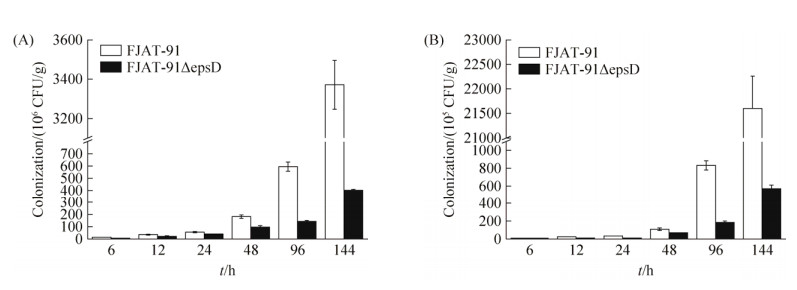 |
| 图 8 不同时间番茄根部和茎部的青枯雷尔氏菌定殖数量 Figure 8 The colonization of R. solanacearum in root and stem of tomato at different time after inoculation. A: the colonization of FJAT-91 and FJAT-91ΔepsD in root of tomato at different time after inoculation; B: the colonization of FJAT-91 and FJAT-91ΔepsD in stem of tomato at different time after inoculation. Vertical bars represent the mean±SE (n=3). |
| 图选项 |
3 讨论 Husain等认为植物中的粘性物质可通过阻塞维管束而在致萎过程中起着重要作用,大量粘性物质在导管中的存在阻碍了液体流动,导致水分运输困难或停止[18-21]。经分析,青枯雷尔氏菌粘性物质主要为酸性胞外多糖。青枯雷尔氏菌通过根部伤口进入植物组织,并快速定殖到木质部导管中,在其中迅速繁殖并产生大量的胞外多糖,EPS的释放会造成植株导管堵塞,从而阻碍植物体内水分的运输或者使导管由于流体静压力过大而破裂[22]。EPS还可以掩盖或阻止脂多糖(lipoplysaccharides,LPS)对寄主植物根表的识别和吸附作用,降低LPS引起的病原菌对寄主的非亲和性识别,有利于病原菌回避寄主的抵抗反应,从而提高了病菌的致病性。
青枯雷尔氏菌胞外多糖合成基因epsD缺失突变株的胞外多糖产量显著降低(图 3),与Richard (1999)在乳酸乳球菌[9]、Assavasirijinda (2016)在芽孢杆菌[10]的研究结果一致。如图 5所示,胞外多糖合成基因epsD缺失突变株在对数期早期的生长速率小于出发菌株,推测可能是由于胞外多糖的缺失影响其代谢平衡导致其生长变缓慢。在青枯雷尔氏菌FJAT-91中epsD缺失导致突变株FJAT-91ΔepsD生长速率降低,这个结果与Peyraud等(2016)在青枯雷尔氏菌GMI1000研究结果相反,突变EPS合成相关基因epsB、xpsR、phcA基因后,对数期突变株的生长速率较出发菌提高,分析结果可能与能量分布与平衡相关,导致EPS合成能量物质流向细胞生长[2]。这两株菌EPS合成缺失后对细胞生长影响差异有待进一步研究。
弱化指数法为本实验开发的一种新的鉴定青枯雷尔氏菌致病性的方法,该方法简单方便,易于操作。程本亮等(2011)利用弱化指数法快速的从EZ-Tn5转座子随机插入青枯雷尔氏菌FJAT-91中筛选到13株无致病力菌株[23]。马健尧(2014)利用弱化指数法构建的青枯雷尔氏菌毒力筛选模型,筛选强致病力连续继代培养后出现的无致病力菌株,共筛选到390株无致病力菌株,其中35株具有较好的抑制强致病力菌株生长的作用[24]。
如图 4所示,对突变菌株FJAT-91ΔepsD的致病性和致病力分析,EPS合成缺陷导致青枯雷尔氏菌不具有致病性和致病力。在其他相关研究报道中,也发现植物病原菌胞外多糖合成能力与致病力相关。通过基因敲除玉米枯萎病菌(Pantoeas tewartii)的群体感应系统调控基因lrhA和rcsA,胞外多糖的产量显著下降,从而降低玉米枯萎病菌致病性[25]。将胞外多糖降解酶在蔷薇科果树中表达,能降低苹果和梨树对火疫欧文氏菌敏感性[26-27]。将十字花科黑腐病菌的双组分调控系统的响应调节基因XC2252敲除后,胞外多糖的产量显著降低,对满身红萝卜致病力减弱[28]。将水稻条斑病菌UDP-葡萄糖脱氢酶编码基因udgH突变后,其胞外多糖的产量仅约为野生型的30%,在致病力上的丧失为野生型的70%–80%[29]。将费氏中华根瘤菌WGF03胞外多糖分泌相关基因exoD敲除后,胞外多糖产量明显减少,接种大豆幼苗后,产生的根瘤数量较多,但个体小、形状不一,多为无效根瘤,且固氮酶活也显著下降[10]。
泳动能力(swimming motility)是指细菌在培养基表面由接种点向周围进行的依赖鞭毛在液体中进行的迁移运动;群集运动能力(swarming motility)是指细菌以群体方式在培养基表面由接种点向周围进行的依赖菌毛成群的在固体表面移位运动[30]。青枯雷尔氏菌的swimming motility和swarming motility均对于青枯雷尔氏菌致病力和生态适应能力非常重要[31-32]。如图 6和图 7所示,当FJAT-91ΔepsD的EPS合成缺陷时,其swimming motility和swarming motility与野生型相比显著降低。本研究中突变株运动能力减弱与粟月萍(2013)在根瘤菌[33]、廖洁(2007)在黑腐病菌[29]、刘文竹(2015)在溶藻弧菌[34]的研究结果一致。胞外多糖与细菌的运动能力相关,Liu(2016)发现胞外多糖可以增加交替假单胞菌菌落边缘的湿润程度,为鞭毛运动提供了液体环境,从而促进其运动能力[15]。Tans-Kersteny (2001)发现在青枯雷尔氏菌中,swimming motility是病原菌从土壤侵入宿主根部再进一步在木质部中增殖的必要条件[6]。在发病过程中,运动可以帮助病原体从已感染的木质部导管扩散到相邻的未感染的导管和木质部薄壁细胞中。Tans-Kersteny的研究显示:通过灌根接种的生物测定,无运动性突变株对番茄的侵染力和定殖能力显著降低;而通过叶柄注射法接种的生物测定,突变株与野生株具有同样的致病力,表明swimming motility在青枯雷尔氏菌入侵宿主植物和定殖过程中起着重要的作用[6]。Saile(1997)通过Tn5转座子插入的方法获得EPS-突变株,灌根接种后突变株不能像出发菌株那样快速的在茎中定殖,叶柄注射后突变株虽然能够繁殖但是并不能在整个茎部扩散,因此得出结论EPS-突变株在茎部的定殖能力减弱是由于其在茎中的运动能力减弱所致[4]。如图 8所示,青枯雷尔氏菌胞外多糖缺失突变株FJAT-91ΔepsD在番茄植株中的定殖能力减弱,与Meneses (2017)在Gluconacetobacter diazotrophicus[35]、宋志伟(2015)在水稻细菌性条斑病菌[36]的研究结果一致。
通过本课题研究结果表明,青枯雷尔氏菌致病力因子胞外多糖的缺失降低细胞的swimming motility和swarming motility,影响它在番茄侵入能力以及根茎部的定殖能力,尤其是茎部定殖能力,从而导致青枯雷尔氏菌的致病性和致病力降低或者丧失。本课题组保存了多种不合成EPS的野生型菌株FJAT-1458[37],突变体菌株(phcA突变)[23]、epsD突变株等,形成了一批具有不同基因型和免疫活性的植物疫苗。本研究构建了青枯雷尔氏菌高毒力菌株FJAT-91,使得植物疫苗的基因型更加丰富,为我们研究植物青枯病致病机理,植物青枯病疫苗的定殖、诱导宿主免疫抗病机理研究;筛选植物疫苗免疫蛋白、开发植物疫苗的研究方向的探索提供了优良的材料与研究基础。本研究为植物青枯病的防治、开发以胞外多糖的合成为靶标来设计新型农药,为作物病害防治提供一种新的策略。
References
| [1] | Hayward AC. Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum. Annual Review of Phytopathology, 1991, 29(1): 65-87. DOI:10.1146/annurev.py.29.090191.000433 |
| [2] | Peyraud R, Cottret L, Marmiesse L, Gouzy J, Genin S. A resource allocation trade-off between virulence and proliferation drives metabolic versatility in the plant pathogen Ralstonia solanacearum. PLoS Pathogens, 2016, 12(10): e1005939. DOI:10.1371/journal.ppat.1005939 |
| [3] | Schell MA. Control of virulence and pathogenicity genes of Ralstonia solanacearum by an elaborate sensory network. Annual Review of Phytopathology, 2000, 38(1): 263-292. DOI:10.1146/annurev.phyto.38.1.263 |
| [4] | Saile E, McGarvey JA, Schell MA, Denny TP. Role of extracellular polysaccharide and endoglucanase in root invasion and colonization of tomato plants by Ralstonia solanacearum. Phytopathology, 1997, 87(12): 1264-1271. DOI:10.1094/PHYTO.1997.87.12.1264 |
| [5] | Mori Y, Inoue K, Ikeda K, Nakayashiki H, Higashimoto C, Ohnishi K, Kiba A, Hikichi Y. The vascular plant-pathogenic bacterium Ralstonia solanacearum produces biofilms required for its virulence on the surfaces of tomato cells adjacent to intercellular spaces. Molecular Plant Pathology, 2016, 17(6): 890-902. DOI:10.1111/mpp.12335 |
| [6] | Tans-Kersten J, Huang HY, Allen C. Ralstonia solanacearum needs motility for invasive virulence on tomato. Journal of Bacteriology, 2001, 183(12): 3597-3605. DOI:10.1128/JB.183.12.3597-3605.2001 |
| [7] | Huang JZ, Carney BF, Denny TP, Weissinger AK, Schell MA. A complex network regulates expression of eps and other virulence genes of Pseudomonas solanacearum. Journal of Bacteriology, 1995, 177(5): 1259-1267. DOI:10.1128/jb.177.5.1259-1267.1995 |
| [8] | Huang JZ, Schell M. Molecular characterization of the eps gene cluster of Pseudomonas solanacearum and its transcriptional regulation at a single promoter. Molecular Microbiology, 1995, 16(5): 977-989. DOI:10.1111/mmi.1995.16.issue-5 |
| [9] | van Kranenburg R, Vos HR, van Swam Ⅱ, Kleerebezem M, de Vos WM. Functional analysis of glycosyltransferase genes from Lactococcus lactis and other Gram-positive cocci: complementation, expression, and diversity. Journal of Bacteriology, 1999, 181(20): 6347-6353. |
| [10] | Assavasirijinda N, Ge DY, Yu B, Xue YF, Ma YH. Efficient fermentative production of polymer-grade D-lactate by an engineered alkaliphilic Bacillus sp. strain under non-sterile conditions. Microbial Cell Factories, 2016, 15: 3. DOI:10.1186/s12934-015-0408-0 |
| [11] | 曹文瑞. 纤维堆囊菌GSUV3-205发酵生产埃博霉素过程中关键因子的探索及优化. 山东大学博士学位论文, 2011. |
| [12] | Ma TT, Zhang J, Su YP, Song ZY, Tang XL, Shen PH, Wu B. A preliminary study of exoD gene relating exopolysaccharides secretion in Sinorhizobium fredii WGF03. China Biotechnology, 2014, 34(6): 47-54. (in Chinese) 马婷婷, 张健, 粟月萍, 宋张杨, 唐咸来, 申佩弘, 武波. Sinorhizobium fredii WGF03胞外多糖分泌相关基因exoD功能初探. 中国生物工程杂志, 2014, 34(6): 47-54. |
| [13] | Che JM, Lan JL, Liu B. GFP tagging Ralstonia solanacearum with gfp/luxAB mini-Tn5. Scientia Agricultura Sinica, 2008, 41(11): 3626-3635. (in Chinese) 车建美, 蓝江林, 刘波. 转绿色荧光蛋白基因的青枯雷尔氏菌生物学特性. 中国农业科学, 2008, 41(11): 3626-3635. DOI:10.3864/j.issn.0578-1752.2008.11.024 |
| [14] | Liu B, Lin YZ, Zhu YJ, Ge CB, Cao Y. Attenuation characteristics of bacterial-wilt-disease biocontrol strain anti-8098A (Bacillus cereus) to Ralstonia solanacearum. Journal of Agricultural Biotechnology, 2004, 12(3): 322-329. (in Chinese) 刘波, 林营志, 朱育菁, 葛慈斌, 曹宜. 生防菌对青枯雷尔氏菌的致弱特性. 农业生物技术学报, 2004, 12(3): 322-329. |
| [15] | Liu A, Mi ZH, Zheng XY, Yu Y, Su HN, Chen XL, Xie BB, Zhou BC, Zheng YZ, Qin QL. Exopolysaccharides play a role in the swarming of the benthic bacterium Pseudoalteromonas sp. SM9913. Frontiers in Microbiology, 2016, 7: 473. |
| [16] | Che JM, Liu B, Zhang Y, Su MX, Zhu YJ, Zheng XF. Study on the bioassay method for pathogenicity of Ralstonia solanacearum. Fujian Journal of Agricultural Sciences, 2011, 26(5): 804-807. (in Chinese) 车建美, 刘波, 张彦, 苏明星, 朱育菁, 郑雪芳. 青枯雷尔氏菌致病性生物测定方法的研究. 福建农业学报, 2011, 26(5): 804-807. |
| [17] | Liu B, Zhu YJ, Lin KM, Xiao RF, Ge CB, Lan JL, Mao NH. Study on numerical and pathogenic variations of Ralstonia solanacearum distributed within the tissue of host plants. Scientia Agricultura Sinica, 2007, 40(7): 1559-1566. (in Chinese) 刘波, 朱育菁, 林抗美, 肖荣凤, 葛慈斌, 蓝江林, 冒乃和. 青枯雷尔氏菌在植株体内分布及其致病力的异质性研究. 中国农业科学, 2007, 40(7): 1559-1566. |
| [18] | Husain A, Kelman A. Relation of slime production to mechanism of wilting and pathogenicity of Pseudomonas solanacearum. Phytopathology, 1958, 48: 155-165. |
| [19] | Genin S, Denny TP. Pathogenomics of the Ralstonia solanacearum species complex. Annual Review of Phytopathology, 2012, 50(1): 67-89. DOI:10.1146/annurev-phyto-081211-173000 |
| [20] | Garg RP, Huang JZ, Yindeeyoungyeon W, Denny TP, Schell MA. Multicomponent transcriptional regulation at the complex promoter of the exopolysaccharide Ⅰ biosynthetic operon of Ralstonia solanacearum. Journal of Bacteriology, 2000, 182(23): 6659-6666. DOI:10.1128/JB.182.23.6659-6666.2000 |
| [21] | Gao MS, Coggin A, Yagnik K, Teplitski M. Role of specific quorum-sensing signals in the regulation of exopolysaccharide Ⅱ production within Sinorhizobium meliloti spreading colonies. PLoS One, 2012, 7(8): e42611. DOI:10.1371/journal.pone.0042611 |
| [22] | Milling A, Babujee L, Allen C. Ralstonia solanacearum extracellular polysaccharide is a specific elicitor of defense responses in wilt-resistant tomato plants. PLoS One, 2011, 6(1): e15853. DOI:10.1371/journal.pone.0015853 |
| [23] | Cheng BL, Che JM, Liu B. Construction of avirulent mutants of Ralstonia solanacearum by Tn5 transposon and analysis of its biological characteristics. Journal of Agricultural Biotechnology, 2011, 19(1): 26-35. (in Chinese) 程本亮, 车建美, 刘波. 青枯雷尔氏菌Tn5转座子无致病力突变株构建及其生物学特性. 农业生物技术学报, 2011, 19(1): 26-35. |
| [24] | 马健尧. 番茄青枯雷尔氏菌无致病力菌株筛选及对番茄青枯病的室内控病研究. 四川农业大学硕士学位论文, 2014. |
| [25] | Burke AK, Duong DA, Jensen RV, Stevens AM. Analyzing the transcriptomes of two quorum-sensing controlled transcription factors, RcsA and LrhA, important for Pantoea stewartii virulence. PLoS One, 2015, 10(12): e0145358. DOI:10.1371/journal.pone.0145358 |
| [26] | Hanke V, Geider K, Richter K. Transgenic apple plants expressing viral EPS-depolymerase: evaluation of resistance to the phytopathogenic bacterium Erwinia amylovora//Vasil IK. Plant biotechnology 2002 and beyond. Kluwer, Dordrecht: Springer, 2003: 153-157. |
| [27] | Malnoy M, Faize M, Venisse JS, Geider K, Chevreau E. Expression of viral EPS-depolymerase reduces fire blight susceptibility in transgenic pear. Plant Cell Reports, 2005, 23(9): 632-638. DOI:10.1007/s00299-004-0855-2 |
| [28] | 廖洁. 十字花科黑腐病菌一个与致病相关的双组份调控系统基因的研究. 广西大学硕士学位论文, 2007. |
| [29] | Cai WX, Huang GH, Wang TT, Fu S, He YQ, Jiang W. Functional analysis of a hypothetical udgH gene in Xanthomona oryzae pv. oryzicola. Journal of Guangxi Normal University (Natural Science Edition), 2014, 32(3): 109-115. (in Chinese) 蔡文侠, 黄光辉, 王婷婷, 付珊, 何勇强, 姜伟. 水稻细菌性条斑病菌一个假定的udgH基因的功能研究. 广西师范大学学报(自然科学版), 2014, 32(3): 109-115. |
| [30] | Partridge JD, Nieto V, Harshey RM. A new player at the flagellar motor: Flil controls both motor output and bias. mBio, 2015, 6(2): e02367-14. |
| [31] | Ottemann KM, Miller JF. Roles for motility in bacterial-host interactions. Molecular Microbiology, 1997, 24(6): 1109-1117. DOI:10.1046/j.1365-2958.1997.4281787.x |
| [32] | Tans-Kersten J, Brown D, Allen C. Swimming motility, a virulence trait of Ralstonia solanacearum, is regulated by FlhDC and the plant host environment. Molecular Plant-Microbe Interactions, 2004, 17(6): 686-695. DOI:10.1094/MPMI.2004.17.6.686 |
| [33] | 粟月萍. 费氏中华根瘤菌WGF03胞外多糖分泌相关基因exoR和exoD的研究. 广西大学硕士学位论文, 2013. |
| [34] | 刘文竹. tssJ基因对溶藻弧菌运动性和生物膜形成的影响. 海南大学硕士学位论文, 2015. |
| [35] | Meneses C, Gon?alves T, Alquéres S, Rouws L, Serrato R, Vidal M, Baldani JI. Gluconacetobacter diazotrophicus exopolysaccharide protects bacterial cells against oxidative stress in vitro and during rice plant colonization. Plant and Soil, 2017, 416(1/2): 133-147. |
| [36] | 宋志伟. 水稻细菌性条斑病菌中hshB基因及其所在基因簇功能的研究. 南京农业大学博士学位论文, 2015. |
| [37] | Chen DJ, Liu B, Zhu YJ, Wang JP, Chen Z, Che JM, Zheng XF, Chen XQ. Complete genome sequence of Ralstonia solanacearum FJAT-1458, a potential biocontrol agent for tomato wilt. Genome Announcements, 2017, 5(14): e00070-17. |
