皮婷, 姚家成, 黄粤, 夏珍珍, 梅枫, 何冬兰, 程国军, 刘涛, 李晓华


中南民族大学生命科学学院, 微生物资源与利用湖北省工程技术研究中心, 湖北 武汉 430074
收稿日期:2017-10-22;修回日期:2017-12-26;网络出版日期:2018-01-24
基金项目:国家自然科学基金(31070087,30570046);湖北省自然科学基金(2011CDA079,2008CDB076);中央科研基本业务费(CZW16005,YCZW15104)
*通信作者:李晓华, Tel:+86-27-67843541;Fax:+86-27-67842689;E-mail:lixiaohua@mail.scuec.edu.cn
摘要:[目的]本研究对尼古丁降解菌根癌土壤杆菌SCUEC1菌株中agnE基因进行克隆表达,并对agnE基因表达蛋白进行功能鉴定。[方法]通过PCR扩增获得agnE全长基因(1029 bp),构建重组质粒pET28a-agnE,转化大肠杆菌BL21(DE3)菌株进行异源表达,采用SDS-PAGE检测重组蛋白。以2,5-二羟基吡啶作为反应底物,在检测波长320 nm下测定反应液吸光度值,进一步研究温度、pH值和金属离子对AgnE蛋白酶活性的影响。[结果]克隆得到基因agnE,构建了pET28a-agnE重组质粒并进行了表达,AgnE蛋白分子量为42.0 kDa,表达蛋白以包涵体形式存在于细胞中。酶促反应0、5、10、20 min时反应液吸光度分别为0.6170、0.2273、0.0907、0.0667。在pH 8.0、温度20 ℃下,AgnE蛋白具有较高的2,5-二羟基吡啶双加氧酶活性,且Fe2+对酶活性具有明显的促进作用。[结论]明确了AgnE蛋白具有2,5-二羟基吡啶双加氧酶活性。
关键词: 根癌土壤杆菌SCUEC1菌株 尼古丁降解代谢 agnE基因功能 2, 5-二羟基吡啶
Cloning and charaterization of the agnE gene for nicotine degradation in Agrobacterium tumefaciens strain SCUEC1
Ting Pi, Jiacheng Yao, Yue Huang, Zhenzhen Xia, Feng Mei, Donglan He, Guojun Cheng, Tao Liu, Xiaohua Li


Hubei Provincial Engineering and Technology Research Center for Resources and Utilization of Microbiology, College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, Hubei Province, China
Received 22 October 2017; Revised 26 December 2017; Published online 24 January 2018
*Corresponding author: Xiaohua Li, Tel: +86-27-67843541; Fax: +86-27-67842689; E-mail: lixiaohua@mail.scuec.edu.cn
Supported by the National Natural Science Foundation of China (31070087, 30570046), by the Natural Science Foundation of Hubei Province, China (2011CDA079, 2008CDB076) and by the Central Science Research Study Basic Expenses (CZW16005, YCZW15104)
Abstract: [Objective]We cloned and expressed the agnE gene involved in nicotine-degrading in Agrobacterium tumefaciens and characterized the AgnE protein.[Methods]The agnE gene fragment (1029 bp) was amplified with PCR. Recombinant plasmid pET28a-agnE was constructed and transformed into Escherichia coli BL21(DE3) for heterologous expression, and the expressed protein was detected with SDS-PAGE. The enzyme activity of AgnE was determined spectrophotometrically by monitoring the decrease of 2, 5-dihydroxy pyridine at 320 nm. The effect of temperature, pH and metal ion on enzyme activity was investigated.[Results]The agnE gene was cloned and the recombinant plasmid pET28a-agnE was expressed. The molecular weight of the recombinant protein was 42.0 kDa, and the protein was expressed in the form of inclusion bodies in cells. The AgnE protein had high enzyme activity at pH 8.0 and and 20 ℃. In addition, Fe2+ showed significant promoting effect on enzyme activity.[Conclusion]The activity of AgnE protein with 2, 5-dihydroxy pyridine dioxygenase was clarified.
Key words: Agrobacterium tumefaciens SCUEC1 strain nicotine degrading metabolism the function of the agnE gene 2, 5-dihydroxy pyridine
尼古丁是一种存在于茄科植物中的生物碱,是烟草生物碱的主要成分,占烟叶干重的2%-8%,也是烟草生产废弃物中的主要物质[1]。尼古丁是由吡啶环与吡咯环组成的结构稳定的有毒杂环化合物,在自然条件下不易被降解[2-3]。尼古丁对人或动物可产生多种致癌、致畸、致突变效应,是恶性环境污染物之一,欧盟已将每千克尼古丁含量超过500 mg的烟草废弃物列入有毒有害物清单,利用微生物降解尼古丁是低成本、高效率且对环境影响小的尼古丁降解方法[4-5]。尼古丁降解菌株中大约一半以上的细菌属于节杆菌(Arthrobacter)[6-10]和假单胞菌属(Pseudomonas)[11-15],其他的分布于产碱菌(Alicaligenes)[16]、无色杆菌属(Achromobacter)[17]、芽孢杆菌属(Bacillus)[18]、纤维单胞菌(Cellulomonas)[19]和中间苍白杆菌(Ochrobactrum intermedium)[20]。微生物降解尼古丁主要途径有存在于节杆菌属中的吡啶途径[6-8]、存在于假单胞菌属中的吡咯途径[11-15]、存在于真菌中的脱甲基途径[21]。此外,许平等人发现存在于中间苍白杆菌SJY1菌株中的吡啶与吡咯途径的混合途径[22]。
目前,研究较多的双加氧酶为芳香烃双加氧酶,是参与芳香烃化合物生物降解的主要酶类,它能活化空气中的氧分子,使羟基化的芳香烃在活性氧作用下发生双氧化开环反应,可以清除环境中难以降解的芳香烃化合物。在酶的生物学系统分类中,一般将能催化芳香烃类化合物的双加氧酶都归属于非血红素类铁氧化-还原蛋白,按照酶的俗名命名法,根据其产物的基本结构,可把它们区分为双羟基化酶和开环酶[23]。
根癌土壤杆菌SCUEC1全基因测序所得基因簇经在线比对,agnE与中间苍白杆菌SJY1中vppE具有同源性,推测agnE基因编码2, 5-二羟基吡啶双加氧酶[22, 24]。本研究通过克隆表达AgnE蛋白,以2, 5-二羟基吡啶为底物进行功能验证,试图明确agnE基因的功能,为根癌土壤杆菌SCUEC1菌株降解尼古丁分子机制的揭示奠定基础。
1 材料和方法 1.1 菌株和质粒 原核表达载体pET28a、Escherichia coli BL21(DE3)、根癌土壤杆菌SCUEC1菌株为本实验室保藏。
1.2 培养基 液体培养基LB (g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠10.0,pH 7.0。
固体培养基LA (g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠10.0,琼脂18.0,pH 7.0。
1.3 agnE基因克隆与重组质粒构建 按照TaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit Ver.3.0中说明书提取根癌土壤杆菌SCUEC1菌株总DNA。结合尼古丁降解菌SCUEC1中agnE基因的核酸序列和表达载体pET28a的多克隆位点,使用Primer Premier 5.0设计上下游引物,通过PCR反应克隆基因片段。设计的上游引物Primer-F:5′-CGCGAGCTCATGGACCACACGAGTTTCACCGAAATC-3′ (下划线处为Sac Ⅰ酶切位点);下游引物Primer-R:5′-CCCAAGCTTTTATCGTTCCATTTTCATGTCCG-3′ (下划线处为Hind Ⅲ酶切位点)。PCR反应体系:模板DNA 1 μL,Primer-F 1 μL,Primer-R 1 μL,dNTPs 1 μL,10×PCR buffer 2.5 μL,Taq酶0.3 μL,ddH2O 18.2 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 1 min,65 ℃ 1 min,72 ℃ 1.5 min,30个循环;72 ℃ 10 min。回收目的片段,与pET28a载体连接,转化感受态细胞E. coli BL21(DE3)。挑取单菌落,利用SacⅠ和Hind Ⅲ对提取质粒进行双酶切鉴定,将鉴定正确的阳性克隆进行DNA测序鉴定。
1.4 agnE基因的表达与SDS-PAGE分析 在DNA测序鉴定正确的阳性克隆菌液中加入IPTG至终浓度为0.2 mmol/L,16 ℃下诱导表达20 h。将诱导表达的菌液离心,收集菌体,在5 mL裂解液中重悬,超声破碎15 min (超声1 s,间隔2 s)。4 ℃离心,分别收集全菌液、上清液、沉淀。采用镍柱对上清液中AgnE蛋白进行纯化,依次用含80、100、150、250、500 mmol/L咪唑洗脱液洗脱蛋白。12% SDS-PAGE检测,电压为80 V。
1.5 基因的生物信息学分析 使用NCBI中的BLAST在线软件以及ClustalX软件对AgnE氨基酸序列同源性和保守序列进行分析,采用MEGA 6.0软件构建进化树,预测进化关系;利用BioEdit软件和ProtParam在线软件对蛋白理化性质进行预测,采用PROSITE、NCBI BLASTp在线软件对保守结构域(CD)进行预测,pHD在线预测蛋白质的二级结构。
1.6 AgnE酶活的测定 2, 5-二羟基吡啶双加氧酶能将2, 5-二羟基吡啶转化为N-甲酰马来酰胺酸。2, 5-二羟基吡啶在320 nm有特异吸收峰,随着酶促反应的进行,320 nm处的吸光度随之减少。酶催化反应体系:pH 8.0 Tris-HCl缓冲液(含0.025 mmol/L Fe2+),0.1 g/L 2, 5-二羟基吡啶,催化反应温度为20 ℃。500 μL反应体系中加入50 μL的酶样品溶液。两倍体积乙醇终止酶促反应,离心收集上清,测定上清液在320 nm处吸光度值。
1.7 温度、金属离子及pH对酶活性的影响 温度对酶活性的影响测定:将底物处于pH 8.0缓冲溶液(含0.025 mmol/L Fe2+)中,分别在不同温度下进行酶促反应。金属离子对酶活性的影响测定:在20 ℃、pH 8.0条件下,酶促反应分别在不同金属离子条件下进行。pH对酶活性的影响测定:在20 ℃下,酶促反应分别在不同pH值缓冲溶液(含0.025 mmol/L Fe2+)中进行。将最高酶活性设为100%,计算其他条件下的相对酶活。
2 结果和分析 2.1 agnE基因的克隆与重组质粒pET28a-agnE的构建 以根癌土壤杆菌SCUEC1菌株总DNA为模板,Primer-F、Primer-R为引物,通过PCR扩增得到与agnE基因大小一致的约1.0 kb的片段。将扩增得到的片段与pET28a载体连接,转化E. coli BL21(DE3)后挑取转化子,提取质粒,SacⅠ和Hind Ⅲ双酶切得到2个片段,分别对应agnE基因双酶切片段和pET28a载体双酶切片段(图 1),对克隆片段进行核酸序列测定,与基因agnE序列(图 2)一致。
 |
| 图 1 质粒pET28a-agnE的构建 Figure 1 Construction of plasmid pET28a-agnE. M1: DL2000 DNA marker; M2: λ-Hind Ⅲ DNA marker; 1: plasmid pET28a DNA digested with SacⅠand Hind Ⅲ; 2: plasmid pET28a-agnE DNA digested with SacⅠ and Hind Ⅲ; 3: gene agnE DNA fragment digested with SacⅠand Hind Ⅲ. |
| 图选项 |
 |
| 图 2 基因agnE的核苷酸序列 Figure 2 Nucleotide sequence of gene agnE. |
| 图选项 |
2.2 agnE基因表达与SDS-PAGE分析 重组pET28a-AgnE蛋白通过IPTG在16 ℃诱导20 h,用镍柱纯化,12% SDS-PAGE检测结果如图 3所示,上清液中AgnE蛋白浓度较低,沉淀中AgnE蛋白浓度较高,大部分AgnE蛋白存在于沉淀中。用250 mmol/L咪唑对上清液中AgnE蛋白进行洗脱,得到较纯的AgnE蛋白。与蛋白分子量标准比较,AgnE蛋白分子量约为42.0 kDa,与目的蛋白理论计算值(42.0 kDa)相符。
 |
| 图 3 AgnE蛋白的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of the protein AgnE in E. coli BL21(DE3). Lane 1: lysed E. coli BL21 carrying the plasmid pET28a; lane 2: supernant of the lysed E. coli BL21 carrying the plasmid pET28a; lane 3: precipitate of the lysed E. coli BL21 carrying the plasmid pET28a; lane 4: lysed E. coli BL21 carrying the recombinant plasmid pET28a-agnE; lane 5: supernant of the lysed E. coli BL21 carrying the recombinant plasmid pET28a-agnE; lane 6: precipitate of the lysed E. coli BL21 carrying the recombinant plasmid pET28a-agnE; lane 7: purified protein AgnE. |
| 图选项 |
2.3 agnE基因编码的氨基酸序列分析 利用NCBI BLASTp在线软件在GenBank中进行检索,选择相似度较高的氨基酸序列进行比对分析,采用N-J法构建进化树,Bootstrap值为1000,用MEGA 6.0构建进化树(图 4)。AgnE氨基酸序列与中间苍白杆菌SJY1中2, 5-二羟基吡啶双加氧酶和根瘤菌中亮氨酰氨基肽酶氨基酸序列均具有100%的同源性。中间苍白杆菌SJY1中2, 5-二羟基吡啶双加氧酶能将2, 5-二羟基吡啶转化为N-甲酰马来酰胺酸。根瘤菌中亮氨酰氨基肽酶是水解以亮氨酸残基为氨基末端的蛋白质或多肽的酶类。
 |
| 图 4 基于氨基酸序列AgnE蛋白的进化树构建 Figure 4 Phylogenetic tree of AgnE protein based on amino acid sequence. The GenBank accession numbers are given in parentheses. Posterior probabilities are denoted at nodes. Numbers at branching points are bootstrap values. Bar 0.02 at the bottom is the sequence divergence. |
| 图选项 |
根据ExPASy ProtParam在线分析得出,AgnE的氨基酸组成个数为342,理论分子量37.7 kDa,pI 4.97,带负电荷的氨基酸残基数(Asp+Glu)为42,带正电荷的氨基酸残基数(Arg+Lys)为27,不稳定指数42.82,平均亲水系数(GRVAY) -0.167。
采用PROSITE、NCBI BLASTp在线对保守结构域(CD)进行预测,AgnE蛋白属于肽酶M29超家族。pHD在线预测蛋白质的二级结构,有8个α-螺旋,有4个蛋白结合区域,分别为氨基酸序列中第1位点的甲硫氨酸、第46位点的谷酰胺、第110位点的精氨酸以及第133位点的赖氨酸。
综上所述,AgnE不稳定指数高于阈值40,推测AgnE为不稳定蛋白。带负电荷氨基酸数多于带正电荷氨基酸数,推断为酸性蛋白质。根据GRVAY数值推测AgnE为亲水性蛋白。利用SignalP 4.1 Server在线预测AgnE不含信号肽序列,推测AgnE为非分泌性蛋白。
2.4 AgnE蛋白酶活性的检测 在温度为20 ℃、pH 8.0缓冲溶液(含0.025 mmol/L Fe2+)中,用纯化的AgnE蛋白进行酶促反应。分别测定酶促反应0、5、10、20 min时体系吸光度值。结果如图 5所示,320 nm处吸光度值随着酶促反应的进行而降低,反应20 min转化率达到89.19%。而对照在0、5、10、20 min吸光度值保持不变。表明AgnE蛋白具有催化2, 5-二羟基吡啶转化的酶活性。
 |
| 图 5 不同反应时间反应体系的紫外吸光度值 Figure 5 The ultraviolet absorbance of the reaction system at different reaction time. |
| 图选项 |
2.5 温度对AgnE蛋白酶活性的影响 在pH 8.0缓冲溶液(含0.025 mmol/L Fe2+)条件下,分别测定15、20、25、30、35、40、50、60、70 ℃不同温度对AgnE蛋白酶活性影响,结果如图 6所示。在温度为20-70 ℃的范围内,随温度升高,AgnE蛋白酶活性逐渐下降,AgnE蛋白酶活性的最适反应温度为20 ℃。
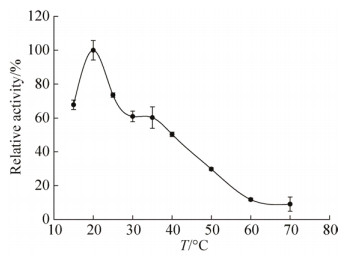 |
| 图 6 温度对AgnE蛋白酶活的影响 Figure 6 The effects of temperature on the enzyme activity of AgnE protein. |
| 图选项 |
2.6 pH对AgnE蛋白酶活性的影响 在温度为20 ℃,分别测定pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0时缓冲溶液(含0.025 mmol/L Fe2+)条件下AgnE蛋白酶的催化活性,结果如图 7所示。在pH为3.0-8.0的范围内,随pH增加,AgnE蛋白酶活性逐渐上升;在pH为8.0-10.0的范围内,随pH增加,AgnE蛋白酶活性逐渐下降,AgnE酶的最适反应pH为8.0。
 |
| 图 7 pH对AgnE蛋白酶活的影响 Figure 7 The effects of metal ion on the enzyme activity of AgnE protein. |
| 图选项 |
2.7 金属离子对AgnE蛋白酶活性的影响 在温度为20 ℃、pH 8.0缓冲溶液(不含金属离子)条件下,分别测定终浓度为0.025 mmol/L的Fe2+、Ca2+、Mg2+、Zn2+、Mn2+、Ni2+、Cu2+对AgnE蛋白酶活性的影响。结果如图 8所示,Ni2+和Cu2+ 对AgnE蛋白酶活性有一定的抑制作用,而Ca2+和Fe2+对AgnE蛋白酶活性有一定的促进作用,Fe2+对AgnE蛋白酶活性的促进作用较高。
 |
| 图 8 金属离子对AgnE蛋白酶活的影响 Figure 8 The effects of metal ion on the enzyme activity of AgnE protein. CK: No metal ions were added. |
| 图选项 |
3 讨论 氮杂环是许多天然分子化合物和人造化学活性物质中共同的结构单元,吡咯、吡啶以及吡嗪衍生物可以用作药物、除草剂、杀虫剂、油漆等[25-26],有些是环境污染物,如烟草中的尼古丁。微生物代谢在清除环境中尼古丁残物起到重要作用,进行尼古丁降解菌代谢途径的探究,对被尼古丁污染的环境中的生物修复具有潜在应用价值[10]。
本研究对根癌土壤杆菌SCUEC1菌株中的一个尼古丁降解相关基因agnE进行克隆和功能研究,该基因编码的氨基酸序列与中间苍白杆菌SJY1中VppE蛋白氨基酸序列具有100%的相似度[22],与恶臭假单胞杆菌中Hpo蛋白氨基酸序列具有82%的相似度[27]。agnE基因编码AgnE蛋白的功能为2, 5-二羟基吡啶双加氧酶。2, 5-二羟基吡啶中吡啶环在自然条件下不易降解开环,2, 5-二羟基吡啶双加氧酶是尼古丁降解途径中关键酶。
AgnE蛋白的氨基酸序列与氨基肽酶(AmpS)具有较高同源性,AgnE蛋白中含有一个与氨基肽酶(AmpS)类似的保守结构域。黄色葡萄球菌的AmpS中含有2个高效的Co2+结合位点[28]。将AgnE的结构模型与AmpS的晶体结构比较后发现,AgnE中与AmpS 2个Co2+结合位点相对应位置的氨基酸残基不同,这可能导致AgnE失去了结合Co2+的能力,推测AgnE蛋白可能不具备氨基肽酶活性,在尼古丁降解基因蛋白Hpo、NicX等也存在类似现象[27, 29-30]。
References
| [1] | Armstrong DW, Wang X, Ercal N. Enantiomeric composition of nicotine in smokeless tobacco, medicinal products, and commercial reagents. Chirality, 1998, 10: 587-591. DOI:10.1002/(ISSN)1520-636X |
| [2] | Kim HS, Jeffrey GA. The crystal structure of a 1:1 nicotine-salicylic acid complex (nicotinyl salicylate). Acta Crystallographica Section B: Structural Science, Crystal Engineering and Materials, 1971, 27(6): 1123-1131. DOI:10.1107/S0567740871003637 |
| [3] | Hawkins BT, Abbruscato TJ, Egleton RD, Brown RC, Huber JD, Campos CR, Davis TP. Nicotine increases in vivo blood-brain barrier permeability and alters cerebral microvascular tight junction protein distribution. Brain Research, 2004, 1027(1/2): 48-58. |
| [4] | Civilini M, Domenis C, Sebastianutto N, de Bertoldi M. Nicotine decontamination of tobacco agro-industrial waste and its degradation by micro-organisms. Waste Management & Research, 1997, 15(4): 349-358. |
| [5] | Brandsch R, Decker K. Isolation and partial characterization of plasmid DNA from Arthrobacter oxidans. Archives of Microbiology, 1984, 138(1): 15-17. DOI:10.1007/BF00425400 |
| [6] | Kaiser JP, Feng Y, Bollag JM. Microbial metabolism of pyridine, quinoline, acridine, and their derivatives under aerobic and anaerobic conditions. Microbiology and Molecular Biology Reviews, 1996, 60(3): 483-498. |
| [7] | Baitsch D, Sandu C, Brandsch R, Igloi GL. Gene cluster on pAO1 of Arthrobacter nicotinovorans involved in degradation of the plant alkaloid nicotine: cloning, purification, and characterization of 2, 6-dihydroxypyridine 3-hydroxylase. Journal of Bacteriology, 2001, 183(18): 5262-5267. DOI:10.1128/JB.183.18.5262-5267.2001 |
| [8] | Igloi GL, Brandsch R. Sequence of the 165-kilobase catabolic plasmid pAO1 from Arthrobacter nicotinovorans and identification of a pAO1-dependent nicotine uptake system. Journal of Bacteriology, 2003, 185(6): 1976-1986. DOI:10.1128/JB.185.6.1976-1986.2003 |
| [9] | Kong W, Xian F, Li CY, Wang JX, Li XH. Isolation and characterization of a high nicotine-degradation bacterium. Journal of Huazhong Agricultural University, 201l, 30(1): 30-33. (in Chinese) 孔雯, 先锋, 李长影, 王家昕, 李晓华. 1株烟碱降解菌的筛选、鉴定及其降解性能的初步研究. 华中农业大学学报, 201l, 30(1): 30-33. |
| [10] | Li XH, Mei F, Kong W, Li Y, Ma TT, Pi T. Research development of nicotine degrading mechanism in microorganisms and their applications. Journal of South-Central University for Nationalities (Natural Science Edition), 2017, 36(4): 27-35. (in Chinese) 李晓华, 梅枫, 孔雯, 李阳, 马婷婷, 皮婷. 尼古丁微生物降解代谢机制和应用的研究进展. 中南民族大学学报(自然科学版), 2017, 36(4): 27-35. |
| [11] | Ruan AD, Min H, Peng XH, Huang Z. Isolation and characterization of Pseudomonas sp. strain HF-1, capable of degrading nicotine. Research in Microbiology, 2005, 156(5/6): 700-706. |
| [12] | Tang HZ, Wang LJ, Meng XZ, Ma LY, Wang SN, He XF, Wu G, Xu P. Novel nicotine oxidoreductase-encoding gene involved in nicotine degradation by Pseudomonas putida strain S16. Applied and Environmental Microbiology, 2009, 75(3): 772-778. DOI:10.1128/AEM.02300-08 |
| [13] | Tang HZ, Wang SN, Ma LY, Meng XZ, Deng ZX, Zhang DK, Ma CQ, Xu P. A novel gene, encoding 6-hydroxy-3-succinoylpyridine hydroxylase, involved in nicotine degradation by Pseudomonas putida strain S16. Applied and Environmental Microbiology, 2008, 74(5): 1567-1574. DOI:10.1128/AEM.02529-07 |
| [14] | Wang LJ, Tang HZ, Yu H, Yao YX, Xu P. An unusual repressor controls the expression of a crucial nicotine-degrading gene cluster in Pseudomonas putida S16. Molecular Microbiology, 2014, 91(6): 1252-1269. DOI:10.1111/mmi.2014.91.issue-6 |
| [15] | Wang SN, Liu Z, Tang HZ, Meng J, Xu P. Characterization of environmentally friendly nicotine degradation by Pseudomonas putida biotype A strain S16. Microbiology, 2007, 153(5): 1556-1565. DOI:10.1099/mic.0.2006/005223-0 |
| [16] | Uchida S, Maeda S, Masubuchi K, Shinohara T, Kisaki T. Isolation of nicotine-degrading bacteria and degradation of nicotine in shredded tobacco and tobacco extract. Nippon Sembai Kosha Chou Kenkyusho Kenkyu Hokoku, 1976, 18: 197-201. |
| [17] | Hylin JW. The microbial degradation of nicotine. Ⅱ. The mode of action of Achromobacter nicotinophagum. Archives of Biochemistry and Biophysics, 1959, 83(2): 528-537. DOI:10.1016/0003-9861(59)90061-X |
| [18] | Brandsch R. Microbiology and biochemistry of nicotine degradation. Applied Microbiology and Biotechnology, 2006, 69(5): 493-498. DOI:10.1007/s00253-005-0226-0 |
| [19] | Kolenbrander PE, Weinberger M. 2-Hydroxypyridine metabolism and pigment formation in three Arthrobacter species. Journal of Bacteriology, 1977, 132(1): 51-59. |
| [20] | Yuan YJ, Lu ZX, Huang LJ, Bie XM, Lü FX, Li Y. Optimization of a medium for enhancing nicotine biodegradation by Ochrobactrum intermedium DN2. Journal of Applied Microbiology, 2006, 101(3): 691-697. DOI:10.1111/jam.2006.101.issue-3 |
| [21] | Kyerematen GA, Vesell ES. Metabolism of nicotine. Drug Metabolism Reviews, 1991, 23(1/2): 3-41. |
| [22] | Yu H, Tang HZ, Zhu XY, Li YY, Xu P. Molecular mechanism of nicotine degradation by a newly isolated strain, Ochrobactrum sp. Strain SJY1. Applied and Environmental Microbiology, 2015, 81(1): 272-281. DOI:10.1128/AEM.02265-14 |
| [23] | Zhang J, Xia CG. Studies of structure and function of aromatic hydrocarbon dioxygenases. Progress in Chemistry, 2004, 16(1): 116-122. (in Chinese) 章俭, 夏春谷. 芳香烃双加氧酶的结构与功能研究. 化学进展, 2004, 16(1): 116-122. |
| [24] | Mei F, Kong W, Li Y, Ma TT, Pi T, He DL, Cheng GJ, Liu T, Li XH. Isolation and gene characterization of a nicotine-degradation strain Agrobacterium tumefacience SCUEC1. Acta Microbiologica Sinica, 2017, 57(5): 701-709. (in Chinese) 梅枫, 孔雯, 李阳, 马婷婷, 皮婷, 何冬兰, 程国军, 刘涛, 李晓华. 尼古丁降解菌SCUEC1菌株的分离及其降解基因. 微生物学报, 2017, 57(5): 701-709. |
| [25] | Scriven EFV, Murugan R. Pyridine and pyridine derivatives. Kirk-Othmer Encyclopedia of Chemical Technology, 2005, 20: 1-33. |
| [26] | O'Hagan D. Pyrrole, pyrrolidine, pyridine, piperidine and tropane alkaloids. Natural Product Reports, 2000, 17(5): 435-446. DOI:10.1039/a707613d |
| [27] | Tang HZ, Yao YX, Wang LJ, Yu H, Ren YL, Wu G, Xu P. Genomic analysis of Pseudomonas putida: genes in a genome island are crucial for nicotine degradation. Scientific Reports, 2012, 2: 377. DOI:10.1038/srep00377 |
| [28] | Odintsov SG, Sabala I, Bourenkov G, Rybin V, Bochtler M. Staphylococcus aureus aminopeptidase S is a founding member of a new peptidase clan. Journal of Biological Chemistry, 2005, 280(30): 27792-27799. DOI:10.1074/jbc.M502023200 |
| [29] | Yao YX, Tang HZ, Ren HX, Yu H, Wang LJ, Zhang W, Behrman EJ, Xu P. Iron(Ⅱ)-dependent dioxygenase and N-formylamide deformylase catalyze the reactions from 5-hydroxy-2-pyridone to maleamate. Scientific Reports, 2013, 3: 3235. DOI:10.1038/srep03235 |
| [30] | Jiménez JI, Acebrón I, García JL, Díaz E, Manche o JM. A preliminary crystallographic study of recombinant NicX, an Fe2+-dependent 2, 5-dihydroxypyridine dioxygenase from Pseudomonas putida KT2440. Acta Crystallographica Section F-Structural Biology Communications, 2010, 66(5): 549-553. DOI:10.1107/S174430911001119X |
