叶晓锋1, 严羽萍1, 唐蓉1, 朱军莉1

 , 高海春2
, 高海春2 1.浙江工商大学食品与生物工程学院, 浙江省食品安全重点实验室, 浙江 杭州 310018;
2.浙江大学生命科学学院, 浙江 杭州 310058
收稿日期:2017-11-20;修回日期:2018-01-10;网络出版日期:2018-01-25
基金项目:省协同创新中心(2017SICR105);国家自然科学基金(31271954);复旦大学教育部/卫计委医学分子病毒学重点实验室项目(FDMV-2017001)
*通信作者:朱军莉, Tel: +86-571-28008924, E-mail: junlizhu0305@163.com
摘要:[目的]波罗的海希瓦氏菌(Shewanella baltica)是冷藏海产鱼类的特定腐败菌。研究群体感应信号AI-2/LuxS对鱼源S.baltica生物被膜和致腐的调控作用。[方法]扩增SB11分离株的luxS基因,用自杀性质粒构建luxS基因缺失株,通过结晶紫染色、珠涡流法、显微镜观察和HPLC,比较分析野生株与缺失株△luxS在4℃和28℃下生物被膜形成、粘附能力、泳动性和致腐产物的差异。[结果]S.baltica SB11中扩增获得luxS基因,生物信息学分析显示LuxS蛋白由169个氨基酸构成,含有保守的His-Thr-Leu-Glu-His(HTLEH)模体和关键氨基酸位点,蛋白三维空间结构与其他细菌相似。与野生株相比,△luxS缺失株上清荧光信号散失,但不影响生长,生物被膜形成期和成熟期的含量显著低于野生株,在4℃培养96 h和28℃培养24 h被膜分别减少20.1%和27.9%。缺失株在不锈钢片的粘附能力明显减弱,其中在4℃培养72 h和28℃培养24 h后的粘附量比野生株分别减少6.48%和6.57%。荧光显微镜观察发现,野生株能快速粘附于玻璃片,聚集形成大量生物被膜,而△luxS仅形成平坦稀疏的被膜,粘附细菌降低,CLSM证实野生株和△luxS的成熟被膜厚度分别为68.95μm和36.44 μm。并且,△luxS株在4℃和28℃下泳动性均显著强于野生株。然而,野生株和△luxS株三甲胺和腐胺积累无差异。[结论]鱼源S.baltica中LuxS蛋白保守,AI-2/LuxS参与被膜、粘附能力及泳动性等多种生物被膜形成相关的调控作用,然而不是该菌致腐能力的功能性群体感应信号。
关键词: Shewanella baltica 群体感应AI-2 LuxS 生物被膜 致腐性
Regulation of AI-2/LuxS gene on biofilm formation and spoilage of Shewanella baltica
Ye Xiaofeng1, Yan Yuping1, Tang Rong1, Zhu Junli1

 , Gao Haichun2
, Gao Haichun2 1.College of Food Science & Biotechnology Engineering of Zhejiang Gongshang University, Hangzhou 310018, Zhejiang Province, China;
2.College of Life Science, Zhejiang University, Hangzhou 310058, Zhejiang Province, China
Received 20 November 2017; Revised 10 January 2018; Published online 25 January 2018
*Corresponding author: Junli Zhu, Tel: +86-571-28008924, E-mail: junlizhu0305@163.com
Supported by the Collaborative Innovation Central Program of Zhejiang Province (2017SICR105), by the National Natural Science Foundation of China (31271954) and by the Key Laboratory of Medical Molecular Virology of the Ministry of Education/Health Planning of Fudan University (FDMV-2017001)
Abstract: [Objective]Shewanella baltica is a specific spoilage bacterium in marine fish during refrigerated storage. In the present study regulation of quorum sensing AI-2/LuxS on the biofilm formation and spoilage of S. baltica was elucidated.[Methods]LuxS gene in SB11 strain was amplified and knocked out by suicide plasmid. Biofilm formation, adhesion, swimming and amine metabolites between wild strain and △luxS mutant at 4℃ and 28℃ were comparatively measured by using crystal violet staining, bead vortexing, microscopy and HPLC, respectively.[Results]S. baltica SB11 luxS gene was amplified, and bioinformatics analysis revealed that deduced LuxS protein with 169 aa contained conserve His-Thr-Leu-Glu-His (HTLEH) motif and key amino acid functional sites. Three-dimensional structure of LuxS protein was similar to that from various bacteria. Compared with wild strain, supernatant of △luxS mutant lost bioluminance activity, although their growth was the same. △luxS exhibited lower biofilm development and maturation than the wild strain, and decreased by 20.1% and 27.9% at 4℃ for 96 h and at 28℃ for 24 h, respectively. Compared with the wild strain, △luxS reduced adherent cell by 6.48% at 4℃ for 72 h, and 6.57% at 28℃ for 24 h, indicating that the adherence of mutant on steel slide was significantly weak. The observation by fluorescence microscopy showed that the wild strain rapidly adhered to the coverslip and formed a large number of biofilm, whereas, △luxS mutant only seemed to form a flat sparse biofilm and failed to aggregate into clusters. Confocal Laser Scanning Microscope (CLSM) revealed that the thickness of maturing biofilm in the wild and mutant strains was 68.95 μm and 36.44 μm, respectively. Furthermore, the absence of luxS gene significantly promoted the bacterial swimming at 4 and 28℃. However, the production of trimethylamine and putrescine between the wild and mutant strain was similar.[Conclusion]LuxS protein in S. baltica SB11 was conserve, and AI-2/LuxS was involved in biofilm formation, adhesion, swimming, but not a functional signal in the regulation of spoilage potential.
Key words: Shewanella baltica quorum sensing AI-2 LuxS biofilm spoilage potential
细菌在生长繁殖过程中会产生自诱导分子(autoinducer,AI)并释放到环境中,当环境中的信号分子浓度达到一定阈值后开启细胞密度依赖的特定基因表达,该过程为群体感应(quorum sensing,QS)。QS是一种细菌种间和种内信息交流的调控机制,参与生物被膜的形成、发光、毒力因子的释放、泳动能力、蛋白酶活性等大量基因表达的调控[1]。迄今为止,十几种群体感应自诱导分子被鉴定报道,包括高丝氨酸内酯(N-acyl-N-homoserine lactone,AHLs)、寡肽(autoinducing peptides,AIP)和呋喃酮酰硼酸二酯(autoinducer-2,AI-2)等[2]。Bassler等[3]首先发现哈维氏弧菌(Vibro harveyi)除AHLs信号,还有另一套系统AI-2来调控发光。据研究,大量革兰氏阳性及阴性菌中发现AI-2活性,认为AI-2是一种用于种间QS的信号分子[4]。在多种食品介质和食源性微生物中也报道AI-2活性,西红柿、香瓜和胡萝卜等新鲜果蔬[5]、牛奶[5]和腐败水产品[6]中鉴定出AI-2类信号分子,在气调保藏的牛肉中分离得到15株乳酸菌也检到AI-2活性[7]。
迄今为止,已发现包括鼠伤寒沙门氏菌(Salmonella typhimurium)、幽门螺旋杆菌(Helicobacter pylori)、流感嗜血杆菌(Heamophilus influenzae)、乳酸菌等在内的许多细菌中报道存在AI-2合成的关键luxS基因。LuxS蛋白在1999年才被确认为信号分子,然而Miller等[8]早在1968年发现LuxS是S-核糖高半胱氨酸(S-ribosylhomocysteine,SRH)的裂解酶。现在细菌体内AI-2的生物合成途径已较清楚,以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)作为甲基供体,在甲基转移酶的作用下,生成中间产物S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),然后通过甲硫腺苷核苷酸酶作用下生成SRH,SRH在LuxS蛋白作用下分解成等摩尔的4, 5-羟基-2, 3-戊二酮(4, 5-Dihydroxy-2, 3-pentanedione,DPD)和高半胱氨酸,随后DPD自发快速环化形成AI-2[9]。该过程也是细菌甲基代谢循环(activated methyl cycle,AMC)的一个部分,LuxS蛋白是其中一个重要的代谢酶。研究报道了多种细菌中luxS基因功能,表明其参与调控控制发光、毒力、生物被膜形成等表型[4, 9]。然而,不同细菌的luxS基因对同一表型的影响不完全一致。
波罗的海希瓦氏菌(Shewanell baltica)为革兰氏阴性,嗜冷性,具有将氧化三甲胺还原为三甲胺能力,产H2S,导致鱼体腐败出现酸臭味等异味,是多种海产品在贮运过程中品质下降的特定腐败菌[10-11]。前期研究发现,S. baltica能产生AI-2活性,而LuxS蛋白对S. baltica生物被膜形成和致腐性的影响未见报道。鉴于此,本研究拟扩增分析波罗的海希瓦氏菌luxS基因,构建luxS基因缺失株,比较研究在冷藏和室温培养条件下野生株和缺失株对生物被膜形成、泳动性和致腐性的影响。该研究将为探究AI-2/LuxS系统在S. baltica中的生物学功能、研究QS系统对腐败菌的调控作用奠定良好基础。
1 材料和方法 1.1 主要试剂和仪器 酪胺、腐胺、鸟胺、组胺、尸胺、色胺、亚精胺、精胺等生物胺标准品,异硫氰酸荧光素标记的刀豆球蛋白A(FITC),购于美国Sigma公司;氧化三甲胺(TMAO)、三甲胺盐酸盐(TMA)、丹磺酰氯购自阿拉丁有限公司;LB、胰蛋白胨大豆肉汤(TSB)等购于青岛海博生物有限公司。主要仪器有:酶标仪VICTOR X,美国Perkin Elmer公司;荧光显微镜LEICA DM4000,德国莱卡公司;PCR仪,杭州博日科技有限公司;高效液相色谱仪HPLC 1100,美国安捷伦公司。
1.2 菌种和质粒 波罗的海希瓦氏Shewanella baltica SB11是大黄鱼中分离的特定腐败菌,其16S rRNA的NCBI登录号为KT716389,为本实验室保存。V. harveyi BB170购于中国普通微生物保藏管理中心,基因敲除的自杀性质粒pHGM01从Jin等[12]处获赠,宿主菌大肠杆菌WM3064为浙江大学微生物实验室保藏。限制性内切酶EcoR Ⅰ和Hind Ⅲ,T4 DNA连接酶、Taq DNA聚合酶、DNA纯化试剂盒、质粒提取试剂盒等,均购自宝生物工程有限公司。
1.3 SB11菌株luxS基因扩增和生物信息学分析 用煮沸法提取S. baltica DNA,PCR体系为:dNTPs Mixture 2 μL,10×PCR Buffer 2.5 μL,上下游引物各0.5 μL,DNA模板0.5 μL,Taq酶0.25 μL,ddH2O 18.75 μL,共25 μL。PCR扩增程序为:94 ℃ 5 min;94 ℃ 40 s,49 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min,产物经纯化后测序。菌株SB11的LuxS蛋白序列提交至PredictProtein (https://www.predictprotein.org/)分析蛋白空间结构,并在SWISS-MODEL (http://swissmodel.expasy.org/)寻找合适的已知该蛋白三维空间结构,采用Alignment Mode建立LuxS蛋白模拟的三维空间。
1.4 SB11菌株luxS基因缺失株的构建 采用att-融合PCR构建S. baltica SB11的luxS基因缺失株,将缺失的luxS基因克隆到自杀性质粒pHGM01,并转化到大肠杆菌WM3064,利用同源重组技术并利用庆大霉素获得luxS基因缺失株△luxS[10]。本研究构建缺失株△luxS的引物见表 1。
表 1. luxS基因缺失株构建实验中所使用的引物 Table 1. Primers used in this study of luxS mutant
| Primer name | Sequence (5'→3') description |
| luxS-5O | GGGGACAAGTTTGTACAAAAAAGCAGGCTTCGGTCTACATAAAGTGGCG |
| luxS-5I | GGTCCGGGTTCGCTATCTATGAGTATGATCGACGGTAAAG |
| luxS-3I | ATAGATAGCGAACCCGGACCGACGAAATTCTAGGTAATCT |
| luxS-3O | GGGGACCACTTTGTACAAGAAAGCTGGGTCAACCGCCATATTCGCCATT |
| luxS-LF | GTCGGTGCTATTCCTGTGAA |
| luxS-SR | AATTGCGGTGCAGAATAAGG |
| luxS-SF | ACAGCGTCAACACTAAATGC |
| luxS-LR | TGGTGCGACAGTTGATACTT |
表选项
1.5 野生株和缺失株luxS基因扩增及AI-2活性检测 将SB11野生株和缺变株培养24 h后,提取基因组DNA,同1.3方法PCR扩增luxS基因。参考Bodor等[13]方法取培养12 h的野生株与△luxS菌液,离心(10000×g,3 min)取上清,过滤后获得无菌上清液。将过夜活化的V. harveyi BB170报告菌用AB培养基以1:5000稀释,分别将10 μL待测的无菌上清液和90 μL稀释的BB170菌液添加至96孔酶标板。以大肠杆菌DH5α和哈维氏弧菌BB120为阴阳性对照,AB培养基为空白对照。荧光酶标仪选择OPS模式检测,在30 ℃培养每隔0.5 h检测1次,连续测定6 h。
1.6 生长和生物被膜测定 取1%过夜活化的S. baltica SB11野生株与△luxS缺失株分别接种LB培养基。在4 ℃静置培养120 h,每隔24 h取样,在28 ℃培养24 h,每隔3 h取样,分光光度计600 nm处测定吸光度。将SB11与△luxS菌液用TSB培养基分别稀释1000倍,添加至96孔板,每孔200 μL。菌体在4 ℃和28 ℃分别培养至144 h和48 h,每隔12 h或24 h取出。参考Djordjevic等[14]方法用结晶紫法测定样品被膜含量,最后用酶标仪测量600 nm处吸光值。
1.7 细菌的粘附性 将SB11野生株与△luxS株用于被膜分析的稀释菌液同时接种至8孔板中,加入不锈钢片(1 cm× 1 cm)和盖玻片(14 mm×14 mm)。菌体分别在4 ℃和28 ℃静置培养至144 h和48 h,每隔12 h或24 h取出后参考Nguyen等[15]的珠涡流法对粘附在不锈钢片表面的细菌进行计数。用无菌磷酸缓冲液(PBS)洗去不锈钢片表面的浮游菌,放于含无菌生理盐水的Falcon管中,加入适量玻璃珠,剧烈涡旋3 min,梯度稀释计数。
1.8 荧光和共聚焦显微镜(CLSM)观察 将细菌粘附中4 ℃培养的野生株与△luxS株盖玻片取出,用无菌PBS洗去表面的浮游菌,在2.5%戊二醛中固定12 h,用PBS清洗,烘箱干燥后,取70 μL 20 μg/mL FITC均匀滴加在盖玻片表面,4 ℃避光孵育30 min,取出盖玻片,漂洗3次,干燥后,放置荧光显微镜下观察。将野生株与△luxS分别接种含TSB的共聚焦培养皿,在4 ℃培养120 h后去菌悬液,用SYTO-9染料处理样品15 min。采用Zeiss LSM 710 CLSM在63×油镜下观察,用ZEN 2012软件处理三维图像。
1.9 泳动性测定 参考Packiavathy等[16]方法,泳动培养基(1.5%胰蛋白胨、0.5%氯化钠、0.3%琼脂)凝固后,吸取5 μL过夜培养的SB11野生株与△luxS菌液滴在平板中央,吸干后分别移至4 ℃和28 ℃静置培养观察。
1.10 TMA和生物胺含量测定 将活化SB11野生株与△luxS接种于TMAO-LB培养基中。经4 ℃和28 ℃培养后取上清采用苦味酸法测定TMA[18]。同时将2个菌株分别接种于LB培养基(含0.50% L-赖氨酸盐酸盐,0.25% L-鸟氨酸盐酸盐,含0.0005%吡哆醛溶剂的0.25% L-络氨酸二钠盐),在4 ℃和28 ℃培养后,经衍生后高效液相色谱法测定生物胺[17]。
1.11 数据处理 每组样品设3个重复,其中生物被膜分析设5个重复,采用Microsoft Excel 2007和Origina 8.5进行数据处理和作图,并利用SPSS 22.0的ANOVA进行方差分析,采用Duncan法进行多重比较,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果和分析 2.1 S. baltica SB11中luxS基因扩增及蛋白序列分析 经PCR扩增,S. baltica SB11获得约为550 bp的编码AI-2的luxS基因。经测序后,发现该基因由510 bp核酸序列组成,NCBI登录号为KX192394。经生物信息学分析发现,SB11 LuxS蛋白共编码169个氨基酸,理论等电点(pI)为4.77,分子量为18831.40 U。蛋白序列比对分析显示,LuxS蛋白拥有His-Xaa-Xaa-Glu-His (HXXGH)模体,由His-Thr-Leu-Glu-His (HTLEH)氨基酸构成(图 1)。该模体中3个保守的氨基酸组氨酸(H54)、组氨酸(H58)和谷氨酸(E57)与保守的半胱氨酸(C127)共同结合二价锌离子,从而组成蛋白催化中心,催化DPD的形成。LuxS蛋白中对反应催化起关键作用的C83、E57以及对LuxS活性起重要作用的S6、H11和R39、G93无任何改变,表明S. baltica LuxS蛋白较为保守。在SWISS-MODEL网站模拟S. baltica SB11 LuxS蛋白的模拟三维空间结构(图 2),发现SB11 LuxS蛋白由4个α螺旋和5个β折叠片构成,在亚基表面有一个锌离子结合位点,与其他细菌的LuxS蛋白相似。
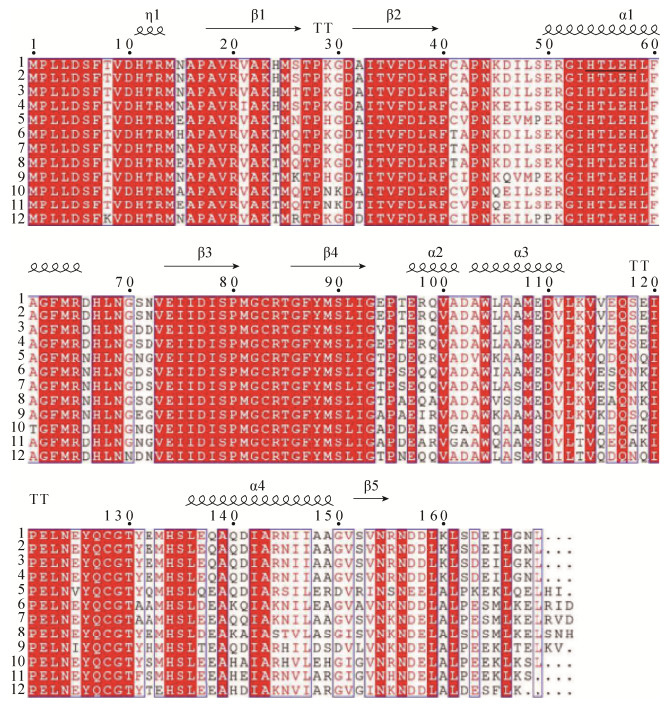 |
| 图 1 S. baltica SB11与11种不同细菌LuxS蛋白氨基酸序列多重序列同源比对 Figure 1 Alignment of LuxS protein among S. baltica SB11 and 11 species of bacteria. 1: S. baltica SB11 (KX192394); 2: S. baltica BA175 (AEG12577.1); 3: S. oneidensis (WP_011071345.1); 4: S. putrefaciens (WP_028761570.1); 5: Escherichia coli O157:H7 (BAB36972.1); 6: Vibro harveyi (WP_050936802.1); 7: Vibro parahaemolyticus (WP_005462534.1); 8: Vibro fischeri (WP_011261308.1); 9: Photorhabdus luminescens (WP_036814109.1); 10: Aeromonas hydrophila (ACD45693.1); 11: Aeromonas salmonicida (WP_005313423.1); 12: Haemophilus influenzae (WP_005694994.1). |
| 图选项 |
 |
| 图 2 S. baltica SB11 LuxS蛋白三维模型 Figure 2 Three-dimensional model of LuxS protein in S. baltica SB11. |
| 图选项 |
2.2 缺失株△luxS基因扩增和活性分析 S. baltica SB11经自杀性质粒转入和同源重组获得luxS基因缺失株△luxS。PCR扩增野生株与缺失株的luxS基因,发现野生株扩增出约550 bp的产物,与预期相符,而△luxS无条带(图 3),表明缺失株中luxS基因已成功敲除。采用V. harveyi BB170报告菌检测两株菌的AI-2活性,野生株上清液诱导报告菌培养12 h的荧光强度达到78650 RLUs,而△luxS荧光强度很低(P < 0.01),表明△luxS无AI-2活性,提示luxS基因敲除导致功能丧失。
 |
| 图 3 S. baltica SB11野生株与△luxS株luxS基因扩增(A)和AI-2活性(B) Figure 3 Amplification of luxS gene (A) and AI-2 activity (B) between SB11 wild type strain and mutant strain. M: DNA marker DL 2000; 1: SB11 wild type strain; 2: △luxS mutant strain. Data was expressed as means± standard deviations (n=5, **: P < 0.01). |
| 图选项 |
2.3 luxS缺失对S. baltica生长和生物被膜的影响 野生株与△luxS缺失株在4 ℃和28 ℃下的生长和生物被膜如图 4所示。野生株与△luxS在4 ℃前24 h生长缓慢,之后生长迅速,96 h后到达稳定期(图 4-A),而在28 ℃培养18 h达到稳定期(图 4-B)。野生株与△luxS在低温和常温下表现相似的生长(P > 0.05)。同时,野生株与△luxS在静止培养下生物被膜随着时间的延长不断增长,在4 ℃、96 h与28 ℃、48 h到达最大值后开始缓慢下降。野生株和△luxS在4 ℃初期的12 h生物被膜量相似,24 h后野生株生物被膜形成量明显大于△luxS,96 h时△luxS生物被膜量减少20% (P < 0.05) (图 4-C)。相似地,野生株在28 ℃下生物被膜形成量明显大于△luxS (P < 0.05),在48 h时△luxS生物被膜减少19% (图 4-D)。而且在4 ℃下SB11野生株生物被膜生成显著大于28 ℃ (P < 0.05)。结果表明,luxS缺失显著减弱S. baltica在低温和常温下的生物被膜形成能力。
 |
| 图 4 S. baltica SB11野生株与△luxS株在4 ℃和28 ℃下的生长和生物被膜形成 Figure 4 Growth and biofilm formation in S. baltica wild strain and luxS mutant on TSB at 4 ℃ and 28 ℃. A: Growth at 4 ℃; B: Growth at 28 ℃; C: Biofilm at 4 ℃; D: Biofilm at 28 ℃. Data was expressed as means ± standard deviations (n=5, *: P < 0.05). |
| 图选项 |
2.4 luxS缺失对S. baltica粘附能力的影响 细菌粘附在介质表面为生物被膜形成第一步,因此菌体的粘附能力对被膜形成十分重要。分析了野生株与luxS基因缺失株在不锈钢片上的粘附能力,如图 5所示。SB11野生株与△luxS在4 ℃下粘附速度较为缓慢,在初期12 h两者粘附数量较少,24 h后粘附量快速增加,72 h达到最大,分别为7.25 log10CFU/cm2和6.78 log10CFU/cm2,之后粘附量开始缓慢减少并趋于稳定。野生株与△luxS在28 ℃培养24 h粘附量达到最大,分别为6.85 log10CFU/cm2与6.40 log10CFU/cm2。△luxS在4 ℃和28 ℃下粘附量均显著低于野生株(P < 0.01),其中最大粘附量时△luxS分别减少6.48%和6.57%。结果表明,luxS基因缺失导致S. baltica粘附能力降低。
 |
| 图 5 S. baltica SB11野生株与△luxS株在4 ℃ (A)和28 ℃ (B)下粘附能力 Figure 5 The adherence of S. baltica wild strain and luxS mutant on TSB at 4 ℃ (A) and 28 ℃ (B). Data was expressed as means±standard deviations (n=3, *: P < 0.05, **: P < 0.01). |
| 图选项 |
运用荧光显微镜观察S. baltica野生株和△luxS株在玻璃片上的粘附,如图 6所示。在4 ℃粘附初期细菌分布稀疏,24 h后SB11细菌聚集增多,形成细菌团块,到72 h整块玻璃片几乎覆盖S. baltica细胞,并有堆积显现,96 h后逐渐减少。而△luxS细菌初期无聚集成团,分布均匀,生物被膜较少且较为平坦。相似地,野生株在28 ℃粘附量显著高于△luxS,在24 h粘附量达到最大值,之后便进入播撒,细菌在玻璃片上的粘附量少于4 ℃ (结果未显示)。可见,S. baltica野生株粘附量都大于△luxS,且△luxS播撒更快。CLSM观察也发现SB11野生株在4 ℃粘附5 d形成的被膜厚58.95 μm,而△luxS仅36.44 μm,其成熟被膜显著薄于野生株,与荧光显微镜观察一致。
 |
| 图 6 荧光显微镜和CLSM观察S. baltica SB11野生株与△luxS株在4 ℃下粘附和被膜结 Figure 6 Fluorescence microscope and CLSM images showing adherence and biofilm structure of S. baltica wild strain and △luxS at 4 ℃. A: willd strain; B: luxS mutant (Fluorescence microscope); C: CLSM observation. |
| 图选项 |
2.5 luxS缺失对S. baltica泳动性的影响 细菌泳动是一种由鞭毛控制的细菌运动现象,与细菌粘附、被膜形成、播撒关系密切[16]。如图 7所示,S. baltica野生株与缺失株△luxS在4 ℃泳动缓慢,培养72 h后△luxS泳动的扩散直径明显大于野生株,其扩散直径分别达到32.3 mm和25.9 mm,而在120 h后,野生株扩散直径仅为△luxS的80%。在28 ℃培养12 h后泳动的扩散直径快速增大,野生株与缺失株泳动差距也随之增大,培养48 h后分别为53.1 mm和71.5 mm。可见,△luxS在4 ℃和28 ℃下泳动性均强于野生株(P < 0.01),暗示luxS基因对S. baltica泳动性有反调控作用。
 |
| 图 7 S. baltica SB11野生株与△luxS株在4 ℃ (A)和28 ℃ (B)下的泳动 Figure 7 Swimming motility of S. baltica wild strain and △luxS at 4 ℃ (A) and 28 ℃ (B). a: Wild strain; b: luxS mutant. |
| 图选项 |
2.6 luxS基因缺失对S. baltica三甲胺和腐胺形成的影响 TMA和腐胺是水产品中特征性的腐败物质,分析luxS基因缺失对S. baltica的TMA和腐胺生成影响。如图 8所示,野生株与△luxS在4 ℃培养24 h后TMA逐渐增加,在72 h后达到最大值,分别为3.38 mg/L与3.29 mg/L (图 8-A)。野生株与△luxS在28 ℃ TMA形成量也无明显差异,其中在24 h含量为3.10–3.20 mg/L,趋于稳定。S. baltica在4 ℃生长初期腐胺形成缓慢,在72 h后含量稳定在900 mg/L左右(图 8-C),在28 ℃下腐胺形成快速,12 h后便达到最大值(图 8-D),野生株与△luxS的腐胺含量均无差异。结果表明,luxS基因缺失对S. baltica三甲胺和腐胺形成能力无显著影响(P > 0.05)。
 |
| 图 8 S. baltica SB11野生株与△luxS株在4 ℃和28 ℃下三甲胺和腐胺的形成 Figure 8 Production of TMA and putrescine in S. baltica wild strain and △luxS at 4 ℃ and 28 ℃. A: TMA level at 4 ℃; B: TMA level at 28 ℃; C: Putrescine level at 4 ℃; D: Putrescine level at 28 ℃. Data was expressed as means±standard deviations (n=3). |
| 图选项 |
3 讨论 革兰氏阴性菌和阳性菌中广泛存在AI-2/LuxS系统,在E. coli、S. Typhimurium、V. harveyi、V. cholerae等多种细菌中均已报道[9]。希瓦氏菌属中luxS基因最早由Bodor等[13]报道,在165株海洋菌中有9株希瓦氏菌检测到luxS基因和AI-2活性,发现所有希瓦氏菌均存在luxS基因,并拥有不同活性的AI-2。课题组也发现不同致腐性S. baltica的AI-2活性存在差异[6],进一步探究AI-2/LuxS对S. baltica生物被膜形成和致腐性的调控作用。研究在S. baltica SB11中扩增出预期的luxS基因,生物信息学分析表明,LuxS蛋白中存在多种保守氨基酸,如模体HTLEH中的H54、H58和E57,与其他菌种的LuxS蛋白相似。蛋白三级结构模拟发现LuxS折叠方式和空间结构与已研究的嗜血流感菌和幽门螺旋杆菌X射线衍射图的空间结构较为相似,其中与嗜血流感菌最为接近,为LuxS功能蛋白。
研究构建了缺失株△luxS,显示luxS缺失导致S. baltica上清液散失诱导BB170产生荧光信号。Learman等[18]构建S. oneidensis的luxS基因缺失株和回补株,发现野生株与回补株在对数末期有高强度的荧光值,而缺失株荧光值很低。研究发现luxS基因缺失不影响S. baltica细菌在4 ℃和28 ℃的生长,Bodor等[19]构建S. oneidensis的luxS缺失株与野生株生长无差异。通过结晶紫分析和粘附计数,发现luxS基因缺失在常温和低温下显著减少S. baltica生物被膜形成,减弱在不锈钢片上的粘附能力。也相似地发现S. oneidensis的luxS基因缺失株在第1天生物被膜量比野生株只低10%左右,而培养3 d后却低40%[18]。利用荧光显微镜和CLSM观察S. baltica野生株在4 ℃和28 ℃下粘附的细菌量明显多于△luxS株,且野生株容易聚集成团,△luxS菌难以形成大块生物被膜,成熟被膜菌变薄。Bodor等[19]利用荧光显微镜观察S. oneidensis野生株形成紧密、圆形的生物被膜,而luxS缺失株的生物被膜疏松地覆盖在表面。Niu等[20]利用CLSM发现E. coli luxS基因回补株与野生株的生物被膜更加容易聚集,且更厚实,而luxS缺失株生物被膜范围更广,分布均匀。然而,也有报道luxS缺失导致Enterococcus faecalis生物被膜形成加速[21]。该现象表明luxS基因参与细菌生物被膜形成的调控作用,但在不同种属细菌中存在差异。
已表明LuxS蛋白是细菌活性甲基代谢循环中重要的组成部分,这一循环显著影响含硫氨基酸的代谢,如S-腺苷甲硫氨酸的合成[9]。luxS基因在AI-2的合成和细菌甲基代谢中有重要作用,因此推测△luxS缺失株生物被膜减少可能是由于S. baltica丧失AI-2合成能力,也可能与甲基代谢循环通路破坏有关。细菌粘附和泳动与生物被膜形成密切相关,与野生株相比,△luxS细菌粘附性显著减弱,而泳动性却明显增大,可能是luxS缺失同时导致S. baltica生物被膜和鞭毛相关基因表达改变。Ling等[22]发现E. coli K12敲除luxS基因后能显著地促进泳动及鞭毛合成,该现象与flhDC转录水平的提升或c-di-GMP浓度减少有关。由此推测,△luxS株的粘附能力降低及泳动性增强可能导致生物被膜中菌体聚集量减少,厚度变薄。
S. baltica能产生高含量的TMA和生物胺等致腐产物,为冷藏海产鱼类的特定腐败菌。前期研究表明,群体感应与食品微生物腐败密切关联[23],发现二酮哌嗪分子正调控S. baltica腐败菌蛋白酶和胺类产物的形成[10-11],然而AI-2/LuxS系统对其致腐性的影响仍未见明确的报道。本研究表明,△luxS与野生株的三甲胺和腐胺形成无差异,前期研究[10-11]也发现添加AI-2前体物质DPD至S. baltica中对胺类产物形成无显著影响。因此,推测AI-2在希瓦氏菌中只是AMC代谢循环的副产物,可能不是一种参与调控致腐性的种间交流的信号分子。
由此可见,S. baltica SB11含有保守的LuxS,为细菌LuxS家族功能蛋白。通过比较研究野生株和△luxS缺失株的生物被膜形成和致腐代谢产物,阐明AI-2/LuxS参与调控S. baltica生物被膜,但并不是致腐性的功能性信号。
References
| [1] | Fuqua C, Greenberg EP. Signalling:Listening in on bacteria:acyl-homoserine lactone signalling. Nature Reviews Molecular Cell Biology, 2002, 3(9): 685-695. DOI:10.1038/nrm907 |
| [2] | Parker CT, Sperandio V. Cell-to-cell signalling during pathogenesis. Cellular Microbiology, 2009, 11(3): 363-369. DOI:10.1111/cmi.2009.11.issue-3 |
| [3] | Bassler BL, Wright M, Silverman MR. Multiple signalling systems controlling expression of luminescence in Vibrio harveyi:sequence and function of genes encoding a second sensory pathway. Molecular Microbiology, 1994, 13(2): 273-286. DOI:10.1111/mmi.1994.13.issue-2 |
| [4] | Vendeville A, Winzer K, Heurlier K, Tang CM, Hardie KR. Making 'sense' of metabolism:autoinducer-2, LUXS and pathogenic bacteria. Nature Reviews Microbiology, 2005, 3(5): 383-396. DOI:10.1038/nrmicro1146 |
| [5] | Liu M, Gray JM, Griffiths MW. Occurrence of proteolytic activity and N-acyl-homoserine lactone signals in the spoilage of aerobically chill-stored proteinaceous raw foods. Journal of Food Protection, 2006, 69(11): 2729-2737. DOI:10.4315/0362-028X-69.11.2729 |
| [6] | Zhu JL, Zhao EK, Sun LX, Huang XZ, Li JR, Tian DY. Dynamic variation rule of spoilage bacterial and quorum sensing signal molecules in the refrigerated large yellow croaker. Journal of Chinese Institute of Food Science and Technology, 2015, 15(4): 175-182. (in Chinese) 朱军莉, 赵二科, 孙丽霞, 黄旭镇, 励建荣, 田迪英. 冷藏大黄鱼腐败菌群和群体感应信号分子的动态变化规律. 中国食品学报, 2015, 15(4): 175-182. |
| [7] | Blana VA, Doulgeraki AI, Nychas GJE. Autoinducer-2-like activity in lactic acid bacteria isolated from minced beef packaged under modified atmospheres. Journal of Food Protection, 2011, 74(4): 631-635. DOI:10.4315/0362-028X.JFP-10-276 |
| [8] | Miller CH, Duerre JA. S-ribosylhomocysteine cleavage enzyme from Escherichia coli. The Journal of Biological Chemistry, 1968, 243(1): 92-97. |
| [9] | Pereira CS, Thompson JA, Xavier KB. AI-2-mediated signalling in bacteria. FEMS Microbiology Reviews, 2013, 37(2): 156-181. DOI:10.1111/j.1574-6976.2012.00345.x |
| [10] | Zhu JL, ZhaoAF, FengLF, Gao HC. Quorum sensing signals affect spoilage of refrigerated large yellow croaker (Pseudosciaena crocea) by Shewanella baltica. International Journal of Food Microbiology, 2016, 217: 146-155. DOI:10.1016/j.ijfoodmicro.2015.10.020 |
| [11] | Zhu SQ, Wu HH, Zeng MY, Liu ZY, Wang Y. The involvement of bacterial quorum sensing in the spoilage of refrigerated Litopenaeus vannamei. International Journal of Food Microbiology, 2015, 192: 26-33. DOI:10.1016/j.ijfoodmicro.2014.09.029 |
| [12] | Jin M, Jiang YM, Sun LL, Yin JH, Fu HH, Wu GF, Gao HC. Unique organizational and functional features of the cytochrome c maturation system in Shewanella oneidensis. PLoS One, 2013, 8(9): e75610. DOI:10.1371/journal.pone.0075610 |
| [13] | Bodor A, Elxnat B, Thiel V, Schulz S, Wagner-D?bler I. Potential for luxS related signalling in marine bacteria and production of autoinducer-2 in the genus Shewanella. BMC Microbiology, 2008, 8(1): 13. DOI:10.1186/1471-2180-8-13 |
| [14] | Djordjevic D, Wiedmann M, McLandsborough L A. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied & Environmental Microbiology, 2002, 68(6): 2950-2958. |
| [15] | Nguyen HDN, Yang YS, Yuk HG. Biofilm formation of Salmonella typhimurium on stainless steel and acrylic surfaces as affected by temperature and pH level. LWT-Food Science and Technology, 2014, 55(1): 383-388. DOI:10.1016/j.lwt.2013.09.022 |
| [16] | Packiavathy IASV, Sasikumar P, Pandian SK, Ravi AV. Prevention of quorum-sensing-mediated biofilm development and virulence factors production in Vibrio spp. by curcumin. Applied Microbiology and Biotechnology, 2013, 97(23): 10177-10187. DOI:10.1007/s00253-013-4704-5 |
| [17] | Zhao EK, Zhu JL, Feng LF, Shi YQ, Li JR. Preliminary mechanism of different spoilage potential of specific spoilage organism, Shewanella, in refrigerated Larimichthys crocea. Journal of Fisheries of China, 2015, 39(2): 256-264. (in Chinese) 赵二科, 朱军莉, 冯立芳, 施永清, 励建荣. 冷藏大黄鱼SSO希瓦氏菌致腐能力差异机制初探. 水产学报, 2015, 39(2): 256-264. |
| [18] | Learman DR, Yi H, Brown SD, Martin SL, Geesey GG, Stevens AM, Hochella MF. Involvement of Shewanella oneidensis MR-1 LuxS in biofilm development and sulfur metabolism. Applied & Environmental Microbiology, 2009, 75(5): 1301-1307. |
| [19] | Bodor AM, J?nsch L, Wissing J, Waqner-D?bler I. The luxS mutation causes loosely-bound biofilms in Shewanella oneidensis. BMC Research Notes, 2011, 4(1): 180. DOI:10.1186/1756-0500-4-180 |
| [20] | Niu C, Robbins CM, Pittman KJ, Osborn JL, Stubblefield BA, Simmons RB, Gillbert ES. LuxS influences Escherichia coli biofilm formation through autoinducer-2-dependent and autoinducer-2-independentmodalities. FEMS Microbiology Ecology, 2013, 83(3): 778-791. DOI:10.1111/fem.2013.83.issue-3 |
| [21] | He ZY, Liang JP, Zhou W, Xie Q, Tang ZS, Ma R, Huang ZW. Effect of the quorum-sensing luxS gene on biofilm formation by Enterococcus faecalis. European Journal of Oral Sciences, 2016, 124(3): 234-240. DOI:10.1111/eos.2016.124.issue-3 |
| [22] | Ling H, Kang A, Tan MH, Qi XB, Chang MW. The absence of the luxS gene increases swimming motility and flagella synthesis in Escherichia coli K12. Biochemical & Biophysical Research Communications, 2010, 401(4): 521-526. |
| [23] | Zhu JL, Feng LF, Wang YB, Li JR. Spoilage mechanism of fresh food based on bacterial quorum sensing. Journal of Chinese Institute of Food Science and Technology, 2017, 17(3): 225-234. (in Chinese) 朱军莉, 冯立芳, 王彦波, 励建荣. 基于细菌群体感应的生鲜食品腐败机制. 中国食品学报, 2017, 17(3): 225-234. |
