方彦伦, 陈姗姗


福建农林大学资源与环境学院, 福建省土壤环境健康与调控重点实验室, 福建 福州 350002
收稿日期:2018-01-31;修回日期:2018-03-26;网络出版日期:2018-05-28
基金项目:国家自然科学基金(41501248)
*通信作者:陈姗姗, Tel:+86-591-86398509;E-mail:chenss@fafu.edu.cn
摘要:产电呼吸是指电活性微生物(electroactive microorganisms,EAMs)以胞外固体电极作为电子受体的一种呼吸形式,在可再生能源利用和环境修复方面具有广阔的应用前景。能否进一步提高EAMs的产电呼吸能力是相关技术能否从实验室走向实际应用的核心,而提高产电呼吸能力的关键是加强EAMs与胞外固体电极间的电子传递能力。目前总结如何促进EAMs产电呼吸能力的综述文献极少。因此,本文从投加化学试剂、施加物理作用及改造生物基因3个方面总结了现有的促进EAMs产电呼吸能力的方法,介绍了每种方法的优势与缺陷,重点阐述了每种手段的作用机理及促进效果,并从实际应用和机理研究的角度展望了今后的研究方向。
关键词: 电活性微生物 产电呼吸 生物电化学系统 电子传递途径 生物基因改造
Advances in approaches for promoting electricigenic respiration of electroactive microorganisms
Yanlun Fang, Shanshan Chen


Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China
Received 31 January 2018; Revised 26 March 2018; Published online 28 May 2018
*Corresponding author: Shanshan Chen, Tel: +86-591-86398509; E-mail: chenss@fafu.edu.cn
Supported by the National Natural Science Foundation of China (41501248)
Abstract: Microbial electricigenic respiration is a microbial metabolism mode in which electroactive microorganisms (EAMs) degrade organics and then transfer the produced electrons to extracellular solid electrodes through the respiratory chain, while EAMs gain energy to support their own growth. Microbial electricigenic respiration has broad application prospects in renewable energy utilization and environmental remediation. How to improve the microbial electricigenic respiration performances of EAMs is at the heart of promotion of relevant techniques from lab-scale research to full-scale application, and the electron transfer between EAMs and extracellular solid electrodes plays a pivotal role in microbial electricigenic respiration. To date, there have been many reviews focusing on how to improve electrode materials, however, very few literatures summarize how to strengthen the electricigenic respiration capability of EAMs. In this review, we summarized the existing approaches for promoting the respiratory performances of EAMs from the following three aspects:the addition of chemical reagents for example surfactants and signal molecules, physical force application such as ultrasonic waves and magnetic field forces, and genetic modification for instance phenazine secretion-related gene overexpression and pilA gene heterogenous expression. Advantages and disadvantages of each method were introduced, mechanisms and effects were expatiated upon, and future research directions from the perspectives of the practical application and the mechanism research were proposed.
Key words: electroactive microorganism electricigenic respiration bioelectrochemical system electron transport pathway genetic modification
微生物通过多种代谢途径产生能量以供自身生长繁殖,其中,胞外呼吸是近年来发现的一种新型微生物能量代谢方式。根据胞外电子受体的不同,胞外呼吸主要分为铁呼吸、腐殖质呼吸和产电呼吸3种方式[1]。产电呼吸是指微生物以胞外固体电极为电子受体,将代谢有机物产生的电子由呼吸链传递至电极表面产生电流,同时微生物获得能量支持自身生长的呼吸形式,该过程通常发生在生物电化学系统(bioelectrochemical systems,BES)的阳极室[2]。具备产电呼吸能力的微生物被称为电活性微生物(electroactive microorganisms,EAMs),EAMs与胞外固体电极间的电子传递是BES运作的关键机制。已知的EAMs胞外电子传递机制有:(1)直接电子传递(direct electron transfer,DET):部分EAMs通过细胞外膜上的细胞色素c蛋白,或长出具有导电性的PilA菌毛结构蛋白聚合微丝将电子直接传递到电极表面,如Geobacter sulfurreducens PCA及Geobacter metallireducens GS15;(2)间接电子传递(indirect electron transfer,IET):部分EAMs可分泌可溶性氧化还原物质作为电子穿梭的介体,介导EAMs与电极间的电子传递,如能分泌绿脓菌青素和吩嗪-1-酰胺的Pseudomonas aeruginosa KRP1,能分泌核黄素的Shewanella oneidensis MR-1[3]。目前涉及产电呼吸的研究中,如何提高EAMs与电极间的电子传递效率是研究的核心。
现有的EAMs提高与电极间的电子传递效率的研究主要集中在2个方面:(1)制作导电性能好、比表面积大、生物兼容性强的电极;(2)提高EAMs及其形成的电活性生物膜(electroactive biofilms,EABs)的产电呼吸能力。已有的总结如何改进电极材料的综述文献较多[4-5],而总结如何促进EAMs及EABs产电呼吸能力的综述文献极少。因此,本文将从投加化学试剂、施加物理作用及改造生物基因3个方面总结现有的促进EAMs及EABs产电呼吸能力的手段,阐明每种方法的原理,介绍每种方法的优势与缺陷,最后展望今后可能的研究方向。
1 对EAMs投加化学试剂 投加化学试剂可改变EAMs的细胞通透性、细胞分裂等特征,以达到增强其产电呼吸能力的目的(表 1)。表面活性剂在EAMs中应用最为广泛。Liu等[6]在BES中添加乙二胺四乙酸(EDTA)和聚乙烯亚胺(PEI),发现两种化学表面活性剂均能破坏Pseudomonas aeruginosa细胞膜外的脂多糖层,形成更多孔道,从而促进其分泌氧化还原介体吩嗪的能力,处理后的BES电流密度均达到对照组的1.6倍。Wen等[7]在混合菌BES中加入吐温80化学表面活性剂以改变细胞膜的超微结构,加快营养物质的运输。随着吐温80的浓度从0增加到80 mg/L,BES功率密度及电流密度分别提高了7.7倍及9.6倍。
表 1. 投加化学试剂提高微生物(膜)产电呼吸性能 Table 1. Improvement on electricigenic respiration of EAMs/EABs with addition of reagents
| Reagent type | Reagent addition | Microorganism | Mechanism | Reference |
| Surfactants | chitosan EDTA PEI | Pseudomonas aeruginosa | Increase membrane permeability | [6] |
| Tween 80 | Mixed-culture bacteria | [7] | ||
| Sophorolipid | Pseudomonas aeruginosa | [9] | ||
| Rhamnolipid | Mixed-culture bacteria | [10] | ||
| Metal ions | ([Pt(NH3)2Cl2]0) | Shewanella oneidensis | Inhibit cell division to enable elongated growth | [11] |
| Cu2+, Cd2+ | Shewanella oneidensis | Enhance the flavin secretion | [12] | |
| Signal molecules | 3OC6-HSL | Mixed-culture bacteria | Increase proportions of EABs | [14] |
| C4-HSL C6-HSL 3OC12-HSL | Mixed-culture bacteria | Increase the electrode-associated biomass, the proportion of Geobacter sp., concentration and redox activity of extracellular polymeric substances | [15] | |
| Electronic shuttles | Neutral red | Escherichia coli Shewanella putrefaciens | Improve the electron transfer between microbes and electrodes | [17-18] |
| AQC AQS | Shewanella putrefaciens | [19] | ||
| Flavin mononucleotide Riboflavin | Shewanella oneidensis | [20] |
表选项
然而,化学表面活性剂对EAMs有一定的毒性,表现在会一定程度上阻碍EABs的形成及降低细胞活性[8]。因此使用化学表面活性剂时需谨慎选择合适的投加浓度和投加时间等参数。生物表面活性剂是由微生物代谢过程中自体分泌的物质,比化学表面活性剂更具有生物友好性(图 1-A)。投加外源的鼠李糖脂和槐糖脂被证明可用于改善BES的产电性能。Shen等[9]发现添加47 mg/L槐糖脂会增大P. aeruginosa的细胞膜渗透性令吩嗪的分泌增加,同时不影响EAMs的生长,功率密度约为对照组的5倍。Wen等[10]在混合菌BES中添加80 mg/L鼠李糖脂,增加了细胞膜通透性,减小了电子转移过细胞膜的阻力,功率密度约为对照组的12.5倍。
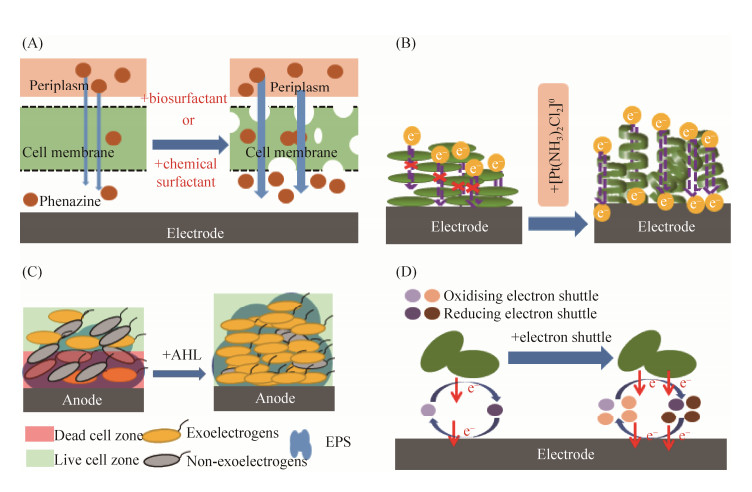 |
| 图 1 添加化学试剂提高微生物(膜)产电呼吸能力的原理 Figure 1 Mechanisms of improvement on electricigenic respiration of EAMs/EABs with addition of chemical reagents. A: Surfactants; B:[Pt(NH3)2Cl2]0; C:Signal molecules; D: Electron shuttles. |
| 图选项 |
希瓦氏菌Shewanella oneidensis MR-1可以通过DET和IET两种方式进行胞外电子传递,通常认为DET比IET更简单高效。Patil等[11]在培养MR-1时加入10 mg/L顺铂([Pt(NH3)2Cl2]0),顺铂可以抑制细胞的正常分裂,每个细菌长度上增长了约25倍,达50–75 μm。处理后的细菌在电极表面上呈现螺旋扭曲方式排布,只需有一小部分细胞直接粘附着电极表面,则整个细胞产生的电子均可通过DET方式传递到电极上,实现了最大程度的胞外电子转移,电流密度约为对照组的5.8倍。同时,与未处理的细菌相比,核黄素量增加了(0.550±0.147) μmol/L,表明投加顺铂可能也增强了由核黄素介导的IET过程(图 1-B)。
Xu等[12]研究添加不同重金属离子对S. oneidensis MR-1纯菌BES性能的影响,发现当Cu2+的添加量约为6 nmol/L时,电流输出密度增加了约1.3倍;当Cd2+的添加量约为5 nmol/L时,电流输出密度增加了约1.6倍。通过高效液相色谱进一步分析表明,核黄素浓度分别增加了21.8%和18.2%,表明添加低浓度的Cu2+或Cd2+离子,可以诱导电子穿梭体核黄素的分泌从而提高胞外电子传递效率。
群感效应(Quorum Sensing,QS)是指微生物间通过分泌、释放特定的信号分子,感知浓度变化,调控菌群生理功能,从而适应环境条件的一种信号交流机制[13],在生物膜形成过程中起重要作用。大部分的革兰氏阴性菌是通过化学信号分子——酰基高丝氨酸内酯(acylhomoserine lactones,AHLs)来实现QS的,研究表明投加外源的AHLs可以通过调控QS从而调控EABs的特性,达到提高BES性能的目的。Cai等[14]添加了短链的AHLs (3OC6-HSL)来调节产氢气的BES中的微生物群落结构,使EABs增加而嗜氢菌减少,促使BES的产氢率提高5.57%–81.82%。Chen等[15]在产电的混合BES中添加了两种短链(C4-HSL和C6-HSL)和一种长链(3OC12-HSL)的AHLs,发现AHLs通过提高附着在电极上的生物膜的活菌比例、Geobacter属所占比例和胞外聚合物的浓度及氧化还原活性来提高混合菌的产电能力(图 1-C)。
一些外生电子穿梭体包括醌类物质、腐殖质等被证明具有接受和给出电子的能力[16]。Park等[17-18]分别在Escherichia coli和Shewanella putrefaciens构建的BES中添加中性红作为电子穿梭体,平均电流均比对照组高出10倍(图 1-D)。Wu等[19]对多种人工合成的电子穿梭体研究发现,在S. putrefaciens 200构建的电化学系统中添加AQC (9, 10- anthraquinone-2-carboxylic acid)和AQS (9, 10- anthraquinone-2-sulfonic acid)作为电子穿梭体时,平均电流分别提高2.9倍和2.8倍。Velasquezorta等[20]在S. oneidensis MR-1构建的BES中分别加入核黄素和黄素单核苷酸作为电子穿梭体,最大功率密度均比对照组高出10倍。
2 对EAMs施加物理作用 相较于投加化学试剂,施加物理作用的调控方法具有无毒性试剂残留、效率高和参数易于控制的优点[21]。BES中的EABs会不断积累死细胞,对产电效果造成不利的影响。常规的膜生物反应器通常使用超声、旋转、机械清理等物理方法能有效去除生物膜中的死细胞[22],这些物理方法同样被用来优化EABs。
2.1 超声波 在厚层EABs形成过程中,由于贴近电极表面的内层细胞缺乏营养物质的供应,会形成死细胞层,对BES性能造成负面影响。低频超声可以在短时间内通过强剪切力使细菌脱离,从而防止死细菌层及其他惰性生物质沉积在电极表面。Islam等[22]在BES运行第21天电流值下降到最低时对其进行低频超声处理(20 kHz,64 W)以修复EABs。发现经30 min的超声处理后,效果最佳,处理后电流值每天升高34.47 μA,3 d后达到230±10 μA的稳定值,场发射电子显微镜显示微生物分散在电极周围但电极表面大部分未被覆盖,因此来自本体溶液的电子穿梭体可以更容易在电极和微生物间移动,带来更稳定的高电流产生(图 2-A)。此外,More等[23]也利用低频超声(40 kHz,120 W)对接种到BES前的混合厌氧污泥进行超声波预处理5 min,实验表明,处理后的BES最大功率密度是未处理的3.5倍。文章指出,低频超声预处理增大了EAMs细胞膜和细胞壁的通透性,加速了营养底物的跨膜运输。同时也增强了酶的活性,促进了细胞外蛋白质、多糖和酶从污泥絮凝物的内层向外层的转移,提高了底物的利用效率,从而提高了EAMs电子胞外转移的速度。
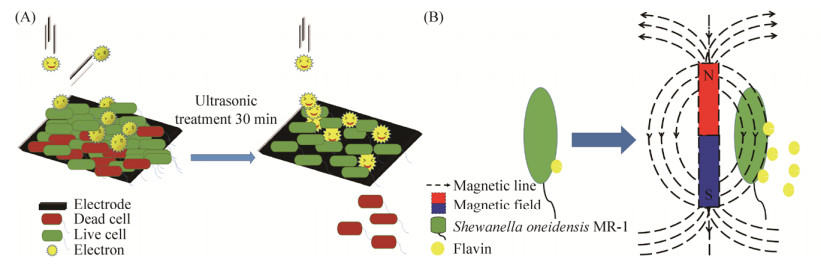 |
| 图 2 物理作用提高微生物(膜)产电呼吸能力的原理 Figure 2 Mechanisms of improvement on electricigenic respiration of EAMs/EABs with physical process. A: The low-frequency ultrasound; B: The magnetic field. |
| 图选项 |
2.2 磁场力 Katz等[24]发现磁场可以通过增大电极-溶液界面处电子转移的速度从而影响与电极相连的酶组件的生物电催化转化,进而显著提高电子的传递效率。Li等[25]的研究发现垂直于或平行于阳极表面对Shewanella oneidensis MR-1纯菌BES施加强度为100 mT的静磁场力时,无辅助电极的BES输出电压都增加了20%–27%,三电极BES体系中的输出电流增加了2倍以上。该实验还发现外加磁场使电子穿梭体核黄素的分泌量增加了20%,并推测外加磁场是通过促进细胞增殖,或通过激发EAMs的氧化应激反应,来提高自由基的水平,自由基含量的提高进一步刺激氧化应激系统的启动,从而增加能量的消耗,进一步增强能量代谢反应,因此产生更多的电子(图 2-B)。
3 改造EAMs的生物基因 投加化学试剂和施加物理作用的处理手段操作简单,但具有随机性,无法靶向定点化,除了我们想要改造的部分,对微生物整体的生存能力和新陈代谢情况也可能造成影响,常常不可预知微生物的生长和演化方向。改造EAMs的生物基因的方法,虽然在操作上难度较大且耗时较长,却可以实现对微生物的精准靶向定点改造。
3.1 基于电子传递途径的基因改造 在本部分,我们总结了对EAMs的电子传递途径相关基因进行改造的研究(表 2)。
表 2. 改造生物基因提高微生物(膜)产电呼吸性能 Table 2. Improvement on electricigenic respiration of EAMs/EABs with genetic modification
| Microorganism | Gene | Expression | Mechanism | Improvement on electricigenic respiration | Reference |
| Shewanella oneidensis MR-1 | ydeH | + | Promote the biofilm formation, and increase the outer membrane cytochrome C | The power density was ~2.8 times of the control | [27] |
| Pseudomonas aeruginosa CGMCC 1.860 | rhlI、rhlR | + | Increase yields of pyocyanin | The current output was ~2.7 times of the control | [36] |
| Pseudomonas aeruginosa PAO1 | rhlA | + | Increase yields of rhamnolipid to enhance membrane permeability | The power density was ~4.5 times of the control | [8] |
| Pseudomonas aeruginosa | phzM | + | Increase yields of pyocyanin | The power density was ~4 times of the control | [37] |
| Pseudomonas aeruginosa PAO1 | nadE | + | Increase intracellular releasable electrons | The power density was ~4 times of the control | [39] |
| Escherichia coli | oprF | + | Increase membrane permeability | The current density was ~1.75 times of the control | [40] |
| Escherichia coli BL21 | ldhA | – | Abolish the lactate synthesis pathway to shift the energy to microbial electron output | The current density was ~6 times of the control | [45] |
| +: overexpression; –: knockout | |||||
表选项
3.1.1 基于膜结合蛋白机制的基因改造: 部分EAMs是通过细胞外膜或周质上的蛋白将电子直接传递给胞外固体电极的,细胞色素c蛋白是该过程最重要的一类蛋白[26],因此,有****通过增加EAMs中该类蛋白的数量,来提高EAMs的胞外电子传递效率。Liu等[27]尝试在Shewanella oneidensis MR-1中过表达二鸟苷环化酶基因ydeH,该基因是合成第二信使分子c-di-GMP的关键基因。细胞内高水平的c-di-GMP具有促进粘合剂机制表达、促进生物膜形成的作用[28]。ydeH基因的过表达促进了生物膜的形成,形成的生物膜中生物量增多,导致外膜细胞色素c的总量增加,提高了直接电子传递效率(图 3-A)。接种ydeH基因过表达的工程菌株的BES最大功率密度是接种野生型MR-1的约2.8倍[(167.6±3.6) mW/m2 vs. (61.0±1.9) mW/m2]。Koch和Harnisch[29]的文章认为Escherichia coli也属于EAMs,它可以在外源添加的电子穿梭体辅助下进行产电呼吸。Jensen等[30]在E. coli中表达了S. oneidensis MR-1的胞外电子传递链的MtrC、MtrA和MtrB蛋白,基因改造后的E. coli对金属离子和固体金属氧化物的还原比野生型E. coli分别快8倍和4倍。
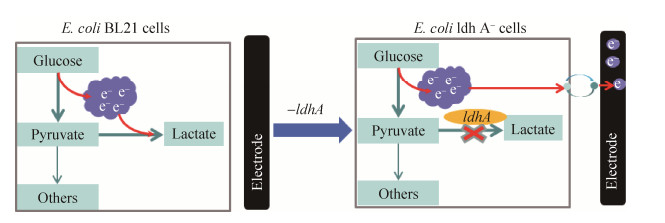 |
| 图 3 消除乳酸合成途径以重新定向胞内电子流向的原理图(据文献[45]绘制) Figure 3 Schematic of redirecting releasable intracellular electrons by eliminating the lactate synthesis pathway (adapted from reference [45]). |
| 图选项 |
3.1.2 基于纳米导线机制的基因改造: 部分EAMs能产生具有导电性的PilA菌毛结构蛋白聚合微丝(又被称为纳米导线)作为电子转移的通道,来实现电子在微生物与胞外固体电极间的远距离传递。2005年,Reguer等[31]发现Geobacter sulfurreducens DL-1表面存在一种导电性能佳的Ⅳ型菌毛,在电子传递过程中起着重要的桥梁作用。2006年,该课题组报道,DL-1野生型菌株产电效率是缺失该菌毛蛋白的突变株的3倍,同时发现突变株不会在电极表面上堆叠形成生物膜,证明了该菌毛蛋白在微生物产电呼吸中的重要性[32]。基于此,研究者通过改造该菌毛蛋白相关基因的表达,来提高EAMs的产电呼吸能力。
Geobacter sulfurreducens导电菌毛是由PilA肽单体组装的直径约3 nm、长度为10–20 μm的导电材料。芳香族氨基酸苯丙氨酸和酪氨酸在电子沿菌毛传递的过程中起重要作用,但是PilA肽单体中不包含色氨酸,色氨酸比苯丙氨酸或酪氨酸更有效地促进电子传递。当色氨酸替代二苯丙氨酸肽中的一种苯丙氨酸时,肽网络的电导率增加,归因于芳族氨基酸的π-π堆积增加。Tan等[33]将G. sulfurreducens PCA的PilA蛋白羧基末端的苯丙氨酸和酪氨酸用色氨酸替代,将改造后的菌株命名为W51W57。在pH 2环境下制备的W51W57菌毛的线性电流-电压响应计算出的电导率平均值比PCA菌毛的导电率高约2000倍。与其他导电材料的双探针测量值相比,W51W57菌毛的电导率略低于碳纳米管,高于DNA纳米线及聚乙撑二氧噻吩(PEDOT)纳米线。G. metallireducens GS15菌毛的导电率达到(277.0±18.9) S/cm,高出G. sulfurreducens PCA菌毛的5000倍。Tan等[34]用G. sulfurreducens PCA异源表达G. metallireducens GS15的PilA蛋白的基因,工程菌株被命名为G. sulfurreducens MP,该工程菌株产生大量的菌毛,并且接种MP菌株的BES中,最大电流密度与GS15相当。
以上结果证明了用生物基因改造法合成导电纳米导线的可行性。导电性菌毛是一种良好的导电材料,由EAMs自体产生,不需要苛刻的化学过程,在最终的产品中不含有毒成分,因此有研究者提出,开发生物合成导电性菌毛的绿色技术有望在未来应用到电子设备和传感器中[35]。
3.1.3 基于电子穿梭体机制的基因改造: 部分EAMs可利用一些自身分泌或外源添加的具有氧化还原活性的物质,在菌体与胞外固体电极间充当电子穿梭体来进行间接电子传递。已知的内源电子穿梭体包括吩嗪、黄素、核黄素、醌类物质等[36]。有研究者通过对EAMs的QS系统进行基因改造来调节内源电子穿梭体的合成和分泌。
QS系统可以调节Pseudomonas aeruginosa中吩嗪的合成和分泌。Yong等[36]在P. aeruginosa CGMCC 1.860中过表达rhlI基因(与高丝氨酸内酯合酶相关)和rhlR基因(与转录激活因子相关),并将该工程菌株命名为P. aeruginosa IR。IR菌株的rhl-调节基因(rhlA)的转录显著上调,rhl系统得到增强,接种IR菌株的BES中,吩嗪类物质(包括绿脓素和吩嗪-1-羧酸盐)的浓度远高于野生型菌株,电流输出比野生型菌株提高了约1.7倍。鼠李糖脂是一种P. aeruginosa PAO1自身分泌的生物表面活性剂,其分泌也受到rhl系统的调控。Zheng等[8]通过过表达P. aeruginosa PAO1的rhlA基因,该基因是QS系统中影响鼠李糖脂合成的关键基因。突变株在纯培养5 d后,鼠李糖脂的产量为野生型菌株的约1.4倍(2.0 g/L vs. 1.4 g/L)。鼠李糖脂产量的增加直接增强了微生物的细胞膜通透性,从而提高了绿脓素的产生,分泌的绿脓素为对照菌株的2.5倍(0.10 mg/L vs. 0.04 mg/L),接种突变株的BES最大功率密度为野生型菌株功率密度的3.5倍[(9.4±0.6) mW/m2 vs. (2.74±0.00) mW/m2]。
除了改造相关的QS系统基因,有研究者改造了电子穿梭体的合成酶基因,促进电子穿梭体的合成和分泌来提高间接电子传递的效率。甲基转移酶PhzM是Pseudomonas aeruginosa中电子穿梭体绿脓素生物合成途径的关键酶。Yong[37]等构建了P. aeruginosa PAO1中phzM过表达的菌株,接种工程菌株到BES后,最大功率密度为对照组的4倍(166.68 μW/cm2 vs. 42.53 μW/cm2),并且BES内阻降低了约82.31%,原因是phzM过表达的菌株产生的绿脓素约是野生型菌株的2.6倍。烟酰胺腺嘌呤二核苷酸(NAD+)及其还原形式NADH是参与细胞代谢反应和能量生成的主要辅因子和电子载体,在细胞外电子转移和代谢途径中占据核心地位[38]。Yong等[39]通过对P. aeruginosa PAO1的nadE基因(NAD合成酶基因)的过表达增加了NADH/NAD+的比例,增加了绿脓素的产生,二者均提高了电子转移效率。因此突变株的最大功率密度是野生型菌株的4倍(40.13 μW/cm2 vs. 10.86 μW/cm2)。
此外,有研究通过在微生物中异源表达大孔径孔蛋白的基因,促进电子穿梭体的跨膜运输。OprF为Pseudomonas属主要的外膜孔蛋白,可通过2000–3000 Da大小的多糖,而Escherichia coli的外膜孔蛋白只能通过尺寸小于600 Da的多糖。Yong等[40]在E. coli BL21中异源表达P. aeruginosa PAO1的oprF基因,当外源添加核黄素作为电子穿梭体时,E. coli突变株跨膜运输电子穿梭体的数量增多、速度增大,使E. coli突变株的最大电流密度达到野生型的–1.75倍(3.47 μA/cm2 vs. 1.98 μA/cm2)。
3.2 基于能量代谢途径的基因改造 与基于电子传递途径的基因改造以提高EAMs产电呼吸能力的研究相比,基于能量代谢途径的基因改造的报道较少,主要有以下三种方式:
拓宽EAMs的底物摄取范围可提高其产电呼吸能力。野生型Shewanella oneidensis只能利用乳酸、丙酮酸、抗坏血酸和一些氨基酸作为碳源进行产电呼吸[41]。Choi等[42]在S. oneidensis MR-1体内异源表达来自Zymomonas mobilis的葡萄糖促进基因glf和葡萄糖激酶基因glk,突变菌株可在需氧或厌氧条件下,以葡萄糖为碳源进行产电呼吸。Flynn等[43]在S. oneidensis体内异源表达来自Escherichia coli体内甘油模块的基因glpF、glpK、glpD和tpiA,使S. oneidensis能够利用甘油作为碳源进行产电呼吸。
加快EAMs的ATP合成和底物利用速度,可有效地促进其产电呼吸。复杂的光系统或者光依赖质子泵可加快EAMs的ATP合成,因此Johnson等[44]在S. oneidensis内异源引入藻类的光合质子泵系统,突变菌株的乳酸消耗速率提高,从而促进了电流输出。
废止EAMs细胞内某些物质合成反应,使更多胞内电子流向胞外产电反应,是提高EAMs产电性能的一种方式。Yong等[45]E. coli乳酸脱氢酶基因ldhA,破坏丙酮酸转化为乳酸的合成途径,储存在丙酮酸和其他产物中的电子被重新释放出来,在电子穿梭体(醌衍生物)的介导下转移至阳极,突变株的最大电流密度约为野生型菌株的6倍(3.0 μA/cm2 vs. 0.51 μA/cm2) (图 3)。
4 展望 EAMs是近年来土壤、生物、能源和环保等研究领域的热点,能否进一步提高EAMs的产电呼吸能力是其能否从实验室走向实际应用的核心,而提高产电呼吸能力的关键是加强EAMs与胞外固体电极间的电子传递能力。综上所述,目前提高EAMs产电呼吸能力的手段已遍及化学试剂的投加、物理作用的施加以及生物基因的改造3个方面,如何在实际应用中联合施用这些手段以达到最佳效果,是未来研究中需要涉及的方向。已被报道的EAMs有九十余种,然而已有的促进EAMs产电呼吸能力的研究对象基本上集中于Geobacter sulfurreducens、Geobacter metallireducens、Shewanella oneidensis和Pseudomonas aeruginosa这几个模式菌。究其原因是目前的产电呼吸机制研究也集中于上述模式菌,而产电呼吸的机制研究,正是提高产电呼吸能力方法研究的基础,除上述模式菌,关于其他EAMs的电子传递机制的报道十分匮乏,亟待研究者的更多关注与深入探索,如何在EAMs研究中运用不断发展的分子组学、同位素示踪技术,挖掘其他EAMs中新的产电呼吸机制,对拓宽产电呼吸的理论广度具有重要意义。
References
| [1] | Lovley DR. Bug juice:harvesting electricity with microorganisms. Nature Reviews Microbiology, 2006, 4(7): 497-508. DOI:10.1038/nrmicro1442 |
| [2] | Harnisch F, Schr?der U. From MFC to MXC:chemical and biological cathodes and their potential for microbial bioelectrochemical systems. Chemical Society Reviews, 2010, 39(11): 4433-4448. DOI:10.1039/c003068f |
| [3] | Lovley DR. Electromicrobiology. Annual Review of Microbiology, 2012, 66(1): 391-409. DOI:10.1146/annurev-micro-092611-150104 |
| [4] | Krieg T, Sydow A, Schr?der U, Schrader J, Holtmann D. Reactor concepts for bioelectrochemical syntheses and energy conversion. Trends in Biotechnology, 2014, 32(12): 645-655. DOI:10.1016/j.tibtech.2014.10.004 |
| [5] | Xie X, Criddle C, Cui Y. Design and fabrication of bioelectrodes for microbial bioelectrochemical systems. Energy & Environmental Science, 2015, 8(12): 3418-3441. |
| [6] | Liu J, Qiao Y, Lu ZS, Song H, Li C. Enhance electron transfer and performance of microbial fuel cells by perforating the cell membrane. Electrochemistry Communications, 2012, 15(1): 50-53. DOI:10.1016/j.elecom.2011.11.018 |
| [7] | Wen Q, Kong FY, Ma F, Ren YM, Pan ZC. Improved performance of air-cathode microbial fuel cell through additional Tween 80. Journal of Power Sources, 2011, 196(3): 899-904. DOI:10.1016/j.jpowsour.2010.09.009 |
| [8] | Zheng T, Xu YS, Yong XY, Li B, Yin D, Cheng WW, Yuan HR, Yong YC. Endogenously enhanced biosurfactant production promotes electricity generation from microbial fuel cells. Bioresource Technology, 2015, 197: 416-421. DOI:10.1016/j.biortech.2015.08.136 |
| [9] | Shen HB, Yong XY, Chen YL, Liao ZH, Si RW, Zhou J, Wang SY, Yong YC, Ouyang PK, Zheng T. Enhanced bioelectricity generation by improving pyocyanin production and membrane permeability through sophorolipid addition in Pseudomonas aeruginosa-inoculated microbial fuel cells. Bioresource Technology, 2014, 167: 490-494. DOI:10.1016/j.biortech.2014.05.093 |
| [10] | Wen Q, Kong FY, Ren YM, Cao DX, Wang GL, Zheng HT. Improved performance of microbial fuel cell through addition of rhamnolipid. Electrochemistry Communications, 2010, 12(12): 1710-1713. DOI:10.1016/j.elecom.2010.10.003 |
| [11] | Patil SA, Górecki K, H?gerh?ll C, Gorton L. Cisplatin-induced elongation of Shewanella oneidensis MR-1 cells improves microbe-electrode interactions for use in microbial fuel cells. Energy & Environmental Science, 2013, 6(9): 2626-2630. |
| [12] | Xu YS, Zheng T, Yong XY, Zhai DD, Si RW, Li B, Yu YY, Yong YC. Trace heavy metal ions promoted extracellular electron transfer and power generation by Shewanella in microbial fuel cells. Bioresource Technology, 2016, 211: 542-547. DOI:10.1016/j.biortech.2016.03.144 |
| [13] | Yong YC, Wu XY, Sun JZ, Cao YX, Song H. Engineering quorum sensing signaling of Pseudomonas for enhanced wastewater treatment and electricity harvest:a review. Chemosphere, 2015, 140: 18-25. DOI:10.1016/j.chemosphere.2014.10.020 |
| [14] | Cai WW, Zhang JZ, Ren G, Shen QX, Hou YN, Ma AZ, Deng Y, Wang AJ, Liu WZ. Quorum sensing alters the microbial community of electrode-respiring bacteria and hydrogen scavengers toward improving hydrogen yield in microbial electrolysis cells. Applied Energy, 2016, 183: 1133-1141. DOI:10.1016/j.apenergy.2016.09.074 |
| [15] | Chen SS, Jing XY, Tang JH, Fang YL, Zhou SG. Quorum sensing signals enhance the electrochemical activity and energy recovery of mixed-culture electroactive biofilms. Biosensors and Bioelectronics, 2017, 97: 369-376. DOI:10.1016/j.bios.2017.06.024 |
| [16] | Li XM, Liu L, Liu TX, Yuan T, Zhang W, Li FB, Zhou SG, Li YT. Electron transfer capacity dependence of quinone-mediated Fe(Ⅲ) reduction and current generation by Klebsiella pneumoniae L17. Chemosphere, 2013, 92(2): 218-224. DOI:10.1016/j.chemosphere.2013.01.098 |
| [17] | Park D, Zeikus J. Impact of electrode composition on electricity generation in a single-compartment fuel cell using Shewanella putrefaciens. Applied Microbiology and Biotechnology, 2002, 59(1): 58-61. DOI:10.1007/s00253-002-0972-1 |
| [18] | Park DH, Zeikus JG. Electricity generation in microbial fuel cells using neutral red as an electronophore. Applied and Environmental Microbiology, 2000, 66(4): 1292-1297. DOI:10.1128/AEM.66.4.1292-1297.2000 |
| [19] | Wu YD, Liu TX, Li XM, Li FB. Exogenous electron shuttle-mediated extracellular electron transfer of Shewanella putrefaciens 200:Electrochemical parameters and thermodynamics. Environmental Science & Technology, 2014, 48(16): 9306-9314. |
| [20] | Velasquez-Orta SB, Head IM, Curtis TP, Scott K, Lloyd JR, Canstein HV. The effect of flavin electron shuttles in microbial fuel cells current production. Applied Microbiology and Biotechnology, 2010, 85(5): 1373-1381. DOI:10.1007/s00253-009-2172-8 |
| [21] | Zhao WR, Hu S, Huang J, Mei LH. Improve microorganism cell permeability for whole-cell bioprocess:methods and strategies. China Biotechnology, 2014, 34(3): 125-131. (in Chinese) 赵伟睿, 胡升, 黄俊, 梅乐和. 微生物细胞通透性改善方法与策略. 中国生物工程杂志, 2014, 34(3): 125-131. |
| [22] | Islam MA, Woon CW, Ethiraj B, Cheng CK, Yousuf A, Maksudur M, Khan R. Ultrasound driven biofilm removal for stable power generation in microbial fuel cell. Energy & Fuels, 2016, 31(1): 968-976. |
| [23] | More TT, Ghangrekar MM. Improving performance of microbial fuel cell with ultrasonication pre-treatment of mixed anaerobic inoculum sludge. Bioresource Technology, 2010, 101(2): 562-567. DOI:10.1016/j.biortech.2009.08.045 |
| [24] | Katz E, Lioubashevski O, Willner I. Magnetic field effects on bioelectrocatalytic reactions of surface-confined enzyme systems:enhanced performance of biofuel cells. Journal of the American Chemical Society, 2005, 127(11): 3979-3988. DOI:10.1021/ja044157t |
| [25] | Li WW, Sheng GP, Liu XW, Cai PJ, Sun M, Xiao X, Wang YK, Tong ZH, Dong F, Yu HQ. Impact of a static magnetic field on the electricity production of Shewanella-inoculated microbial fuel cells. Biosensors and Bioelectronics, 2011, 26(10): 3987-3992. DOI:10.1016/j.bios.2010.11.027 |
| [26] | Kong GN, Xu MY, Yang YG. Direct contact-dependent microbial extracellular electron transfer. Acta Microbiologica Sinica, 2017, 57(5): 643-650. (in Chinese) 孔冠楠, 许玫英, 杨永刚. 基于直接接触的微生物胞外电子传递. 微生物学报, 2017, 57(5): 643-650. |
| [27] | Liu T, Yu YY, Deng XP, Ng CK, Cao B, Wang JY, Rice SA, Kjelleberg S, Song H. Enhanced Shewanella biofilm promotes bioelectricity generation. Biotechnology and Bioengineering, 2015, 112(10): 2051-2059. DOI:10.1002/bit.v112.10 |
| [28] | Hengge R. Principles of c-di-GMP signalling in bacteria. Nature Reviews Microbiology, 2009, 7(4): 263-273. DOI:10.1038/nrmicro2109 |
| [29] | Koch C, Harnisch F. Is there a specific ecological niche for electroactive microorganisms?. ChemElectroChem, 2016, 3(9): 1282-1295. DOI:10.1002/celc.201600079 |
| [30] | Jensen HM, Albers AE, Malley KR, Londer YY, Cohen BE, Helms BA, Weigele P, Groves JT, Ajo-Franklin CM. Engineering of a synthetic electron conduit in living cells. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19213-19218. DOI:10.1073/pnas.1009645107 |
| [31] | Reguera G, McCarthy KD, Mehta T, Nicol JS, Tuominen MT, Lovley sDR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [32] | Reguera G, Nevin KP, Nicoll JS, Covalla SF, Woodard TL, Lovley DR. Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells. Applied and Environmental Microbiology, 2006, 72(11): 7345-7348. DOI:10.1128/AEM.01444-06 |
| [33] | Tan Y, Adhikari RY, Malvankar NS, Pi S, Ward JE, Woodard TL, Nevin KP, Xia QF, Tuominen MT, Lovley DR. Synthetic Biological Protein Nanowires with High Conductivity. Small, 2016, 12(33): 4481-4485. DOI:10.1002/smll.v12.33 |
| [34] | Tan Y, Adhikari RY, Malvankar NS, Ward JE, Woodard TL, Nevin KP, Lovley DR. Expressing the Geobacter metallireducens PilA in Geobacter sulfurreducens Yields Pili with Exceptional Conductivity. mBio, 2017, 8(1): e02203-16. |
| [35] | Rabaey K, Rodríguez J, Blackall L L, Keller J, Gross P, Batstone D, Verstraete W, Nealson KH. Microbial ecology meets electrochemistry:electricity-driven and driving communities. The ISME Journal, 2007, 1(1): 9-18. DOI:10.1038/ismej.2007.4 |
| [36] | Yong YC, Yu YY, Li CM, Zhong JJ, Song H. Bioelectricity enhancement via overexpression of quorum sensing system in Pseudomonas aeruginosa-inoculated microbial fuel cells. Biosensors and Bioelectronics, 2011, 30(1): 87-92. DOI:10.1016/j.bios.2011.08.032 |
| [37] | Yong XY, Shi DY, Chen YL, Feng J, Xu L, Zhou J, Wang SY, Yong YC, Sun YM, Ouyang PK, Zheng T. Enhancement of bioelectricity generation by manipulation of the electron shuttles synthesis pathway in microbial fuel cells. Bioresource Technology, 2014, 152: 220-224. DOI:10.1016/j.biortech.2013.10.086 |
| [38] | Berríos-Rivera SJ, Bennett GN, San KY. The effect of increasing NADH availability on the redistribution of metabolic fluxes in Escherichia coli chemostat cultures. Metabolic Engineering, 2002, 4(3): 230-237. DOI:10.1006/mben.2002.0228 |
| [39] | Yong XY, Feng J, Chen YL, Shi DY, Xu YS, Zhou J, Wang SY, Xu L, Yong YC, Sun YM, Shi CL, Ouyang PK, Zheng T. Enhancement of bioelectricity generation by cofactor manipulation in microbial fuel cell. Biosensors and Bioelectronics, 2014, 56: 19-25. DOI:10.1016/j.bios.2013.12.058 |
| [40] | Yong YC, Yu YY, Yang Y, Liu J, Wang JY, Song H. Enhancement of extracellular electron transfer and bioelectricity output by synthetic porin. Biotechnology and Bioengineering, 2013, 110(2): 408-416. DOI:10.1002/bit.24732 |
| [41] | Biffinger JC, Byrd JN, Dudley BL, Ringeisen BR. Oxygen exposure promotes fuel diversity for Shewanella oneidensis microbial fuel cells. Biosensors and Bioelectronics, 2008, 23(6): 820-826. DOI:10.1016/j.bios.2007.08.021 |
| [42] | Choi D, Lee SB, Kim S, Min B, Choi I, Chang S. Metabolically engineered glucose-utilizing Shewanella strains under anaerobic conditions. Bioresource Technology, 2014, 154: 59-66. DOI:10.1016/j.biortech.2013.12.025 |
| [43] | Flynn JM, Ross DE, Hunt KA, Bond DR, Gralnick JA. Enabling unbalanced fermentations by using engineered electrode-interfaced bacteria. mBio, 2010, 1(5): e00190-10. |
| [44] | Johnson ET, Baron DB, Naranjo B, Bond DK, Schmidt-Dannert C, Gralnick JA. Enhancement of survival and electricity production in an engineered bacterium by light-driven proton pumping. Applied and Environmental Microbiology, 2010, 76(13): 4123-4129. DOI:10.1128/AEM.02425-09 |
| [45] | Yong YC, Yu YY, Yang Y, Li CM, Jiang RR, Wang X, Wang JY, Song H. Increasing intracellular releasable electrons dramatically enhances bioelectricity output in microbial fuel cells. Electrochemistry Communications, 2012, 19: 13-16. DOI:10.1016/j.elecom.2012.03.002 |
