刘晓宇1,2, 陈芳艳2, 韩黎2


1.军事科学院军事医学研究院, 北京 100039;
2.解放军疾病预防控制所医院感染监控中心, 北京 100071
收稿日期:2017-08-25;修回日期:2018-01-19;网络出版日期:2018-02-05
基金项目:国家自然科学基金(81373138,81571542)
*通信作者:韩黎, Tel:+86-10-66948316;E-mail:hanlicdc@163.com
摘要:LC3相关吞噬作用(LC3-associated phagocytosis,LAP)是一种宿主细胞吞噬和降解病原体的高效过程。近年来越来越多的研究表明,LAP在清除病原微生物感染过程中具有非常重要的作用,其作用机制不同于传统的吞噬作用和自噬作用。在外源刺激下,宿主细胞通过招募自噬相关的蛋白实现LC3向单层膜吞噬泡的聚集,从而提高其吞噬和杀伤病原体的效率。不同病原微生物应对LAP的杀伤作用的方式是不同的,本文对LAP发生的一般规律、各种微生物感染过程中LAP发生的不同情况及其近期研究进展予以综述。
关键词: LC3相关吞噬作用(LAP) 微生物感染 吞噬作用 细胞自噬
LC3-associated phagocytosis and microbial infections
Xiaoyu Liu1,2, Fangyan Chen2, Li Han2


1.Academy of Military Medicine, Academy of Military Science PLA, Beijing 100039, China;
2.Department for Hospital Infection Control & Research, Institute for Disease Control and Prevention, PLA, Beijing 100071, China
Received 25 August 2017; Revised 19 January 2018; Published online 5 February 2018
*Corresponding author: Li Han, Tel: +86-10-66948316; E-mail: hanlicdc@163.com
Supported by the National Natural Science Foundation of China (81373138, 81571542)
Abstract: LC3-associated phagocytosis (LAP) is an efficient process for the phagocytosis and degradation of invading pathogens. Recently, many studies show that LAP plays a very important role in the elimination of pathogenic microorganism, and its mechanism is different from the conventional phagocytosis and autophagy. Upon the extracellular stimulation, the activation of some autophagy related proteins in host cells induces the recruit of LC3 to the single membrane of phagosome, which promotes the efficiency of phagocytosis and killing of the pathogens. Different pathogens have different mechanisms to cope with the killing of LAP. The general mechanism of LAP, different responses to LAP to various pathogens and the research progress in recent years are reviewed in this paper.
Key words: LC3-associated phagocytosis (LAP) microbial infection phagocytosis cell autophagy
吞噬作用和细胞自噬作用是两种非常古老且保守的过程,对细胞摄取营养物质和清除病原微生物均非常重要。吞噬作用是细胞表面模式识别受体(pattern recognition receptors,PRRs)识别并结合微生物表面的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)后,激活胞内级联反应、骨架重排,将病原体内吞形成吞噬泡,与细胞中的早期内体及晚期内体融合形成成熟的吞噬泡,最终与溶酶体融合消化降解吞入的微生物的过程[1]。细胞自噬是细胞维持自身稳态的经典过程,双层膜的自噬泡可包裹胞内受损的细胞器、无用的蛋白复合物及入侵的病原体,并和溶酶体融合,降解其内容物。LC3是细胞自噬过程中重要的标志蛋白,哺乳动物中至少有8种LC3的同源蛋白,根据氨基酸序列的不同分为两个超家族,LC3超家族和GABARAP超家族,LC3超家族包括LC3A (包含两种剪接变体)、LC3B及LC3C,其中LC3B是被广泛用来标记自噬泡形成过程的亚型[2]。近几年研究发现一种特殊的吞噬作用,即LC3相关的吞噬作用(LC3-associated phagocytosis, LAP),是一种非典型性自噬作用,其特点是在单层膜的吞噬泡上发现了LC3的存在,该过程被激活后LC3被招募至吞噬体,加速吞噬泡的成熟,促进吞噬泡与溶酶体的融合以及抗原呈递作用,提高机体的天然免疫及适应性免疫反应的效率,从而更快地杀灭病原体[3]。本文将重点对现有的研究中LAP与微生物感染相关的成果进行综述。
1 LAP概述 1.1 LAP的发生机制 Sanjuan等在10年前首次发现了LAP现象,在小鼠巨噬细胞系(RAW-GFP-LC3)吞噬酵母多糖、脂多糖包裹的乳胶颗粒或者直接吞噬酿酒酵母、大肠埃希氏菌过程中,细胞自噬的标志蛋白LC3迅速被募集至吞噬泡上,该过程伴随着Toll样受体(TLRs)的激活、Beclin-1的招募及PI3K的激活,同时还需要自噬通路蛋白Atg5和Atg7的参与。尽管该吞噬及LC3募集过程中的吞噬泡没有典型的自噬泡双层膜结构,但是该吞噬泡可以和溶酶体快速融合,更快地杀灭病原体[4]。此后,关于LAP的研究越来越多,研究者们先后发现,LAP的激活首先需要被吞噬的颗粒物表面的PAMPs (脂多糖、肽聚糖、酵母多糖、β-葡聚糖、磷脂酰丝氨酸等)结合并激活细胞表面的PRRs (TLRs、NLRs、dectin-1、TIM4和FcR等),招募部分自噬通路相关蛋白至含有吞噬物的吞噬泡上,加速该吞噬泡成熟、吞噬物的降解并调节免疫反应。
LAP和细胞自噬过程很相似,共用许多蛋白包括Beclin-1、Atg3、Atg5和Atg7等,但不同的是,LAP形成的吞噬泡是单层膜,不需要预起始复合物(包括ULK1/2、FIP2000和Atg13)的参与,另外,NADPH氧化酶2 (NADPH oxidase 2,NOX2)复合物对LAP的发生是必需的,因为LC3的招募需要其催化产生的ROS的参与。值得注意的是,Rubicon在细胞自噬过程中是非必要的蛋白,甚至具有抑制作用,但是它对LAP的发生必不可少,Rubicon具有稳定NOX2复合物和持续将PI(3)P固定在吞噬泡上的功能,这对脂化的LC3Ⅱ稳定结合在吞噬泡上是非常重要的。自噬和LAP的异同见表 1[5-6]。
表 1. 自噬和LAP关键特征的比较 Table 1. Comparison between autophagy and LAP
| Key characteristics | Autophagy | LC3-associated phagocytosis |
| Membrane (of vesicle) | Double membrane | Single membrane |
| Pre-initiation ULK complex | Essential | Non-essential |
| Rubicon protein | Non-essential or inhibition | Essential |
| NADPH oxidase complex | Non-essential | Essential |
| Proteins shared in both signal pathway | Beclin-1, Atg3, Atg5, Atg7, LC3 | |
表选项
由于LC3是自噬和LAP共有的蛋白,之前的很多研究都利用LC3斑点的聚集指示自噬的发生,所以很多关于微生物感染清除机制的研究并不能确定是自噬还是LAP在发挥作用[7]。透射电镜的应用及LAP机制的逐渐清晰为LAP与自噬的区分提供了新的方法,可以用来检验上述研究的正确性[8]。
1.2 LAP的功能 目前为止,公认的LAP的主要功能是增强天然免疫细胞杀灭病原体的能力,主要表现为3个方面:一是促进吞噬泡和溶酶体的融合,从而加速吞噬溶酶体的成熟;二是LAP可能将吞噬泡中的病原体运送到其模式识别受体使其更高效地被识别和杀灭;三是LAP更有利于发生MHCⅡ类分子抗原递呈,提高适应性免疫反应的效率[9]。除了加速清除病原微生物外,LAP还可以识别并吞噬即将死亡(凋亡和坏死)的细胞,预防自身免疫性疾病如系统性红斑狼疮的发生,吞噬细胞表面的TIM-4受体识别并结合死亡细胞表面的磷脂酰丝氨酸,激活LAP系统,杀伤降解死亡细胞。LAP过程出现缺陷时,巨噬细胞吞噬死亡细胞时会释放更多的促炎症细胞因子,抗炎症细胞因子分泌减少,使机体更容易发生自身免疫疾病[10]。此外,LAP还与视网膜色素功能有很大关系[11]。
2 LAP与病原微生物感染 由于杀灭病原体效率高,LAP被认为是机体天然免疫反应的重要组成部分,可以参与应对众多病原体的感染过程,包括胞内细菌、真菌及原生动物。但是,感染的病原微生物也可以逃避LAP的杀伤,或者通过绑架LAP系统帮助其自身复制和扩散,每种微生物应对LAP的措施也有不同,下面分类阐述。
2.1 LAP与细菌感染 病原细菌种类繁多,其表面的PAMP主要是脂多糖(LPS)和肽聚糖,可以与天然免疫细胞表面的Toll样受体(TLR2、TLR4)及胞内受体NLRs (NOD1、NOD2)结合。LPS激活的信号可以刺激NOX2产生ROS,NLRs可以将Atg16L蛋白招募至细胞膜周围微生物感染发生的位置,促进LC3向吞噬泡聚集[2],从而引发LAP产生杀菌作用。Abnave等用16种常见的可以感染人、线虫或者果蝇的细菌感染真涡虫,筛选出18种抗性基因,其中9种基因是和人类同源的,他们发现其中一个基因编码的MORN2蛋白可以加速吞噬作用所介导的结核分枝杆菌、嗜肺军团菌及金黄色葡萄球菌的清除。MORN2蛋白还可以促进LC3向含有结核分枝杆菌的吞噬泡募集,促进LAP的发生以实现杀菌的目的[12]。杜氏军团菌感染细胞时大部分可逃避传统的吞噬泡成熟过程,形成内质网膜泡样的小囊泡,在该小泡中进行定居和复制;但一小部分含杜氏军团菌的吞噬泡可招募LC3至其膜上,限制该菌的生存和繁殖,这个过程需要细菌的Dot/Icm Ⅳ型分泌系统参与,还需要宿主细胞Toll样受体、Rubicon、二酰甘油(DAG)信号及NADPH氧化酶复合物的参与[13]。
为了逃避LAP系统的杀伤,福氏志贺菌感染早期,其Ⅲ型分泌系统分泌的IcsB蛋白可以招募宿主的Toca-1蛋白至细菌周围,这个过程会抑制LC3向细菌吞噬泡的募集,从而使该细菌暂时逃避LAP的杀伤[14],类似的,类鼻疽伯霍尔德杆菌也可以利用其Ⅲ型分泌系统及效应蛋白BopA、转运蛋白BipD帮助其逃避LAP的杀伤,BopA或BipD的突变或缺失会使该菌更多地存在于LC3吞噬泡中,延迟或者无法逃逸至细胞质,使其在RAW264.7细胞中的存活率降低[15]。此外,最新研究发现,结合分枝杆菌虽然能激活一些LAP的受体,但是LAP清除该细菌的效率很低,原因是结合分枝杆菌分泌的CpsA蛋白,是一种含LytR-CpsA-Psr (LCP)结构域的蛋白,能参与抑制巨噬细胞产生呼吸爆发,即可以抑制NAPDH氧化酶从而抑制ROS的产生,进而抑制LAP[16]。
2.2 LAP与真菌感染 LAP与真菌感染关系非常密切。近年来,LAP与常见的病原真菌如白色念珠菌、烟曲霉及新型隐球菌等的感染之间的关系研究非常多。这些真菌普遍存在于自然环境中,对人类而言通常是条件致病菌,在机体免疫功能低下的条件下才会发生感染,但是病死率都比较高,白色念珠菌感染引起的念珠菌血症和烟曲霉感染引起的侵袭性肺曲霉病的病死率均可达到50%以上[17]。慢性肉芽肿病(CGD)是一种先天生NOX2复合物的编码基因缺陷病,该病患者机体内LAP过程缺陷,更容易感染烟曲霉并发展成侵袭性肺曲霉病[18]。还有研究表明临床上做移植手术时应用的免疫抑制剂皮质固醇类可以抑制Syk的磷酸化进而抑制ROS的释放,这也是免疫抑制患者易患侵袭性肺曲霉病的原因之一[19]。
病原真菌细胞壁上的PAMP主要是β-1, 3-葡聚糖,天然免疫细胞表面的受体Dectin-1是其主要的模式识别受体[20],此外,一些跨膜的Toll样受体如TLR1、TLR2、TLR4、TLR6以及TLR9都可以协同Dectin-1实现对真菌病原体的识别[21]。Dectin-1的胞质区含有一个免疫受体酪氨酸基序(ITAM)[22],当其胞外段识别病原菌的抗原表位后,该基序就会被Syk家族的激酶磷酸化,从而招募并激活Syk激酶[23],同时招募Class Ⅲ PI3K复合物,这些激酶可以引起下游NOX2复合物的活化,释放ROS[24],协同Atg5、Atg7等组成的蛋白复合物实现LC3的脂化和在吞噬泡上的锚定,从而加速吞噬泡与溶酶体的融合,杀灭病原体并呈递抗原(图 1)。
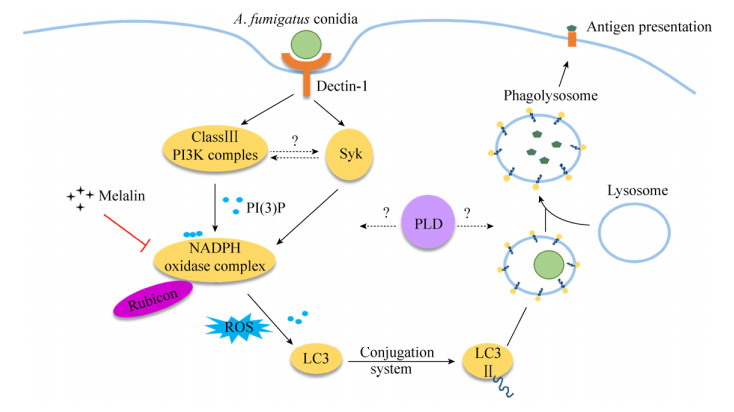 |
| 图 1 烟曲霉感染引起的巨噬细胞胞内LAP信号通路模式图 Figure 1 Intracellular LAP signaling pathway in macrophage induced by Aspergillus fumigatus infection. Upon recognition of the conidia of Aspergillus fumigatus, the Class Ⅲ PI3K complex and Syk are activated to recruit NADPH oxidase complex which produces ROS to help conjugates LC3Ⅰ to phosphatidylethanolamine to form LC3Ⅱ. The deposition of LC3Ⅱ on the single membrane enhances the maturation of phagosome and its fusion with lysosome, finally the conidia is degraded and its antigen is presented to facilitate adaptive immune response. The function of signal molecule, PLD is being investigated. Syk: spleen tyrosine kinase; PLD: phospholipase D. |
| 图选项 |
对于宿主细胞LAP的杀伤作用,病原真菌也有相应的防御措施,比如白色念珠菌的热灭活形式比活菌形式更容易引起RAW264.7细胞中LC3斑点在吞噬泡上的聚集,在斑马鱼中也是如此,活菌很少引起LC3斑点的聚集,Kanayama等推测是由于活菌表面没有暴露β-1, 3-葡聚糖[25]。与酵母多糖包被的乳胶颗粒及烟曲霉膨胀孢子引发的LC3的聚集不同,烟曲霉休眠孢子诱导的LC3募集过程具有延迟性,因为休眠孢子是免疫钝化的[19],其表面的β-1, 3-葡聚糖外包裹着一层黑色素和疏水蛋白,阻碍其与受体的结合;当孢子膨胀后或者用遗传的方法敲除黑色素和疏水蛋白的编码基因后,都能更快地引发LC3的招募和免疫应答的发生[26]。除了阻碍β-1, 3-葡聚糖的暴露之外,孢子表面的黑色素还可以通过抑制宿主细胞LAP的发生来逃避宿主对其的杀伤作用,黑色素通过选择性地去除NOX2复合物中的p22phox亚基,破坏其稳定性,阻断ROS的产生,从而抑制LAP的发生[27]。黑色素敲除株(Δalb1)比野生株能更快地激活NOX2复合物,促进ROS的产生,而Δalb1与人单核细胞相互作用时加入纯的人工合成的黑色素,ROS的产生几乎被完全阻断,因此也阻断了LAP的发生。而且,黑色素被认为是烟曲霉的毒力因子之一,黑色素敲除株不能引起免疫缺陷小鼠肺部烟曲霉菌丝的侵袭性生长,而野生株可以引起菌丝生长并且能使小鼠死亡[28]。
当然,真菌感染时胞内信号传递还需要更深入的研究,比如吞噬过程中的经典信号蛋白Syk和自噬过程中经典的PI3K复合物的招募和激活是否有关?还是两者可以单独激活NOX2复合物参与LAP过程?另外,本团队前期报道,烟曲霉可以内化侵入肺泡上皮细胞,并能激活胞内的磷脂酶D[29]。我们都知道,磷脂酶D在自噬过程中发挥重要作用[30],而且我们的实验结果显示烟曲霉能引起肺上皮细胞系A549细胞中LC3斑点的聚集,提示有自噬或LAP的发生,那么肺上皮细胞中能否发生LAP,磷脂酶D等非自噬通路特有的但和自噬有很大关联的蛋白是否参与LAP过程,有何生理意义?都是我们关心且下一步要探索的问题。
2.3 LAP与原生动物感染 除了细菌、真菌之外,还有其他一些病原微生物的感染与LAP过程有关。原生动物属于胞内寄生微生物,其感染和引发的免疫反应与LAP过程联系紧密。如IFN-γ介导的肝部疟原虫的清除有赖于宿主细胞中LAP过程的激活,该过程可以直接使LC3锚定在疟原虫寄生泡(PVM)的膜上,提高寄生泡与溶酶体融合的几率和效率[31]。
当然,一些原生动物也可以逃避宿主杀伤或利用宿主的蛋白帮助其存活和播散,如巨噬细胞在吞噬利什曼原虫时虽然会促使LC3的脂化,但是该寄生虫表面的非金属蛋白酶GP63会下调蛋白VAMP8 (该蛋白调控NOX2在吞噬泡上的组装)的表达,从而抑制NADPH氧化酶复合物NOX2向吞噬泡的聚集,导致吞噬泡募集LC3受阻,宿主杀灭该寄生虫的效率降低[32]。除此之外,利什曼原虫在感染宿主细胞时,一部分原虫会发生自主的死亡,死亡原虫的存在会绑架宿主细胞的LAP系统中的自噬相关蛋白,减少CD4+ T细胞的增殖,导致其感染的总体数量增加,加速感染进程[33]。
3 展望 综上所述,LAP和病原微生物感染关系密切,LAP是细胞对病原微生物感染的一种免疫应答方式,通过将LC3锚定在吞噬泡上加速其与溶酶体的融合,提高杀菌效率。微生物也有一些应对措施,细菌会通过其Ⅲ型分泌系统释放一些效应蛋白,还可以绑架一些宿主蛋白抑制这种免疫应答;真菌通过表面的一些成分阻碍PAMP的暴露,逃避LAP系统的识别,其中涉及到很多蛋白及脂类分子的参与。
LAP是一个比较新的研究领域,还有很多问题需要探究,例如,LAP的发生机制还未详细阐明,研究者们不能排除LC3向吞噬泡的聚集是由很多自噬小泡和吞噬泡融合而成[4];以前很多以LC3聚集作为细胞自噬指标的研究成果都需要重新确定是细胞自噬还是LAP在发挥作用;自噬和LAP的发生是随机过程还是需要特定的调控开关控制,目前很不明确。自噬的发生需要预起始复合物ULK的激活,而LAP的发生需要Rubicon蛋白参与,这些蛋白是否会是这2个过程的调控开关呢?还有哪些分子参与LAP过程?在动物模型中对LAP的研究最终是否能应用到人类感染性疾病的治疗等等。此外,关于LC3在吞噬泡上的锚定加速吞噬泡成熟的机制,仅有研究表明,一种含有FYVE和卷曲螺旋(coiled-coil)结构域的蛋白FYCO1 (在自噬泡运输过程中发挥重要作用)可以被LC3直接招募至含有dectin-1受体的吞噬泡上,加速早期p40phox+吞噬泡向晚期LAMP1+吞噬泡转变,即加速吞噬泡的成熟[34]。其余关于该方面的研究很少。
更值得探讨的是,不同的物种中LAP的发生和功能也是有区别的,现有的关于LAP的研究大部分集中在小鼠细胞巨噬细胞系中,而有研究表明,在感染发生时,小鼠细胞系和人细胞系LAP的发生程度及吞噬泡和溶酶体的融合速度是有很大区别的[9, 35]。这些异同可能都折射了LAP的不同功能,需要更加深入的研究。另外,现在对LAP的研究都集中在巨噬细胞,其他的细胞如中性粒细胞、树突细胞、上皮细胞中LAP相关的研究相对较少,而这些细胞在天然免疫反应中也发挥重要作用,比如机体应对烟曲霉感染时,中性粒细胞是主要防线,中性粒细胞缺乏症患者易患侵袭性肺曲霉病[36];树突细胞是专业的抗原呈递细胞,感染发生时该细胞中LAP的发生情况对适应性免疫的激活及感染的最终清除非常重要;上皮细胞不仅是呼吸道抵御病原体感染的首要物理屏障,而且在病原体识别、炎症因子释放及免疫信号传递等机体天然免疫应答过程中发挥重要作用[37]。这些细胞系中LAP的发生情况如何?是非常值得研究的科学问题。总之,LAP的病原微生物感染过程中的研究仍面临很多挑战,需要更加深入的探索。
References
| [1] | Sprenkeler EGG, Gresnigt MS, van de Veerdonk FL. LC3-associated phagocytosis:a crucial mechanism for antifungal host defence against Aspergillus fumigatus. Cellular Microbiology, 2016, 18(9): 1208-1216. DOI:10.1111/cmi.v18.9 |
| [2] | Lai SC, Devenish RJ. LC3-associated phagocytosis (LAP):Connections with host autophagy. Cells, 2012, 1(3): 396-408. DOI:10.3390/cells1030396 |
| [3] | Mehta P, Henault J, Kolbeck R, Sanjuan MA. Noncanonical autophagy:one small step for LC3, one giant leap for immunity. Current Opinion in Immunology, 2014, 26: 69-75. DOI:10.1016/j.coi.2013.10.012 |
| [4] | Sanjuan MA, Dillon CP, Tait SWG, Moshiach S, Dorsey F, Connell S, Komatsu M, Tanaka K, Cleveland JL, Withoff S, Green DR. Toll-like receptor signalling in macrophages links the autophagy pathway to phagocytosis. Nature, 2007, 450(7173): 1253-1257. DOI:10.1038/nature06421 |
| [5] | Martinez J, Malireddi RKS, Lu Q, Cunha LD, Pelletier S, Gingras S, Orchard R, Guan JL, Tan HY, Peng JM, Kanneganti TD, Virgin HW, Green DR. Molecular characterization of LC3-associated phagocytosis reveals distinct roles for Rubicon, NOX2 and autophagy proteins. Nature Cell Biology, 2015, 17(7): 893-906. DOI:10.1038/ncb3192 |
| [6] | Boyle KB, Randow F. Rubicon swaps autophagy for LAP. Nature Cell Biology, 2015, 17(7): 843-845. DOI:10.1038/ncb3197 |
| [7] | Cemma M, Brumell JH. Interactions of pathogenic bacteria with autophagy systems. Current Biology, 2012, 22(13): R540-R545. DOI:10.1016/j.cub.2012.06.001 |
| [8] | Ligeon LA, Barois N, Werkmeister E, Bongiovanni A, Lafont F. Structured illumination microscopy and correlative microscopy to study autophagy. Methods, 2015, 75: 61-68. DOI:10.1016/j.ymeth.2015.01.017 |
| [9] | Romao S, Münz C. LC3-associated phagocytosis. Autophagy, 2014, 10(3): 526-528. DOI:10.4161/auto.27606 |
| [10] | Martinez J, Cunha LD, Park S, Yang M, Lu Q, Orchard R, Li QZ, Yan M, Janke L, Guy C, Linkermann A, Virgin HW, Green DR. Noncanonical autophagy inhibits the autoinflammatory, lupus-like response to dying cells. Nature, 2016, 533(7601): 115-119. DOI:10.1038/nature17950 |
| [11] | Ferguson TA, Green DR. Autophagy and phagocytosis converge for better vision. Autophagy, 2014, 10(1): 165-167. DOI:10.4161/auto.26735 |
| [12] | Abnave P, Mottola G, Gimenez G, Boucherit N, Trouplin V, Torre C, Conti F, Ben Amara A, Lepolard C, Djian B, Hamaoui D, Mettouchi A, Kumar A, Pagnotta S, Bonatti S, Lepidi H, Salvetti A, Abi-Rached L, Lemichez E, Mege JL, Ghigo E. Screening in planarians identifies MORN2 as a key component in LC3-associated phagocytosis and resistance to bacterial infection. Cell Host & Microbe, 2014, 16(3): 338-350. |
| [13] | Hubber A, Kubori T, Coban C, Matsuzawa T, Ogawa M, Kawabata T, Yoshimori T, Nagai H. Bacterial secretion system skews the fate of Legionella-containing vacuoles towards LC3-associated phagocytosis. Scientific Reports, 2017, 7: 44795. DOI:10.1038/srep44795 |
| [14] | Baxt LA, Goldberg MB. Host and bacterial proteins that repress recruitment of LC3 to Shigella early during infection. PLoS One, 2014, 9(4): e94653. DOI:10.1371/journal.pone.0094653 |
| [15] | Gong L, Cullinane M, Treerat P, Ramm G, Prescott M, Adler B, Boyce JD, Devenish RJ. The Burkholderia pseudomallei type Ⅲ secretion system and BopA are required for evasion of LC3-associated phagocytosis. PLoS One, 2011, 6(3): e17852. DOI:10.1371/journal.pone.0017852 |
| [16] | K?ster S, Upadhyay S, Chandra P, Papavinasasundaram K, Yang G, Hassan A, Grigsby SJ, Mittal E, Park HS, Jones V, Hsu FF, Jackson M, Sassetti CM, Philips JA. Mycobacterium tuberculosis is protected from NADPH oxidase and LC3-associated phagocytosis by the LCP protein CpsA. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(41): E8711-E8720. DOI:10.1073/pnas.1707792114 |
| [17] | Tam JM, Mansour MK, Acharya M, Sokolovska A, Timmons AK, Lacy-Hulbert A, Vyas JM. The role of autophagy-related Proteins in Candida albicans infections. Pathogens, 2016, 5(2): 34. DOI:10.3390/pathogens5020034 |
| [18] | de Luca A, Smeekens SP, Casagrande A, Iannitti R, Conway KL, Gresnigt MS, Begun J, Plantinga TS, Joosten LA, van der Meer JW, Chamilos G, Netea MG, Xavier RJ, Dinarello CA, Romani L, van de Veerdonk FL. IL-1 receptor blockade restores autophagy and reduces inflammation in chronic granulomatous disease in mice and in humans. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(9): 3526-3531. DOI:10.1073/pnas.1322831111 |
| [19] | Kyrmizi I, Gresnigt MS, Akoumianaki T, Samonis G, Sidiropoulos P, Boumpas D, Netea MG, van de Veerdonk FL, Kontoyiannis DP, Chamilos G. Corticosteroids block autophagy protein recruitment in Aspergillus fumigatus phagosomes via targeting dectin-1/Syk kinase signaling. The Journal of Immunology, 2013, 191(3): 1287-1299. DOI:10.4049/jimmunol.1300132 |
| [20] | Tsoni SV, Brown GD. β-Glucans and dectin-1. Annals of the New York Academy of Sciences, 2008, 1143: 45-60. DOI:10.1196/nyas.2008.1143.issue-1 |
| [21] | Inoue M, Shinohara ML. Clustering of pattern recognition receptors for fungal detection. PLoS Pathogens, 2014, 10(2): e1003873. DOI:10.1371/journal.ppat.1003873 |
| [22] | Ariizumi K, Shen GL, Shikano S, Xu S, Ritter Ⅲ R, Kumamoto T, Edelbaum D, Morita A, Bergstresser PR, Takashima A. Identification of a novel, dendritic cell-associated molecule, dectin-1, by subtractive cDNA cloning. Journal of Biological Chemistry, 2000, 275(26): 20157-20167. DOI:10.1074/jbc.M909512199 |
| [23] | Hara H, Ishihara C, Takeuchi A, Imanishi T, Xue LQ, Morris SW, Inui M, Takai T, Shibuya A, Saijo S, Iwakura Y, Ohno N, Koseki H, Yoshida H, Penninger JM, Saito T. The adaptor protein CARD9 is essential for the activation of myeloid cells through ITAM-associated and Toll-like receptors. Nature Immunology, 2007, 8(6): 619-629. DOI:10.1038/ni1466 |
| [24] | Gantner BN, Simmons RM, Canavera SJ, Akira S, Underhill DM. Collaborative induction of inflammatory responses by dectin-1 and Toll-like receptor 2. The Journal of Experimental Medicine, 2003, 197(9): 1107-1117. DOI:10.1084/jem.20021787 |
| [25] | Kanayama M, Shinohara ML. Roles of autophagy and autophagy-related proteins in antifungal immunity. Frontiers in Immunology, 2016, 7: 47. |
| [26] | Aimanianda V, Bayry J, Bozza S, Kniemeyer O, Perruccio K, Elluru SR, Clavaud C, Paris S, Brakhage AA, Kaveri SV, Romani L, Latgé JP. Surface hydrophobin prevents immune recognition of airborne fungal spores. Nature, 2009, 460(7259): 1117-1121. DOI:10.1038/nature08264 |
| [27] | Chamilos G, Akoumianaki T, Kyrmizi I, Brakhage A, Beauvais A, Latge JP. Melanin targets LC3-associated phagocytosis (LAP):A novel pathogenetic mechanism in fungal disease. Autophagy, 2016, 12(5): 888-889. DOI:10.1080/15548627.2016.1157242 |
| [28] | Akoumianaki T, Kyrmizi I, Valsecchi I, Gresnigt MS, Samonis G, Drakos E, Boumpas D, Muszkieta L, Prevost MC, Kontoyiannis DP, Chavakis T, Netea MG, van de Veerdonk FL, Brakhage AA, El-Benna J, Beauvais A, Latge JP, Chamilos G. Aspergillus cell wall melanin blocks LC3-associated phagocytosis to promote pathogenicity. Cell Host & Microbe, 2016, 19(1): 79-90. |
| [29] | Han XL, Yu RT, Zhen DY, Tao S, Schmidt M, Han L. β-1, 3-Glucan-induced host phospholipase D activation is involved in Aspergillus fumigatus internalization into type Ⅱ human pneumocyte A549 cells. PLoS One, 2011, 6(7): e21468. DOI:10.1371/journal.pone.0021468 |
| [30] | Dall'Armi C, Hurtado-Lorenzo A, Tian H, Morel E, Nezu A, Chan RB, Yu WH, Robinson KS, Yeku O, Small SA, Duff K, Frohman MA, Wenk MR, Yamamoto A, Di Paolo G. The phospholipase D1 pathway modulates macroautophagy. Nature Communications, 2010, 1(9): 142. DOI:10.1038/ncomms1144 |
| [31] | Boonhok R, Rachaphaew N, Duangmanee A, Chobson P, Pattaradilokrat S, Utaisincharoen P, Sattabongkot J, Ponpuak M. LAP-like process as an immune mechanism downstream of IFN-γ in control of the human malaria Plasmodium vivax liver stage. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(25): E3519-E3528. DOI:10.1073/pnas.1525606113 |
| [32] | Matte C, Casgrain PA, Séguin O, Moradin N, Hong WJ, Descoteaux A. Leishmania major Promastigotes Evade LC3-Associated Phagocytosis through the Action of GP63. PLoS Pathogens, 2016, 12(6): e1005690. DOI:10.1371/journal.ppat.1005690 |
| [33] | Crauwels P, Bohn R, Thomas M, Gottwalt S, Jackel F, Kramer S, Bank E, Tenzer S, Walther P, Bastian M, van Zandbergen G. Apoptotic-like Leishmania exploit the host's autophagy machinery to reduce T-cell-mediated parasite elimination. Autophagy, 2015, 11(2): 285-297. DOI:10.1080/15548627.2014.998904 |
| [34] | Ma J, Becker C, Reyes C, Underhill DM. Cutting edge:FYCO1 recruitment to dectin-1 phagosomes is accelerated by light chain 3 protein and regulates phagosome maturation and reactive oxygen production. The Journal of Immunology, 2014, 192(4): 1356-1360. DOI:10.4049/jimmunol.1302835 |
| [35] | Romao S, Gasser N, Becker AC, Guhl B, Bajagic M, Vanoaica D, Ziegler U, Roesler J, Dengjel J, Reichenbach J, Münz C. Autophagy proteins stabilize pathogen-containing phagosomes for prolonged MHC Ⅱ antigen processing. The Journal of Cell Biology, 2013, 203(5): 757-766. DOI:10.1083/jcb.201308173 |
| [36] | Wiederhold NP, Lewis RE, Kontoyiannis DP. Invasive aspergillosis in patients with hematologic malignancies. Pharmacotherapy, 2003, 23(12): 1592-1610. DOI:10.1592/phco.23.15.1592.31965 |
| [37] | Evans SE, Xu Y, Tuvim MJ, Dickey BF. Inducible innate resistance of lung epithelium to infection. Annual Review of Physiology, 2010, 72: 413-435. DOI:10.1146/annurev-physiol-021909-135909 |
