李开怀1, 张超1, 余永红2, 郭巧巧1, 廖裕玲1, 马金成1, 王海洪1


1.华南农业大学生命科学学院, 广东省农业生物蛋白质功能与调控重点实验室, 广东 广州 510642;
2.广东食品药品职业学院, 广东 广州 510520
收稿日期:2017-07-02;修回日期:2017-08-26;网络出版日期:2017-09-26
基金项目:国家重点基础研究计划(973计划)(2015CB150600);国家自然科学基金(31671987,31471743);广东省自然科学基金(2014A030313455,2015A030312005)
*通信作者:王海洪, Tel:+86-20-85281389;Fax:+86-20-85282180;E-mail:wanghh36@scau.edu.cn
摘要:[目的]系统鉴定哈氏弧菌脂酰-ACP合成酶(Acyl-ACP synthetase,AasS)以不同链长游离脂肪酸和非脂肪链羧酸作为底物的体外催化反应。[方法]利用非变性蛋白质凝胶电泳和紫外分光光度计法从定性和定量两个方面分析了AasS的体外催化功能与活性。[结果]AasS能够催化不同链长直链的自由脂肪酸合成脂酰-ACP,其中以C6-C12作为底物时活性最高;以羟基脂肪酸作为底物的情况下,AasS催化C8-C14的羟基脂肪酸有较高的活性。非脂肪链羧酸类作为底物的反应中,20种蛋白质氨基酸、苯甲酸和水杨酸均可以作为AasS的底物,合成相应的脂酰-ACP。[结论]本研究系统地证明了哈氏弧菌脂酰-ACP合成酶(AasS)对不同底物的不同催化活性,为生物体内氨基酸代谢和菌黄素合成代谢的研究提供了可行性的分析依据。
关键词: 脂酰-ACP合成酶 自由脂肪酸 氨基酸 苯甲酸 水杨酸
Identification and characterization of acyl-acyl carrier protein synthetase of Vibrio harveyi in vitro
Kaihuai Li1, Chao Zhang1, Yonghong Yu2, Qiaoqiao Guo1, Yuling Liao1, Jincheng Ma1, Haihong Wang1


1.Guangdong Provincial Key Laboratory of Protein Function and Regulation in Agricultural Organisms, College of Life Sciences, South China Agricultural University, Guangzhou 510642, Guangdong Province, China;
2.Guangdong Food and Drug Vocational College, Guangzhou 510520, Guangdong Province, China
Received 2 July 2017; Revised 26 August 2017; Published online 26 September 2017
*Corresponding author: Haihong Wang, Tel: +86-20-85281389; Fax: +86-20-85282180; E-mail: wanghh36@scau.edu.cn
Supported by the National Key Project for Basic Research (2015CB150600), by the National Natural Science Foundation of China (31671987, 31471743) and by the Natural Science Foundation of Guangdong Province (2014A030313455, 2015A030312005)
Abstract: [Objective]The aim of this study was to characterize Vibro harveyi acyl-ACP synthetase (AasS) with free fatty acids of different chain length and other carboxylic acids as substrates in vitro.[Methods]We analyzed the catalytic activity of AasS in vitro qualitatively and quantitatively by Urea-PAGE and UV spectrophotometry, respectively.[Results]AasS could catalyze the synthesis of fatty acyl-ACPs using straight chain free fatty acids with different chain length as substrates, and the enzymatic activity was much higher than C6-C12 fatty acids. In the case of 3-hydroxyl fatty acids, AasS showed higher activities to C8-C14 chain length as substrates. Furthermore, AasS could utilize such as 20 amino acids, benzoic acid and salicylic acid as substrates, and all formed corresponding acyl-ACPs.[Conclusion]Vibro harveyi acyl-ACP synthetase (AasS) catalyzed different substrates with different activities, and this finding could provide a reference for analyzing the metabolism of amino acids.
Key words: fatty acyl-ACP synthetase free fatty acids amino acids benzoic acid salicylic acid
酰基载体蛋白(Acyl carrier protein,ACP)是一类小分子蛋白物质(约9 kDa),在细菌脂肪酸合成过程发挥着重要作用[1-2]。在脂肪酸合成过程中,细菌细胞内脂肪酸酰基基团通过4-磷酸泛酰巯基乙胺“柔性臂”共价连接到ACP上,而后在Ⅱ型脂肪酸合酶(fatty aicd synthase)催化下合成不同链长的脂肪酸[3-4]。酰基载体蛋白在细菌聚酮化合物合成过程中也具有类似功能[5]。
脂酰-ACP合成酶(Acyl-ACP synthetase,AasS)能将自由脂肪酸脂酰化,合成脂酰-ACP,该催化反应分两步进行,首先AasS催化游离脂肪酸与ATP结合,生成脂酰-AMP (acyl-denosine monophosphate,脂酰-腺苷一磷酸),然后催化ACP-SH与脂酰-AMP结合,合成脂酰-ACP[6]。脂酰-ACP合成酶(AasS)属于磷酸泛酰巯基酰胺酶家族[6],最早发现于大肠杆菌(Escherichia coli)中,主要功能为在ATP存在的情况下,催化脂肪酸与ACP共价连接合成脂酰-ACP[7]。研究证明大肠杆菌(E. coli)的AasS是一类具有2-酰基甘油磷酸乙醇胺酰基转移酶和脂酰-ACP合成酶的双功能蛋白[8]。而后在哈氏弧菌(Vibrio harveyi)[9]、拟南芥(Arabidopsis)[10]、蓝藻(Cyanophyta)[11]中陆续发现AasS的同源蛋白。其中,哈氏弧菌(V. harveyi) AasS和大肠杆菌(E. coli) AasS具有相似的功能,也是一个双功能酶,在催化脂酰-ACP合成中具有相同的机制[9]。但哈氏弧菌(V. harveyi) AaaS还能催化外源脂肪酸生成脂酰-ACPs[12],因此研究认为哈氏弧菌(V. harveyi) AasS在外源自由脂肪酸吸收利用中发挥重要作用[6]。
哈氏弧菌(V. harveyi) AasS对许多中长链脂肪酸都具有催化活性,包括直链脂肪酸、支链脂肪酸、3-羟基脂肪酸以及不饱和脂肪酸等[6, 13]。但是,哈氏弧菌(V. harveyi) AasS对不同脂肪酸的催化活性差异还未见报道。同时,哈氏弧菌(V. harveyi) AasS对其他非脂肪链羧酸,如氨基酸、苯甲酸、水杨酸等,是否也具有催化活性,也未见相关报道。
因此,本研究表达纯化了哈氏弧菌(V. harveyi) AasS,以不同类型的羧酸作为底物,通过非变性的Urea-PAGE定性分析AasS对不同底物的催化活性。同时利用紫外分光光度计法测定哈氏弧菌AasS对不同底物的催化活性,分析哈氏弧菌(V. harveyi)脂酰-ACP合成酶(AasS)对不同底物的催化活性差异,为其他方面的生物学功能研究提供理论基础。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒和培养基: 本研究使用的菌株有大肠杆菌(E. coli)菌株DH5α、BL21(DE3),哈氏弧菌(V. harveyi)。质粒载体有pMD19-T、pET-28b,其他载体均为上述质粒的衍生质粒(具体构建见下文)。菌株的构建均采用CaCl2处理受体菌,从而制备感受态,质粒热激转化后获得。LB用作培养大肠杆菌(E. coli)的丰富培养基,培养条件37 ℃。常用的试剂和抗生素的使用浓度如下:100 mg/L氨苄青霉素,30 mg/L卡那霉素,200 mg/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG)。
1.1.2 试剂: 限制性内切酶,T4 DNA连接酶,Taq,pfu DNA聚合酶,Marker DL2000,T-载体克隆、质粒提取和DNA凝胶回收等试剂盒均购自大连TaKaRa公司;氨苄青霉素,卡那霉素等购自北京鼎国公司;IPTG试剂购自Sigma公司;亮氨酸(Leu),异亮氨酸(Ile),缬氨酸(Val)及其他17种氨基酸购自上海伯奥生物科技有限公司。强阴离子交换柱和蛋白质浓度测定试剂盒从Bio-Rad购买。Ni-NTA琼脂糖购自上海英俊公司。PCR扩增引物寡核苷酸由上海Sangon公司合成。
1.2 大肠杆菌ACP纯化 大肠杆菌(E. coli) ACP纯化参照文献[14],将用于表达大肠杆菌(E. coli) ACP的2个质粒pZL013 (acpP)和pZL014(acpS)共同转化进入大肠杆菌(E. coli) BL21(DE3)菌株,过夜培养后将培养物1:100转接入2 L含有0.1 mmol/L阿拉伯糖(Ara)的新鲜LB液体培养基中。37 ℃振荡培养至OD600= 0.6时加入1 mmol/L IPTG诱导蛋白表达。4 h后收集菌体并用50 mL无菌水清洗细胞1次。用30 mL AcpS缓冲溶液重新悬浮细胞后进行超声破碎。4 ℃条件下将细胞裂解物20000 r/min离心20 min。在上清液中加入辅酶A至终浓度为1 mmol/L,并于37 ℃温浴4 h,使细胞裂解物中的无活性的ACP (apo-ACP)转化为4-酰基泛巯基乙胺(4-PP)基团修饰后的活性ACP (holo-ACP)。完成温浴之后在体系中加入等体积预冷的异丙醇并混匀,冰浴1 h后在4 ℃条件下20000 r/min离心20 min。将离心后的上清液用氮气挥发至原体积的1/2,然后再次4 ℃、20000 r/min离心20 min,将离心所得上清液过夜透析于4 L浓度为50 mmol/L的K-MES (pH 6.1)溶液中。
将强阴离子交换柱连接到快速蛋白液相色谱仪上并用溶液A平衡,同时将样品用0.22 μm微孔滤膜过滤并低压除气30 min。将样品上样,完全进样后用10 mL溶液A冲洗离子交换柱,然后在50 mL体积内匀速提高溶液B的浓度至100%,最后继续用溶液B洗涤至无蛋白流出。在开始上样后即用部分收集器收集流出液,并用含有0.5 mol/L尿素的17.5% PAGE检测主要流出峰中ACP的浓度和纯度。
收集含有ACP蛋白的流出液,透析至50 mmol/L的Tris-HCl缓冲溶液(pH 8.0)中,加入终浓度为5%的甘油和5 mmol/L的二硫苏糖醇或β-巯基乙醇后-20 ℃保存。
1.3 哈氏弧菌脂酰-ACP合成酶的纯化 以哈氏弧菌(V. harveyi)基因组DNA为模板,通过PCR扩增出aasS基因,连接到pMD19-T,送测序。aasS用相应的限制性内切酶消化DNA片段后,连接到pET-28b载体上得到表达载体质粒pET-28b-aasS,然后转化大肠杆菌(E. coli) BL21 (DE3)后进行蛋白纯化,AasS蛋白的表达和分离纯化参照文献[15-16]进行。接种表达菌株于5 mL液体LB培养基中,37 ℃振荡培养后转接1-2 mL过夜培养物至100 mL新鲜的液体LB培养基中,在相应的温度下振荡培养至OD600=0.6时(3-4 h)加入1 mmol/L IPTG诱导蛋白表达。4 h后收集菌体并用20 mL无菌水清洗细胞1次。用5 mL裂解缓冲溶液悬浮细胞,240 W超声波冰水浴破碎15 min。将细胞裂解液在4 ℃离心,将上清液转移至用裂解缓冲溶液预处理的镍离子亲和层析柱中,4 ℃温和混匀1 h。将液体滤出并用10 mL清洗缓冲溶液洗涤亲和填料2次后用洗脱缓冲溶液洗脱蛋白,每次0.5 mL,重复洗脱4-6次。分别收集每次的洗脱液,利用浓度为12.5%的SDS-PAGE检测洗脱液中蛋白含量与纯度,收集目的蛋白相应的洗脱溶液,在4 L预冷的透析缓冲溶液中透析过夜。测定透析后样品的蛋白浓度并添加甘油至15%,-80 ℃保存。
1.4 脂酰ACP的制备 具体体系组分如表 1,反应体系在37 ℃温浴60 min。反应完全后,使用非变性蛋白质凝胶电泳(Urea-PAGE)检测,其中,C4-C6链长的脂肪酸用20%非变性蛋白质凝胶电泳(含0.5 mol/L脲)检测;C7-C12链长的脂肪酸用17.5%非变性蛋白质凝胶电泳(含2.5 mol/L脲)检测;C13-C18链长的脂肪酸用17.5%非变性蛋白质凝胶电泳(含3 mol/L脲)检测;苯甲酸、水杨酸和氨基酸均用17.5%非变性蛋白质凝胶电泳(含2.5 mol/L脲)检测。
表 1. AasS反应体系 Table 1. The reactive system of AasS
| Components | Concentration | Dose/μL |
| Fatty acid/carboxylic acid | 10 mmol/L | 2 |
| Tris-HCl (pH 8.0) | 1 mol/L | 5 |
| DTT | 50 mmol/L | 5 |
| MgSO4 | 100 mmol/L | 5 |
| ATP | 100 mmol/L | 5 |
| Holo-ACP | 5 μg/μL | 2 |
| AasS | 0.1 μg/μL | 2 |
| H2O | - | To 50 |
表选项
1.5 分光光度法测定AasS活性 DTNB [5, 5′-dithio-bis(2-nitrobenzoic acid),5, 5′-二硫代双(2-硝基苯甲酸)]能灵敏检测化合物中的巯基基团,而holo-ACP中含有4-磷酸泛酰巯基乙胺基团,可被DTNB检测;当holo-ACP中4-磷酸泛酰巯基乙胺共价连接游离脂肪酸后,其巯基基团被破坏,不能被DTNB所检测。因此本研究以DTNB作为巯基显色剂,定量检测holo-ACP含量。按如表 1所示体系加入200 μL离心管中,不加DTT。反应60 min后,加入同等体积0.4 mmol/L DTNB,OD412测定其吸光值,从而反映holo-ACP的剩余含量。根据holo-ACP的剩余百分含量比较AasS对不同底物的催化活性。
2 结果和分析 2.1 ACP和AasS酶分离纯化 本研究采用实验室改造菌株大肠杆菌(E. coli) DH5α/pBAD-ACP & pBAD-ACPS进行holo-ACP纯化[14],获得了高纯度的holo-ACP。用方法1.2纯化了哈氏弧菌(V. harveyi) AasS,其大小为64.4 kDa,经SDS-PAGE检测为单一条带,分子质量与推测的分子质量相符,表明AasS纯化成功(图 1)。
 |
| 图 1 哈氏弧菌AasS表达纯化 Figure 1 Purification of V. harveyi AasS from E. coli strain BL21(DE3). Purification of V. harveyi AasS by native nickel-chelate chromatography. Lane 1: molecular mass markers; lane 2: V. harveyi AasS protein. |
| 图选项 |
2.2 脂酰-ACP合成酶AasS对直链脂肪酸的催化反应 AasS能够以直链脂肪酸作为底物催化合成脂酰-ACP,但是对不同底物的催化活性是否有差异未有报道。为了确定AasS对直链脂肪酸作为底物时的催化活性,本研究以不同链长的脂肪酸和holo-ACP为底物,用哈氏弧菌AasS催化该反应,37 ℃反应1 h后,使用非变性蛋白质凝胶电泳法(Urea-PAGE)检测。结果表明,链长为C6-C17的直链脂肪酸均能被AasS催化生成相应脂酰-ACP(图 2)。然而,AasS对不同底物之间的催化活性是否有差异性呢?为此,本研究通过紫外分光光度法检测了反应体系中holo-ACP的消耗量,以体系中总holo-ACP含量的吸光值作为100%,并检测反应后体系中剩余holo-ACP的吸光值,换算为相应的holo-ACP剩余百分比含量(ACP%)。结果如图 2-D所示,以链长为C6-C12的脂肪酸为底物时,holo-ACP消耗量超过50%,说明AasS对中短碳链脂肪酸具有较高的催化活性。但以链长C13-C17的脂肪酸为底物的反应体系中,ACP消耗量约为30%,说明AasS对长链脂肪酸虽具有催化活性,但反应活性相对较弱,这与前人研究类似[6]。同时本研究对AasS以直链脂肪酸为底物时的不同时间催化活性,发现随着时间的延长,反应进行越彻底,直至反应完全(图 3)。
 |
| 图 2 AasS对直链脂肪酸的催化反应 Figure 2 The catalytic reaction of AasS for straight fatty acids in vitro. A: The catalytic reaction of AasS for short-chain fatty acids was determined by 20% Urea-PAGE with 0.5 mol/L urea. C6: hexanoic acid; holo-ACP: stand holo-ACP. B: The catalytic reaction of AasS for medium-chain fatty acids was determined by 17.5% Urea-PAGE with 2.5 mol/L urea. C7: heptylic acid; C8: octanoic acid; C9: nonanoic acid; C10: decanoic acid; C11: undecanoic (hendecanoic) acid; C12: dodecanoic (lauric) acid; holo-ACP: Stand holo-ACP. C: The catalytic reaction of AasS for long-chain fatty acids was determined by 17.5% Urea-PAGE with 3 mol/L urea. C13: tridecanoic acid; C14: tetradecanoic (myristic) acid; C15: pentadecanoic acid; C16: hexadecanoic (palmitic) acid; C17: heptadecanoic (margaric) acid; holo-ACP: Stand holo-ACP. D: Vibrio harveyi AasS catalytic activity was monitored spectrophotometrically for straight fatty acids. Data are mean±one standard deviation of three independent assays. Different letters indicate significant between treatments (LSD at P=0.05). |
| 图选项 |
 |
| 图 3 不同时间点AasS对直链脂肪酸C13的催化反应 Figure 3 The catalytic reaction of AasS for straight fatty acids C13 at different times. The catalytic reaction of AasS for C13 was determined by 17.5% urea-PAGE with 3 mol/L urea. |
| 图选项 |
2.3 脂酰-ACP合成酶AasS对羟基脂肪酸的催化反应 本研究证明AasS对直链脂肪酸具有不同的催化活性,那么羟基脂肪酸作为底物是否也会有活性差异?为此本研究检测了AasS对中长碳链羟基脂肪酸的催化活性,结果显示(图 4),AasS也能以羟基脂肪酸作为底物,催化形成相应的羟脂酰- ACP。定量分析如图 4-C所示,AasS催化C8-C14的羟基脂肪酸作为底物的反应活性高于C16羟基脂肪酸,其中C8-C14的羟基脂肪酸反应后holo-ACP剩余量为30%-40%,而在添加3-羟基棕榈酸(C16-OH)的反应体系中holo-ACP剩余量为70%左右。以上结果说明AasS酶对中等链长的羟基脂肪酸催化活性较高,而对长碳链羟基脂肪酸的活性相对较弱。
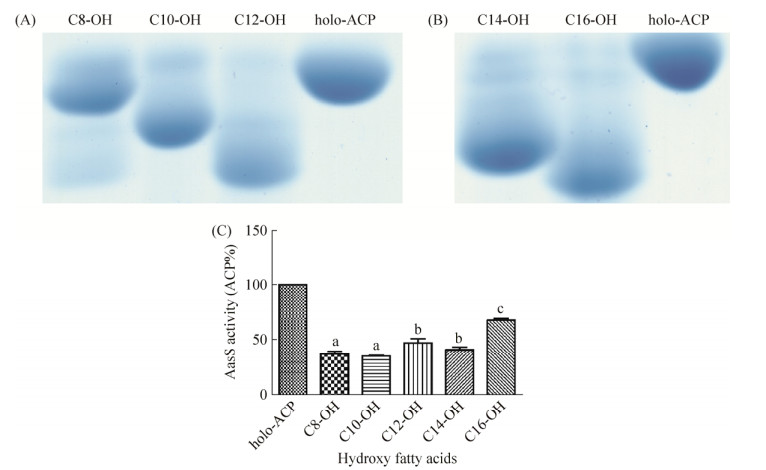 |
| 图 4 AasS对羟基脂肪酸的催化反应 Figure 4 The catalytic reaction of AasS for hydroxy fatty acids in vitro. A: The catalytic reaction of AasS for medium-chain hydroxy fatty acids was determined by 17.5% Urea-PAGE with 2.5 mol/L urea. C8-OH: 3-hydroxyloctanoic acid; C10-OH: 3-hydroxyldecanoic acid; C12-OH: 3-hydroxyldodecanoic acid; holo-ACP: stand holo-ACP. B: The catalytic reaction of AasS for long-chain hydroxy fatty acids was determined by 17.5% Urea-PAGE with 3 mol/L urea. C14-OH: 3-hydroxyltetradecanoic acid; C16-OH: 3-hydroxylhexadecanoic acid; holo-ACP: stand holo-ACP. C: Vibrio harveyi AasS catalytic activity was monitored spectrophotometrically for hydroxy fatty acids. All experiments were repeated three times with similar results. Data are mean±one standard deviation of three independent assays. Different letters indicate significant between treatments (LSD at P=0.05). |
| 图选项 |
2.4 脂酰-ACP合成酶AasS对苯甲酸和水杨酸的催化反应 在生物体内,芳香族化合物具有重要功能。野油菜黄单胞菌(Xanthomonas campestris pv. campestris)中扩散信号分子(diffusible factor,DF)为3-羟基苯甲酸,可作为合成芳香族化合物菌黄素的前体[17-19]。但AasS是否也能催化芳香族的苯甲酸及其衍生物连接ACP并参与生理代谢尚未见报道。因此本研究以苯甲酸和水杨酸为底物,定性和定量分析AasS的催化活性。结果表明(图 5),两种物质均能被AasS催化连接ACP,但不添加holo-ACP、AasS或ATP时,苯甲酸和水杨酸均不能被AasS所催化(图 6-A、B)。定量结果显示,苯甲酸和水杨酸作为底物时,AasS催化反应后ACP的剩余量约为65%。以上结果为体外探究菌黄素的合成机理提供了新的思路。
 |
| 图 5 AasS对苯甲酸和水杨酸的催化反应 Figure 5 The catalytic reaction of AasS for benzoic acid and salicylic acid in vitro. A: The catalytic reaction of AasS for benzoic acid and salicylic acid was determined by 17.5% Urea-PAGE with 2.5 mol/L urea. 1: Benzoic acid; 2: Salicylic acid; holo-ACP: Stand holo-ACP. B: Vibrio harveyi AasS catalytic activity was monitored spectrophotometrically for benzoic acid and salicylic acid. All experiments were repeated three times with similar results. Data are mean±one standard deviation of three independent assays. Different letters indicate significant between treatments (LSD at P=0.05). |
| 图选项 |
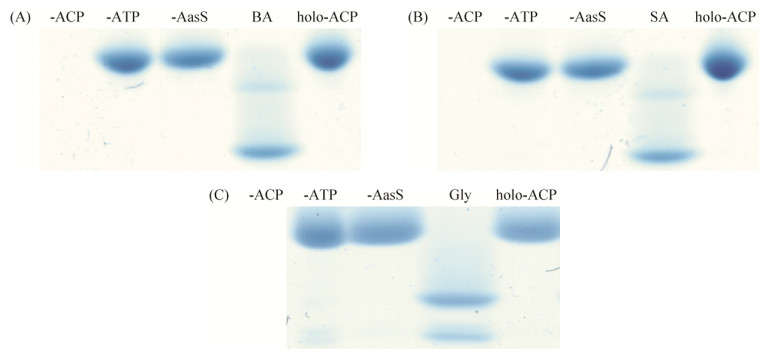 |
| 图 6 AasS酶催化反应鉴定 Figure 6 Identification of AasS enzyme catalytic reaction. AasS enzyme catalytic reaction was determined by 17.5% Urea-PAGE with 2.5 mol/L urea. A: BA, B: SA, C: Gly. -ACP: No addition of holo-ACP; -ATP: No addition of ATP; -AasS: No addition of AasS; BA: Synthesis of benzoic acid-ACP; SA: Synthesis of salicylic acid-Acyl-ACP; holo-ACP: Stand holo-ACP. All experiments were repeated three times with similar results. |
| 图选项 |
2.5 脂酰-ACP合成酶AasS对氨基酸的催化反应 氨基酸在生物体内具有不可替代的功能,可用于蛋白质合成,也是其他代谢途径的中间产物。但氨基酸作为特殊结构的羧酸,能否被AasS催化连接ACP,形成氨基酸-ACP?本研究以类似的体系和相同的策略检测了脂酰-ACP合成酶对不同氨基酸的催化反应,结果如图 7所示,20种氨基酸均能发生反应,其中以组氨酸(His)和色氨酸(Trp)为底物时活性最高,holo-ACP的剩余量约40%,其他氨基酸作为底物时holo-ACP的剩余量为50%左右。以甘氨酸作为代表,检测AasS对氨基酸的酶催化反应,结果显示不添加AasS和ATP时,AasS不能催化甘氨酸连接ACP (图 6-C)。在这过程中,半胱氨酸(Cys)作为底物时,Urea-PAGE胶显示AasS催化活性相对较弱,同时,因为半胱氨酸中含有二硫键基团,无法用DTNB作为显色剂指示holo-ACP的剩余含量,故无法测定以半胱氨酸为底物时AasS的催化活性。
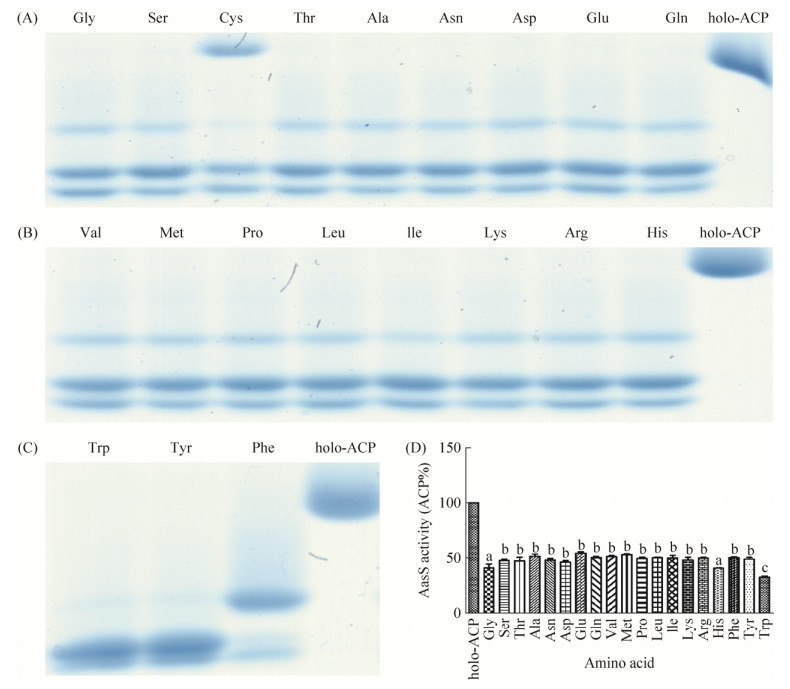 |
| 图 7 AasS对氨基酸的催化反应 Figure 7 The catalytic reaction of AasS for Amino acid in vitro. The catalytic reaction of AasS for Amino acid was determined by 17.5% Urea-PAGE with 2.5 mol/L urea (A, B, C). Gly: Glycine; Ser: Serine; Cys: Cysteine; Thr: Threonine; Ala: Alanine; Asn: Asparagine; Asp: Aspartic acid; Glu: Glutamic acid; Gln: Glutamine; Val: Valine; Met: Methionine; Pro: Proline; Leu: Leucine; Ile: Isoleucine; Lys: Lysine; Arg: Argnine; His: Hlstidine; Trp: Tryptophane; Tyr: Tyrosine; Phe: Phenylalanine; holo-ACP: Stand holo-ACP. D: Vibrio harveyi AasS catalytic activity was monitored spectrophotometrically for Amino acid. All experiments were repeated three times with similar results. Data are mean±one standard deviation of three independent assays. Different letters indicate significant between treatments (LSD at P=0.05). |
| 图选项 |
3 讨论 脂酰-ACP合成酶(AasS)是大多数生物体合成脂酰-ACP的关键酶[20-21],在生物体内具有很重要的作用。脂酰-CoA连接酶(FadD)和脂酰-ACP合成酶(AasS)是细菌利用脂肪酸的两种重要酶,细菌细胞利用脂肪酸转运蛋白FadL吸收胞外脂肪酸[22],而后在FadD催化下合成脂酰-CoA,从而进入β-氧化产生大量能量[23-24]。而AasS则不同,能将胞内自由脂肪酸催化生成脂酰-ACP,进入脂肪酸和磷脂合成途径[25]。因此,脂酰-ACP合成酶具有重要的生理功能。
为系统研究哈氏弧菌脂酰-ACP合成酶(AasS)对不同底物的催化活性特点,本研究首先检测AasS对不同链长脂肪酸的活性,证明了其对于C6-C12的直链自由脂肪酸具有较高的催化活性,而对于C13-C18的直链自由脂肪酸其催化活性相对中等碳链的较弱(图 3)。脂酰-ACP合成酶(AasS)对以羟基脂肪酸为底物的催化活性也有所不同,其中以3-羟基棕榈酸(C16-OH)为底物时,酶活性较低(图 4)。生物体内氨基酸常作为很多代谢途径的中间产物,是生物体生存所必需的物质。然而对于氨基酸作为底物是否能被脂酰-ACP合成酶(AasS)催化连上ACP还未有报道,本研究从定性和定量两个方面系统研究了脂酰-ACP合成酶(AasS)对于氨基酸作为底物的催化活性,证明脂酰-ACP合成酶(AasS)对不同氨基酸均具有催化活性,均能产生氨基酸脂酰-ACP (图 7)。在此过程中我们发现与催化脂肪酸的反应不同,以氨基酸为底物时,其Urea-PAGE胶显示出现了3种产物,该现象引起了我们极大的兴趣,后续我们将通过体外质谱学的方法进一步鉴定相关产物,研究体内是否存在相应的生化反应,并系统鉴定这些产物的生理学意义。本研究进一步证明,以氨基酸为底物的催化反应体系中,不添加ACP、AasS或ATP,该反应均不能进行,说明该反应是AasS的酶催化反应。本研究能为氨基酸的体内代谢研究提供一些理论借鉴。
黄单胞菌(X. anthomonas)中菌黄素为芳香族化合物,以3-羟基苯甲酸作为前体,在一系列酶的作用下合成[19]。但是具体的合成机理未曾报道,体外菌黄素的合成重建更是未曾报道,那么是否菌黄素的合成是以ACP作为载体蛋白,在相关酶的催化下产生,便成为一种可行的猜想。本研究为了验证脂酰-ACP合成酶(AasS)是否能以芳香族羧酸为底物合成相应的脂酰-ACP,以苯甲酸和水杨酸作为底物,检测脂酰-ACP合成酶(AasS)的催化活性,发现脂酰-ACP合成酶(AasS)同样能催化带苯环的羧酸,产生苯脂酰-ACP (图 5)。这为菌黄素的合成机理研究提供了理论前提,为体外重建菌黄素合成途径奠定了现实基础,具有重要的意义。
本研究仍然存在许多问题没有解决,DTNB作为显色剂测定巯基具有很高的灵敏性,所以定量检测时很容易被含有巯基的底物所影响。本研究中测定脂酰-ACP合成酶(AasS)催化不同脂肪酸和氨基酸合成脂酰-ACP时,定性分析显示其ACP含量几乎完全被消耗,但是定量分析显示其ACP的剩余量大多在50%以上,这可能的原因主要为定量分析中缺少还原剂DTT,故不能完全反应。
References
| [1] | White SW, Zheng J, Zhang YM, Rock CO. The structural biology of type Ⅱ fatty acid biosynthesis. Annual Review of Biochemistry, 2005, 74: 791-831. DOI:10.1146/annurev.biochem.74.082803.133524 |
| [2] | Smith S. Architectural options for a fatty acid synthase. Science, 2006, 311(5765): 1251-1252. DOI:10.1126/science.1125411 |
| [3] | Lu YJ, Zhang YM, Rock CO. Product diversity and regulation of type Ⅱ fatty acid synthases. Biochemistry and Cell Biology, 2004, 82(1): 145-155. DOI:10.1139/o03-076 |
| [4] | Feng SX, Zhu L, Luo B, Sun YR, Wang HH. Reconstitution of Escherichia coli fatty acid biosynthesis reaction in vitro. Progress in Biochemistry and Biophysic, 2008, 35(8): 954-963. (in Chinese) 冯赛祥, 朱磊, 罗彪, 孙益嵘, 王海洪. 大肠杆菌(Escherichia coli)体外脂肪酸合成反应的重建. 生物化学与生物物理进展, 2008, 35(8): 954-963. |
| [5] | Beld J, Finzel K, Burkart MD. Versatility of acyl-acyl carrier protein synthetases. Chemistry & Biology, 2014, 21(10): 1293-1299. |
| [6] | Jiang YF, Chan CH, Cronan JE. The soluble acyl-acyl carrier protein synthetase of Vibrio harveyi B392 is a member of the medium chain acyl-CoA synthetase family. Biochemistry, 2006, 45(33): 10008-10019. DOI:10.1021/bi060842w |
| [7] | Ray TK, Cronan JE. Activation of long chain fatty acids with acyl carrier protein: demonstration of a new enzyme, acyl-acyl carrier protein synthetase, in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America, 1976, 73(12): 4374-4378. DOI:10.1073/pnas.73.12.4374 |
| [8] | Jackowski S, Jackson PD, Rock CO. Sequence and function of the aas gene in Escherichia coli. Journal of Biological Chemistry, 1994, 269(4): 2921-2928. |
| [9] | Byers DM, Holmes CG. A soluble fatty acyl-acyl carrier protein synthetase from the bioluminescent bacterium Vibrio harveyi. Biochemistry and Cell Biology, 1990, 68(7/8): 1045-1051. |
| [10] | Koo AJK, Fulda M, Browse J, Ohlrogge JB. Identification of a plastid acyl-acyl carrier protein synthetase in Arabidopsis and its role in the activation and elongation of exogenous fatty acids. The Plant Journal, 2005, 44(4): 620-632. DOI:10.1111/tpj.2005.44.issue-4 |
| [11] | Kaczmarzyk D, Fulda M. Fatty acid activation in Cyanobacteria mediated by acyl-acyl carrier protein synthetase enables fatty acid recycling. Plant Physiology, 2010, 152(3): 1598-1610. DOI:10.1104/pp.109.148007 |
| [12] | Byers DM. Elongation of exogenous fatty acids by the bioluminescent bacterium Vibrio harveyi. Journal of bacteriology, 1989, 171(1): 59-64. DOI:10.1128/jb.171.1.59-64.1989 |
| [13] | Bi H, Yu YH, Dong HJ, Wang HH, Cronan JE. Xanthomonas campestris RpfB is a fatty acyl-CoA ligase required to counteract the thioesterase activity of the RpfF diffusible signal factor (DSF) synthase. Molecular Microbiology, 2014, 93(2): 262-275. DOI:10.1111/mmi.2014.93.issue-2 |
| [14] | Wang LL, Yang J, Huang CZ, Wang HH. Overexpression and purification of Escherichia coli holo-acyl carrier proteinand synthesis of acyl carrier protein. Acta Microbiologica Sinica, 2008, 48(7): 963-969. (in Chinese) 汪玲玲, 杨辑, 黄诚之, 王海洪. 大肠杆菌holo-ACP的过表达、分离纯化及长链脂酰ACP的合成. 微生物学报, 2008, 48(7): 963-969. |
| [15] | Zhu L, Lin JS, Ma JC, Cronan JE, Wang HH. Triclosan resistance of Pseudomonas aeruginosa PAO1 is due to FabV, a triclosan-resistant enoyl-acyl carrier protein reductase. Antimicrobial Agents and Chemotherapy, 2010, 54(2): 689-698. DOI:10.1128/AAC.01152-09 |
| [16] | Zhu L, Cheng JL, Luo B, Feng SX, Lin JS, Wang SB, Cronan JE, Wang HH. Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis. BMC Microbiology, 2009, 9: 119. DOI:10.1186/1471-2180-9-119 |
| [17] | He YW, Wu JE, Zhou L, Yang F, He YQ, Jiang BL, Bai LQ, Xu YQ, Deng ZX, Tang JL, Zhang LH. Xanthomonas campestris diffusible factor is 3-hydroxybenzoic acid and is associated with xanthomonadin biosynthesis, cell viability, antioxidant activity, and systemic invasion. Molecular Plant-Microbe Interactions, 2011, 24(8): 948-957. DOI:10.1094/MPMI-02-11-0031 |
| [18] | Starr MP, Jenkins CL, Bussey LB, Andrewes AG. Chemotaxonomic significance of the xanthomonadins, novel brominated aryl-polyene pigments produced by bacteria of the genus Xanthomonas. Archives of Microbiology, 1977, 113(1/2): 1-9. |
| [19] | Zhou L, Huang TW, Wang JY, Sun S, Chen G, Poplawsky A, He YW. The rice bacterial pathogen Xanthomonas oryzae pv. oryzae produces 3-hydroxybenzoic acid and 4-hydroxybenzoic acid via XanB2 for use in xanthomonadin, ubiquinone, and exopolysaccharide biosynthesis. Molecular Plant-Microbe Interactions, 2013, 26(10): 1239-1248. DOI:10.1094/MPMI-04-13-0112-R |
| [20] | von Berlepsch S, Kunz HH, Brodesser S, Fink P, Marin K, Flügge UI, Gierth M. The acyl-acyl carrier protein synthetase from Synechocystis sp. PCC 6803 mediates fatty acid import. Plant Physiology, 2012, 159(2): 606-617. DOI:10.1104/pp.112.195263 |
| [21] | Campopiano DJ. ACP-AasS you like it. Chemistry & Biology, 2014, 21(10): 1257-1259. |
| [22] | Kumar GB, Black PN. Bacterial long-chain fatty acid transport. Identification of amino acid residues within the outer membrane protein FadL required for activity. The Journal of Biological Chemistry, 1993, 268(21): 15469-15476. |
| [23] | Magnuson K, Oh W, Larson TJ, Cronan JE. Cloning and nucleotide sequence of the fabD gene encoding malonyl coenzyme A-acyl carrier protein transacylase of Escherichia coli. FEBS Letters, 1992, 299(3): 262-266. DOI:10.1016/0014-5793(92)80128-4 |
| [24] | Kang Y, Zarzycki-Siek J, Walton CB, Norris MH, Hoang TT. Multiple FadD acyl-CoA synthetases contribute to differential fatty acid degradation and virulence in Pseudomonas aeruginosa. PLoS One, 2010, 5(10): e13557. DOI:10.1371/journal.pone.0013557 |
| [25] | Jiang YF, Morgan-Kiss RM, Campbell JW, Chan CH, Cronan JE. Expression of Vibrio harveyi acyl-ACP synthetase allows efficient entry of exogenous fatty acids into the Escherichia coli fatty acid and lipid a synthetic pathways. Biochemistry, 2010, 49(4): 718-726. DOI:10.1021/bi901890a |
