唐欢宇1,2,3, 任海燕1,2,3, 吴宗福1,2,3

 , 陆承平1,2,3
, 陆承平1,2,3 1.南京农业大学动物医学院, 江苏 南京 210095;
2.农业部动物细菌学重点实验室, 江苏 南京 210095;
3.世界动物卫生组织猪链球菌病参考实验室, 江苏 南京 210095
收稿日期:2016-06-02;修回日期:2016-12-06;网络出版日期:2016-12-23
基金项目:留学回国人员科研启动基金(第46批,南京农业大学,吴宗福);国家自然科学基金面上项目(31572544);公益性行业(农业)科研专项“猪链球菌病防控技术研究与示范”(201303041);江苏高校优势学科建设工程资助项目(PAPD)
*通信作者:吴宗福, Tel/Fax:+86-25-84398606; E-mail: wuzongfu@njau.edu.cn
摘要: [目的]除了猪链球菌2型外,猪链球菌9型(SS9)也是目前流行血清型,同时也是人畜共患病原菌。前期研究发现,DNA核酸酶(SsnA)存在于SS9毒力株中,在SS9无毒株中不存在。为明确SsnA对SS9毒力的影响,本研究构建ssnA缺失株ΔssnA,并研究其生物学功能。[方法]用穿梭质粒pSET-4s构建ΔssnA,并通过斑马鱼毒力试验、HEp-2细胞黏附、猪全血存活和酶活检测等试验,评价SsnA对SS9毒力的影响。[结果]斑马鱼毒力试验显示,ΔssnA对斑马鱼毒力显著降低,半数致死量是野生株的11.2倍;ΔssnA对HEp-2细胞的黏附率为野生株的60.61%;ΔssnA在猪全血中的存活率为野生株的71.88%;酶活试验表明,SsnA可降解线性和环状DNA。[结论]本研究表明SS9 SsnA具有降解线性和环状DNA能力,该基因缺失后细菌对斑马鱼毒力、黏附HEp-2细胞能力、在猪全血中存活及分解DNA能力都显著降低,证实SsnA是SS9的一个毒力因子。
关键词: 猪链球菌9型 DNA核酸酶 毒力因子
Relationship between DNA nuclease and the virulence of Streptococcus suis serotype 9
Huanyu Tang1,2,3, Haiyan Ren1,2,3, Zongfu Wu1,2,3

 , Chengping Lu1,2,3
, Chengping Lu1,2,3 1.College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
2.Key Laboratory of Animal Bacteriology, Ministry of Agriculture, Nanjing 210095, Jiangsu Province, China;
3.OIE Reference Laboratory for Swine Streptococcosis, Nanjing 210095, Jiangsu Province, China
Received 02 June 2016; Revised 06 December 2016; Published online 23 December 2016
*Corresponding author: Zongfu Wu, Tel/Fax:+86-25-84398606; E-mail: wuzongfu@njau.edu.cn
Supported by the Scientific Research Foundation for the Returned Overseas Chinese Scholars (Zongfu Wu, Nanjing Agricultural University), by the National Natural Science Foundation of China (31572544), by the Special Fund for Public Welfare Industry of Chinese MoA (201303041) and by the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD)
Abstract: [Objective]In addition to Streptococcus suis serotype 2, Streptococcus suis serotype 9 (SS9) is also a currently prevalent serotype and a zoonotic pathogen. In our previous study, SS9 DNA nuclease (SsnA) was considered as a candidate virulence factor. To clarify the impact of SsnA on SS9 virulence, we constructed ssnA mutant (ΔssnA) and studied its biological functions.[Methods]We evaluated the virulence of wild type strain and ΔssnA in a zebrafish infection model and compared the adherence rate to HEp-2 cells, the survival rate in pig blood, and enzymatic activity between wild type stain and ΔssnA.[Results]In a zebrafish infection experiment, the 50% lethal dose value of ΔssnA was 11.2-fold higher than that of wild type strain. The adherence rate of ΔssnA to HEp-2 cells was only 60.61% of the wild strain level. The survival rate of ΔssnA in pig blood was declined to 71.88% of wild strain level. The enzymatic activity assay showed that SsnA can degrade both linear and circular DNA.[Conclusion]SsnA contributes to SS9 virulence in a zebrafish infection model, the adherence to HEp-2 cells, and the survival in pig blood. SsnA is indeed an essential virulence factor for SS9.
Key words: Streptococcus suis serotype 9 DNA nuclease virulence factor
猪链球菌 (Streptococcus suis) 是一种重要的人畜共患病原菌,可导致猪的脑膜炎、心内膜炎、关节炎、败血症等多种疾病[1]。根据荚膜多糖抗原性的不同,猪链球菌可分为33个血清型和部分未定型菌株,其中猪链球菌2型 (SS2) 流行最广,对人和猪的致病力最强[1]。除了SS2以外,猪链球菌9型 (SS9) 也是一个流行血清型,在中国、澳大利亚、荷兰、比利时和德国等国家分离率较高[2-5]。最新研究表明,SS9也可感染人致病[6]。目前,对猪链球菌毒力因子的研究主要集中在SS2,对SS9毒力因子的研究相对较少。
在革兰氏阳性致病菌金黄色葡萄球菌和化脓链球菌中,DNA核酸酶 (SsnA) 是重要的毒力因子。金黄色葡萄球菌DNA核酸酶通过降解中性粒细胞胞外陷阱 (Neutrophil extracellular traps,NETs) 中的DNA,从而抵抗中性粒细胞清除[7]。化脓链球菌DNA核酸酶不仅可以降解NETs的DNA,抵抗中性粒细胞清除[8],还可以抑制TLR9介导的天然免疫防御和吞噬细胞的杀菌能力[9]。本课题组前期比较蛋白组学发现猪链球菌SsnA存在于SS9毒力株GZ0565中,而在SS9无毒株中不存在,提示SsnA可能是SS9的毒力因子[5]。为明确SsnA对SS9毒力的影响,本研究构建SS9毒力株GZ0565 ssnA无痕缺失株,并比较野生株与缺失株在对斑马鱼毒力、HEp-2细胞黏附、猪全血存活及DNA核酸酶活性等方面的差异,从而为更好阐明SsnA功能、了解SS9致病机制和防控该类疫病提供理论依据。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒和培养条件: 猪链球菌9型GZ0565株于2005年在中国广州分离自患脑膜炎病猪[3, 5]。本研究用到的DH5α和BL21 (DE3) 感受态购自南京诺唯赞生物科技有限公司。构建缺失株所用的质粒pSET-4s由日本动物健康国家研究所Daisuke Takamatsu博士馈赠,质粒详细信息及图谱详见参考文献[10]。HEp-2细胞 (ATCC CCL23) 购自美国典型培养物保藏中心 (ATCC)。除特殊标注外,所有的猪链球菌均在37 ℃条件下,培养于THB液体或平板;大肠杆菌在37 ℃条件下培养于LB液体或平板。壮观霉素在需要条件下添加,培养猪链球菌时,壮观霉素终浓度为100 μg/mL,培养大肠杆菌时,壮观霉素终浓度为50 μg/mL,氨苄青霉素终浓度为100 μg/mL。:
1.1.2 主要试剂和仪器: THB购自美国BD公司;限制性内切酶、Premix、T4连接酶、片段回收试剂盒购自TaKaRa生物工程公司;提质粒试剂盒、胶回收试剂盒以及提基因组试剂盒购自Omega公司;绵羊血、抗生素购自北京鼎国生物技术有限公司;RPMI-1640细胞培养液、胰酶等细胞培养相关试剂购自Hyclone公司;THY培养基为添加了5%酵母浸出物的THB。凝胶成像、紫外分光光度计、电击杯、电穿孔仪购自Bio-Rad公司。: 1.2 ssnA缺失质粒的构建 以GZ0565基因组DNA为模板,用引物ssnA-A、ssnA-B和ssnA-C、ssnA-D (表 1),分别扩增ssnA基因的上、下游同源臂ssnA-AB和ssnA-CD片段;以胶回收的PCR产物为模板,ssnA-A、ssnA-D为引物进行融合PCR,扩增ssnA-AD片段;将胶回收的ssnA-AD片段与提取的pSET-4s质粒用Hind Ⅲ和EcoR Ⅰ于37 ℃进行双酶切;酶切片段经片段与质粒连接后转化DH5α感受态,次日挑单菌落进行菌液PCR鉴定;阳性菌落进一步提质粒进行双酶切鉴定,同时送上海桑尼进行测序;测序正确质粒pSET4s-ssnA电转GZ0565感受态,以构建ssnA基因缺失菌株;感受态的制备参照Takamatsu等报道的方法[11]。
表 1. 本研究用到的引物 Table 1. Primers used in this study
| Primers | Sequences (5'→3')a | Restriction sites | Sizes/bp |
| ssnA-A | ATATGCAAGCTTTCAACCCTGCCATGTACCTGCAC | Hind Ⅲ | 1015 |
| ssnA-B | ATGGAAGAGAGAACGGTTTCTAA | ||
| ssnA-C | TTAGAAACCGTTCTCTCTTCCATTGCCTTGTCAAAAAACAAAAA | 1010 | |
| ssnA-D | ATATGCGAATTCTTCCACATCACCAATCATGAA | EcoR Ⅰ | |
| ssnA-X | ACCAGATGGACGAGTCCTACAA | 2274 | |
| ssnA-Y | CATTTCCATAACGACCAGACCT | ||
| ssnA-F | TCTTGTCACTATCGCAGGACG | 464 | |
| ssnA-R | CTGGTCCAGCGATACGACCGGTG | ||
| rssnA-up | GAGTCAGGATCCACAACAACCATTATCCCAAATGATGA | BamH Ⅰ | 1266 |
| rssnA-down | ATACAGGAGCTCTTAGGATTCTTTTTGTTTTTTGACAAGGCAGGTG | Sac Ⅰ | |
| aUnderlined sequences are introduced restriction sites. | |||
表选项
1.3 无痕缺失株的筛选 缺失株的筛选参照Takamatsu等[11]方法:将电转阳性菌落划壮观霉素抗性THB平板,28 ℃培养过夜;挑单菌落,37 ℃,加壮观霉素条件下静置培养于THB培养基至浑浊,划壮观霉素抗性平板;挑单菌落,37 ℃,180 r/min,加壮观霉素THB液体传3代;划THB壮观霉素抗性平板,37 ℃培养过夜;挑单菌落于THB液体,28 ℃,180 r/min,不添加抗生素条件下培养于THB液体,传5-10代;传至第5代,取1 mL细菌,10倍比稀释至103,取100 μL细菌稀释液分别涂壮观霉素抗性平板和无抗性平板;观察2个平板菌落数是否有显著差异,若差异显著,则表明有可能发生同源重组;将无抗性平板上的菌落划线有壮观霉素抗性和无壮观霉素抗性的THB平板,28 ℃培养24 h;挑取在无抗性平板上生长,在壮观霉素抗性平板上不生长的菌株用引物ssnA-X、ssnA-Y和引物ssnA-F、ssnA-R同时进行菌液PCR鉴定筛选;最后用引物ssnA-X、ssnA-Y进行PCR测序。
1.4 截短SsnA (rSsnA) 的表达纯化及兔抗血清的制备 以GZ0565基因组为模板,用引物rssnA-up和rssnA-down扩增截短的ssnA基因片段;PCR反应产物经DNA回收试剂盒回收后,与表达载体pET-32a连接,转化DH5α大肠杆菌感受态细胞,获得重组表达质粒pET-32a-rssnA;将含有pET-32a-rssnA质粒的BL21 (DE3) 菌液以1:100的比例接种于含100 μg/mL氨苄青霉素抗性的LB培养基中,37 ℃摇床180 r/min培养至OD600=0.4时,加入异丙基-β-D-半乳糖苷 (IPTG) 至终浓度为0.1 mmol/L;继续37 ℃摇床180 r/min培养4 h后,经PBS (pH 7.4) 洗2遍,用上清溶解缓冲液 (磷酸钠20 mmol/L、氯化钠500 mmol/L、咪唑30 mmol/L) 重悬菌体;菌体超声波裂解 (250 W,5 s,间隔10 s,总共30 min) 后,4 ℃、12000 r/min离心5 min,分别取上清和沉淀进行SDS-PAGE电泳检测蛋白表达情况。
使用GE Healthcare公司的HisTrap Purification Kit纯化rSsnA融合蛋白,具体方法参照说明书。将纯化后rSsnA背部皮下多点注射免疫新西兰大白兔,0.5 mL纯化的重组蛋白rSsnA (200 μg) 混合0.5 mL弗氏完全佐剂首次免疫,14 d后用0.5 mL纯化的重组蛋白rssnA (200 μg) 混合0.5 mL弗氏不完全佐剂二次免疫,28 d后用0.5 mL纯化的重组蛋白rssnA (200 μg) 混合0.5 mL弗氏不完全佐剂三次免疫。首次免疫前耳缘静脉采血作为阴性血清,三免后14 d心脏采血,ELISA测定抗体效价。
1.5 Western blot检测SsnA Western blot方法参照我们前期发表的文章[12];取1 mL培养至OD600=1的野生株和ΔssnA的菌液,13000 r/min离心2 min,用SDS-PAGE上样缓冲液稀释至0.01 OD/μL,100 ℃水浴10 min使蛋白变性;取10 μL蛋白样品经12% SDS-PAGE电泳后转移至PVDF膜 (GE Healthcare),用含5%脱脂奶的TBST (含0.05% Tween 20的PBS) 37 ℃封闭2 h;根据Tanon TM High-sig ECL Western Blotting化学发光试剂盒 (上海天能) 说明,以兔抗rSsnA血清为一抗 (1:1000稀释),HRP标记的羊抗兔IgG抗体 (北京鼎国,1:5000稀释) 作为二抗,使用Tanon 5100化学发光仪 (上海天能) 捕捉信号。
1.6 斑马鱼毒力试验 斑马鱼毒力试验参照我们前期发表的文章[5, 13-14]。AB纯系斑马鱼,饲养1 w确认健康之后进行毒力试验。野生株GZ0565、缺失株ΔssnA分别在THB血平板上复苏,复苏菌株经斑马鱼复壮后进行攻毒。挑经斑马鱼复壮单菌落过夜培养,第2天早上1:100转接THB液体,37 ℃,180 r/min,培养至OD600=0.6;各取适量菌液,8000 r/min,5 min,4 ℃,经PBS洗2次后,用PBS重悬细菌,并用PBS将细菌分别稀释至104、105、106和107活菌数/mL,用于攻毒试验;取一部分细菌进行倍比稀释,涂THB平板进行计数,以确认斑马鱼体内实际注射的细菌数。斑马鱼随机分成9组,15只/组,其中8组分别经腹腔注射野生株和缺失株不同稀释度细菌悬液,另外一组注射PBS做空白对照;斑马鱼在注射前用90 mg/L甲磺酸三卡因 (MS-222) 进行麻醉;细菌接种后于28 ℃温箱培养,连续观察1 w记录斑马鱼死亡情况,按Reed-Muench法计算半数致死量LD50。
1.7 HEp-2细胞黏附试验 野生株GZ0565、缺失株ΔssnA分别在THB血平板复苏,复苏菌株经斑马鱼复壮后进行该试验,参照我们前期发表的文章[15];挑单菌落过夜培养,第2天早上1:100转接THB液体,37 ℃,180 r/min,培养至OD600=0.6;取1 mL细菌,8000 r/min,5 min,4 ℃,PBS洗2次;用不含血清的RPMI-1640细胞培养基将细菌调整至5×107活菌数/mL;取一部分细菌悬液进行倍比稀释,涂THB固体平板,以确认加入细胞中的实际细菌数;HEp-2细胞稳定培养1 w后,试验前一天晚上铺24孔板,每个细胞孔中加入约1×106个细胞,37 ℃,5% CO2培养过夜,至细胞长满70%-80%;细胞用不含血清的RPMI-1640洗2次,5 min/次;加入1 mL不含血清的RPMI-1640细菌悬液,每株菌做3个重复,800×g,25 ℃离心15 min,37 ℃孵育2 h;细胞板用1 mL PBS洗5次,5 min/次;PBS弃去,加入100 μL胰酶,37 ℃,作用10 min;待细胞消化下来,加入900 μL无菌的ddH2O迅速吹打终止胰酶消化;取100 μL进行倍比稀释,涂THB平板,37 ℃,24 h,计数。同时设不加细胞的阴性对照,比较野生株与缺失株黏附在细胞板的数量。试验重复3次,用非配对t检验做统计学分析。
1.8 猪全血存活试验 猪全血存活试验参照我们前期发表的文章,采集经ELISA检测猪链球菌抗体为阴性的健康猪血液[14]。野生株GZ0565、缺失株ΔssnA经血平板复苏后,挑单菌落过夜培养,第2天早上1:100转接THB液体;37 ℃,180 r/min,培养至OD600=0.6;取1 mL细菌,8000 r/min,5 min,4 ℃,PBS洗1次;用适量PBS重悬细菌,使细菌量达到5×106活菌数/mL;取一部分菌液进行倍比稀释,以确认加入血液中的细菌数;另取200 μL细菌悬液与2 mL新鲜血液混匀,37 ℃,每隔15 min上下颠倒混匀,1 h后取100 μL全血培养物进行倍比稀释,涂THB平板计数,以确认细菌在猪血中的存活率,试验重复3次,用非配对t检验做统计学分析。
1.9 DNA核酸酶活性检测 DNA核酸酶活性检测参照Nicole de Buhr等的方法[16]。野生株GZ0565、缺失株ΔssnA经THB血平板复苏;挑单菌落过夜培养,第2天1:100转接,37 ℃,180 r/min,培养至OD600=0.6;取1.5 mL,8000 r/min,4 ℃,5 min,THB洗2次,最后用适量体积液体将细菌重悬,细菌浓度控制在OD600=1.8;在比较菌株GZ0565和缺失株ΔssnA对DNA降解程度的试验中,20 μL THB细菌悬液添加40 μL SsnA缓冲液1 (300 mmol/L Tris-HCl pH 7.5,3 mmol/L CaCl2,3 mmol/L MgCl2) 和适量DNA (λDNA的终浓度为40 ng/μL,细菌基因组DNA的终浓度为32.5 ng/μL),用THB将终体积补至100 μL,于37 ℃作用24 h;DNA降解程度通过1%的琼脂糖凝胶电泳确定。
为了探讨DNA核酸酶在细菌降解宿主DNA产生脱氧腺苷中的作用,比较了野生株GZ0565和ΔssnA降解λDNA产生磷酸根的含量;细菌的处理与DNA核酸酶活性检测相同,用20 μL SsnA缓冲液2 (100 mmol/L Tris-HCl pH 7.5,1 mmol/L CaCl2,1 mmol/L MgCl2) 重悬细菌后添加40 μL SsnA缓冲液1和4 μg λ DNA,用SsnA缓冲液2将终体积补至100μL,于37 ℃作用24 h。细菌降解DNA产生磷酸根的含量通过试剂盒Quanti-Chrom Phosphate Assay Kit (BioAssay Systems) 进行检测,具体的操作参照说明书进行:以上反应液,10000 r/min,离心5 min;取上清,用试剂盒中的空白对照液体稀释至合适的浓度;取50 μL加入96孔板,另取50 μL阳性对照液和空白对照液加入96孔板;各反应孔中加入100 μL反应液,轻轻混匀,室温作用30 min;用酶标仪检测OD620,(1 mg/dL磷酸根等于105.3 μmol/L) 根据说明书公式计算产生的磷酸根的含量,数据用非配对t检验做统计学分析。
2 结果 2.1 ssnA缺失菌株的构建和鉴定 用引物ssnA-A、ssnA-B和ssnA-C、ssnA-D,分别扩增ssnA基因的上、下游同源臂AB和CD片段,经PCR融合后,与pSET-4s质粒相连。缺失质粒经PCR和酶切鉴定,融合片段大小2025 bp,表明成功构建缺失质粒pSET4s-ssnA (图 1-A,B)。
 |
| 图 1. pSET4s-ssnA PCR以及酶切鉴定 Figure 1. PCR and restriction endonuclease confirmation of pSET4s-ssnA. A: PCR confirmation of pSET4s-ssnA. Lane 1: primers ssnA-A/ssnA-D, pSET4s-ssnA as template; lane 2: primers ssnA-A/ssnA-D, pSET4s as negative control; M: DNA marker DL5000. B: Restriction endonuclease analysis of recombinant plasmid pSET4s-ssnA. Lane 1: pSET4s-ssnA digested by Hind Ⅲ and EcoR Ⅰ; lane 2: pSET4s digested by Hind Ⅲ and EcoR Ⅰ as negative control; M: DNA marker DL5000. |
| 图选项 |
按照无痕缺失方法,将缺失质粒pSET4s-ssnA电转化GZ0565感受态细胞,挑选无痕缺失株。用引物ssnA-F/ssnA-R扩增ssnA基因内部片段,野生株GZ0565中可扩增出464 bp的片段,从缺失株中则不能扩增出该片段;用引物ssnA-X/ssnA-Y区分野生株和缺失株,在野生株GZ0565中能扩增出5334 bp的片段,从缺失株则扩增出2274 bp的片段 (图 2)。上述结果表明,ssnA缺失株ΔssnA成功构建。
 |
| 图 2. ΔssnA PCR鉴定 Figure 2. PCR confirmation of the deletion mutant △ssnA. Lane 1: primers ssnA-X/ssnA-Y, GZ0565; lane 2: primers ssnA-X/ssnA-Y, △ssnA; lane 3: primers ssnA-F/ssnA-R, GZ0565; lane 4: primers ssnA-F/ssnA-R, △ssnA; M: DNA marker DL5000. |
| 图选项 |
2.2 rSsnA的表达及Western blot检测SsnA 含有重组质粒pET-32a-rssnA的BL21 (DE3) 经IPTG诱导后4 h,样品处理后经SDS-PAGE电泳,如图 3所示,菌体表达了分子量为64 kDa左右的融合蛋白 (rSsnA分子量45.4 kDa加上pET-32a融合片段18 kDa),且融合蛋白主要表达在超声裂解上清中。
 |
| 图 3. SDS-PAGE检测rSsnA表达 Figure 3. The expression of rSsnA analyzed by SDS-PAGE. M: Protein molecular weight marker; lane 1: BL21 (DE3) containing pET-32a-rssnA without IPTG induction; lane 2: BL21 (DE3) containing pET-32a-rssnA with IPTG induction for 4 h; lane 3: the supernatant of BL21 (DE3) after sonication that contains pET-32a-rssnA with IPTG induction. |
| 图选项 |
将野生株GZ0565和ΔssnA全菌蛋白经SDS-PAGE并转至PVDF膜后,分别以兔抗rSsnA血清和免疫前的阴性血清作为一抗进行Western blot检测。如图 4-A所示,以兔抗rSsnA血清为一抗时,GZ0565在112 kDa处有明显条带 (SsnA全长为112 kDa),而ΔssnA未见相应条带;如图 4B所示,以免疫前的阴性血清作为一抗,GZ0565和ΔssnA均未见相应大小条带,证实缺失株不能表达SsnA。
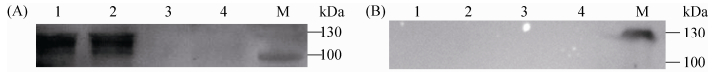 |
| 图 4. Western blot检测SsnA蛋白 Figure 4. Western blot analysis of SsnA expression. A: M: protein molecular weight marker; lane 1-2: wild type strain GZ0565 was probed with rabbit anti-rSsnA serum; lane 3-4: ΔssnA was probed with rabbit anti-rSsnA serum; B: M: protein molecular weight marker; lane 1-2: wild type strain GZ0565 was probed with rabbit serum before immunization; lane 3-4: ΔssnA was probed with rabbit serum before immunization. |
| 图选项 |
2.3 斑马鱼毒力试验 将野生株GZ0565和ΔssnA分别攻击斑马鱼,计算其LD50,结果如表 2所示,GZ0565对斑马鱼的LD50为1.75×105活菌数/尾,而ΔssnA对斑马鱼的LD50为1.96×106活菌数/尾,缺失株的LD50是野生株的11.2倍 (表 2),证实ssnA缺失后对斑马鱼毒力降低。
表 2. 斑马鱼毒力试验中GZ0565和ΔssnA LD50测定结果 Table 2. LD50of GZ0565 and ΔssnA in zebrafish model
| Dose of infection (CFU) | Mortality of mice | |||
| GZ0565 | ΔssnA | GZ0565 | ΔssnA | |
| 1.12×108 | 7.00×107 | 14/15 | 14/15 | |
| 1.12×107 | 7.00×106 | 14/15 | 12/15 | |
| 1.12×106 | 7.00×105 | 11/15 | 4/15 | |
| 1.12×105 | 7.00×104 | 3/15 | 1/14 | |
| LD50 | 1.75×105 | 1.96×106 | ||
表选项
2.4 HEp-2细胞黏附试验 HEp-2细胞是评价猪链球菌黏附宿主细胞的较好体外模型[17]。为探究SsnA对SS9黏附宿主细胞能力的影响,比较了野生株GZ0565和ΔssnA对HEp-2细胞的黏附能力。与野生株相比,ΔssnA对HEp-2细胞的黏附能力极显著下降 (P < 0.01),仅为野生株的60.61% (图 5);同时设不加细胞的阴性对照,野生株与缺失株黏附在细胞板的数量活菌数无显著差异。
 |
| 图 5. GZ0565和ΔssnA对HEp-2细胞的黏附率 Figure 5. The adherence rate of wild type strain GZ0565 and ΔssnA to HEp-2 cells. The adherence rate of ΔssnA was only 60.61%±6.65% (Mean±SD) of wild type level. **P < 0.01. |
| 图选项 |
2.5 猪全血存活试验 要引起宿主致病,猪链球菌首先必须要能在血液中存活[18]。为探讨SsnA对SS9在猪血液中的存活能力的影响,比较了野生株GZ0565和ΔssnA在猪全血中的存活。如图 6所示,ssnA缺失后,缺失株在血液中的存活能力极显著下降 (P < 0.01),仅为野生株的71.88%。
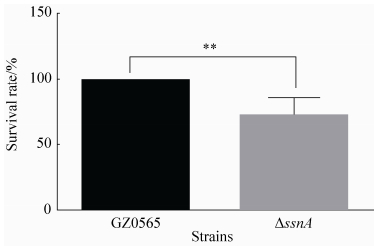 |
| 图 6. GZ0565和ΔssnA在猪全血中的存活率 Figure 6. Survival rate of GZ0565 and ΔssnA in pig blood. The survival rate of ΔssnA in pig blood was only 71.88%±6.76% (Mean±SD) of wild type level. **P < 0.01. |
| 图选项 |
2.6 DNA酶活性的检测 为证实SS9 SsnA降解DNA活性,分别以线性DNA (λ DNA) 和环状DNA (GZ0565基因组DNA) 为底物,比较野生株和ΔssnA降解DNA能力。如图 7所示,与野生株GZ0565相比,ΔssnA降解DNA的能力明显降低。有研究表明,金黄色葡萄球菌DNA核酸酶降解宿主DNA,进而核苷酸酶进一步降解产生脱氧腺苷和磷酸根,产生的脱氧腺苷介导巨噬细胞凋亡,促进细菌在体内增殖,可通过检测磷酸根的量判定产生脱氧腺苷的水平[19]。通过检测磷酸根的浓度,比较野生株和ΔssnA降解DNA产生脱氧腺苷的水平。如表 3所示,与野生株相比,ΔssnA降解DNA产生磷酸根含量极显著降低 (P < 0.0001),提示产生更少的脱氧腺苷。
 |
| 图 7. GZ0565和ΔssnA降解DNA试验 Figure 7. Electrophoretic analysis of DNA degradation by strain GZ0565 and ΔssnA. Lane 1: Control GZ0565 genome DNA; lane 2: GZ0565 genome DNA+strain GZ0565; lane 3: GZ0565 genome DNA+strain ΔssnA; lane 4: Control λ DNA; lane 5: λ DNA+strain GZ0565; lane 6: λ DNA+strain ΔssnA; M: DNA Marker DL5000. |
| 图选项 |
表 3. 细菌降解λ DNA产生磷酸根的能力 Table 3. Ability of bacteria to produce Pi by degrading λ DNA
| Strains | Average of total concentration of Pi (μmol/L) | Bacteria added (CFU/mL) | Ability of bacteria to produce Pi (nmol/min/108cells) |
| GZ0565 | 107.0 | 1.31×109 | 0.272 |
| ΔssnA | 39.0 | 8.05×108 | 0.161 |
表选项
3 讨论 Fontaine等已经确定SsnA分泌于SS2上清中,证明从内在器官中分离的菌株与表达该酶具有正相关,但并未对其功能进行深入研究[20]。Nicole de Buhr等通过体外实验 (in vitro) 证实SS2 SsnA能够有效降解中性粒细胞胞外陷阱 (Neutrophil extracellular traps,NETs)[16],但并未通过动物实验证实其对细菌毒力的影响。虽然Haas等通过转座子插入方法筛选SS2 ssnA突变株,突变株对阿米巴毒力降低[21],但转座子存在多位点插入的可能,除了ssnA基因外,可能还存在其他基因的突变。
本研究通过无痕缺失方法,成功构建ssnA无痕缺失株。通过体内外等一系列实验,证实SsnA是SS9毒力因子,且ssnA缺失后细菌黏附HEp-2细胞、在猪全血中存活及分解DNA能力显著降低。金黄色葡萄球菌在感染宿主的过程中,DNA核酸酶降解NETs中DNA,进而核苷酸酶进一步降解产生脱氧腺苷和磷酸根,产生脱氧腺苷介导巨噬细胞凋亡,促进细菌在体内增殖[19]。本实验首次证实猪链球SsnA也可促进细菌降解DNA产生磷酸根,提示产生更多的脱氧腺苷。是否猪链球菌SsnA也能参与细菌介导宿主免疫细胞凋亡,促进细菌在体内增殖,值得后续深入研究。
参考文献
| [1] | Gottschalk M, Segura M. The pathogenesis of the meningitis caused by Streptococcus suis: the unresolved questions.Veterinary Microbiology, 2000, 76(3): 259–272DOI:10.1016/S0378-1135(00)00250-9. |
| [2] | Allgaier A, Goethe R, Wisselink HJ, Smith HE, Valentin-Weigand P. Relatedness of Streptococcus suis isolates of various serotypes and clinical backgrounds as evaluated by macrorestriction analysis and expression of potential virulence traits.Journal of Clinical Microbiology, 2001, 39(2): 445–453DOI:10.1128/JCM.39.2.445-453.2001. |
| [3] | Yu WL, Li CL, Wang GP, Lu CP. Pathogenic characteristics of Streptococcus suis type 2 and type 9 isolated from Guangdong province.Veterinary Science in China, 2007, 37(8): 650–654(in Chinese).余炜烈, 李春玲, 王贵平, 陆承平. 猪链球菌2型和9型广东分离株的病原特性.中国兽医科学, 2007, 37(8): 650–654. |
| [4] | Tang F, Pan ZH, Li DZ, Ma L, Xiong Y, Lu CP. Isolation and characterization of a Streptococcus suis serotype 9 from a wild cat.Acta Microbiologica Sinica, 2016, 56(2): 275–282(in Chinese).汤芳, 潘子豪, 李德志, 马琳, 熊毅, 陆承平. 一株分离自流浪猫的猪链球菌9型的分子生物学鉴定.微生物学报, 2016, 56(2): 275–282. |
| [5] | Wu ZF, Zhang W, Lu CP. Comparative proteome analysis of secreted proteins of Streptococcus suis serotype 9 isolates from diseased and healthy pigs.Microbial Pathogenesis, 2008, 45(3): 159–166DOI:10.1016/j.micpath.2008.04.009. |
| [6] | Kerdsin A, Hatrongjit R, Gottschalk M, Takeuchi D, Hamada S, Akeda Y, Oishi K. Emergence of Streptococcus suis serotype 9 infection in humans. Journal of Microbiology, Immunology and Infection, doi: 10.1016/j.jmii.2015.06.011. |
| [7] | Berends ETM, Horswill AR, Haste NM, Monestier M, Nizet V, von K?ckritz-Blickwede M. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps.Journal of Innate Immunity, 2010, 2(6): 576–586DOI:10.1159/000319909. |
| [8] | Buchanan JT, Simpson AJ, Aziz RK, Liu GY, Kristian SA, Kotb M, Feramisco J, Nizet V. DNase expression allows the pathogen group A Streptococcus to escape killing in neutrophil extracellular traps.Current Biology, 2006, 16(4): 396–400DOI:10.1016/j.cub.2005.12.039. |
| [9] | Uchiyama S, Andreoni F, Schuepbach RA, Nizet V, Zinkernagel AS. DNase sda1 allows invasive M1T1 group A Streptococcus to prevent TLR9-dependent recognition.PLoS Pathogens, 2012, 8(6): e1002736DOI:10.1371/journal.ppat.1002736. |
| [10] | Takamatsu D, Osaki M, Sekizaki T. Thermosensitive suicide vectors for gene replacement in Streptococcus suis.Plasmid, 2001, 46(2): 140–148DOI:10.1006/plas.2001.1532. |
| [11] | Takamatsu D, Osaki M, Sekizaki T. Construction and characterization of Streptococcus suis-Escherichia coli shuttle cloning vectors.Plasmid, 2001, 45(2): 101–113DOI:10.1006/plas.2000.1510. |
| [12] | Wu ZF, Shao J, Ren HY, Tang HY, Zhou MY, Dai J, Lai LY, Yao HC, Fan HJ, Chen D, Zong J, Lu CP. A Streptococcus suis LysM domain surface protein contributes to bacterial virulence.Veterinary Microbiology, 2016, 187: 64–69DOI:10.1016/j.vetmic.2016.03.017. |
| [13] | Ju CX, Gu HW, Lu CP. Characterization and functional analysis of atl, a novel gene encoding autolysin in Streptococcus suis.Journal of Bacteriology, 2012, 194(6): 1464–1473DOI:10.1128/JB.06231-11. |
| [14] | Wu ZF, Wu CY, Shao J, Zhu ZZ, Wang WX, Zhang WW, Tang M, Pei N, Fan HJ, Li JG, Yao HC, Gu HW, Xu X, Lu CP. The Streptococcus suis transcriptional landscape reveals adaptation mechanisms in pig blood and cerebrospinal fluid.RNA, 2014, 20(6): 882–898DOI:10.1261/rna.041822.113. |
| [15] | Shao J, Zhang W, Wu ZF, Lu CP. The truncated major pilin subunit sbp2 of the srtBCD pilus cluster still contributes to Streptococcus suis pathogenesis in the absence of pilus shaft.Current Microbiology, 2014, 69(5): 703–707DOI:10.1007/s00284-014-0642-4. |
| [16] | de Buhr N, Neumann A, Jerjomiceva N, von K?ckritz-Blickwede M, Baums CG. Streptococcus suis DNase SsnA contributes to degradation of neutrophil extracellular traps (NETs) and evasion of NET-mediated antimicrobial activity.Microbiology, 2014, 160(Pt 2): 385–395. |
| [17] | Li JQ, Tan C, Zhou Y, Fu SL, Hu LL, Hu J, Chen HC, Bei WC. The two-component regulatory system CiaRH contributes to the virulence of Streptococcus suis 2.Veterinary Microbiology, 2011, 148(1): 99–104DOI:10.1016/j.vetmic.2010.08.005. |
| [18] | Chabot-Roy G, Willson P, Segura M, Lacouture S, Gottschalk M. Phagocytosis and killing of Streptococcus suis by porcine neutrophils.Microbial Pathogenesis, 2006, 41(1): 21–32DOI:10.1016/j.micpath.2006.04.001. |
| [19] | Thammavongsa V, Missiakas DM, Schneewind O. Staphylococcus aureus degrades neutrophil extracellular traps to promote immune cell death.Science, 2013, 342(6160): 863–866DOI:10.1126/science.1242255. |
| [20] | Fontaine MC, Perez-Casal J, Willson PJ. Investigation of a novel DNase of Streptococcus suis serotype 2.Infection and Immunity, 2004, 72(2): 774–781DOI:10.1128/IAI.72.2.774-781.2004. |
| [21] | Haas B, Bonifait L, Vaillancourt K, Charette SJ, Gottschalk M, Grenier D. Characterization of DNase activity and gene in Streptococcus suis and evidence for a role as virulence factor.BMC Research Notes, 2014, 7: 424DOI:10.1186/1756-0500-7-424. |
