常宇慧, 张洪峰, 彭忠, 李慧, 陈焕春, 吴斌


农业微生物学国家重点实验室, 生猪健康养殖协同创新中心, 华中农业大学动物科学技术学院、动物医学院, 湖北 武汉 430070
收稿日期:2016-06-30;修回日期:2016-09-16;网络出版日期:2016-10-26
基金项目:中博合作项目(720107-107012)
*通信作者:吴斌,Tel/Fax:+86-27-87287201;E-mail:wub@mail.hzau.edu.cn
摘要: [目的]构建猪支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)Ⅵ型分泌系统(T6SS)溶血素共调节蛋白hcp基因缺失株,并对其基本生物学特性进行初步的研究。[方法]使用自杀性质粒介导同源重组的方法敲除猪支气管败血波氏杆菌QH0814菌株hcp基因,并比较hcp基因缺失前后,菌体对细胞的黏附入侵、小鼠毒力及组织载菌量上的差异。[结果]成功构建支气管败血波氏杆菌hcp基因缺失株QH0814Δhcp,连续传50代且遗传稳定;缺失株与亲本株生长无明显差异;缺失株的黏附能力与亲本株差异不显著,但入侵能力显著降低(P<0.05);与亲本株相比,半数致死量提高,同时,缺失株对昆明鼠的感染能力也显著降低(P<0.05)。[结论]hcp基因的缺失对支气管败血波氏杆菌增殖无影响,但缺失后其入侵能力和定殖能力显著降低,由此推测hcp基因与支气管败血波氏杆菌的入侵和定殖相关。
关键词: 支气管败血波氏杆菌 hcp基因 缺失
Construction and characterization of an hcp mutant of swine Bordetella bronchiseptica
Chang Yuhui, Zhang Hongfeng, Peng Zhong, Li Hui, Chen Huanchun, Wu Bin


State Key Laboratory of Agricultural Microbiology, the Cooperative Innovation Center for Sustainable Pig Productin, College of Veterinary Medicine, Huazhong Agricultural University, Wuhan 430070, Hubei Province, China
Received 30 June 2016; Revised 16 September 2016; Published online 26 October 2016
*Corresponding author: Tel/Fax: +86-27-87287201;E-mail:wub@mail.hzau.edu.cn
Supported by the Zhongbo Cooperative Project(720107-107012)
Abstract: [Objective] We constructed Bordetella bronchiseptica QH0814 hcp mutant to characterize its pathogenicity.[Methods] Through the homologous recombination mediated by a suicide plasmid pRE112, we acquired the mutant QH0814Δhcp successfully. Then, we evaluated the growth condition, the ability of adhesion and invasion, the median lethal dose (LD50) and the infection capacity.[Results] There was no significant variation of the growth rate between the mutant and the parental strain. Compared with the parental strain, the adherence ability of the mutant did not change remarkably. However, the invasion ability decreased significantly. Mice lethal test showed that the LD50 of the mutant was higher than that of the parental strain. Correspondingly, the bacterial colonization of the mutant in mice blood, lung and liver was much less than that of the parental strain.[Conclusion] The knocking-out of the hcp gene had no influence on bacterial growth, but it could attenuate significantly the invasion and colonization of the bacterium. Therefore, the gene may play a role in the pathogenesis of Bordetella bronchiseptica.
Key words: Bordetella bronchiseptica hcp gene deletion
猪支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)是存在于猪呼吸道中的1种重要革兰氏阴性病原菌,可引起猪肺炎和猪萎缩性鼻炎(Atrophic rhinitis,AR),也是猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)的重要致病因子之一,且易与其它多种病原微生物发生混合感染,增加猪群呼吸道疾病的发病率和复杂程度,给养猪业带来了一定的经济损失[1-3]。
六型分泌系统(Type Ⅵsecretion systems,T6SS)是广泛存在于大多数革兰氏阴性病原菌中的一种蛋白分泌系统,是一个固定于胞质中且跨越内膜、周质、外膜的管状结构复合体,结构上类似于可收缩的噬菌体尾部注射器样结构[4]。T6SS的功能是转运相关的效应因子到靶细胞内或者直接释放于外环境中发挥作用。溶血素共调节蛋白(Hemolysin-coregulated protein,Hcp)是T6SS复合体中重要的管道结构蛋白,也可作为效应蛋白发挥一定的生物学效应,是功能性T6SS的标识[5]。
有研究表明,hcp基因与细菌的致病性有一定的关系[6-8],然而目前未见到hcp基因在猪支气管波氏杆菌中的相关性报道,因此,本研究通过使用自杀性质粒介导同源重组的方法结合负向筛选技术[9],成功构建了无任何外源基因插入的支气管败血波氏杆菌hcp基因缺失株QH0814Δhcp,并对其生长特性、黏附入侵能力及对小鼠的致病力进行了研究,为hcp基因在猪支气管败血波氏杆菌致病过程中的作用奠定了基础。
1 材料和方法 1.1 菌株、质粒、试剂和动物 猪支气管败血波氏杆菌QH0814由本实验室分离鉴定并保存。自杀性质粒pRE112(Cmr)及其宿主菌大肠杆菌x7213由美国华盛顿大学Dr. Roy Curtiss Ⅲ教授惠赠,本实验室保存。大肠杆菌在LB (Luria-Bertani)培养基、猪支气管败血波氏杆菌在TSA (胰蛋白胨大豆琼脂培养基)或TSB (胰蛋白胨大豆肉汤培养基)中加入血清(终浓度5%-10%)在37 °C中培养。5周龄的雌性无特定病原菌(SPF级)昆明鼠购自湖北省疾病预防控制中心。DNA聚合酶(Ex Taq)、DNA连接酶(T4)、各种限制性内切酶、dNTPs等均购自大连宝生物(TaKaRa)工程有限公司。
1.2 引物设计与合成 参照GenBank公布全基因组序列的支气管败血波氏杆菌标准菌株RB50 (登录号:NC_002927.3)的hcp基因序列设计扩增引物(表 1),并由武汉金开瑞生物工程有限公司合成。
表 1. 本研究使用的引物 Table 1. Primers used in this study
| Primers | Sequences (5′→3′) | Size/bp |
| A1 | TGCGGTACCTGACCAAGATCTTCACCAATAC | 926 |
| A2 | CGCGGATCCATCAACAGCCACTTGCTTTCTC | |
| B1 | CGCGGATCCCCGAACACGTATTCATGCAG | 876 |
| B2 | TAAGAGCTCAGGTTGACCGTGTTGAGCAG | |
| C1 | CTGGATCATGAACTACGTCGAC | Mutant 425 |
| C2 | AGCCAGCTGGAAAAGTTGC | Parental strain 893 |
表选项
1.3 支气管败血波氏杆菌hcp基因缺失株的构建 使用引物A1/A2及B1/B2分别扩增hcp基因上游(926 bp)和下游(876 bp)片段,PCR反应体系如下:dH2O 17.5 μL,10×Ex缓冲液2.5 μL,dNTPs 0.5 μL,引物各1 μL,Ex Taq酶0.5 μL,模板2 μL。反应条件:94 °C 10 min;94 °C 45 s,57 °C 45 s,72 °C 1 min,25个循环;72 °C 5 min,4 °C保存。上、下游PCR产物分别使用KpnⅠ/BamHⅠ、BamHⅠ/SacⅠ双酶切后,与pBluescript ⅡSK(+)连接构建pSK-Δhcp质粒。使用KpnⅠ/SacⅠ酶切pSK-Δhcp质粒及pRE112自杀性质粒,构建重组自杀性质粒pRE-Δhcp。参考文献[10]的方法,以含有质粒pRE-Δhcp的大肠杆菌X7213为供体,QH0814为受体进行接合转移,最后使用C1/C2引物PCR鉴定阳性接合子,随后将其不断无抗性传代,直至筛选出Cm敏感的克隆,继续使用C1/C2引物确认。
1.4 hcp基因缺失株遗传稳定性及生长曲线的测定 缺失株连续传50代,每隔5代使用PCR鉴定其遗传稳定性。将菌株接种TSB培养到OD600为0.6时,以1∶1000转接到新鲜的TSB培养基中继续培养,每2 h取样测OD600值绘制生长曲线。
1.5 细胞黏附与入侵实验 为探究hcp基因缺失后是否影响菌株对细胞的黏附入侵能力。参考文献[11]的方法,将缺失株和亲本株以感染复数(multiplicity of infection,MOI)=100分别感染PK-15细胞,置于37 °C 5% CO2培养箱作用2 h。黏附组每孔加入0.1%胰酶200 μL室温作用5 min,裂解细胞后平板计数法进行细菌计数;入侵组使用含有100 U/mL青霉素和0.1 mg/mL链霉素的无菌磷酸缓冲液1 mL作用45 min后,无菌PBS洗3次。用预冷的无菌ddH2O使细胞膨胀破碎,将获得的液体稀释一定的倍数涂板计数。
1.6 小鼠半数致死量(LD50)的测定 25只5周龄昆明鼠随机分为5组,分别以 108 CFU、107 CFU、106 CFU、105 CFU的梯度、200 μL剂量腹腔注射攻毒。观察2周,记录小鼠死亡情况,采用寇氏(Korbor)法计算半数致死量(LD50)。同样的方法计算亲本株的LD50。
1.7 小鼠组织载菌量实验 10只5周龄昆明鼠随机分为2组,每只小鼠腹腔注射200 μL 106 CFU,48 h后采血、取肝脏、肺脏匀浆倍比稀释涂平板计数。
1.8 统计学分析 各试验组之间的差异显著程度通过统计软件Prism (Graph-Pad Software,Inc.)进行分析。P<0.05表示差异显著,图标中以“*”表示。用P<0.01为差异极显著,图标中以“**”表示。
2 结果和分析 2.1 hcp基因缺失株鉴定 接合转移后使用引物C1/C2进行PCR鉴定,亲本株只能扩增得到900 bp条带,而阳性单交换子可以同时扩增得到900 bp和500 bp两条片段。在无抗性传代筛选后,目的缺失株只能扩增得到500 bp条带(图 1)。
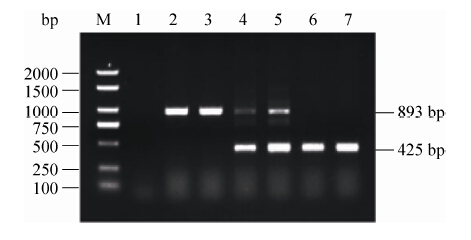 |
| 图 1. 亲本株、单交换子和缺失株PCR鉴定 Figure 1. PCR identification of parental strain,single of commutator,mutant. lane |
| 图选项 |
2.2 缺失株遗传稳定性和生长曲线的测定 连续传50代后都只能扩增得到500 bp条带,结果表明缺失株具有一定的遗传稳定性。缺失株与亲本株生长曲线无明显变化,说明体外培养条件下,hcp基因对本身细菌生长代谢无影响(图 2)。
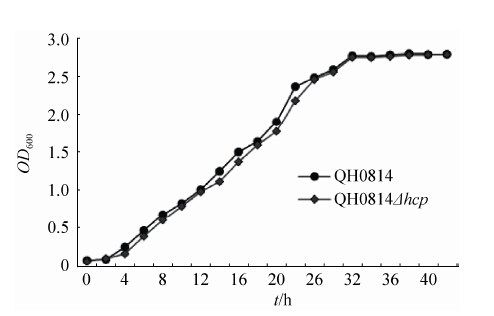 |
| 图 2. 缺失株和亲本株生长曲线 Figure 2. The growth curves of mutant and parental strain. |
| 图选项 |
2.3 细胞黏附与入侵实验 经测定每孔中亲本株的黏附平均量和入侵平均量分别为57333 CFU、2767 CFU;缺失株的黏附平均量和入侵平均量分别为51667 CFU、2300 CFU。实验结果(图 3)以亲本株对PK-15的黏附率和入侵率为基准,即定义为100%进行展示。缺失株的相对黏附率为90.12%,缺失株的黏附能力并无显著降低;缺失株的相对入侵率为83.12%,缺失株对PK-15的入侵能力显著降低(P<0.05)。
 |
| 图 3. 缺失株和亲本株的黏附入侵实验 Figure 3. The adherence and invasion assays of mutant and parental strain. P<0.05. |
| 图选项 |
2.4 小鼠半数致死量(LD50)的测定 经寇氏(Korbor)法计算得到,亲本株对小鼠的LD50为1.6×107 CFU,而缺失株的LD50为3.1×107 CFU,缺失株的半数致死量较亲本株提高,毒力减弱(表 2)。
表 2. 缺失株和亲本株LD50的测定 Table 2. LD50 of mutant and parental strain
| Group | CFU Per mouse/(1×106) | Mortality | LD50/(CFU) | ||||||||||
| parental strain | 370 | 40 | 7.1 | 2.0 | 0.37 | 5/5 | 4/5 | 3/5 | 1/5 | 0/5 | 1.6×107 | ||
| mutant | 340 | 42 | 7.0 | 2.3 | 0.40 | 5/5 | 3/5 | 2/5 | 0/5 | 0/5 | 3.1×107 | ||
表选项
2.5 小鼠组织载菌量实验 结果以每毫升血液和每克器官中所含菌量(CFU)的对数为纵坐标进行展示。在血液中,亲本株lg(CFU/mL)平均值为4.53,缺失株为3.89。在肺脏中,亲本株的lg(CFU/g)平均值为5.49,缺失株为4.62。在肝脏中,亲本株的lg(CFU/g)平均值为3.09,缺失株为2.55 (图 4)。可知,缺失株感染小鼠后在血液、肺脏和肝脏中的细菌量均低于亲本株(P<0.05),其中,缺失株在肺脏中的定殖能力极显著下降(P<0.01)。
 |
| 图 4. 小鼠体内组织载菌量 Figure 4. Colonization ability in different tissues of mice. |
| 图选项 |
3 讨论 本研究使用的基因敲除方法是由自杀性质粒介导的两步同源重组,此法结合了反向筛选,即先将含有筛选标记(氯霉素抗性基因)的质粒整合到细菌基因组上,再用反向选择标记(SacB)筛选缺失株,最后得到的缺失株是不含有任何外源基因和筛选标记的菌株。本研究成功的敲除了QH0814菌株hcp基因,获得QH0814Δhcp缺失株并对其
基本的生物学特性进行研究,为进一步研究该基因的功能奠定了基础。
目前有报道对大肠杆菌、沙门氏菌、铜绿假单胞杆菌等病原菌hcp基因研究发现,hcp基因参与细菌的侵袭、致病性等[12-14]。对缺失株生长特性研究发现,hcp基因缺失并不影响QH0814的生长,说明hcp基因不参与细菌的生长代谢。连续传50代,缺失株QH0814Δhcp仍具有良好的遗传稳定性,未发生恢复突变。缺失株对PK-15的黏附能力虽无明显改变,但入侵能力差异显著(P<0.05),由此表明QH0814Δhcp对非吞噬细胞侵袭能力减弱,hcp基因可能参与黏附入侵或者导致分泌相关的黏附入侵蛋白降低[15]。对LD50的测定表明,基因缺失后菌株毒力有所下降。缺失株在小鼠血液、肺脏和肝脏中的定殖菌量均少于亲本株,且差异显著(P<0.05),其中在肺脏中的定殖能力下降极显著(P<0.01),说明hcp基因缺失后对小鼠组织器官的定殖能力减弱。
综上所述,本研究构建了支气管波氏杆菌hcp基因缺失株QH0814Δhcp,对缺失株的生长特性、对细胞的侵袭性、对小鼠的毒力和对机体的定殖情况等进行研究,初步表明hcp对Bb的致病性发挥了一定作用,主要参与对机体的入侵定殖及感染等,由此可知细菌的hcp基因与致病性有一定的相关。
参考文献
| [1] | Goodnow RA. Biology of Bordetella bronchiseptica.Microbiological Reviews, 1980, 44(4): 722–738. |
| [2] | Hibrand-Saint Oyant L, Bourges D, Chevaleyre C, Raze D, Locht C, Salmon H. Role of Bordetella bronchiseptica adenylate cyclase in nasal colonization and in development of local and systemic immune responses in piglets.Veterinary Research, 2005, 36(1): 63–77DOI:10.1051/vetres:2004056. |
| [3] | García-de-la-Fuente C, Guzmán L, Cano ME, Agüero J, Sanjuán C, Rodríguez C, Aguirre A, Martínez-Martínez L. Microbiological and clinical aspects of respiratory infections associated with Bordetella bronchiseptica.Diagnostic Microbiology and Infectious Disease, 2015, 82(1): 20–25DOI:10.1016/j.diagmicrobio.2015.01.011. |
| [4] | Cascales E, Cambillau C. Structural biology of type VI secretion systems.Philosophical Transactions of the Royal Society of London B:Biological Sciences, 2012, 367(1592): 1102–1111DOI:10.1098/rstb.2011.0209. |
| [5] | Ruiz FM, Santillana E, Spínola-Amilibia M, Torreira E, Culebras E, Romero A. Crystal structure of Hcp from Acinetobacter baumannii:a component of the type VI secretion system.PLoS One, 2015, 10(6). |
| [6] | Zhou Y, Tao J, Yu H, Ni JJ, Zeng LB, Teng QH, Kim KS, Zhao GP, Guo XK, Yao YF. Hcp family proteins secreted via the type VI secretion system coordinately regulate Escherichia coli K1 interaction with human brain microvascular endothelial cells.Infection and Immunity, 2012, 80(3): 1243–1251DOI:10.1128/IAI.05994-11. |
| [7] | Wu HY, Chung PC, Shih HW, Wen SR, Lai EM. Secretome analysis uncovers an Hcp-family protein secreted via a type VI secretion system in Agrobacterium tumefaciens.Journal of Bacteriology, 2008, 190(8): 2841–2850DOI:10.1128/JB.01775-07. |
| [8] | Wang SH, Dai JJ, Meng QM, Han XG, Han Y, Zhao YC, Yang DH, Ding C, Yu SQ. DotU expression is highly induced during in vivo infection and responsible for virulence and Hcp1 secretion in avian pathogenic Escherichia coli.Frontiers in Microbiology, 2014, 5: 588. |
| [9] | Zhang Q, Hu RM, Hu JY, He H, Tang XB, Jin ML, Chen HC, Wu B. aroA deleted Bordetella bronchiseptica inspiring robust mucosal immune response and provide full protection against intranasal challenge.Research in Veterinary Science, 2013, 94(1): 55–61DOI:10.1016/j.rvsc.2012.07.019. |
| [10] | Edwards RA, Keller LH, Schifferli DM. Improved allelic exchange vectors and their use to analyze 987P fimbria gene expression.Gene, 1998, 207(2): 149–157DOI:10.1016/S0378-1119(97)00619-7. |
| [11] | ZhuGe XK, Wang SH, Fan HJ, Pan ZH, Ren JL, Yi L, Meng QM, Yang XQ, Lu CP, Dai JJ. Characterization and functional analysis of AatB, a novel autotransporter adhesin and virulence factor of avian pathogenic Escherichia coli.Infection and Immunity, 2013, 81(7): 2437–2447DOI:10.1128/IAI.00102-13. |
| [12] | Corcionivoschi N, Gundogdu O, Moran L, Kelly C, Scates P, Stef L, Cean A, Wren B, Dorrell N, Madden RH. Virulence characteristics of hcp+ Campylobacter jejuni and Campylobacter coli isolates from retail chicken.Gut Pathogens, 2015, 7: 20DOI:10.1186/s13099-015-0067-z. |
| [13] | Ho BT, Dong TG, Mekalanos JJ. A view to a kill:the bacterial type VI secretion system.Cell Host & Microbe, 2014, 15(1): 9–21. |
| [14] | Leung KY, Siame BA, Snowball H, Mok YK. Type VI secretion regulation:crosstalk and intracellular communication.Current Opinion in Microbiology, 2011, 14(1): 9–15DOI:10.1016/j.mib.2010.09.017. |
| [15] | Yu Y, Yang H, Li J, Zhang PP, Wu BB, Zhu BL, Zhang Y, Fang WH. Putative type VI secretion systems of Vibrio parahaemolyticus contribute to adhesion to cultured cell monolayers.Archives of Microbiology, 2012, 194(10): 827–835DOI:10.1007/s00203-012-0816-z. |
