朱峰, 肖圣燕, 张永红, 邵榆岚, 唐芬芬, 陈世良, 白兴荣


云南省农业科学院蚕桑蜜蜂研究所, 云南 蒙自 661101
收稿日期:2017-01-05;修回日期:2017-02-14;网络出版日期:2017-02-20
基金项目:国家自然科学基金(31560675);云南省农业科学院蚕桑蜜蜂研究所青年创新基金(QC2015001)
*通信作者:白兴荣, E-mail:bxrong3@163.com
摘要:[目的]在无任何外界凋亡因素诱导条件下,探究家蚕微孢子虫感染对家蚕卵巢细胞-BmN凋亡的影响,以及凋亡蛋白抑制因子IAPs实相表达的变化情况。[方法]显微镜下观察家蚕微孢子虫感染BmN细胞后不同时间段宿主细胞的变化情况,以及利用荧光定量PCR方法检测家蚕促凋亡基因——细胞色素C (BmCyt c)表达水平的变化,随后检索家蚕基因组与蛋白质家族数据库搜寻家蚕凋亡蛋白抑制因子IAPs基因信息,并通过荧光定量PCR方法对这些基因的实相表达情况进行定量分析。[结果]家蚕微孢子虫感染BmN细胞的前5 d,细胞状态未见明显变化。感染后7 d,BmN细胞的生长受到了一定程度的影响。第12天时,对照组中几乎所有细胞出现空泡化或细胞死亡的现象,而感染家蚕微孢子虫的BmN细胞未见空泡的出现,并且大量细胞形态完整,细胞核清晰可见。同时,BmCyt c基因的表达几乎一直处于被抑制状态,特别是感染后的第10天与第12天,该基因的表达量显著性降低(P < 0.01)。通过数据库检索共得到4个家蚕凋亡蛋白抑制因子:BmIAP-1、BmIAP-2、BmSurvivin-1与BmSurvivin-2。荧光定量PCR结果表明:BmIAP-1和BmSurvivin-1基因在感染后期(10 d与12 d)表达量有上升趋势,尤其是感染后的12 d,表达量显著上升(P < 0.01)。然而,BmIAP-2与BmSurvivin-2基因的表达在大多数时间段均处于下调状态。[结论]当无任何外界凋亡因素诱导条件下,家蚕微孢子虫感染BmN细胞后可影响宿主细胞的生长,并可抑制细胞的正常生理凋亡。依据荧光定量PCR结果,我们推测在家蚕微孢子虫感染BmN细胞时,BmIAP-1和BmSurvivin-1蛋白可能在调节细胞凋亡的过程中起一定作用。
关键词: 家蚕卵巢细胞 家蚕微孢子虫 细胞凋亡 家蚕凋亡蛋白抑制因子 荧光定量PCR
Effect of Nosema bombycis on apoptosis of BmN cells and expression level of BmIAPs
Feng Zhu, Shengyan Xiao, Yonghong Zhang, Yulan Shao, Fenfen Tang, Shiliang Chen, Xingrong Bai


Institute of Sericulture and Apiculture, Yunnan Academy of Agricultural Sciences, Mengzi 661101, Yunnan Province, China
Received 5 January 2017; Revised 14 February 2017; Published online 20 February 2017
*Corresponding author: Xingrong Bai, E-mail:bxrong3@163.com
Supported by the National Natural Science Foundation of China (31560675) and by the Youth Innovative Foundation of Institute of Sericulture and Apiculture, Yunnan Academy of Agricultural Sciences (QC2015001)
Abstract: [Objective]To study the effect of Nosema bombycis on the apoptosis of BmN cells and the expression level of BmIAPs under the condition without external apoptosis-inducing factor.[Methods]We observed the change of BmN cells at different times by using microscope after inoculation with N. bombycis. The relative expression level of BmCyt c in the N. bombycis infected BmN cells was detected by using real-time PCR. We searched databases of silkworm genome and Pfam finding information of Bombyx mori inhibitor of apoptosis proteins (BmIAPs). Real-time PCR was used to demonstrate the relative expression level of BmIAPs in N. bombycis infected BmN cells.[Results]Compared with the normal BmN cells, BmN cells infected by N. bombycis had no obviously change at 5 d post-inoculation. The growth of BmN cells was influenced by N. bombycis at 7 d post-inoculation. The vacuolization and apoptosis were found in most BmN cells at 12 d. However, the phenomenon was not found in N. bombycis infected BmN cells. Moreover, the relative expression level of BmCyt c was suppressed in N. bombycis infected BmN cells at most of the time, except for 7 d. The expression of BmCyt c was lowest compared with control groups (P < 0.01) at 10 d and 12 d post-inoculation. Through searching the databases, we obtained four BmIAPs, including BmIAP-1, BmIAP-2, BmSurvivin-1 and BmSurvivin-2. The results of real-time PCR indicated that the relative expression level of BmIAP-1 and BmSurvivin-1 had up-regulating tendency at 10 d and 12d post-inoculation, especially at 12 d post-inoculation. But, BmIAP-2 and BmSurvivin-2 had down-regulated expression at most times.[Conclusion]Under the condition without external apoptosis-inducing factor, growth and apoptosis of BmN cells can be influenced by N. bombycis. According to the results of real-time PCR, we speculated that BmIAP-1 and BmSurvivin-1 may play a certain role in regulating the apoptosis of BmN cells infected by N. bombycis.
Key words: BmN cells Nosema bombycis apoptosis Bombyx mori inhibitor of apoptosis proteins real-time PCR
家蚕(Bombyx mori)作为一种经济昆虫,在人类经济生活与文化历史上均有重要地位。我国有5000多年的养蚕历史,是一个名副其实的养蚕大国,也是目前世界上最大的蚕茧生产国。微粒子病由家蚕微孢子虫(Nosema bombycis)感染家蚕而引起,具有水平传播和垂直传播等特点。微粒子病作为蚕桑产业生产中的重要疫病,一直是蚕种生产和家蚕大面积饲养中的重大安全隐患。因此,家蚕微孢子虫作为蚕种检疫中的唯一检测对象而被重视,对家蚕微孢子虫的侵染分子机制以及与宿主的互作研究也一直是热点课题。
作为专营细胞内寄生的病原生物,微孢子虫侵染宿主细胞后,为能够充分利用宿主细胞的能量系统不断繁殖出子代孢子,必然通过一定机制对宿主细胞循环与凋亡过程进行调节,使其有利于微孢子虫自身的生存与繁衍。研究报道,3种脑炎微孢子虫属微孢子虫(兔脑炎微孢子虫Encephalitozoon cuniculi,海伦脑炎微孢子虫Encephalitozoon hellem和肠脑炎微孢子虫Encephalitozoon intestinalis)感染非洲绿猴肾细胞后,可通过抑制半胱天冬蛋白酶3 (caspase-3)活化以及抑癌基因p53磷酸化与入核作用,来抑制宿主细胞发生凋亡[1]。此外,具有活性的兔脑炎微孢子虫可显著降低经星孢菌素(Staurosporine)诱导的人巨噬细胞的凋亡比例[2]。Scanlon等[3]报道,在按蚊微孢子虫(Brachiola algerae)感染细胞后,存在于线粒体外膜的凋亡抑制因子Bcl-2与促凋亡因子Bax蛋白的含量比值为1.14,暗示按蚊微孢子虫可能通过促进Bcl-2或者抑制Bax的表达来抑制宿主细胞的凋亡。
2001年研究工作者从家蚕卵巢细胞BmN中,克隆获得家蚕凋亡蛋白抑制因子(Bombyx mori inhibitor of apoptosis protein,BmIAP-1),并发现BmIAP-1能够有效抑制由Bax诱导的细胞凋亡[4]。近期研究发现,家蚕微孢子虫可抑制由放线菌素D (Actinomycin D,ActD)诱导的BmN细胞的凋亡[5]。细胞凋亡是细胞程序性死亡(Programmed cell death, PCD)的一种,细胞发生凋亡时,通过一系列凋亡相关基因的激活、表达和调控导致细胞在形态和生理方面发生明显变化。细胞凋亡除参与器官发育过程、维持体内动态平衡、清除被损坏的细胞成分、阻止一些细胞毒素或抗原物质向周围组织渗漏等过程外,还在免疫系统中具有重要的防御病原微生物(病毒、细菌、寄生虫等)的功能。然而,目前有关微孢子虫侵染与宿主细胞凋亡相互关系的研究依然较少。本研究旨在未经任何外界凋亡因素诱导条件下,观察家蚕微孢子虫感染对BmN细胞凋亡的影响,并通过荧光定量PCR方法研究家蚕微孢子虫感染后BmN细胞相关IAPs基因的实相表达特征。希望通过本研究,能进一步了解家蚕微孢子虫侵染对宿主细胞凋亡的影响,并为探索微孢子虫的感染机制奠定一定的基础。
1 材料和方法 1.1 主要试剂和仪器 TC-100干粉购自美国AppliChem公司;Gibco胎牛血清与TRIzol?Reagent购自美国Invitrogen公司;PrimeScript? RT reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒与SYBR? Premix Ex Taq? II (Tli RNaseH Plus)荧光定量试剂盒购自宝生物工程(大连)有限公司。主要仪器包括:IX71倒置显微镜(日本OLYMPUS);梯度PCR仪(美国BIO-RAD);StepOne Plus荧光定量PCR仪(美国ABI);高速冷冻离心机(德国Sigma);双光束紫外/可见光核酸蛋白分析仪(美国Thermo Fisher Scientific)。
1.2 菌株与细胞株
1.2.1 菌株: 家蚕微孢子虫CQ1(Nosema bombycis CQ1,中国兽医微生物菌种保藏管理中心CVCC No. 102059)由西南大学周泽扬教授惠赠并由本实验室保存与扩繁。
1.2.2 细胞株: 家蚕卵巢细胞BmN由云南省农业科学院蚕桑蜜蜂研究所家蚕病虫害研究室保存。
1.3 BmN细胞的培养 BmN细胞用TC-100培养基(终浓度:22.09 g/L)含10% (V/V) Gibco胎牛血清,于生化培养箱27 ℃培养,2-3 d换液1次,5-6 d转瓶。
1.4 BmN细胞的感染实验 参照文献[6]对家蚕微孢子虫进行纯化。将纯化后的家蚕微孢子虫加入新鲜细胞培养基,48 h后观察,细胞培养基若无细菌或真菌污染情况,计算纯化孢子的浓度,用于细胞感染实验[7]。取3.0×108个纯化的家蚕微孢子虫孢子用0.2 mol/L的KOH溶液室温处理40 min后,5000 r/min离心1 min,弃上清,用200 μL细胞培养基重悬后,立即加入用25 cm2细胞培养瓶培养的细胞中,27 ℃恒温培养。家蚕微孢子虫感染BmN细胞1、3、5、7、10与12 d后,在倒置显微镜下进行观察拍照并收集细胞。同时,以无菌水处理的BmN细胞为对照组。将收集的BmN细胞保存于-80 ℃超低温冰箱,用于后续总RNA的提取。
1.5 家蚕凋亡蛋白抑制因子IAPs基因的检索与分析 杆状病毒IAP重复序列结构域(Baculoviral inhibitors of apoptosis repeat,BIR)是凋亡蛋白抑制因子的重要组成单元。检索家蚕基因组数据库(http://silkworm.genomics.org.cn/)与蛋白质家族数据库Pfam (http://pfam.xfam.org/)获得家蚕凋亡蛋白抑制因子基因数据,并在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行比对分析。利用在线结构域预测软件SMART (http://smart.embl-heidelberg.de/)进行结构域分析与确认。
1.6 荧光定量PCR引物的设计与合成 针对上述检索获得的家蚕凋亡蛋白抑制因子IAPs基因以及家蚕细胞色素C基因序列(GenBank No. XM_004931724),利用Primer Premier 5.0软件设计特异性引物,见表 1所示。以家蚕肌动蛋白(Actin3, GenBank No. U49854.1)作为内参基因设计引物A3F/A3R。引物序列由生工生物工程(上海)股份有限公司合成。
表 1. 荧光定量PCR反应所用引物 Table 1. The used primers of real-time qRT-PCR
| Primer names | Primers (5′→3′) | Genes | Product sizes/bp |
| BmIAP1-F | TCCTCGTGTGAGTCTTCAACGA | BmIAP-1 | 227 |
| BmIAP1-R | GCACAGCACACTTCGTCGCC | ||
| BmIAP2-F | CCCCAATACAGTCACCACCAGA | BmIAP-2 | 276 |
| BmIAP2-R | CGTCACAGTAGAAACAGCGAACC | ||
| BmSurvivin1-F | ATGGACCTCCTAAATCCGTATCTG | BmSurvivin-1 | 201 |
| BmSurvivin1-R | TGGTATGCTTCGGGTGCTATCT | ||
| BmSurvivin2-F | GTAACGTGCGAAATATGGCAGA | BmSurvivin-2 | 173 |
| BmSurvivin2-R | GAGTTGTACAAATGCGCACTGA | ||
| BmCyt cF | TCATACTCCGATGCCAATA | BmCytochrome c | 152 |
| BmCyt cR | TAGGCAATAAGGTCAGCAC | ||
| A3F | CCGTATGCAAAAGGAAATCA | Actin3 | 126 |
| A3R | TTGGAAGGTAGAGAGGGAGG |
表选项
1.7 BmN细胞总RNA的提取与反转录 取1.4中-80 ℃超低温冰箱保存备用的BmN细胞,根据TRIzol?Reagent试剂盒说明书提取RNA,获得的总RNA使用双光束紫外/可见光核酸蛋白分析仪检测RNA样品的浓度(μg/μL)和纯度(OD260/OD280)。用PrimeScript? RT reagent Kit with gDNA Eraser反转录试剂盒中的gDNA Eraser消化处理去除基因组DNA的污染,随后将RNA反转录成cDNA,获得的cDNA置于-20 ℃备用。
1.8 荧光定量PCR检测与数据分析 以上述获得的cDNA为模板,采用SYBR? Green方法进行荧光定量PCR检测。20 μL反应体系为:2×SYBR? Premix Ex TaqⅡ 10 μL,上下游引物(10 μmol/L)各0.4 μL,ROX Reference Dye 0.4 μL,稀释后cDNA模板2.0 μL,用无菌RNA free H2O补足至20 μL。反应条件:95℃预变性5 min;95℃变性15 s,68℃退火30 s,共40个循环。扩增后用2-ΔΔCt法[8]对得到的结果数据进行相对定量分析,并以SPSS进行统计差异显著性分析检验。其中ΔΔCt= (CtBmIAPs or BmCyt c -CtActin3)处理-(CtBmIAPs or BmCyt c -CtActin3)对照,式中CtBmIAPs、CtBmCyt c、CtActin3分别代表靶标基因BmIAPs、BmCyt c、内参基因Actin3在实时荧光定量PCR反应过程中扩增的Ct值。试验设置3个重复。
2 结果和分析 2.1 家蚕微孢子虫感染对BmN细胞的影响 与对照组相比,家蚕微孢子虫感染BmN细胞的前5 d (1 d、3 d与5 d)其细胞状态未见明显变化,结果见图 1-A。当感染后第7天,BmN细胞的生长受到了一定程度的影响。如图 1-B所示,在第7天的正常细胞中出现了细胞聚集现象,且较实验组细胞密度较大,这一现象在第10天的更为明显。与此同时,被感染BmN细胞内的家蚕微孢子虫大量增殖(图 1-B红色方框所示)。第12天时,对照组中几乎所有细胞出现空泡化或细胞死亡的现象(图 2-A,红色箭头所示)。而感染家蚕微孢子虫的BmN细胞未见空泡的出现,并且大量细胞形态完整,细胞核清晰可见(图 1-B与图 2-B)。同时检测了促凋亡基因——家蚕细胞色素C(Bombyx mori Cytochrome c,BmCyt c)基因的表达量变化(图 3),发现除感染后第7天,BmN细胞接种家蚕微孢子虫后该基因的表达几乎一直处于被抑制状态,相对表达量分别是对照组的0.5倍、0.6倍、0.7倍、1.4倍、0.4倍与0.3倍(1 d、3 d、5 d、7 d、10 d与12 d),如图 3-A所示。特别是感染后的第10天与第12天(图 3-B),实验组BmCyt c基因的表达量显著性降低(P < 0.01)。结果进一步表明,家蚕微孢子虫感染可以抑制宿主BmN细胞的凋亡。
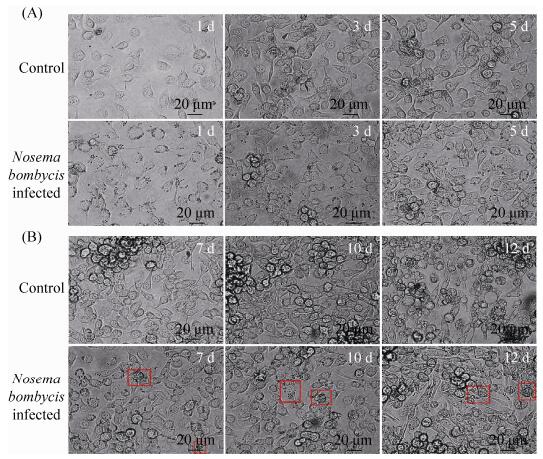 |
| 图 1 家蚕微孢子虫感染BmN细胞的观察(×400倍) Figure 1 Observation of the BmN cells infected by Nosema bombycis (×400). A: The BmN cells infected by Nosema bombycis at 1 d, 3 d and 5 d post-inoculation, and the normal BmN cells at 1 d, 3 d and 5 d; B: The BmN cells infected by Nosema bombycis at 7 d, 10 d and 12 d post-inoculation, and the normal BmN cells at 7 d, 10 d and 12 d. The infected BmN cells by Nosema bombycis indicated by the red box. Scale = 20 μm. |
| 图选项 |
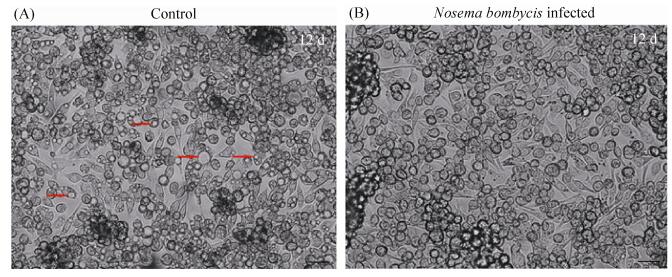 |
| 图 2 家蚕微孢子虫感染后12 d对BmN细胞的影响(×200倍) Figure 2 The influence of Nosema bombycis on the BmN cells after 12 d post-inoculation. A: The normal BmN cells at 12 d; B: The BmN cells infected by Nosema bombycis at 12 d post-inoculation. The red arrows indicate the apoptotic BmN cells. Scale=20 μm. |
| 图选项 |
 |
| 图 3 BmN细胞感染家蚕微孢子虫后家蚕细胞色素C基因相对转录水平的变化情况 Figure 3 The relative expression level of BmCyt c in the BmN cells infected by Nosema bombycis. A: Single histogram; B: Double histogram. The data were analyzed using Student's t test. P-values are 0.0522, 0.3262, 0.4103, 0.6591, 0.001 and 0.0001, at 1; 3, 5, 7, 10 and 12 d post-inoculation, respectively. *P < 0.05, **P < 0.01. |
| 图选项 |
2.2 家蚕凋亡蛋白抑制因子IAPs基因的检索结果与结构域分析
2.2.1 基因鉴定: 从家蚕基因组数据库与蛋白质家族数据库中共检索到4个家蚕凋亡蛋白抑制因子相关基因(表 2),将它们的氨基酸序列在NCBI数据库中进行BLASTp比对,比对出4个家蚕凋亡蛋白抑制因子IAPs基因编码的氨基酸序列,GenBank登录号见表 2所示。
表 2. 家蚕凋亡蛋白抑制因子IAPs基因检索结果 Table 2. The search results of Bombyx mori inhibitor of apoptosis proteins.
| Name | SilkDB ID | GenBank No. | Gene length/bp | Protein length/aa | The numbers of BIR domain |
| BmIAP-1 | BGIBMGA011524 | XP_012551315 | 1041 | 386 | 2 |
| BmIAP-2 | BGIBMGA011523 | NP_001189458 | 1686 | 561 | 3 |
| BmSurvivin-1 | BGIBMGA005071 | NP_001243911 | 12711 | 4236 | 1 |
| BmSurvivin-2 | BGIBMGA003946 | ADM32525.1 | 411 | 136 | 1 |
表选项
2.2.2 结构域分析: 利用SMART软件分析结果表明:BmIAP-1含有2个杆状病毒IAP重复序列结构域-BIR和1个RING锌指结构;BmIAP-2含有3个BIR结构域和1个RING锌指结构;BmSurvivin-1含有1个BIR结构域和1个泛素连接酶E2催化结构域(Ubiquitin-conjugating enzyme E2,catalytic domain,UBCc);而BmSurvivin-2仅含有1个BIR结构域(图 4)。
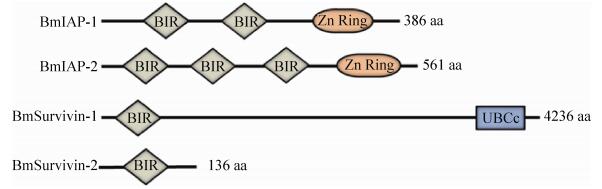 |
| 图 4 家蚕凋亡蛋白抑制因子结构示意图 Figure 4 Schematic diagram of Bombyx mori inhibitor of apoptosis proteins. |
| 图选项 |
2.3 家蚕微孢子虫感染对BmN细胞凋亡蛋白抑制因子IAPs基因表达的影响 利用荧光定量PCR对家蚕微孢子虫感染BmN细胞后BmIAP-1、BmIAP-2、BmSurvivin-1与BmSurvivin-2基因的实相转录情况进行了定量分析(图 5),显著性分析结果见表 3所示。由图 5-A可以看出,BmIAP-1基因在家蚕微孢子虫感染后的1、5、7、10与12 d呈上调趋势,其相对表达水平分别是对照组的1.7倍、1.1倍、1.6倍、1.4倍与2.1倍。由图 5-C可以看出,BmSurvivin-1基因在家蚕微孢子虫感染后的前4个时间段(1 d、3 d、5 d与7 d),其表达水平受到了抑制。而在感染后的10 d与12 d表达水平呈上调趋势,尤其是感染后的12 d,其相对表达水平分别是对照组的4.2倍。由图 5-B和4-C可以看出,BmIAP-2与BmSurvivin-2基因的表达情况,在大多数时间段均处于下调状态。特别是BmSurvivin-2基因,与1 d的对照组相比,其表达水平一直处于被抑制状态(1 d、3 d、5 d、7 d、10 d与12 d),分别是1 d对照组相对表达量的0.6倍、0.6倍、0.4倍、0.5倍、0.6倍与0.9倍。总体而言,4个家蚕凋亡蛋白抑制因子在家蚕微孢子虫感染宿主BmN细胞后,其基因表达水平呈不规则现象,未见持续性上调或下调趋势。分析可能原因,首先是基因自身的表达水平存在一定的波动性;其次是家蚕微孢子虫感染宿主细胞后的前期阶段,寄主与宿主之间存在着复杂的相互调控关系,一方极力抑制细胞凋亡来营造更好的寄生环境,一方极力促进细胞凋亡来对抗病原体的入侵。然而,基因表达水平出现波动性的具体原因仍需进一步探讨。
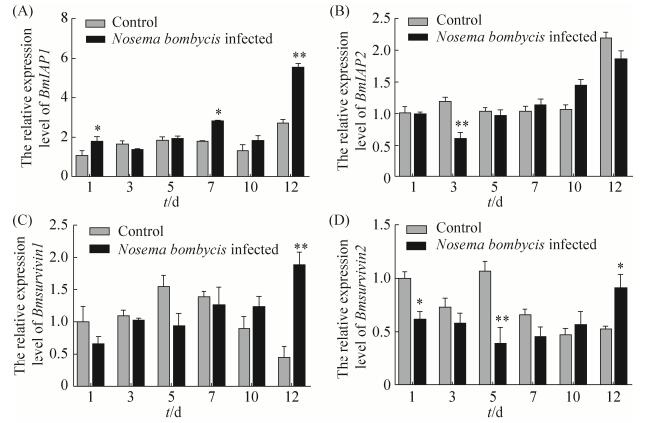 |
| 图 5 BmN细胞感染家蚕微孢子虫后家蚕蛋白凋亡抑制因子IAPs基因相对转录水平的变化情况 Figure 5 The relative expression level of IAPs genes in the BmN cells infected by Nosema bombycis. A: The relative expression level of BmIAP-1 in the N. bombycis infected BmN cells and control; B: The relative expression level of BmIAP-2 in the N. bombycis infected BmN cells and control; C: The relative expression level of BmSurvivin-1 in the N. bombycis infected BmN cells and control; D: The relative expression level of BmSurvivin-2 in the N. bombycis infected BmN cells and control. Vertical bars represent the mean±SE (n=3). The data were analyzed using Student's t test, *P < 0.05, **P < 0.01. |
| 图选项 |
表 3. 家蚕凋亡蛋白抑制因子IAPs基因相对表达量变化的差异显著性分析/P值 Table 3. Analysis on significant difference of the relative expression of Bombyx mori inhibitor of apoptosis proteins.
| t/d | BmIAP1 | BmIAP2 | BmSurvivin-1 | BmSurvivin-2 |
| 1 | 0.0246 | 0.8759 | 0.2663 | 0.0190 |
| 3 | 0.2536 | 0.0089 | 0.5284 | 0.3416 |
| 5 | 0.7420 | 0.5824 | 0.0923 | 0.0023 |
| 7 | 0.0345 | 0.4517 | 0.6981 | 0.1184 |
| 10 | 0.3067 | 0.0508 | 0.2658 | 0.5580 |
| 12 | 0.0008 | 0.1361 | 0.0065 | 0.0299 |
表选项
3 讨论 病原微生物感染机体后,可以启动或者抑制宿主细胞凋亡机制的发生,进而有利于自身在宿主机体内的传播,抑制或调解宿主的免疫反应,有利于病原在宿主细胞内的存活。微孢子虫作为一类专营细胞内寄生的真核生物,对宿主细胞的依赖性更为重要。深入了解微孢子虫与宿主细胞的分子和细胞作用机制,对深入研究微粒子病的发病机理、细胞凋亡的生物学过程,以及对探寻疾病防控的新方法都具有十分重要的帮助。本文通过细胞生物学观察与荧光定量PCR方法,初步探索了家蚕微孢子虫感染对家蚕BmN细胞凋亡以及凋亡蛋白抑制因子IAPs的影响。本研究实验结果发现,当无任何外界凋亡因素(如ActD、紫外线照射等)诱导条件下,家蚕微孢子虫感染BmN细胞后可影响细胞的正常生长和细胞空泡化。有研究表明,在多种细胞凋亡的过程中,细胞质都会出现空泡现象[9-11]。与此同时,家蚕促凋亡基因BmCyt c在家蚕微孢子虫感染后其表达水平几乎一直处于被抑制状态。特别是感染后的第10天与第12天,BmCyt c基因的表达量显著性降低(P < 0.01)。由此可见,家蚕微孢子虫可抑制宿主细胞BmN的正常生理凋亡,为自身在宿主细胞内的生长和增殖营造有利环境。He等[5]采用DNA ladder、流式细胞术以及ROS检测方法证明家蚕微孢子虫能够在一定程度上阻止因ActD诱导的BmN细胞凋亡发生。
细胞凋亡在多细胞生物的生理周期中起着十分重要的作用,宿主细胞可以表达凋亡基因,用来抵御病原微生物的感染,而病原微生物也可通过某些途径调节抑制宿主细胞的凋亡。IAPs为近年来发现的新一类细胞内凋亡抑制蛋白,在许多物种中广泛存在,包括病毒、真核生物、哺乳动物等[4, 12-14]。IAP家族分子,结构上具有同源性,功能上可起到延长宿主细胞寿命和生活周期的作用。通过数据库检索,我们在家蚕基因组中共找到4个IAP凋亡蛋白抑制因子(BmIAP-1、BmIAP-2、BmSurvivin-1与BmSurvivin-2),这一结果与之前的相关报道相一致[15]。研究表明,家蚕微孢子虫能够增强宿主抗凋亡基因buffy的表达,抑制促凋亡基因apaf-1、cyt c的表达[5]。荧光定量PCR的检测结果显示,家蚕微孢子虫感染BmN细胞后,家蚕凋亡蛋白抑制因子BmIAP-1和BmSurvivin-1基因在感染后期(10 d与12d)表达量有上升趋势,尤其是感染后的12 d,表达量显著上升(P < 0.01)。而BmIAP-2和BmSurvivin-2基因在感染后的大部分时间段表达量下降。说明BmIAP-1和BmSurvivin-1蛋白可能在家蚕微孢子虫抑制BmN细胞的凋亡过程中具有一定作用,且前者的作用更为明显。此外,可以看出并不是所有的IAP蛋白都一定参与细胞凋亡的抑制过程。例如,一部分IAP蛋白功能与细胞的分化有关[16]。
综上所述,当无任何外界凋亡因素诱导条件下,家蚕微孢子虫感染BmN细胞后可影响宿主细胞的正常生长和凋亡的发生。通过数据库检索获得4个家蚕凋亡蛋白抑制因子IAPs基因。荧光定量PCR结果分析表明,在家蚕微孢子虫感染BmN细胞时,BmIAP-1和BmSurvivin-1蛋白可能在调节细胞凋亡的过程中起一定作用。
References
| [1] | del Aguila C, Izquierdo F, Granja AG, Hurtado C, Fenoy S, Fresno M, Revilla Y. Encephalitozoon microsporidia modulates p53-mediated apoptosis in infected cells. International Journal for Parasitology, 2006, 36(8): 869-876. DOI:10.1016/j.ijpara.2006.04.002 |
| [2] | Didier ES, Sokolova YY, Alvarez X, Bowers LC. Encephalitozoon cuniculi (Microsporidia) suppresses apoptosis in human macrophages. The Journal of Immunology, 2009, 182: 133.112. |
| [3] | Scanlon M, Leitch GJ, Shaw AP, Moura H, Visvesvara GS. Susceptibility to apoptosis is reduced in the Microsporidia-infected host cell. The Journal of Eukaryotic Microbiology, 1999, 46(5): 34S-35S. |
| [4] | Huang Q, Deveraux QL, Maeda S, Stennicke HR, Hammock BD, Reed JC. Cloning and characterization of an inhibitor of apoptosis protein (IAP) from Bombyx mori. Biochimica et Biophysica Acta, 2001, 1499(3): 191-198. DOI:10.1016/S0167-4889(00)00105-1 |
| [5] | He XY, Fu Z, Li MQ, Liu H, Cai SF, Man N, Lu XM. Nosema bombycis (Microsporidia) suppresses apoptosis in BmN cells (Bombyx mori). Acta Biochimica et Biophysica Sinica, 2015, 47(9): 696-702. DOI:10.1093/abbs/gmv062 |
| [6] | Zhu F, Shen ZY, Guo XJ, Xu XF, Tao HP, Tang XD, Xu L. A new isolate of Nosema sp. (Microsporidia, Nosematidae) from Phyllobrotica armata Baly (Coleoptera, Chrysomelidae) from China. Journal of Invertebrate Pathology, 2011, 106(2): 339-342. DOI:10.1016/j.jip.2010.10.005 |
| [7] | Ma ZG, Li CF, Pan GQ, Li ZH, Han B, Xu JS, Lan XQ, Chen J, Yang DL, Chen QM, Sang Q, Ji XC, Li T, Long MX, Zhou ZY. Genome-wide transcriptional response of silkworm (Bombyx mori) to infection by the microsporidian Nosema bombycis. PloS One, 2013, 8(12): e84137. DOI:10.1371/journal.pone.0084137 |
| [8] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)) Method. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [9] | Li Y, Chen DH, Yang SX, Zhou SZ, Liu GL. Ultrastructural morphological changes of human hepatoma cells after exposure to Panshengan. Journal of Chinese Electron Microscopy Society, 2004, 23(3): 201-204. (in Chinese) 李煜, 陈德蕙, 杨素霞, 周淑珍, 刘国廉. 盼生安对人肝癌细胞超微结构的影响. 电子显微学报, 2004, 23(3): 201-204. |
| [10] | Du A, Zhang S, Miao J, Zhao B. Safrole oxide induces apoptosis in A549 human lung cancer cells. Experimental Lung Research, 2004, 30(6): 419-429. DOI:10.1080/01902140490476337 |
| [11] | Ono K, Kim SO, Han J. Susceptibility of lysosomes to rupture is a determinant for plasma membrane disruption in tumor necrosis factor alpha-induced cell death. Molecular and Cellular Biology, 2003, 23(2): 665-676. DOI:10.1128/MCB.23.2.665-676.2003 |
| [12] | Clem RJ, Miller LK. Control of programmed cell death by the baculovirus genes p35 and iap. Molecular and Cellular Biology, 1994, 14(8): 5212-5222. DOI:10.1128/MCB.14.8.5212 |
| [13] | Ikeda M, Yamada H, Ito H, Kobayashi M. Baculovirus IAP1 induces caspase-dependent apoptosis in insect cells. The Journal of General Virology, 2011, 92(Pt 11): 2654-2663. |
| [14] | Katsuma S, Kawaoka S, Mita K, Shimada T. Genome-wide survey for baculoviral host homologs using the Bombyx genome sequence. Insect Biochemistry and Molecular Biology, 2008, 38(12): 1080-1086. DOI:10.1016/j.ibmb.2008.05.008 |
| [15] | Zhang JY, Pan MH, Sun ZY, Huang SJ, Yu ZS, Liu D, Zhao DH, Lu C. The genomic underpinnings of apoptosis in the silkworm, Bombyx mori. BMC Genomics, 2010, 11: 611. DOI:10.1186/1471-2164-11-611 |
| [16] | O'Riordan MX, Bauler LD, Scott FL, Duckett CS. Inhibitor of apoptosis proteins in eukaryotic evolution and development: a model of thematic conservation. Developmental Cell, 2008, 15(4): 497-508. DOI:10.1016/j.devcel.2008.09.012 |
