刘瑞艳1,2, 侯运华1

 , 王逸凡2, 钱远超2, 钟耀华2
, 王逸凡2, 钱远超2, 钟耀华2

1.齐鲁工业大学生物工程学院, 山东 济南 250353;
2.山东大学生命科学学院, 微生物技术国家重点实验室, 山东 济南 250100
收稿日期:2016-11-29;修回日期:2017-02-19;网络出版日期:2017-02-24
基金项目:国家自然科学基金(31370135);山东大学基本科研业务费专项资金(2015JC005);山东省农业科技成果转化资金(2014-45)
*通信作者:侯运华, Tel:+86-531-89631776, E-mail:houyunhua@sohu.com
钟耀华, Tel:+86-531-88366118, E-mail:zhongyaohua@sdu.edu.cn
摘要:[目的]丝状真菌里氏木霉是纤维素酶生产的主要工业真菌。纤维素酶分泌过程中的蛋白运输途径是控制大量纤维素酶成功输出的重要环节,因此,研究蛋白分泌途径的特定靶标基因功能将有助于鉴定纤维素酶运输分泌过程的关键调控因子。本研究借助基因敲除方法将里氏木霉液泡蛋白分选相关基因VPS13缺失,分析了该基因缺失对菌株生长、生孢尤其是纤维素酶分泌的影响。[方法]利用Double-jointPCR技术和同源重组策略构建里氏木霉VPS13基因缺失突变株,通过菌丝培养、显微观察、生孢检测、蛋白与酶活测定,系统比较VPS13基因敲除前后菌株的生长特征、菌丝形态、孢子形成、蛋白分泌以及纤维素酶活等。[结果]成功获得两株VPS13基因缺失株。与出发菌株相比,该基因突变后菌丝蔓延速率明显减慢,但菌体生物量在对数生长期后显著增多。通过显微观察,发现该基因缺失株菌丝更加密集,分支明显增多。此外,该基因缺失也导致菌株生孢延迟。纤维素底物平板分析发现VPS13基因缺失株菌落周围透明圈更加清晰,且透明圈圈径比是出发菌株的4倍,说明降解纤维素的能力有明显提高。进一步的液体发酵实验结果显示,该基因缺失导致蛋白产量及纤维素酶活力分别提高16.4%和21.9%。[结论]里氏木霉VPS13基因在菌丝生长、生孢、蛋白分泌等不同生物学过程中具有功能多样性,且该基因在菌种改良上可以作为提高纤维素酶产量的重要靶点。
关键词: 里氏木霉 VPS13 基因缺失 生孢 蛋白分泌 纤维素酶
Effects of VPS13 deletion on hyphal branch, sporulation and cellulase production in Trichoderma reesei
Liu Ruiyan1,2, Hou Yunhua1

 , Wang Yifan2, Qian Yuanchao2, Zhong Yaohua2
, Wang Yifan2, Qian Yuanchao2, Zhong Yaohua2

1.College of Biological Engineering, Qilu University of Technology, Jinan 250353, Shandong Province, China;
2.State Key Laboratory of Microbial Technology, School of Life Sciences, Shandong University, Jinan 250100, Shandong Province, China
Received 29 November 2016; Revised 19 February 2017; Published online 24 February 2017
*Corresponding author: Yunhua Hou, Tel: +86-531-89631776, E-mail: houyunhua@sohu.com
Yaohua Zhong, Tel: +86-531-88366118, E-mail: zhongyaohua@sdu.edu.cn
Supported by the National Natural Science Foundation of China (31370135), by the Fundamental Research Funds of Shandong University (2015JC005) and by the Agricultural Science and Technology Achievement Transformation Fund of Shandong Province (2014-45)
Abstract: [Objective]Trichoderma reesei is one of the major industrial fungi for cellulase production. A large amount of cellulases are secreted from the fungal cell through the protein secretion pathway. Therefore, knowledge of specific gene functions related to protein secretion would contribute to identification of key factors controlling cellulase production. In this study, the vacuolar protein sorting-associated gene VPS13 was deleted by gene knockout strategy in T. reesei and effects of VPS13 deletion on fungal growth and cellulase production were analyzed.[Methods]Double-joint PCR technique and homologous recombination method were used to delete VPS13 gene in T. reesei QP4 strain. Fungal cultivation, microscopic observation, sporulation detection, protein content and enzyme activity determination were applied to compare the growth characteristics, morphology, spore formation, and cellulase activity between the deletion strains and the parental strain.[Results]Two VPS13 deletion strains, ΔVPS13-1 and ΔVPS13-2, were obtained successfully. Compared with the parental strain, the mutants showed slower hyphae spreading, but their biomass increased significantly after the logarithmic growth phase. In addition, VPS13 deletion led to delay of sporulation. Cellulose plate cultivation revealed that VPS13 mutants produced clearer transparent halos around colonies than the parental strain, indicating that VPS13 deletion increased the ability to degrade cellulose. Furthermore, liquid fermentation showed that VPS13 deletion also improved protein yield and cellulase activity.[Conclusion]T. reesei VPS13 gene can be used as an important target to improve cellulase yield.
Key words: Trichoderma reesei VPS13 gene deletion sporulation protein secretion cellulase
木质纤维素降解转化为乙醇等生物能源过程中,纤维素酶的生产成本是制约纤维乙醇等可再生新能源发展的重要因素[1]。因此,提高工业菌种纤维素酶生产水平是降低纤维素酶生产成本的重要途径。里氏木霉是目前纤维素酶生产的主要工业丝状真菌,具有菌丝生长快速、孢子繁殖旺盛、纤维素酶产率高等优点[2]。自2008年里氏木霉全基因组测序公布以来(http://genome.jgi-psf.org/Trire2/Trire2.home.html),对里氏木霉关键功能基因的研究已成为热点,尤其是揭示纤维素酶诱导表达调控机制方面取得了重要进展[3–4]。然而,对里氏木霉蛋白合成分泌机制的探索仍然不多,因此,深入研究纤维素酶分泌相关的重要基因功能将为菌种改良提供潜在靶点,有利于提升纤维素酶生产水平[5]。
纤维素酶通过蛋白分泌途径实现其合成与分泌。一般来说,纤维素酶新生肽首先进入内质网进行折叠和修饰,然后经高尔基体进一步处理,并最终由复杂的囊泡分选系统实现胞外运输[6]。在蛋白分泌途径的分选系统中,不同真核生物的液泡蛋白分选相关基因(Vacuolar protein sorting,VPS)已经被鉴定[7]。其中,VPS13蛋白家族在真核细胞中是高度保守的[8]。人类有4个VPS13同源基因:VPS13A、B、C和D。目前已证明,VPS13A、B和C基因的突变分别与神经退行性疾病舞蹈症、棘红细胞增多症(ChAc)、发育障碍科恩综合征、帕金森氏病等有关[9]。但是,VPS13基因如何参与这些相关疾病的分子机理还不清楚。酿酒酵母VPS13同源基因只有1个,它至少在2个不同生物学过程中是必需的:囊泡分选和生孢作用[8]。VPS13基因突变导致羧肽酶Y分选受体不能从内体转运到高尔基体而导致羧肽酶Y分泌到胞外[10]。VPS13也是Kex2蛋白、Ste3蛋白(2型跨膜蛋白,α-因子合成所必需的)和VPS10蛋白有效定位到反面高尔基体网(TGN)所必需的。VPS13基因的缺失显著影响Kex2蛋白和Ste13蛋白的TGN定位,以及加速VPS10分选受体的降解[11–12]。因此,VPS13在蛋白分泌途径后期、囊泡分选运输过程中可能具有相当重要的功能。此外,VPS13也是生孢过程所必需的,此功能被证实不依赖于囊泡分选功能[13]。孢子形成的一个关键步骤是从头合成前孢子膜(prospore membranes),而VPS13在生孢过程中定位到前孢子膜上且其缺失会导致前孢子膜上磷脂酸水平降低[14]。最新研究也发现,VPS13存在于细胞器之间(如核和液泡、内体和线粒体等)的膜连接处,可能起到增强磷脂类分子交换的作用[8]。综上所述,VPS13基因功能的具体机制仍不很清楚,但该基因在真核细胞蛋白分泌过程和生孢作用方面具有重要功能。
丝状真菌里氏木霉作为低等真核微生物,不仅有生长快速、繁殖/生孢迅速、易于培养等优点,而且具有极强的蛋白合成分泌能力。据报道,里氏木霉突变菌株的纤维素酶产量在高水平发酵条件下可达100 g/L[5]。VPS13基因在蛋白分泌过程中具有重要作用,其是否参与里氏木霉纤维素酶合成分泌以及相关生理代谢值得深入探讨。本研究借助基因敲除方法成功构建里氏木霉VPS13缺失株,并分别对野生株、缺失株的生长特征、孢子形成、蛋白产量及纤维素酶水平进行了系统分析,证明该基因缺失对菌丝分支、孢子形成以及纤维素酶合成分泌具有重要影响,这为里氏木霉菌种改良、提升纤维素酶产量提供了一个潜在的重要靶点。
1 材料和方法 1.1 材料
1.1.1 菌种和质粒: 里氏木霉QP4菌株(尿嘧啶营养缺陷型)来自本实验室构建[15]。质粒pAB4-1含有黑曲霉乳清酸核苷-5′-磷酸脱羧酶基因(pyrG),氨苄抗性(本实验室保存)。
1.1.2 主要的酶和试剂: 里氏木霉原生质体制备所用的哈茨木霉裂解酶购自SIGMA;DNA聚合酶HiFiTaq polymerase、EasyTaq polymerase购自TransGen;琼脂糖凝胶回收纯化、PCR纯化和质粒小提试剂盒均购自Omega;Southern杂交的试剂盒DIG-High Prime DNA Labeling and Detection Starter Kit Ⅰ购自Roche;酶活测定所用滤纸为Whaterman 1号滤纸;DNA GeneRuler 1 kb购自ThermoFisher Scientific;尿嘧啶(Uracil)购自上海生工;引物由北京六合华大基因科技股份有限公司合成。
1.1.3 主要培养基: (1) 基本培养基(MM)(g/L):葡萄糖20.0,KH2PO4 15.0,(NH4)2SO4 5.0,MgSO4·7H2O 0.6,CaCl2 0.6,FeSO4·7H2O 0.005,MnSO4·H2O 0.0016,ZnSO4·7H2O 0.0014,CoCl2 0.002,调节pH至4.5–5.5,配固体培养基需添加2%琼脂粉,115 ℃灭菌30 min。(2) 土豆培养基(PDA):去皮的土豆200 g切块加水1 L煮30 min后用纱布过滤取滤液,加20 g葡萄糖至滤液中溶解后定容至1 L,pH自然。115 ℃灭菌30 min。(3) 纤维素双层平板上层培养基(g/L):球磨纤维素5.0,(NH4)2SO4 5.0,KH2PO4 15.0,MgSO4·7H2O 0.6,CaCl2 0.6,FeSO4·7H2O 0.005,MnSO4·H2O 0.0016,ZnSO4·7H2O 0.0014,CoCl2 0.002,Triton 10.0,琼脂粉20.0。纤维素双层平板下层培养基为2%水琼脂培养基。(4) 种子培养基(g/L):葡萄糖10,CaCl2 1,MgSO4·7H2O 0.6,KH2PO4 5,(NH4)2SO4 2.5,玉米浆20,115 ℃灭菌30 min。(5) 产酶发酵培养基(g/L):结晶纤维20.0,CaCl2 1.0,MgSO4·7H2O 0.6,KH2PO4 5.0,(NH4)2SO4 2.5,玉米浆20.0,121 ℃灭菌30 min。(6) 细菌培养基(LB)(g/L):酵母粉5,蛋白胨10,NaCl 10,用NaOH调节pH至7.2,固体培养基添加2%的琼脂粉,115 ℃灭菌30 min。若需要,可加入氨苄青霉素至终浓度100 μg/mL。以上培养基在培养尿嘧啶缺陷型时均需添加10 mmol/L的尿嘧啶。
1.1.4 引物: 本研究构建VPS13缺失菌株及其验证所用引物名称和序列见表 1。
表 1. 本研究中使用的引物 Table 1. Primers used in this study
| Primers | Sequence (5′→3′) |
| VPS13-2352UF (P1) | TAAGGCAGCGTCCCTGTAAG |
| VPS13-451UR (P2) | AGACGAGACACGACGGCGGCTTCAGGTCAGGGCAGAG |
| pyrG-S (P3) | CGCCGTCGTGTCTCGTCT |
| VPS13-10270DF (P5) | GATAACATTGACCAGCGGCTCGTCTACAGGGCTCACTTGC |
| pyrG-A (P4) | AGCCGCTGGTCAATGTTATC |
| VPS13-12076DR (P6) | GAAACTGCTGGTTCTTCGCTAC |
| VPS13-12037DR (P7) | TGCCCATACCGCAACTTCT |
| VPS13-2593UF (P8) | TGGGTTAGAAATAGGCGAGATAC |
| pyrG-731UR (P9) | TACTTCAGTCCAGCTACCAG |
| pyrG-780F (P10) | TCTCGGCTACTCCGTCCAAT |
| pyrG-356F (P11) | TCATTGACATCGGCAACACG |
| pyrG-1149DR (P12) | GTCGCCATTTTCTCTACGCAA |
| VPS13-951F (P13) | TTCGCCATCAAGAATACAAGG |
| VPS13-1869R (P14) | CTTTGTCGTGGGAGTTGTCG |
| The sequences underlined are the complementary sequences of the next adjacent segments. The names in brackets are the abbreviations for the corresponding primers. | |
表选项
1.2 里氏木霉VPS13缺失菌株构建、纯化及Southern blot 以里氏木霉QP4基因组DNA为模板,用引物P1/P2、P5/P6分别扩增得到1.90 kb上游同源臂(U-VPS13)和1.80 kb下游同源臂(D-VPS13)。以pAB4-1质粒DNA为模板,用引物P3/P4扩增得到2.75 kb黑曲霉pyrG片段。然后采用原生质体法转化里氏木霉QP4,里氏木霉原生质体的制备和转化实验主要参照Penttil 的方法进行[17]。待长出转化子,首先将转化平板上的转化子在基本平板上进行培养并连续转接4次,随后利用PCR验证基因敲除的正确性,再对验证正确的菌株进行生孢传代,也连续传代4次,同时进行PCR的验证,直至随机挑取的4个单孢的PCR验证结果均正确,说明转化子已经分纯。以引物P1/P2扩增得到的1.90 kb片段,经EcoR Ⅰ酶切回收后的片段(1.29 kb)制作探针。用探针对Nco Ⅰ酶切的基因组进行Southern blot验证,预期结果是缺失菌株杂交条带大小为6.38 kb,出发菌株为4.38 kb。Southern blot杂交方法主要参照Roche的DIG High Prime DNA Labeling and Detection Starter Kit Ⅰ说明书。
1.3 菌株生长规律及分支观察
1.3.1 菌丝生长速率测定: 取1 μL孢子(浓度约108个/mL)接种至MM固体平板中央,每个菌株做3个重复(本研究中的所有实验数据均采用3个生物学平行,后续实验中不再赘述),30 ℃恒温培养,每隔12 h测量菌落直径来表征菌株生长速度。
1.3.2 液体生物量测定: 将孢子液接种到150 mL MM液体培养基中(孢子接种终浓度为106个/mL),30 ℃、200 r/min摇床培养。每隔12 h取样10 mL,13000 r/min离心10 min,用真空泵抽滤收集菌丝,并用镊子小心将菌丝聚到一团,用滤纸包裹放到70 ℃烘箱烘干至恒重后测定生物量。
1.3.3 菌丝分支观察: 取1 μL孢子(浓度约108个/mL)接种MM固体平板中央,将无菌盖玻片以45°角斜插入培养基中,30 ℃恒温培养,待边缘菌丝蔓延过插片时显微镜观察菌丝分支。
1.4 生孢检测
1.4.1 生孢观察: 取1 μL孢子液(浓度约108个/mL)接种PDA固体平板中央,30 ℃恒温培养,待生孢满板时拍照记录生孢形态,并用适量体积的无菌水洗下平板上的所有孢子,用血球计数板计数。
1.4.2 等距离插片法观察孢子形态: 取1 μL孢子(浓度约108个/mL)接种PDA固体平板中央,将无菌盖玻片以45°角斜插入培养基中,30 ℃恒温培养,待边缘菌丝蔓延过插片时显微镜观察孢子形态。
1.5 纤维素双层平板分析 将1 μL孢子液(浓度约108个/mL)接种到0.5%纤维素双层平板上,30 ℃培养4 d,观察并测量纤维素平板上透明圈大小,计算圈径比,同时拍照记录实验结果。
1.6 纤维素酶活力测定 将孢子悬液接种到100 mL (500 mL的三角瓶)复合种子培养基中,30 ℃、200 r/min培养36 h,取10 mL菌液转接到100 mL (500 mL的三角瓶)发酵培养基中,一定时间后取样。将样品13000 r/min离心10 min,取上清测定胞外蛋白量及滤纸酶活。胞外蛋白含量的测定采用Bradford方法进行测定。滤纸酶活的测定如下:将(50±1) mg Whatman滤纸折叠放到25 mL酶标管底部,加入1.5 mL pH 4.8的柠檬酸缓冲液和0.5 mL稀释一定倍数的粗酶液,混匀;然后在50 ℃条件下水浴60 min,再加入3.0 mL DNS终止反应,煮沸10 min,用蒸馏水定容到25.0 mL,摇匀,540 nm处测OD值。对照开始不加酶液,加入DNS之后再加入酶液。
2 结果和分析 2.1 里氏木霉VPS13鉴定 根据酿酒酵母液泡蛋白分选相关蛋白VPS13基因序列(NCBI GenBank:Z73145.1),利用里氏木霉基因组(http://genome.jgi-psf.org/Trire2/Trire2.home.html)比对查找里氏木霉VPS13同源基因。该基因序列(jgi|Trire2|65104|)翻译成氨基酸序列得到3124个氨基酸残基。再经BLASTp比对分析,发现该基因在氨基酸水平上与Ceratocystis platani (KKF96583)、Hypsizygus marmoreus (KYQ45681)、Komagataella phaffii (CCA36675)、Saccharomyces cerevisiae (CAA97491)、Drosophila melanogaster (NP_610299) 和Homo sapiens VPS13A (Q96RL7) 蛋白具有较高相似性。将以上VPS13序列与里氏木霉VPS13序列在氨基酸水平上构建系统发育树(图 1-A)。里氏木霉与Ceratocystis platani亲缘关系最为相近且VPS13蛋白从低等单细胞真核生物到高等真核生物均是保守的。另一方面,选择里氏木霉、酿酒酵母的VPS13蛋白及人类VPS13A蛋白进行结构域分析,结果发现VPS13蛋白均含有3个功能保守的结构域:Chorein_N (Chorein或者VPS13 N端区域;pfam12624)、SHR-BD (液泡分选相关蛋白13 SHR结合区域;pfam06650) 和ATG_C (自噬相关蛋白C端结构域;pfam09333) (图 1-B)。综上,VPS13基因在真核生物中是高度保守的,且该基因在真核细胞中可能具有重要功能。
 |
| 图 1 里氏木霉VPS13蛋白鉴定 Figure 1 Identification of T. reesei VPS13 protein. A: phylogenetic analyses of VPS13 proteins were performed using Neighbour Joining from T. reesei (XP_006967068), C. platani (KKF96583), H. marmoreus (KYQ45681), K. phaffii (CCA36675), S. cerevisiae (CAA97491), D. melanogaster (NP_610299) and H. sapiens VPS13A (Q96RL7). Numbers indicate the bootstrap value. The bar marker indicates the genetic distance, which is proportional to the number of amino acid substitutions. B: domain analysis of VPS13 proteins shows relatively higher level of homology in the Chorein_N, SHR-BD and ATG_C from T. reesei (XP_006967068), S. cerevisiae (CAA97491), and H. sapiens VPS13A (Q96RL7). |
| 图选项 |
2.2 里氏木霉?VPS13菌株构建及PCR和Southern blot验证 参照Double-joint PCR融合技术[16],将U-VPS13、pyrG、D-VPS13进行3片段融合,使用巢式引物P1/P7扩增得到敲除盒,构建示意图如图 2-A。
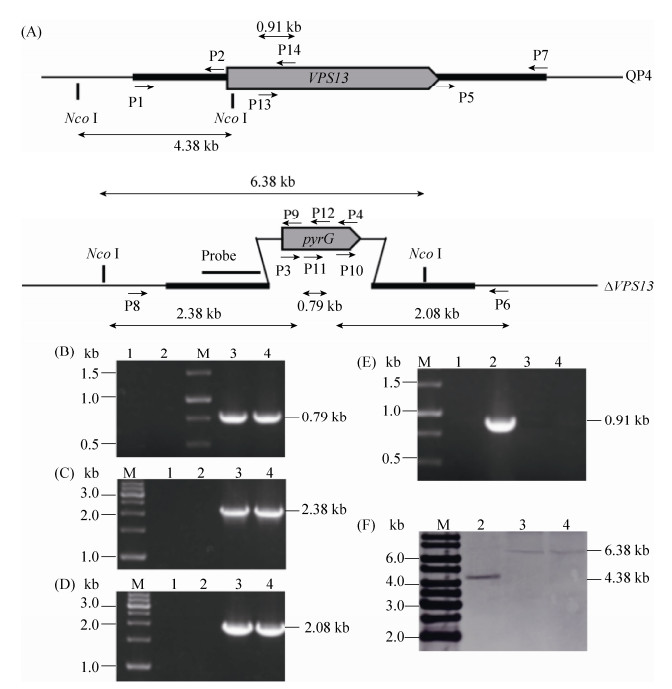 |
| 图 2 里氏木霉VPS13基因缺失菌株构建及PCR和Southern blot验证 Figure 2 Construction of VPS13 deletion in T. reesei and identification of the mutants by PCR and Southern blot. A: schematic representation of the deletion of VPS13; B-E: confirmation of VPS13 deletion by PCR amplification; F: confirmation of VPS13 deletion by Southern blot. M: 1 kb ladder DNA marker; 1: PCR product with H2O as template; 2–4: products of PCR or Southern blot with the genomic DNA of QP4, ?VPS13-1 and ?VPS13-2, respectively. |
| 图选项 |
分别以里氏木霉QP4基因组DNA和pAB4-1质粒DNA为模板,扩增得到的1.90、1.80和2.75 kb的VPS13上下游同源臂和pyrG基因片段经融合PCR得到6.45 kb的VPS13敲除盒。然后采用CaCl2-PEG介导的原生质体法转化里氏木霉QP4,挑取转化子进行传代和分纯。通过PCR及Southern blot验证,成功获得2株验证正确的VPS13基因缺失株,将其命名为?VPS13-1和?VPS13-2。验证结果显示,VPS13转化子中可以扩增得到敲除盒pyrG编码区内部基因0.79 kb (图 2-B)、染色体上游锚定片段2.38 kb (图 2-C)和染色体下游锚定片段2.08 kb左右的条带(图 2-D),而出发菌株QP4染色体和阴性对照H2O为模板时没有扩展出目的片段条带,与预期结果符合。这表明VPS13敲除盒已经发生同源交换,成功插入里氏木霉QP4染色体中。进而使用VPS13基因内部引物(P13/P14) 扩增0.91 kb片段,VPS13转化子和H2O没有目的条带,QP4能扩增出0.91 kb的目的带(图 2-E),说明里氏木霉VPS13在染色体水平已经被定点敲除。为了进一步确认VPS13基因敲除的正确性,本文开展了Southern blot实验,结果显示,缺失菌株基因组的杂交条带由4.38 kb增大为6.38 kb (图 2-F),与预期相符(图 2-A),因此,里氏木霉VPS13基因缺失菌株构建成功。
2.3 里氏木霉VPS13基因缺失影响菌株的生长 首先对VPS13基因缺失株和出发菌株QP4进行了生长规律分析。在2%葡萄糖的MM固体平板上接种?VPS13和QP4孢子(孢子浓度108个/mL),每隔12 h测量菌丝直径来表征菌丝生长速率。实验结果发现,与QP4相比,?VPS13菌丝蔓延变慢(图 3-A)。对其生物量测定发现,?VPS13生物量在48 h之后比QP4明显增多,且出发菌株QP4在72 h时生物量达到最大值3.40 mg/mL,而?VPS13-1和?VPS13-2在96 h生物量到达最大值,分别为4.70 mg/mL和4.47 mg/mL (图 3-B)。这个结果似乎与?VPS13菌丝蔓延速率减慢相矛盾。进一步对?VPS13及QP4的菌丝分支进行显微观察,结果发现?VPS13菌丝分支明显比QP4增多(图 4)。因此,VPS13基因缺失导致菌株生长速率变慢,但同时增多了菌丝分支。
 |
| 图 3 VPS13基因缺失对里氏木霉生长的影响 Figure 3 Effects of VPS13 deletion on growth of the T. reesei. A: colony diameter of the T. reesei QP4 and ?VPS13-1/2 strains grown on plates contained 2% glucose; B: growth curves for QP4 and ?VPS13-1/2 strains. |
| 图选项 |
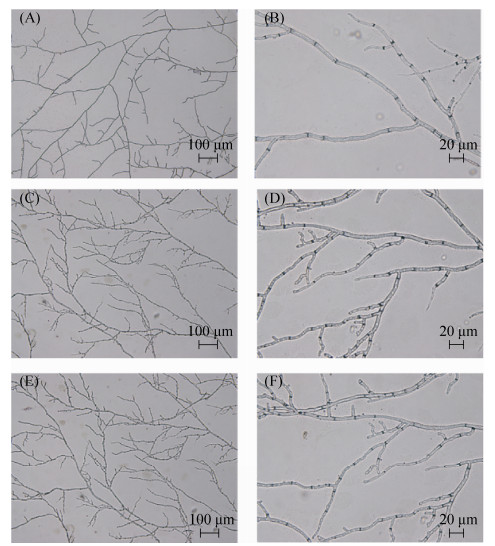 |
| 图 4 里氏木霉?VPS13菌丝显微观察 Figure 4 Microscopic observation of hyphae of T. reesei ?VPS13 strains. A, C, E: microscopic images of hyphae of T. reesei QP4 and ?VPS13-1/2 strains; B, D, F: microscopic images of hyphae of T. reesei QP4 and ?VPS13-1/2 strains. |
| 图选项 |
2.4 VPS13基因缺失影响菌株的生孢 有研究报道,VPS13是酿酒酵母孢子形成过程中胞质分裂所必需的[13]。本研究对VPS13基因缺失是否影响里氏木霉菌株的生孢进行了分析。从生孢平板上绿色孢子的颜色可以看出,?VPS13比QP4平板颜色浅(图 5-A)。对生孢5 d的平板进行孢子量统计,结果表明?VPS13-1和?VPS13-2孢子量(均为3.12×108个/平板)约是QP4 (14.1×109个/平板)的1/4 (图 5-C)。为进一步验证该结果,对?VPS13和QP4进行等距离插片观察菌株生孢形态,实验结果发现当QP4开始生孢时,?VPS13-1和?VPS13-2还没有孢子形成(图 5-B)。因此,里氏木霉VPS13基因缺失对菌株生孢具有重要影响。
 |
| 图 5 里氏木霉VPS13基因缺失对生孢的影响 Figure 5 Impacts of the VPS13 gene deletion on sporulation in T. reesei. A: spore plates of T. reesei QP4 and ?VPS13-1/2 strains grown on PDA plates. B: microscopic observation of sporulation of T. reesei QP4 and ?VPS13-1/2 strains. C: sporulation of T. reesei QP4 and ?VPS13-1/2 strains on PDA plates. |
| 图选项 |
2.5 VPS13影响里氏木霉纤维素酶分泌 为了确定里氏木霉VPS13基因是否参与胞外蛋白及纤维素酶的分泌,首先在含有尿嘧啶的0.5%纤维素平板上接种等量?VPS13和QP4孢子,30 ℃培养5 d,分别测量纤维素平板上?VPS13和QP4菌落透明圈直径并计算圈径比来衡量菌株纤维素酶活力。从纤维素平板可以看出,在?VPS13-1和?VPS13-2突变株菌丝周围有一个较明显的透明圈,而出发菌株QP4菌丝周围的透明圈不显著(图 6-A)。进一步比较?VPS13和QP4的圈径比(图 6-B),结果显示,?VPS13-1和?VPS13-2圈径比(分别为0.13,0.12) 约是QP4圈径比(0.03) 的4倍。因此,?VPS13的纤维素酶分泌能力显著高于QP4。
 |
| 图 6 里氏木霉?VPS13降解纤维素能力分析 Figure 6 Analysis of the capacity of T. reesei ?VPS13 strains to degrade cellulose. A: avicel double layer plates of T. reesei QP4 and ?VPS13-1/2 strains. B: the radio of transparent halos of T. reesei QP4 and ?VPS13-1/2 strains. |
| 图选项 |
对?VPS13与QP4进行纤维素诱导条件下液体发酵,取培养9 d的酶液分别测定胞外蛋白及纤维素酶总活力。胞外蛋白含量的测定采用Bradford方法进行测定,总纤维素酶活力通过滤纸酶活(FPA)来测定。如图 7所示,与出发菌株QP4相比,?VPS13的胞外蛋白量和FPA活力分别平均提高了16.4%和21.9%。综上,里氏木霉VPS13基因缺失对胞外蛋白分泌和总纤维酶活均有重要影响,说明VPS13基因参与了里氏木霉纤维素酶分泌过程,且该基因的缺失有助于蛋白分泌和纤维素酶活力提高。
 |
| 图 7 里氏木霉QP4和?VPS13菌株蛋白量与FPA活力测定 Figure 7 Determination of protein content and the FPA activity of T. reesei QP4 and ?VPS13 strains. A: protein content of T. reesei QP4 and ?VPS13-1/2 strains; B: activity of FPA of T. reesei QP4 and ?VPS13-1/2 strains. |
| 图选项 |
3 讨论 纤维素的有效降解是生物炼制过程中关键步骤,因此提高纤维素酶产量将有效降低生物燃料生产成本。最广泛使用的工业纤维素酶生产菌株如里氏木霉主要通过产生随机突变而实现了高效分泌,但是,其具体分泌机制还没有被阐明[2]。里氏木霉高产菌株NG14和RUT-C30与野生型菌株QM6a比较基因组数据发现,存在包含单核苷酸突变、小片段插入/缺失以及超过100 kb的大基因组DNA缺失等200多个突变[18]。其中有些影响如参与蛋白分泌、液泡定位等功能的基因的突变可能有助于胞外蛋白的高效分泌[19]。液泡蛋白分选相关蛋白VPS13在真核细胞中是高度保守的。有研究报道,VPS13基因参与胞内运输和囊泡调控分选[12]。其次,VPS13基因缺失导致生孢过程的前孢子膜不能关闭,表明VPS13基因对前孢子膜的延伸和关闭具有更加直接的作用[13]。基于VPS13基因在蛋白分泌系统中的重要作用,本文系统分析了里氏木霉VPS13基因缺失对菌株的生长、生孢及纤维素酶产量的影响。
对VPS13功能研究大部分来自酿酒酵母[8],而其在丝状真菌中的功能还不清楚。本研究构建的?VPS13菌株展示的生长规律结果表明,?VPS13在固体平板上菌丝延伸速率明显降低,但生物量显著增多。进一步显微观察发现,VPS13基因缺失使得菌丝分支明显增多。但是,VPS13基因的缺失是如何影响菌丝生长速率和分支的分子机制还有待于下一步研究。有研究报道,将近20个VPS基因突变已经证明在前孢子膜形成之前降低或阻碍了生孢作用[20]。随后的研究也证明VPS13在孢子形成过程中定位到前孢子膜上且对前孢子膜的延伸和关闭具有直接的作用[13]。故本研究对?VPS13与QP4进行生孢分析,结果发现VPS13基因缺失导致菌株生孢延迟。通过等距离插片观察菌丝生孢形态,发现在QP4开始生孢时?VPS13没有孢子形成,进一步佐证了?VPS13生孢延迟。酵母相关研究报道表明这种生孢缺陷可能是由于VPS13基因缺失降低了前孢子膜上磷脂水平而导致的[14]。这将为后续研究该基因与菌丝生长和孢子形成相关的作用机制提供了重要参考。
里氏木霉野生型菌株QM6a自20世纪40年代分离鉴定以来,经过不断的紫外线、NTG、离子诱变等筛选,获得了NG14、RUT-C30和QM9414等高产突变菌株[2]。尽管不断对其纤维素酶产量进行改良,但其合成调控的分子机制还有待进一步阐明。最新研究报道,粗糙脉胞菌VPS13的敲除将胞外蛋白分泌量提高了10.5%[19]。本文研究中,里氏木霉VPS13基因敲除也显著促进了胞外蛋白的分泌,且总蛋白量增加了16.4%,这与粗糙脉胞菌中的报道相吻合。此外,?VPS13菌株在纤维素平板上的透明圈比出发菌株明显增大,而菌落变小,其圈径比提高了4倍。同时,液体发酵结果也证明,VPS13基因的缺失提高了纤维素酶产量,说明VPS13基因对纤维素酶的合成分泌具有重要作用。另外,有研究报道里氏木霉的低生长速率有利于纤维素酶有效分泌[21]。这与本研究中?VPS13菌株生长变慢而产酶提高也相一致。尽管低生长率与纤维素酶分泌之间相关联的具体机制目前还不清楚,但?VPS13的纤维素酶活力提高可能是与菌丝分支增多有相关性,因为菌丝分支增多可能有助于纤维素酶从菌丝顶端向胞外分泌。综上所述,里氏木霉VPS13基因参与了菌丝生长、生孢和蛋白分泌等不同生物学过程,这说明该基因具有功能多样性。值得关注的是,该基因缺失促进了纤维素酶分泌,因此,该基因在里氏木霉菌种改良上可作为提高纤维素酶产量的重要靶点。
References
| [1] | Van Dyk JS, Pletschke BI. A review of lignocellulose bioconversion using enzymatic hydrolysis and synergistic cooperation between enzymes-factors affecting enzymes, conversion and synergy. Biotechnology Advances, 2012, 30(6): 1458-1480. DOI:10.1016/j.biotechadv.2012.03.002 |
| [2] | Peterson R, Nevalainen H. Trichoderma reesei RUT-C30-thirty years of strain improvement. Microbiology, 2012, 158(Pt 1): 58-68. |
| [3] | Martinez D, Berka RM, Henrissat B, Saloheimo M, Arvas M, Baker SE, Chapman J, Chertkov O, Coutinho PM, Cullen D, Danchin EGJ, Grigoriev IV, Harris P, Jackson M, Kubicek CP, Han CS, Ho I, Larrondo LF, de Leon AL, Magnuson JK, Merino S, Misra M, Nelson B, Putnam N, Robbertse B, Salamov AA, Schmoll M, Terry A, Thayer N, Westerholm-Parvinen A, Schoch CL, Yao J, Barabote R, Nelson MA, Detter C, Bruce D, Kuske CR, Xie G, Richardson P, Rokhsar DS, Lucas SM, Rubin EM, Dunn-Coleman N, Ward M, Brettin TS. Genome sequencing and analysis of the biomass-degrading fungus Trichoderma reesei (syn. Hypocrea jecorina). Nature Biotechnology, 2008, 26(5): 553-560. DOI:10.1038/nbt1403 |
| [4] | Zhang WX, Kou YB, Xu JT, Cao YL, Zhao GL, Shao J, Wang H, Wang ZX, Bao XM, Chen GJ, Liu WF. Two major facilitator superfamily sugar transporters from Trichoderma reesei and their roles in induction of cellulase biosynthesis. The Journal of Biological Chemistry, 2013, 288(46): 32861-32872. DOI:10.1074/jbc.M113.505826 |
| [5] | Saloheimo M, Pakula TM. The cargo and the transport system:secreted proteins and protein secretion in Trichoderma reesei (Hypocrea jecorina). Microbiology, 2012, 158(Pt 1): 46-57. |
| [6] | Yan SM, Wu G. Secretory pathway of cellulase:a mini-review. Biotechnology for Biofuels, 2013, 6: 177. DOI:10.1186/1754-6834-6-177 |
| [7] | Lemmon SK, Traub LM. Sorting in the endosomal system in yeast and animal cells. Current Opinion in Cell Biology, 2000, 12(4): 457-466. DOI:10.1016/S0955-0674(00)00117-4 |
| [8] | Park JS, Thorsness MK, Policastro R, McGoldrick LL, Hollingsworth NM, Thorsness PE, Neiman AM. Yeast Vps13 promotes mitochondrial function and is localized at membrane contact sites. Molecular Biology of the Cell, 2016, 27(15): 2435-2449. DOI:10.1091/mbc.E16-02-0112 |
| [9] | Velayos-Baeza A, Vettori A, Copley RR, Dobson-Stone C, Monaco AP. Analysis of the human VPS13 gene family. Genomics, 2004, 84(3): 536-549. DOI:10.1016/j.ygeno.2004.04.012 |
| [10] | Bankaitis VA, Johnson LM, Emr SD. Isolation of yeast mutants defective in protein targeting to the vacuole. Proceedings of the National Academy of Sciences of the United States of America, 1986, 83(23): 9075-9079. DOI:10.1073/pnas.83.23.9075 |
| [11] | Brickner JH, Fuller RS. SOI1 encodes a novel, conserved protein that promotes TGN-endosomal cycling of Kex2p and other membrane proteins by modulating the function of two TGN localization signals. The Journal of Cell Biology, 1997, 139(1): 23-36. DOI:10.1083/jcb.139.1.23 |
| [12] | Luo WJ, Chang A. Novel genes involved in endosomal traffic in yeast revealed by suppression of a targeting-defective plasma membrane ATPase mutant. The Journal of Cell Biology, 1997, 138(4): 731-746. DOI:10.1083/jcb.138.4.731 |
| [13] | Park JS, Neiman AM. VPS13 regulates membrane morphogenesis during sporulation in Saccharomyces cerevisiae. Journal of Cell Science, 2012, 125(Pt 12): 3004-3011. |
| [14] | Park JS, Halegoua S, Kishida S, Neiman AM. A conserved function in phosphatidylinositol metabolism for mammalian Vps13 family proteins. PLoS One, 2015, 10(4): e0124836. DOI:10.1371/journal.pone.0124836 |
| [15] | Zhong LX, Qian YC, Dai MX, Zhong YH. Improvement of uracil auxotrophic transformation system in Trichoderma reesei QM9414 and overexpression of β-glucosidase. CIESC Journal, 2016, 67(6): 2510-2518. (in Chinese) 钟立霞, 钱远超, 戴美学, 钟耀华. 里氏木霉QM9414尿嘧啶缺陷型转化体系改进和β-葡萄糖苷酶的过量表达. 化工学报, 2016, 67(6): 2510-2518. |
| [16] | Yu JH, Hamari Z, Han KH, Seo JA, Reyes-Domínguez Y, Scazzocchio C. Double-joint PCR:a PCR-based molecular tool for gene manipulations in filamentous fungi. Fungal Genetics and Biology, 2004, 41(11): 973-981. DOI:10.1016/j.fgb.2004.08.001 |
| [17] | Penttil? M, Nevalainen H, R?tt? M, Salminen E, Knowles J. A versatile transformation system for the cellulolytic filamentous fungus Trichoderma reesei. Gene, 1987, 61(2): 155-164. DOI:10.1016/0378-1119(87)90110-7 |
| [18] | Le Crom S, Schackwitz W, Pennacchio L, Magnuson JK, Culley DE, Collett JR, Martin J, Druzhinina IS, Mathis H, Monot F, Seiboth B, Cherry B, Rey M, Berka R, Kubicek CP, Baker SE, Margeot A. Tracking the roots of cellulase hyperproduction by the fungus Trichoderma reesei using massively parallel DNA sequencing. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(38): 16151-16156. DOI:10.1073/pnas.0905848106 |
| [19] | Pei X, Fan FY, Lin LC, Chen Y, Sun WL, Zhang SH, Tian CG. Involvement of the adaptor protein 3 complex in lignocellulase secretion in Neurospora crassa revealed by comparative genomic screening. Biotechnology for Biofuels, 2015, 8: 124. DOI:10.1186/s13068-015-0302-3 |
| [20] | Piekarska I, Kucharczyk R, Mickowska B, Rytka J, Rempola B. Mutants of the Saccharomyces cerevisiae VPS genes CCZ1 and YPT7 are blocked in different stages of sporulation. European Journal of Cell Biology, 2010, 89(11): 780-787. DOI:10.1016/j.ejcb.2010.06.009 |
| [21] | Pakula TM, Salonen K, Uusitalo J, Penttil? M. The effect of specific growth rate on protein synthesis and secretion in the filamentous fungus Trichoderma reesei. Microbiology, 2005, 151(Pt 1): 135-143. |
