王沛雅1,2, 郑群1,2, 彭轶楠1,2, 巩晓芳1,2, 王治业1,2, 杨晖1,2


1.甘肃省科学院生物研究所, 甘肃 兰州 730030;
2.甘肃省微生物资源开发利用重点实验室, 甘肃 兰州 730030
收稿日期:2017-03-03;修回日期:2017-05-31;网络出版日期:2017-07-06
基金项目:甘肃省国际科技合作项目(1504WKCA073);甘肃省基础研究创新群体计划(1606RJIA325);甘肃省科学院创新团队项目(CX201601)
*通信作者:杨晖, Tel:+86-931-8618085;E-mail:yanghui43@163.com
摘要:[目的]寡雄腐霉(Pythium oligandrum Drechsler)是一种对动、植物和环境无害,兼具杀菌和增产效果的生防真菌。通过研究建立农杆菌介导的寡雄腐霉遗传转化体系。[方法]选用EHA105、AGL-1、LBA4404三种农杆菌菌株对寡雄腐霉进行遗传转化研究,通过对影响遗传转化效果的条件参数试验优化,确立适宜寡雄腐霉遗传转化的农杆菌菌株及转化条件,建立农杆菌介导的寡雄腐霉遗传转化体系。[结果]经研究发现,所选3种农杆菌菌株中EHA105菌株对寡雄腐霉的遗传转化效果最好,其次是AGL-1菌株,LBA4404菌株转化效果不好。EHA105菌株经IM(含300 μmol/L AS)诱导培养至OD600=0.6时,与浓度为106-107个/mL的寡雄腐霉孢子悬浮液以1-10:1的比例混合,在25-26℃以液体振荡的方式避光共培养72 h(pH 5.0,含300 μmol/L AS),寡雄腐霉菌体液体振荡恢复培养24 h,涂布抗性选择平板筛选寡雄腐霉转化子,即可得到寡雄腐霉基因工程菌株,其转化率可达到130个转化子/106个孢子。[结论]本研究首次构建了农杆菌介导的寡雄腐霉遗传转化体系,研究结果可为寡雄腐霉的生防机制及分子育种研究提供技术支撑。
关键词: 寡雄腐霉 生防真菌 农杆菌 遗传转化 egfp基因
Transformation of enhanced green fluorescent protein gene in Pythium oligandrum mediated by Agrobacterium tumefaciens
Wang Peiya1,2, Zheng Qun1,2, Peng Yinan1,2, Gong Xiaofang1,2, Wang Zhiye1,2, Yang Hui1,2


1.Institute of Biology, Gansu Academy of Sciences, Lanzhou 730030, Gansu Province, China;
2.Key Laboratory of Microbial Resources Exploition and Application of Gansu Province, Lanzhou 730030, Gansu Province, China
Received 3 March 2017; Revised 31 May 2017; Published online 6 July 2017
*Corresponding author: Hui Yang, Tel:+86-931-8618085;E-mail:yanghui43@163.com
Supported by the International Science and Technology Cooperation Program of Gansu Province (1504WKCA073), by the Project for Basic Innovative Research Group (1606RJLA325) and by the Project for Basic Innovative Research Group of Gansu Academy of Sciences (CX201601)
Abstract: [Objective]Pythium oligandrum is an environmental friendly mycoparasitic biocontrol fungus that can antagonize several plant pathogens and promote plant growth. We constructed Agrobacterium tumefaciens-mediated transformation of P. oligandrum.[Methods]Three A. tumefaciens strains:EH105, AGL-1 and LBA4404 were compared to find out the strain which showed the best genetic transformation efficiency within P. oligandrum. The factors of transformation system were screened and optimized to establish the genetic transformation system within P. oligandrum mediated by Agrobacterium tumefaciens.[Results]EHA105 strain showed the best genetic transform efficiency within P. oligandrum among three tested strains, followed by AGL-1 strain, and LBA4404 strain performed poorly. Then, the optimized genetic transformation system was as follows:A. tumefaciens EHA105 (OD600=0.6) suspension was mixed with P. oligandrum (106-107 spores per milliliter) suspension in a proportion of 1-10:1, then incubated in dark conditions for 72 h between 25 and 26℃ in the presence of induction medium (pH 5.0) containing acetosyringone at 300 μmol/L. Afterwards, antibiotic was added in to eliminate A. tumefaciens before 24 hours reviving cultivation. In the end, the transformants were selected by medium containing 200 mg/L of Basta and 250 mg/L of cefotaxime sodium on PDA. In this work, egfp was successfully transformed into P. oligandrum with the efficiency of 130 transformants per 106 spores.[Conclusion]We developed an Agrobacterium tumefaciens-mediated genetic transformation system for P. oligandrum for the first time to provide powerful tool for the study of P. oligandrum molecular breeding and biological control mechanisms.
Key words: Pythium oligandrum biocontrol fungus Agrobacterium tumefaciens genetic transformation enhanced green fluorescent protein gene
寡雄腐霉(Pythium oligandrum Drechsler)属于卵菌门腐霉科腐霉属,是一种土壤习居型重寄生生防真菌,对植物和动物都没有毒性,对环境安全[1]。寡雄腐霉不仅可以寄生于很多重要的土传病病原菌内,造成病菌死亡[2–5],也有内生菌功能,可在多种重要的农作物根际定殖并将菌丝伸入植株内,合成色胺、吲哚乙酸等生长活性物质,促进植物生理代谢、养分吸收和生长发育[6–7];寡雄腐霉菌还能诱导农作物产生系统抗性[8–9],是一种非常有应用价值的生防真菌。研究发现,寡雄腐霉寄生于病原菌时是通过菌丝缠绕的方式使病原菌菌体受到机械损伤,同时分泌出可以降解病原菌细胞壁的酶,从而使病原菌死亡[5, 10],而对于寡雄腐霉菌与寄主互作的分子机制知之甚少,有待我们发掘它的功能基因、了解其生防作用机制,从分子水平对其进行更为细致深入的研究利用。
对于寡雄腐霉的关注始于二十世纪七、八十年代,几乎都是对其生防、促生长作用的研究,其生防分子机制及功能基因的研究近年来稍有增多,但鲜有对寡雄腐霉遗传转化研究的报道。现有报道是在2012年,Horner NR等通过PEG-CaCl2介导方法对寡雄腐霉原生质体进行基因转化,获得了少量寡雄腐霉转化子[10]。由于真菌原生质体制备繁琐、再生频率低、转化效率低、而且试验成本高等不利因素,制约了相关研究的广泛开展。农杆菌介导的基因转化方法最先也是最广泛地应用于植物,近年来也成功应用于丝状真菌的遗传转化[11–14]。与传统的真菌遗传转化方法相比,农杆菌介导的转化方法对受体材料要求简单、能得到较多单拷贝的T-DNA插入转化子、转化率更高、转化子稳定遗传性高,此种方法更适合于丝状真菌的DNA插入突变、基因标记、基因改造等方面的研究。目前尚未见利用农杆菌介导法对寡雄腐霉进行遗传转化研究的报道,本研究首次通过农杆菌介导的方法进行寡雄腐霉遗传转化研究,摸索优化其转化体系,为从分子水平深入研究寡雄腐霉作用机理及菌种改良等研究奠定基础。
1 材料和方法 1.1 材料
1.1.1 菌株及载体: 寡雄腐霉(Pythium oligandrum Drechsler) CBS 530.74菌株购自荷兰微生物菌种保藏中心(Centraalbureau voor Schimmelcultures,Utrecht,The Netherlands);寡雄腐霉ACCC 83762菌株由本实验室保存。根癌农杆菌EHA105、AGL-1、LBA4404均为本实验室保存。携带增强型绿色荧光蛋白(Enhanced green fluorescent protein,egfp)基因的真菌表达载体pCAMBIA3301-gpdA-EGFP由本实验室构建。
1.1.2 试剂及仪器: Basta(上海生工),卡那霉素(Sigma),利福平(Sigma),头孢霉素(Sigma),羧苄青霉素(Sigma),乙酰丁香酮(Sigma),胰蛋白胨(OXOID),酵母提取物(OXOID),电泳琼脂糖(BIOWEST),Tris-HCl (Amresco),EDTA-Na2(Amresco),SDS (Amresco),CTAB (Amresco),Taq酶(TaKaRa),Dntp (TaKaRa),引物由上海生工合成,其他试剂均为国产分析纯。
PCR仪(Bio-Rad),培养箱(一恒),摇床(智城),离心机(Eppendorf),核酸蛋白定量仪(Eppendorf),水平电泳仪(Bio-Rad),化学发光凝胶成像系统(Bio-Rad),倒置荧光显微镜(ZEISS AXIO Observer.A1,Carl Zeiss,Germany),显微成像用Zeiss AxioCam MRc5相机。
1.1.3 培养基: IM诱导培养基:马铃薯液体培养基PDB,调其pH值为5.0,高压灭菌,用时加入过滤除菌的乙酰丁香酮(AS),使AS终浓度分别为0、100、200、300、400和500 μmol/L。
1.2 携带egfp基因真菌表达载体的构建 以常用于农杆菌介导植物遗传转化草铵膦抗性bar基因(Bialophos resistance,bar)的植物双元表达载体pCAMBIA3301为载体骨架,加入构巢曲霉3-磷酸甘油醛脱氢酶基因gpdA的真菌强启动子PgpdA,以构巢曲霉色氨酸合成基因trpC的终止子TtrpC为终止信号,并将原来载体上的GUS选择标记基因替换为egfp基因标记,构建出真菌表达载体pCAMBIA3301-gpdA-EGFP (10977 bp) (图 1)。
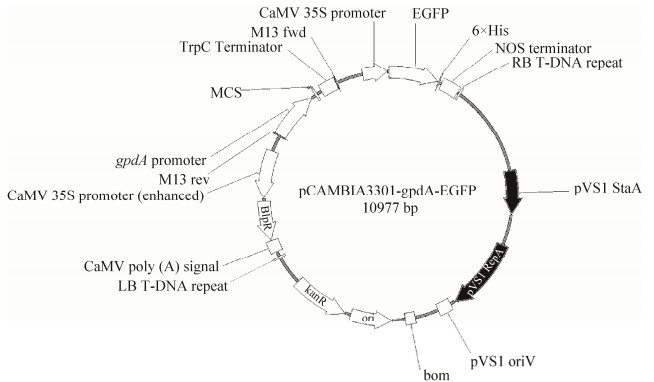 |
| 图 1 pCAMBIA3301-gpdA-EGFP真菌表达载体图 Figure 1 Plasmid map of pCAMBIA3301-gpdA-EGFP |
| 图选项 |
1.3 寡雄腐霉对草铵膦选择压敏感性试验 取生长6 d的寡雄腐霉菌体,用打孔器取菌体培养基圆盘(0.5 cm2),分别接种于含有0、50、100、200、300和500 mg/L Basta的PDA平板中央,于25 ℃生长9 d,观察菌体生长状况。
1.4 农杆菌介导的寡雄腐霉遗传转化体系参数优化
1.4.1 寡雄腐霉孢子悬浮液准备: 打孔器取寡雄腐霉菌体培养基圆盘(0.5 cm2)接种在PDA平板上,于26 ℃培养5–7 d,用诱导培养基IM冲洗平板,将平板上的寡雄腐霉孢子冲洗下来,制备成浓度为1.0×104–1.0×108个/mL寡雄腐霉孢子悬浮液。
1.4.2 农杆菌侵染用菌液制备: 分别从含有目的基因载体的EHA105、AGL-1、LBA4404农杆菌工程菌株抗性平板上挑取单克隆,置于5 mL含有相应抗菌素(50 mg/L利福平Rif+50 mg/L卡那霉素Kan) LB液体培养基中,28 ℃、200 r/min振荡培养20 h;吸取上述菌液2 mL接种于20 mL预培养基(LB液体培养基+50 mg/L Rif+50 mg/L Kan+0、100、200、300、400、500 μmol/L AS)中进行侵染前预培养,28 ℃、240 r/min振荡培养使菌液OD600至1.5–2.5;4 ℃、5000 r/min离心10 min,收集菌体,用IM诱导培养基重悬稀释菌体,使所得农杆菌菌液OD600为0.15–0.90,准备对寡雄腐霉孢子进行侵染转化。
1.4.3 农杆菌对寡雄腐霉的基因遗传转化: 共培养。分别将上述经过预培养的EHA105、AGL-1、LBA4404农杆菌侵染菌液与制备好的寡雄腐霉孢子悬浮液以一定比例混合,避光,于23–28 ℃、60 r/min共培养1–96 h。
恢复培养。共培养后向混合菌液中加入抗菌素使农杆菌菌体死亡,于26 ℃、120 r/min对寡雄腐霉菌体进行一段时间的恢复培养。
选择培养。经恢复培养的寡雄腐霉菌液5000 r/min离心10 min收集菌体,用PDB重悬,涂布添加有抗性选择压的PDA平板(PDA+200 mg/L Basta+200 mg/L头孢霉素),于26 ℃培养,抗性选择压筛选寡雄腐霉转化子。
转化子纯化与传代培养。挑取抗性选择平板上生长出的寡雄腐霉抗性单克隆菌落,接种于抗性选择平板,于26 ℃培养,待菌丝生长铺满平板,从边缘挑取菌丝接种于无选择压的PDA平板上进行传代培养以检测其稳定性。
1.5 寡雄腐霉转化子PCR检测、荧光镜检及Southern blot分析 将寡雄腐霉抗性菌株纯化培养,提取其基因组DNA,通过PCR初步检测筛选目的基因插入的转化子菌株。利用荧光显微镜检测转化子菌丝中egfp基因表达情况。随机挑取检测为阳性的菌株提取基因组DNA用Nde Ⅰ单酶切,以egfp基因为模板制备探针进行Southern blot分析。标记、杂交及检测的方法和步骤参照试剂盒(DIG High Prime DNA Labeling and Detection Starter KitⅡ,Roche)提供的方法进行。
1.6 数据分析 利用统计分析软件DPS和SPSS对数据进行差异显著性分析。
2 结果和分析 2.1 寡雄腐霉对Basta选择压力敏感性试验 为了抗性筛选寡雄腐霉工程菌株,首先对野生型寡雄腐霉进行了Basta抗性试验。对不同浓度Basta抗性选择平板上生长9 d的寡雄腐霉菌落生长情况观察发现,寡雄腐霉对Basta抗性较敏感,当Basta浓度为100 mg/L时只能生长稀薄的菌丝,Basta浓度为200 mg/L时寡雄腐霉菌不能生长(图 2)。故选择200 mg/L Basta浓度作为寡雄腐霉转化子筛选浓度。
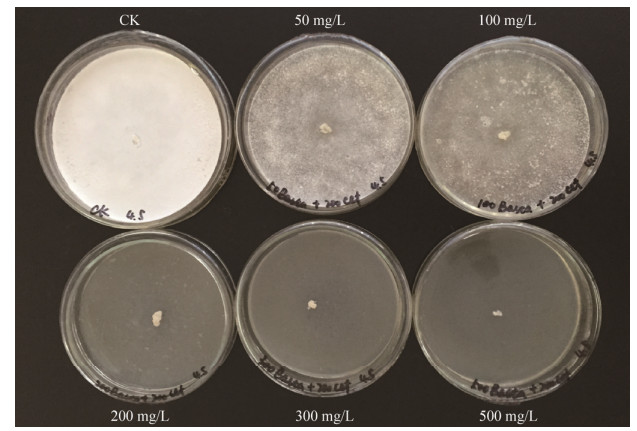 |
| 图 2 寡雄腐霉对Basta抗性试验 Figure 2 P. oligandrum on PDA media with different concentrations of Basta |
| 图选项 |
2.2 不同农杆菌菌株及其菌液浓度对寡雄腐霉遗传转化效果的影响 选用携带有pCAMBIA3301-gpdA-EGFP真菌表达载体的EHA105、LBA4404、AGL-1三种农杆菌菌株分别对寡雄腐霉进行侵染转化。结果表明,EHA105菌株的转化效果最好,其次是AGL-1菌株,LBA4404侵染寡雄腐霉后得到的转化子较少。不同菌株所适宜的侵染浓度也有差异,其中EHA105菌株的最佳侵染浓度为OD600=0.6,随机挑取的100个抗性菌落有97个转化子;AGL-1菌株的最佳侵染浓度为OD600=0.3,随机挑取的100个抗性菌落中有78个转化子;LBA4404菌株在最佳侵染浓度OD600=0.3时,挑取的40个抗性菌落中只有9个转化子(图 3)。本文中后续研究结果均采用EHA105 (OD600=0.6) 农杆菌菌株对寡雄腐霉进行基因遗传转化的试验数据,其他2种农杆菌菌株对寡雄腐霉遗传转化的转化条件与之相似(数据未公开)。
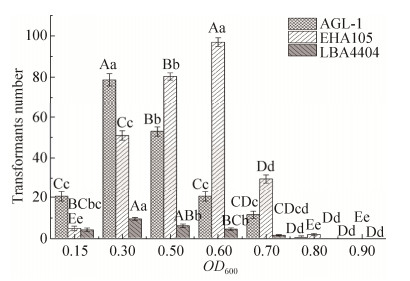 |
| 图 3 农杆菌菌株类型及侵染浓度对寡雄腐霉遗传转化的影响 Figure 3 The effects of the strains and OD600 of A. tumefacien on transformation of P. oligandrum. Different capital and small letters indicate the significant difference at 0.01 and 0.05 levels |
| 图选项 |
2.3 乙酰丁香酮对寡雄腐霉转化的影响 分别在农杆菌菌液预培养阶段和农杆菌与寡雄腐霉共培养阶段添加不同浓度的AS,发现在对寡雄腐霉进行侵染转化时,添加适当浓度的AS可以显著提升转化效果。当AS浓度在300 μmol/L时获得的转化子最多,超过300 μmol/L时反而不利于转化子的获得。在预培养阶段和共培养阶段都需要添加AS来促进寡雄腐霉的转化,而AS在共培养阶段的影响效果更大一些,若是在共培养阶段不添加AS,就无法成功获得寡雄腐霉转化子(图 4)。
 |
| 图 4 乙酰丁香酮对寡雄腐霉遗传转化的影响 Figure 4 The effects of adding acetosyringone concentration during pre-cultivation and co-cultivation on transformation of P. oligandrum. Different capital and small letters indicate the significant difference at 0.01 and 0.05 levels |
| 图选项 |
2.4 农杆菌介导转化寡雄腐霉影响因素 采用农杆菌转化方法对寡雄腐霉进行基因遗传转化时,受到了多种因素的影响,如受侵染真菌孢子的浓度、农杆菌与真菌侵染时的体积比、二者共培养时的条件等,对于不同的真菌所适用的条件参数是不同的。研究发现,当寡雄腐霉孢子悬浮液浓度小于1×105个/mL时无法成功获得转化子;浓度介于1.0×106–1.0×107个/mL时,可以得到很好的转化效果,且浓度在1.0×107个/mL时的转化效果最好;浓度超过1.0×107个/mL时转化率会降低(图 5-A)。故将寡雄腐霉孢子悬浮液的浓度调至1.0×106–1.0×107个/mL用于转化可获得较高的转化率。
 |
| 图 5 农杆菌介导转化寡雄腐霉影响因素 Figure 5 The factors on transformation Pythium oligandrum mediated by Agrobacterium tumefaciens. The effects of spores concentration (A), the proportion between the A. tumefacien and spores suspension (B), co-cultivation temperature (C), co-cultivation time (D), pH value (E) and reviving cultivation (F) on transformation of P. oligandrum. Different capital and small letters indicate the significant difference at 0.01 and 0.05 levels. |
| 图选项 |
农杆菌菌液与寡雄腐霉孢子悬浮液以一定比例混合进行侵染,当二者比例在1–10︰1时可获得很高的转化率,二者比例过小(0.5︰1.0) 或比例过大(100︰1) 时都无法获得转化子(图 5-B)。农杆菌菌液与寡雄腐霉孢子悬浮液混合,置于不同温度下液体振荡共培养,在23 ℃共培养时没有得到转化子;而在适宜农杆菌生长的28 ℃共培养时,得到的转化子只有3个;在25 ℃和26 ℃共培养时,能够很好地促进转化,随机挑取的100个抗性菌落中分别得到97和86个转化子,此温度是转化寡雄腐霉最佳共培养温度(图 5-C)。在25–26 ℃共培养时,寡雄腐霉转化子随着共培养时间的延长而增加,当农杆菌菌液与寡雄腐霉孢子悬浮液共同培养时间在48–96 h时,可以获得很好的转化效果,共培养72 h时转化率达到峰值(图 5-D)。二者共培养时的溶液pH值也会对转化结果有显著影响,pH值为5.0时,获得的转化子最多;pH值大于5.3时,寡雄腐霉的转化率就会下降;pH值到7.0时不会产生转化子(图 5-E)。
农杆菌菌液与寡雄腐霉孢子悬浮液共同培养72 h后,向混合菌液中加入抗菌素除去农杆菌,被侵染后的寡雄腐霉继续振荡恢复培养使其活力增强。通过比较发现,不经历恢复培养直接将共培养后的寡雄腐霉进行抗性选择所获得的转化子较少,而恢复培养阶段可以很好地促进被侵染后的寡雄腐霉菌体恢复生长活力增加转化效果,恢复培养24 h即可显著提高转化效率(图 5-F)。
2.5 寡雄腐霉转化子分子检测与荧光镜检 对寡雄腐霉抗性转化子基因组DNA进行egfp基因(750 bp)和bar基因(500 bp)的PCR扩增,均得到目的基因条带(图 6)。为了排除转化子表面黏附农杆菌而导致假阳性的出现,用T-DNA区域外基因vir基因辅助检测,转化子均没有扩增到vir基因条带,而携带pCAMBIA3301-gpdA-EGFP质粒的农杆菌EHA105和AGL-1工程菌株均可扩增得到vir基因条带(图 7),说明获得的转化子无农杆菌污染。
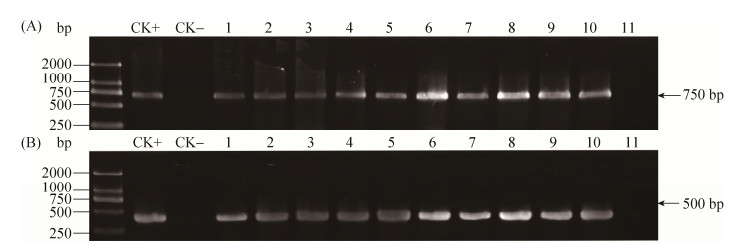 |
| 图 6 寡雄腐霉抗性转化子PCR检测结果 Figure 6 PCR analysis of P. oligandrum transformants. A: PCR analysis of egfp gene. B: PCR analysis of bar gene. CK+: pCAMBIA3301-gpdA-EGFP; CK–: Wild type; lane 1–10: Transformants; lane 11: H2O. |
| 图选项 |
 |
| 图 7 寡雄腐霉抗性转化子vir基因PCR检测结果 Figure 7 PCR analysis of vir gene. CK1: EHA105; CK2: AGL-1; WT: Wild type; lane 1–8: transformants. |
| 图选项 |
在PCR检测为阳性的寡雄腐霉转化子中随机挑取5株菌株与野生型原始菌株的基因组DNA分别用Nde Ⅰ进行单酶切,T-DNA区域内无该酶切位点,按照试剂盒的方法进行egfp基因的Southern blot分析和检测。结果表明egfp基因已经整合到寡雄腐霉基因组中,而且都是以单拷贝的方式整合(图 8)。
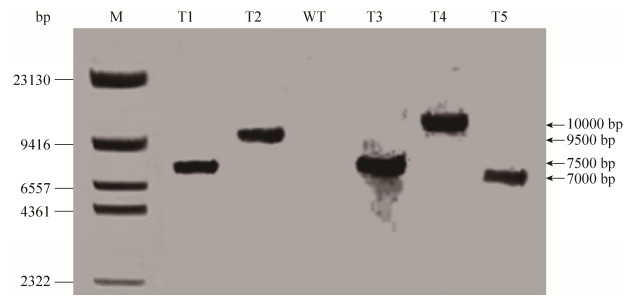 |
| 图 8 寡雄腐霉转化子Southern blot分析 Figure 8 Southern blot analysis of P. oligandrum transformants. T1–T5: transformants of P. oligandrum; WT: Wild type of P. oligandrum. |
| 图选项 |
将寡雄腐霉抗性转化子菌体与野生型菌体置于荧光显微镜GFP滤光片下进行荧光显微镜观察,可见到转化菌丝发出明亮的绿色荧光,而野生型菌丝只有微弱的自荧光现象(图 9)。表明研究所得寡雄腐霉转化子可以正常表达绿色荧光蛋白,egfp基因已整合入其基因组中。
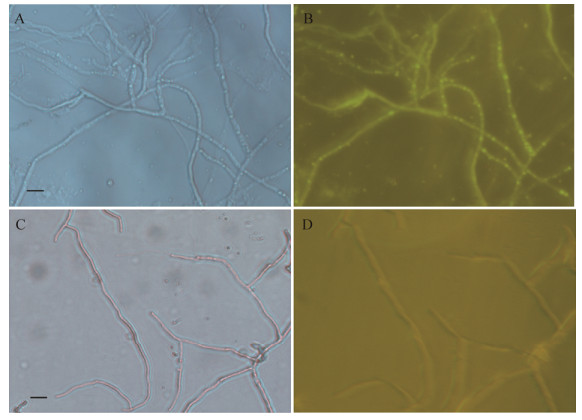 |
| 图 9 荧光倒置显微镜观察寡雄腐霉转化菌株菌丝(400×) Figure 9 Observations of transformants of P. oligandrum using fluorescent microscope (400×). A: The mycelia of transformants under bright field image. B: The mycelia of transformants under the fluorescence microscopy. C: The mycelia of wild type under bright field image. D: The mycelia of wild type under the fluorescence microscopy. Scale bar=500 μm |
| 图选项 |
3 讨论 与其他转化方法相比,农杆菌介导的真菌遗传转化具有诸多优势:农杆菌可以转化完整的细胞,如孢子、菌丝、子实体等,这就免去了制备原生质体的麻烦;农杆菌转化系统转化效率高,农杆菌介导的淡紫拟青霉菌每106个孢子能获得高达2400个转化子[15],比其他真菌转化方法的转化率高很多;产生的突变体大部分为单拷贝插入突变体;而且该方法产生的转化子稳定。真菌孢子是一种有繁殖作用的休眠细胞,能直接发育成新个体,因其为独立单核细胞、性状稳定、容易获得,常作为丝状真菌的转化受体,可以得到后代不分离的转化子,避免了真菌菌丝多核所造成的转化子不稳定的难题。故本研究选用寡雄腐霉真菌孢子作为转化受体,得到130个转化子/106个孢子的转化效率,检测的5株转化子菌株均为单拷贝插入。
农杆菌介导的遗传转化已在多种丝状真菌中得到成功应用,但转化效率在不同的真菌种属之间存在显著差异。我们在对寡雄腐霉进行农杆菌介导的遗传转化时参考过同属于腐霉属的贵阳腐霉转化条件[16],可是未能转化成功,可见即使是同属的真菌,其转化条件也不尽相同。最终的转化结果受到很多因素的影响,如真菌菌种、孢子量、农杆菌菌株类型、AS浓度、诱导培养基、农杆菌侵染浓度、共培养方式、共培养pH值、共培养温度和共培养时间等。大量研究表明农杆菌AGL-1菌株的vir毒力很强,对真菌的侵染力较好,菌液侵染浓度OD600在0.3–0.8之间,而侵染后的共培养方式几乎都采用固体平板暗培养,大都用潮霉素抗性作为筛选标记,得到的转化子数差异很大(表 1)[11–29]。本研究选择了常用的3种农杆菌菌株(EHA105、AGL-1、LBA4404) 分别侵染寡雄腐霉,发现虽然AGL-1菌株是vir毒力很强的菌株,可是其对寡雄腐霉菌的侵染转化效果不如EHA105菌株,对于寡雄腐霉来说LBA4404菌株的侵染效果不理想;在本研究转化过程中这3种农杆菌菌株适宜的转化条件基本相同,只是不同农杆菌菌株适宜的侵染浓度有所差异。选用PDB、1/2MS液体以及其他2种文献中常用的诱导培养基进行比较,发现PDB作为诱导培养基是很好的选择,转化效果好也易于配制。在大多数文献中报道转化共培养的pH值大于等于5.3时转化效果好(表 1),而我们发现寡雄腐霉转化时pH值在5.0的转化率要显著高于pH值在5.3的,pH值大于5.8就无法转化成功。AS有助于寡雄腐霉的遗传转化,在预培养阶段和共培养阶段都需要添加AS来促进寡雄腐霉的转化,而AS在共培养阶段的影响效果更显著一些,若是在共培养阶段不添加AS,就无法成功获得转化子;当AS浓度在300 μmol/L时获得的转化子最多,超过300 μmol/L时不利于转化子的获得,高浓度的AS由于存在细胞毒性会降低转化的效率。另外,本研究过程添加了“恢复培养”阶段,目的是让被农杆菌侵染后的寡雄腐霉经历恢复培养阶段使其活力增强,通过比较发现,不经历恢复培养直接将共培养后的寡雄腐霉进行抗性选择所获得的转化子较少,而恢复培养阶段可以显著促进被侵染后的寡雄腐霉菌体恢复生长活力增加转化效果。
表 1. 农杆菌介导的真菌遗传转化研究 Table 1. Genetic transformation in fungi mediated by Agrobacterium tumefaciens
| A.tumefaciens | Fungus | Receptor | Resistance | Concentration | OD600 | Proportion | Co-cultivation medium | Co-cultivation pH | Co-cultvation temperation/℃ | Co-cultrvation time/h | Transformations/106 spores | Reference |
| AGL-1 | ||||||||||||
| Aureobasidium pullulans | spore | Barr | 106-109 | 0.8 | 1:1 | Filter membrance | 5.3 | 22 | 60 | 800-1200 | [11] | |
| Fusarium oxysporum | spore | Hygr | 106 | 0.3-0.45 | 1:1 | Filter paper scrip | 28 | 36 | 1173 | [12] | ||
| Gliodadium sp. | spore | Hygr | 107 | 0.6 | 4:1 | Filter membrance | 53-5.8 | 24 | 72 | 50-100 | [13] | |
| Paecilomyces lilacinus | spore | G418r | 106 | 0.6 | 1:1 | Liquid shaking | 5.5 | 25 | 16 | 1000-2400 | [15] | |
| Rhizoctonia solani | spore | Hygr | 107 | 0.3 | 1:1 | NC film | 5.6-5.8 | 25 | 20 | 100 | [17] | |
| Pestalotiopsis hetemconis | spore | Hygr | 107 | 0.3 | 1:1 | Cellophane | 25 | 48 | 200-300 | [18] | ||
| Trichoderma virens | spore | Hygr | 106 | 0.6 | 1:1 | NC film | 22 | 48 | 385-460 | [19] | ||
| Trichoderma atroviride | spore | Hygr | 107 | 0.8 | 1:1 | Cellophane | 5.3 | 25 | 48 | 500 | [20] | |
| Chaetomiim globosum | spore | Hygr | 106-109 | 0.6-0.8 | 1:1 | Twice plate | 27 | 48 | 600-1800 | [21] | ||
| EHA105 | ||||||||||||
| Penicillium lilacinus | spore | G418r | 108 | 0.6-0.8 | 1:1 | Liquid standing | 5.3 | 28 | 48 | 140-156 | [22] | |
| Colletotrichum gloeosporioides | spore | Hygr | 105 | 0.6-0.8 | 1:1 | Cellophane | 5.5 | 22 | 24 | 43.9 | [14] | |
| Paecilomyces lilacinus | spore | G418r | 106 | 0.6 | 1:1 | Liquid shaking | 5.5 | 25 | 16 | 1000-2400 | [15] | |
| Trichoderma hamamm | spore | Hygr | 106 | 1.6 | 1:1 | Filter paper | 5.3 | 24 | 48 | 60-150 | [23] | |
| Fusarium oxysporum | spore | Hygr | 106 | 0.6 | 1:1 | Filter paper | 5.5 | 28 | 48 | 68 | [24] | |
| Rhizoctonia solani | protoplast | Hygr | 106 | 0.4-0.6 | 200:1 | Liquid on plate | 12 | 24 | 46 | 600 | [25] | |
| LBA4404 | ||||||||||||
| Pythium guiyangense | spore | Hygr | 108 | 0.15 | 1-100:1 | Filter membrance | 5.3 | 24 | 48 | [16] | ||
| Aspergillus niger | spore | Hygr | 107 | 0.8 | 1:1 | Filter paper | 5.8 | 24 | 48 | 830 | [26] | |
| Penicillium simplicissimum | spore | Hygr | 106 | 0.8 | 1:1 | Cellophane | 5.3 | 28 | 48 | 5 | [27] | |
| C58C1 | ||||||||||||
| Magnaporthe grisea | spore | Hygr | 105 | 0.6-0.8 | 1:1 | NC film | 5.3 | 28 | 96 | 28.9 | [28] | |
| Didymella bryoniae | spore | Hygr | 106 | 0.15 | 1:1 | NC film | 5.5 | 22-25 | 48 | 4.5 | [29] |
表选项
利用此转化系统可广泛深入地对生防真菌寡雄腐霉进行遗传转化研究,建立突变体库,筛选出有价值的工程菌株。有助于克隆生防功能基因并对其分子调控机理深入研究,为培育优质高效的生防工程菌提供技术支撑。
References
| [1] | Bradshaw-Smith RP, Whalley WM, Craig GD. Interactions between Pythium oligandrum and the fungal footrot pathogens of peas. Mycological Research, 1991, 95(7): 861-865. DOI:10.1016/S0953-7562(09)80050-6 |
| [2] | Berry LA, Jones EE, Deacon JW. Interaction of the mycoparasite Pythium oligandrum with other Pythium species. Biocontrol Science and Technology, 1993, 3(3): 247-260. DOI:10.1080/09583159309355280 |
| [3] | Picard K, Tirilly Y, Benhamou N. Cytological effects of cellulases in the parasitism of Phytophthora parasitica by Pythium oligandrum. Applied and Environmental Microbiology, 2000, 66(10): 4305-4314. DOI:10.1128/AEM.66.10.4305-4314.2000 |
| [4] | Martin FN, Hancock JG. The use of Pythium oligandrum for biological control of Preemergence damping-off caused by P. ultimum. Phytopathology, 1987, 77(7): 1013-1020. |
| [5] | Bro?ová J. Exploitation of the mycoparasitic fungus Pythium oligandrum in plant protection. Plant Protection Science, 2002, 38(1): 29-35. |
| [6] | Davanlou M, Madsen AM, Madsen CH, Hockenhull J. Parasitism of macroconidia, chlamydospores and hyphae of Fusarium culmorum by mycoparasitic Pythium species. Plant Pathology, 1999, 48(3): 352-359. DOI:10.1046/j.1365-3059.1999.00345.x |
| [7] | Le Floch G, Rey P, Benizri E, Benhamou N, Tirilly Y. Impact of auxin-compounds produced by the antagonistic fungus Pythium oligandrum or the minor pathogen Pythium group F on plant growth. Plant and Soil, 2003, 257(2): 459-470. DOI:10.1023/A:1027330024834 |
| [8] | Hase S, Shimizu A, Nakaho K, Takenaka S, Takahashi H. Induction of transient ethylene and reduction in severity of tomato bacterial wilt by Pythium oligandrum. Plant Pathology, 2006, 55(4): 537-543. DOI:10.1111/ppa.2006.55.issue-4 |
| [9] | Masunaka A, Sekiguchi H, Takahashi H, Takenaka S. Distribution and expression of elicitin-like protein genes of the biocontrol agent Pythium oligandrum. Journal of Phytopathology, 2010, 158(6): 417-426. |
| [10] | Horner NR, Grenville-Briggs LJ, van West P. The oomycete Pythium oligandrum expresses putative effectors during mycoparasitism of Phytophthora infestans and is amenable to transformation. Fungal Biology, 2012, 116(1): 24-41. DOI:10.1016/j.funbio.2011.09.004 |
| [11] | Tu GW, Wang YK, Feng J, Li XR, Guo MJ, Zou X. Agrobacterium tumefaciens-mediated transformation of Aureobasidium pullulans and high-efficient screening for polymalic acid producing strain. Chinese Journal of Biotechnology, 2015, 31(7): 1063-1072. (in Chinese) 涂光伟, 王永康, 冯骏, 李晓荣, 郭美锦, 邹祥. 农杆菌介导的出芽短梗霉遗传转化及高效筛选聚苹果酸高产菌株. 生物工程学报, 2015, 31(7): 1063-1072. |
| [12] | Ren JJ, Wang LX, Gao HB, Lü GY. Agrobacterium tumefaciens-mediated transformation of Fusarium oxysporum f. sp. niveum. Plant Protection, 2015, 41(1): 93-97. (in Chinese) 任俊杰, 王丽霞, 高洪波, 吕桂云. 农杆菌介导的西瓜枯萎病菌遗传转化. 植物保护, 2015, 41(1): 93-97. |
| [13] | Wang YL, Hu PJ, Li EW, Liu XZ, Che YS, Liu G. Genetic transformation of the fungus Gliocladium sp. mediated by Agrobacterium tumefaciens. Acta Microbiologica Sinica, 2013, 53(11): 1233-1239. (in Chinese) 王艳玲, 胡鹏杰, 李二伟, 刘杏忠, 车永胜, 刘钢. 农杆菌介导的粘帚菌遗传转化. 微生物学报, 2013, 53(11): 1233-1239. |
| [14] | Wang HY, Li BH, Zhang QM, Li GF, Dong XL, Wang CX. Transformation of Agrobacterium tumefaciens-mediated Colletotrichum gloeosporioides and identification of transformants. Scientia Agriculture Sinica, 2013, 46(9): 1799-1807. (in Chinese) 王海艳, 李保华, 张清明, 李桂舫, 董向丽, 王彩霞. 农杆菌介导苹果炭疽病菌的遗传转化及转化子鉴定. 中国农业科学, 2013, 46(9): 1799-1807. |
| [15] | Wang XZ, Piao CG, Li H, Wang LF, Guo MW, Li Y, Liu XL. Establishment of Agrobacterium tumefaciens-mediated transformation system of Paecilomyces lilacinus. Scientia Silvae Sinicae, 2010, 46(10): 95-102. (in Chinese) 王曦茁, 朴春根, 李虹, 汪来发, 郭民伟, 李永, 刘晓莉. 根癌农杆菌介导的淡紫拟青霉遗传转化体系的建立. 林业科学, 2010, 46(10): 95-102. DOI:10.11707/j.1001-7488.20101016 |
| [16] | Liu P, Zheng HL, Zhao JN, Wu JW, Su XQ. Improvement of Pythium guiyangense by constructive expression of Pr1 gene. Microbiology China, 2012, 39(6): 756-763. (in Chinese) 刘萍, 郑慧玲, 赵竟男, 吴建伟, 苏晓庆. 根癌农杆菌介导的Pr1基因在贵阳腐霉的组成性表达. 微生物学通报, 2012, 39(6): 756-763. |
| [17] | Yang YQ, Yang M, Li MH, Li Y, He XX, Zhou EX. Establishment of Agrobacterium tumefaciens-mediated transformation system for Rhizoctonia solani AG-1 I A, the causal agent of rice sheath blight. Chinese Journal of Rice Science, 2010, 24(6): 617-622. (in Chinese) 杨迎青, 杨媚, 李明海, 李勇, 贺晓霞, 周而勋. 根癌农杆菌介导的水稻纹枯病菌转化系统的建立. 中国水稻科学, 2010, 24(6): 617-622. |
| [18] | Zhang LP, Ye JR, Li YY, Huang L, Xu JT, Zhang Y. Agrobacterium tumefaciens mediated transformation system for Pestalotiopsis heterocornis. Journal of Nanjing Forestry University (Natural Science Edition), 2012, 36(1): 28-32. (in Chinese) 张林平, 叶建仁, 李月阳, 黄麟, 许剑涛, 张扬. 根癌农杆菌介导的异角状拟盘多毛孢菌转化系统研究. 南京林业大学学报(自然科学版), 2012, 36(1): 28-32. |
| [19] | Liu LM, Wang L, Huang SW, Hou EQ, Xiao DF. Agrobacterium tumefaciens-mediated transformation of Trichoderma virens and screening for defective mutants in hyperparasitism. Genomics and Applied Biology, 2013, 32(5): 562-568. (in Chinese) 刘连盟, 王玲, 黄世文, 侯恩庆, 肖丹凤. 农杆菌介导的绿木霉遗传转化及重寄生缺陷突变体的筛选. 基因组学与应用生物学, 2013, 32(5): 562-568. |
| [20] | Sun WL, Hu XL, Wu MZ, Chen J, Liu P, Chen YP. Agrobacterium tumefaciens-mediated transformation (ATMT) of Trichoderma atroviride T23. Journal of Shanghai Jiaotong University (Agricultural Science), 2009, 27(5): 489-493. (in Chinese) 孙文良, 胡晓璐, 吴萌章, 陈捷, 刘鹏, 陈云鹏. 根癌农杆菌介导的深绿木霉菌T23遗传转化研究. 上海交通大学学报(农业科学版), 2009, 27(5): 489-493. |
| [21] | Gao XX, Yang Q. Transformation of gene Cry Ⅰ A(b) mediated by Agrobacterium tumefaciens in Chaetomium globosum. Journal of Agro-Environment Science, 2005, 24(1): 22-25. (in Chinese) 高兴喜, 杨谦. 根癌农杆菌介导的Cry Ⅰ A(b)基因在毛壳菌中的转化. 农业环境科学学报, 2005, 24(1): 22-25. |
| [22] | Wang JP, Wang JX, Liu F, Pan CS. Transformation of enhanced green fluorescent protein gene in Paecilomyces lilacinus mediated by Agrobacterium tumefaciens. Chinese Journal of Biotechnology, 2010, 26(5): 630-634. (in Chinese) 王阶平, 汪家旭, 刘凡, 潘沧桑. 根癌农杆菌介导的增强型绿色荧光蛋白基因在淡紫拟青霉中的转化. 生物工程学报, 2010, 26(5): 630-634. |
| [23] | Huang YL, Jiang XL, Tian YL, Ye XB, Guo P, Zhu CX. The optimization of Agrobacterium tumefaciens mediated Trichoderma harzianum transformation system and chariaterization analysis of antagonistic mutants. Chinese Journal of Biological Control, 2009, 25(3): 233-238. (in Chinese) 黄亚丽, 蒋细良, 田云龙, 叶小波, 郭萍, 朱昌雄. 农杆菌介导的哈茨木霉T-DNA转化系统优化及拮抗能力突变子的性质分析. 中国生物防治, 2009, 25(3): 233-238. |
| [24] | 范金霞. 木糖发酵产乙醇尖孢镰刀菌筛选和基因工程菌构建. 哈尔工业大学博士学位论文, 2011. |
| [25] | 孙志光. 农杆菌介导转化水稻纹枯病菌原生质体体系的构建及优化. 四川农业大学硕士学位论文, 2012. |
| [26] | Li M, Liu M, Huang YY, Zhou LY, Sun X, Lu FP. Establishment and optimization of Agrobacterium tumefaciens-mediated transformation system of Aspergillus niger. China Biotechnology, 2012, 32(1): 56-63. (in Chinese) 黎明, 刘萌, 黄云雁, 周丽颖, 孙昕, 路福平. 根癌农杆菌介导的黑曲霉遗传转化体系的建立及优化. 中国生物工程杂志, 2012, 32(1): 56-63. |
| [27] | Zhu YH, Wu K, Zheng M, Jin R, Liao HD, Liu XM. Agrobacterium tumefaciens-mediated transformation of the Penicillium simplicissimum H5. Journal of Hunan University (Natural Sciences), 2010, 37(10): 72-76. (in Chinese) 朱咏华, 吴康, 郑芒, 靳冉, 廖红东, 刘选明. 根癌农杆菌介导的丝状真菌简青霉遗传转化的研究. 湖南大学学报(自然科学版), 2010, 37(10): 72-76. |
| [28] | Zhang JH, Liu Y, Han YT, Pan CQ, Wang ZY, Zhang LL, Cui KX. GFP genetic transformation of Magnaporthe grisea mediated by Agrobacterium tumefaciens. Journal of Northeast Agricultural University, 2014, 45(11): 1-7. (in Chinese) 张俊华, 刘烨, 韩雨桐, 潘春清, 王中业, 张淋淋, 崔凯旋. 农杆菌介导稻瘟病菌绿色荧光蛋白(GFP)遗传转化研究. 东北农业大学学报, 2014, 45(11): 1-7. DOI:10.3969/j.issn.1005-9369.2014.11.001 |
| [29] | Ren HY, Fang L, Li G, Ru SJ, Wang HR. Transformation of Didymella bryoniae mediated by Agrobacterium tumefaciens. Chinese Journal of Biotechnology, 2016, 32(6): 802-808. (in Chinese) 任海英, 方丽, 李岗, 茹水江, 王汉荣. 农杆菌介导的甜瓜蔓枯病菌遗传转化体系的建立. 生物工程学报, 2016, 32(6): 802-808. |
