顾磊1,2, 梅泽3, 许科伟2, 汤玉平2, 杨帆2, 孙永革1


1.浙江大学地球科学系, 浙江 杭州 310027;
2.中国石油化工股份有限公司石油勘探开发研究院无锡石油地质研究所, 江苏 无锡 214151;
3.江南大学环境与土木工程学院, 江苏 无锡 214121
收稿日期:2016-04-12;修回日期:2016-07-15;网络出版日期:2016-09-18
基金项目:中国石化股份公司科技部项目(P14042);国家自然科学基金(41202241,41372131,41172112)
*通信作者:孙永革, Tel/Fax:+86-571-87951336;E-mail:ygsun@zju.edu.cn
摘要: [目的]烃类渗漏是地球化学循环中的自然垂直运移现象。油气微生物勘探技术就是通过检测油气微生物在烃类渗漏条件下形成的异常特征进而预测下伏油气藏。然而,上浮烃类比重小,使得油气微生物丰度小,缺乏对油气藏地表烃类与油气微生物的深入认识。[方法]本研究在人工模拟环境下,采用培养法和定量PCR对油气微生物数量和油气功能基因的变化特征进行研究。[结果]人工模拟的不同渗漏环境,在一定的驯化培养周期下分别考察甲烷氧化菌和丁烷氧化菌数量变化特征,甲烷氧化菌与丁烷氧化菌在不同烃源中呈现不同的发育情况;同时,在气态烃高浓度阳性对照和微渗漏条件下,油气指示基因pmoA与bomX基因丰度呈现增长现象,然而经过吹脱实验基因丰度仍能指示出曾经发育的油气微生物,在油气微生物勘探检测分析时间尺度上精度高于数量水平的检测。[结论]本研究考察了土壤中油气微生物的数量和功能基因变化特征,为烃类渗漏与油气微生物之间的相关性研究奠定了基础,为油气微生物勘探提供直接实验依据。
关键词: 油气微生物勘探 油气渗漏 定量PCR 气态烃诱导
Changes of microbial abundance and functional genes in oil and gas under gaseous hydrocarbon condition
Lei Gu1,2, Ze Mei3, Kewei Xu2, Yuping Tang2, Fan Yang2, Yongge Sun1


1.Department of Earth Science, Zhejiang University, Hangzhou 310027, Zhejiang Province, China;
2.Wuxi Research Institute of Petroleum Geology, Research Institute of Petroleum Exploration & Production, SINOPEC, Wuxi 214151, Jiangsu Province, China;
3.School of Environment and Civil Engineering, Jiangnan University, Wuxi 214121, Jiangsu Province, China
Received 12 April 2016; Revised 15 July 2016; Published online 18 September 2016
*Corresponding author: Sun Yongge, Tel/Fax:+86-571-87951336;E-mail:ygsun@zju.edu.cn
Supported by the Research Project of Sinopec (P14042) and by the National Natural Science Foundation of China (41202241, 41372131, 41172112)
Abstract: [Objective]Hydrocarbon microseepage is a natural phenomenon that hydrocarbon gases of subsurface petroleum accumulations migrate upward by reservoir pressure.The detection of the activity and distribution of these highly specialized populations can be used to forecast the existence of oil and gas deposits.However, the hydrocarbon-oxidizing bacterial population are usually not predominant in soil samples above the typical onshore oil and gas reservoirs.It is hard to assess the abundance of hydrocarbon-oxidizing bacteria.[Methods]In this study, changes of microbial abundance and functional genes were studied.[Results]Under gaseous hydrocarbon condition, changes of methane and butane oxidizing bacteria were different.Furthermore, changes of functional genes indicated that genome analysis was more proper for microbial anomalies detection.[Conclusion]The profiling data of this study provide a comprehensive insight into gene expression profiles and lay the foundation for optimizing the microbial prospecting technology.
Key words: microbial prospecting for oil and gas hydrocarbon seepage RT-PCR gaseous hydrocarbon inducing
油气微生物勘探技术主要研究近地表土壤层中微生物异常与地下深部油气藏的相互关系[1]。在现代勘探法中,微生物法能为初期勘探提供廉价有效的方法,指示和预测有利勘探区块以降低勘探风险。在勘探成熟区,该技术能将地震勘探查明的地质构造划分成各种含烃级别,并指示油、气和水的分布位置,为油藏开发中的油藏表征服务。油气微生物勘探技术的原理是:在油藏压力的驱动下,油气藏的轻烃气体持续地向地表作垂直扩散和运移,土壤中的专性微生物以轻烃气作为其唯一能量来源。在油藏正上方的地表土壤中非常发育并形成微生物异常。采用该技术可以检测出这种微生物异常并进行预测下伏油气藏的存在[2-6]。
微生物勘探技术的发展完善使各油公司认识到了其发展的价值,并纷纷将之应用到勘探实践中,并取得了很好的勘探成果。由此可见微生物油气勘探技术是一项科技含量高的新技术,是现代生物学技术在油气勘探领域开拓性的应用[7-8]。根据美国地质微生物技术公司的总结,在全球3000多个勘探项目中,采用这种技术方法确定的1100口油气探井,钻探的成功率平均高达80%[9]。
虽然微生物勘探是探测油气微渗漏的有效手段,但也受到一定的限制。由于不同类型油气藏在油源性质、烃类组分、盖层性质、断层发育等各个角度都有所不同,其上方微生物异常的表达也必然有所差异。目前的研究多着重生物地理学水平的异常匹配,缺乏对上浮烃类与微生物相互关系的研究[10-13]。此外,目前对于野外土壤样品油气背景信息的认识还存在一定的不确定性,油气藏运移至地表的烃类必须直接与这些微生物关联。因此,这些检测方法的适用性、准确性和灵敏度还有待进一步评估。本研究在确定油气背景信息的人工模拟模型条件下,研究不同油气藏类型的微生物数量和功能基因变化机制,可为油气微生物勘探理论提供更为直接的实验依据,也为油气微生物群落异常识别技术奠定理论基础。
1 材料和方法 1.1 土壤样品 根据地质资料,确定样品采集地域。样品来自苏北盆地海安凹陷的富安区块,是海安凹陷蕴含油气资源潜力最大的一个次级凹陷,目前已达到形成小型油气田的标准。采样过程中将土样装入已灭菌的密封袋中,低温运输至实验室并保存。共取得油气藏区地表浅层土壤样品48个。土壤样品为亚砂土或亚粘土,土壤湿度为30%。采集原位新鲜土壤后,除去肉眼可见的石块和植物残渣等杂物,并通过研钵研磨过筛,随后测定含水量。称取200 g样品置于微宇宙模拟装置中,将其含水量均调制到40%左右,以保证微生物的生长和繁殖需要。
1.2 模拟培养 微宇宙模拟装置如图 1所示,采用透明钢化玻璃,耐高温高压,其中隔网采用不锈钢材质,可拆卸,隔网孔隙为30-40目。模拟装置进气口用于充入轻烃气体,抽气口用于置换装置内气体。根据甲烷、丁烷、混合轻烃不同的培养条件,充入不同浓度和组分轻烃气体,将微宇宙模拟装置设置为对应的3组,每组2个平行。甲烷培养组充入99%纯度的甲烷;丁烷培养组充入99%纯度的正丁烷气体;混合轻烃组中充入70%体积的甲烷、10%体积的乙烷、10%体积的丙烷气体,10%体积正丁烷气体。模拟装置在模拟过程中放置于30 ℃恒温室内,定期从微宇宙模拟装置中取一定量的土样,用于数量测定和定量PCR考察土样中的指代特定油气指示微生物的功能基因拷贝数。在驯化模拟培养实验结束后,对模拟装置进气口通入压缩空气进行吹脱,使瓶中无轻烃气体的存在,并放置30 d,考察在没有轻烃底物的条件下,土壤样品中已经生长发育的油气微生物数量是否会发生变化。
 |
| 图 1. 微宇宙模拟装置 Figure 1. Physical figure of microcosmic culture bottle. |
| 图选项 |
1.3 土壤总DNA提取 采用FastDNA SPIN Kit for Soil (MP Biomedicals,Santa Ana,CA)试剂盒提取样品总DNA。步骤简述如下:称取1 g土壤样品,按照试剂盒说明书提取DNA,将提取到的DNA溶解于50 μL的ddH2O,通过微量紫外分光光度计(NanoDrop ND-1000UV)测定DNA浓度和纯度(OD260/OD280和OD260/OD230),此外,利用1.2%的琼脂糖凝胶电泳分离5 μL的DNA,分析DNA的完整性。
1.4 微生物培养方法 微生物的平板培养计数,培养基的配置方法据文献[14]所示。分别通过甲烷与丁烷特异性培养,对甲烷和丁烷氧化菌进行数量研究。无机琼脂上的菌落形态主要有2种:有微小的、稍带乳白色浑浊的、光亮的、直径1-2 mm的滴状菌落和较大的、带淡灰白色色彩的菌落,使用全自动菌落计数仪(V2全自动计数仪,杭州迅数科技有限公司)进行形态区分和计数。
1.5 定量PCR 定量PCR扩增的体系:20 μL定量PCR反应体系包括:iTaq SYBR Green Supermix 10 μL,PCR Forward Primer (10 μmol/L) 1 μL,PCR Reverse Primer (10 μmol/L) 1 μL (表 1),DNA模板1 μL,加水补足20 μL。扩增的反应条件:94 ℃ 5.0 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃。
表 1. 功能基因扩增引物 Table 1. Amplification primer of functional genes
| Genes | Primers (5′→3′) |
| pmoA[15] | F:GGNGACTGGGACTTCTGG R:CCGGMGCAACGTCYTTACC |
| bmoX[16] | F:CAAAACGCCRAAGTGCCTGCC R:CGCCTTSACGACTACRGARAGT |
表选项
2 结果和分析 2.1 不同烃浓度下油气指示微生物数量变化特征 在模拟实验中设计了不同烃类浓度下油气指示微生物数量变化特征的实验。实验分为2组,分别在微宇宙培养瓶中充入甲烷气体和丁烷气体,每个微宇宙培养瓶中放置50 g相同质量的原始土壤样品。甲烷充气组分为5个气体浓度梯度,分别为10、100、1000、10000和100000 mg/L;丁烷充气一组也分为5个气体浓度梯度,分别为10、100、1000、10000、100000 mg/L。在3个多月的驯化周期内,进行了5次气体置换,以保证微宇宙培养瓶中碳源和氧气的充足。培养结束后,对不同轻烃浓度下油气指示微生物的数量进行检测分析。
图 2为不同甲烷浓度梯度下甲烷氧化菌数量变化特征。在培养驯化之前,初始样品中甲烷氧化菌数量相同,均为8.2×104 CFU/g。我们可以观察到,培养驯化结束后,5种条件下甲烷氧化菌数量均有了增长,但不同甲烷浓度梯度下的甲烷氧化菌数量呈现出明显的差异,在10 mg/L和100 mg/L浓度下,甲烷氧化菌数量增加较少,分别为1.18×105 CFU/g和1.15×105 CFU/g;在1000 mg/L和10000 mg/L浓度下,甲烷氧化菌数量的增幅较大,分别为1.35×105 CFU/g和1.42×105 CFU/g,其中在10000 mg/L浓度下数量增幅最大,在100000 mg/L下甲烷氧化菌数量增长幅度反而下降,甲烷含量增加到一定的浓度,可能会对甲烷氧化菌的生长发育造成一定的抑制作用。
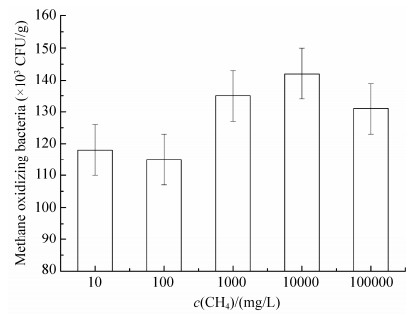 |
| 图 2. 不同甲烷浓度梯度下甲烷氧化菌数量对比 Figure 2. Number of methane oxidizing bacteria under different concentrations of methane. |
| 图选项 |
图 3所示,丁烷氧化菌数量对不同丁烷浓度梯度的响应变化和甲烷氧化菌的结果类似。所不同的是在100 mg/L浓度下,甲烷氧化菌数量反而有较少幅度的减少,而丁烷氧化菌数量的增幅较大,这在一定程度上说明丁烷氧化菌对不同轻烃浓度的适应性较快,随着轻烃浓度升高,其数量也急遽增加,在10000 mg/L浓度下,丁烷氧化菌数量最大,从2.6×104 CFU/g增加到8.8×104 CFU/g;和甲烷氧化菌类似的是,在100000 mg/L浓度下,丁烷氧化菌数量的增幅也有所下降,这也表明浓度较高的丁烷气体对丁烷氧化菌生长发育也会产生一定的抑制作用。
 |
| 图 3. 不同丁烷浓度梯度下丁烷氧化菌数量对比 Figure 3. Number of butane oxidizing bacteria under different concentrations of butane. |
| 图选项 |
这组实验测试结果表明,油气指示微生物在低浓度至高浓度轻烃气体条件下均有增长,低浓度气体下增幅较少,随着气体浓度的增加,其数量也随之增加,但烃气增加到一定的浓度,反之会抑制油气指示微生物的生长发育。在野外地质环境中,烃类微渗漏从地下油气藏扩散至地表的浓度在100 mg/L左右,高浓度阳性对照扩散的浓度在10000 mg/L左右,在此烃气浓度范围内,均会引起地表土壤中油气指示微生物的异常发育。
2.2 不同渗漏条件下油气指示微生物数量变化特征 油气藏中的轻烃组分在地层压力的驱动下向地表作垂直扩散运移。在油气藏保存条件良好,盖层致密、裂缝较少发育的地质环境下,轻烃组分是以微渗漏的方式运移至地表;而油气藏在保存条件较差,裂缝和断层发育的条件下,油气藏中易散失的轻烃组分包括重烃组分在地层压力下会以高浓度阳性对照的方式散失至地表,这也是油苗露出地表的原因。在前面实验中已经获知,在10 mg/L至100000 mg/L轻烃浓度条件下,土壤中的油气指示微生物均有不同程度的增长发育。而在微渗漏(100 mg/L)和高浓度阳性对照(10000 mg/L)这2种渗漏方式下,地表土壤中的油气指示微生物对其响应快慢以及增长幅度如何,尚待进一步研究。通过设置高浓度阳性对照和微渗漏2种轻烃环境,在一定的驯化培养周期(0、15、30、45、60、75、90、100 d)下分别考察甲烷氧化菌和丁烷氧化菌数量变化特征。
如图 4所示,在0 d培养周期的开始,高浓度阳性对照和微渗漏条件下甲烷氧化菌数量和丁烷氧化菌数量差异很小,随着培养周期的增加,2种油气指示微生物数量逐渐增加。在微渗漏环境条件下,甲烷氧化菌和丁烷氧化菌数量在前期增长较缓慢,在45 d左右开始呈现较大幅度增长,在100 d左右两者数量趋于稳定;在高浓度阳性对照环境条件下,甲烷氧化菌和丁烷氧化菌数量从培养刚开始就呈现出较快趋势的增长,明显高于微渗漏条件下的增长趋势,其数量在75 d左右趋于稳定。
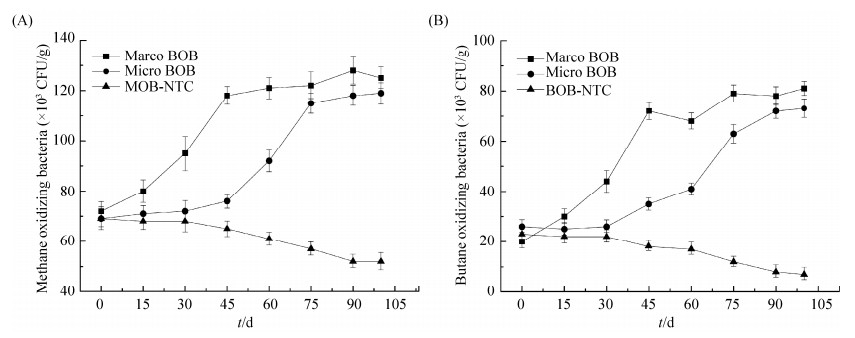 |
| 图 4. 不同渗漏条件下甲烷氧化菌和丁烷氧化菌数量变化曲线 Figure 4. Variation of methane and butane oxidizing bacteria number at different hydrocarbon seepage level. |
| 图选项 |
不同于微渗漏环境条件下的油气指示微生物变化趋势,在高浓度阳性对照条件下丁烷氧化菌数量在60 d时出现了下降趋势。在2种油气指示微生物的数量趋于稳定时,高浓度阳性对照条件下的微生物数量多于微渗漏条件下的微生物数量。这也说明高浓度的烃类气体能够更好的刺激油气指示微生物的生长。
在人工模拟不同类型油气藏条件下,经过一定周期的培养,土壤中的油气指示微生物数量均有增长现象。在驯化培养实验结束后,对培养瓶中的轻烃气体进行吹脱,使瓶中无轻烃气体的存在,并放置30 d,考察在没有轻烃底物的条件下,土壤样品中已经生长发育的油气微生物数量是否会发生变化。如图 5所示,在没有轻烃底物浓度存在的环境条件下,甲烷氧化菌和丁烷氧化菌的数量均有下降,高浓度阳性对照条件下甲烷氧化菌和丁烷氧化菌的数量分别下降了16%和37%,微渗漏条件下甲烷氧化菌和丁烷氧化菌的数量分别下降了6%和15%。
 |
| 图 5. 无轻烃供给条件下甲烷氧化菌和丁烷氧化菌数量变化 Figure 5. Variation of hydrocarbon oxidizing bacteria number at none hydrocarbon inducing condition. |
| 图选项 |
高浓度阳性对照条件下的油气指示微生物数量下降幅度大于微渗漏条件下的微生物数量。在较短周期的高浓度阳性对照条件下,油气指示微生物数量比之微渗漏条件生长发育较快,增幅较大,但若轻烃停止供给或者渗漏结束,高浓度阳性对照条件下的油气微生物数量比之微渗漏条件急遽下降,降幅较大。这也说明了在地质环境条件下,地表土壤中的油气指示菌在微渗漏环境下是一个长期缓慢的驯化过程,在地质年代上,地下油气藏中的轻烃组分只要能够持续渗漏至地表,那么地表土壤中的油气指示菌的数量会达到动态的平衡。从另一角度可知,油气微生物勘探对地表土壤中油气指示微生物数量的检测可以进行剩余油追踪、油田老区块评价等工作。
2.3 不同轻烃组分条件下油气指示基因丰度特征
2.3.1 不同轻烃组分条件下基因丰度 在微宇宙培养瓶中分别充入甲烷、丁烷和不同比例的轻烃气体,分别模拟了在微渗漏条件下不同轻烃组分培养环境。在理想化的条件下考察不同培养条件下,土壤中油气指示基因丰度变化情况。结果显示在微渗漏条件下3种培养条件下,土壤样品中pmoA基因丰度和bomX基因丰度变化情况各不相同。如图 6所示,在甲烷培养条件下,pmoA基因丰度增幅较快,从开始驯化培养到100 d的培养周期内,一直呈现出增长的趋势,没有出现丰度稳定的平台期,由于项目周期较短,因此100 d之后其丰度是否会增加还未知,需要在后期项目中进行跟踪监测。在培养周期内,pmoA基因丰度从12000拷贝到37460拷贝;同样,在甲烷培养条件下,bomX基因丰度基本上没有变化。如图 7所示,在丁烷培养条件下,bomX基因丰度增幅较快,从开始驯化培养到75 d的培养周期内,bomX基因丰度持续增加,在90 d左右趋于平衡,其基因丰度从8500拷贝增加到39380拷贝;而pmoA基因丰度在丁烷培养条件下基本无变化。基因水平的结果与培养条件下的结果有所不同,培养检测中有兼性菌的存在,而分子生物学角度上,油气指示基因各自代谢功能不同,严格遵循自身的代谢途径,所以不同单加氧酶基因在非对应气体存在的条件下并没有增加的趋势。
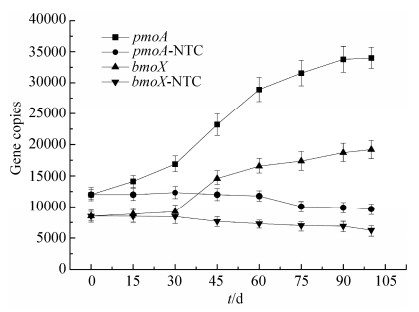 |
| 图 6. 甲烷培养条件下油气指示基因丰度变化曲线(微渗漏条件) Figure 6. Variation of functional genes under methane inducing condition. |
| 图选项 |
 |
| 图 7. 丁烷培养条件下油气指示基因丰度变化曲线(微渗漏条件) Figure 7. Variation of functional genes under butane inducing condition. |
| 图选项 |
以上空白样品中油气指示基因在3个多月的培养周期内其丰度呈现缓慢的下降趋势,说明在无碳源供给的培养环境下,油气指示基因比起培养法中油气指示微生物的数量损耗不明显。 如图 8所示,在混合轻烃培养下,pmoA基因丰度和bomX基因丰度均有不同幅度的增加。由于甲烷组分占70%,C2-C4只占30%,因此甲烷氧化菌可利用的底物浓度较高,其对应的pmoA基因丰度12000拷贝增至33990拷贝,增幅较明显;bomX基因丰度在8500至9190拷贝区间内,浮动幅度微弱。
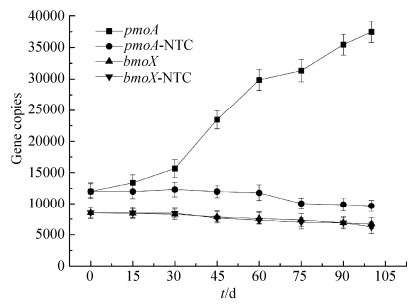 |
| 图 8. 混合轻烃培养条件下油气指示基因丰度变化曲线(微渗漏条件) Figure 8. Variation of functional genes under mixed hydrocarbon inducing condition. |
| 图选项 |
2.3.2 不同烃浓度梯度下油气指示基因丰度变化特征 图 9-A为不同甲烷浓度梯度下pmoA基因丰度变化特征。在培养驯化之前,初始样品中pmoA基因丰度相同,均为12000拷贝。培养驯化培养结束后,5种甲烷浓度梯度条件下pmoA基因丰度均有了增长,但不同甲烷浓度梯度下的pmoA基因丰度呈现出不同的结果,在10 mg/L和100 mg/L浓度下,pmoA基因丰度增加较少,分别为11560拷贝和22760拷贝;在1000 mg/L条件下pmoA基因丰度增加到了42450拷贝;在10000 mg/L浓度下,pmoA基因丰度增加值最大,为58820拷贝;在100000 mg/L下pmoA基因丰度增长幅度反而下降,类似于培养法的计数结果,是因为甲烷含量增加到一定的浓度,可能会对甲烷氧化菌的生长发育造成一定的抑制作用。图 9-B为不同丁烷浓度梯度下bomX基因丰度对不同丁烷浓度梯度的响应变化和甲烷氧化菌的结果类似。所不同的是在100000 mg/L浓度下,pmoA基因丰度有较少幅度的减少,而bomX基因丰度有较小的下降趋势,但丰度依然较大,和10000 mg/L丁烷浓度下的基因丰度相当,分别为60170拷贝和59390拷贝。
 |
| 图 9. 不同烃浓度梯度下油气指示基因丰度变化量 Figure 9. Variation of functional gene at different hydrocarbon concentrations. A: pmoA abundance; B: bomX abundance. |
| 图选项 |
2.3.3 高浓度阳性对照和微渗漏条件下油气指示基因丰度特征 图 10显示,在0 d培养周期的开始,高浓度阳性对照和微渗漏条件下pmoA丰度相同,bomX基因丰度也相同;随着培养周期的增加,2种油气指示基因丰度逐渐增加。在微渗漏环境条件下,pmoA基因和bomX基因在前期增长较缓慢,在30 d左右开始呈现较大幅度增长,在100 d左右其两者丰度趋于稳定;在高浓度阳性对照环境条件下,pmoA基因和bomX基因丰度从培养刚开始就呈现出较快趋势的增长,明显高于微渗漏条件下的增长趋势。从图中也可以观察到,在整个培养周期内,高浓度阳性对照条件下的油气指示基因丰度高于微渗漏条件下的油气指示基因丰度,与培养法的结果相同,同时也说明高浓度的烃类气体能够更好的刺激油气指示微生物的生长。
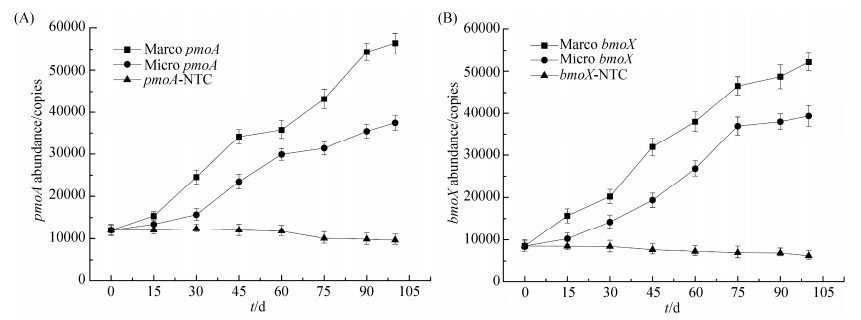 |
| 图 10. 不同渗漏条件下pmoA与bomX基因丰度变化曲线 Figure 10. Variation of functional gene at different hydrocarbon seepage level. A: pmoA abundance; B: bomX abundance. |
| 图选项 |
2.3.4 烃气吹脱后油气指示基因丰度变化 如图 11所示。在没有轻烃底物浓度存在的环境条件下,pmoA基因和bomX基因丰度均有下降,高浓度阳性对照条件下pmoA基因和bomX基因丰度分别下降了13%和12%,微渗漏条件下pmoA基因和bomX基因丰度分别下降了5%和4%。高浓度阳性对照条件下的油气指示基因丰度下降幅度大于微渗漏条件下的微生物数量。
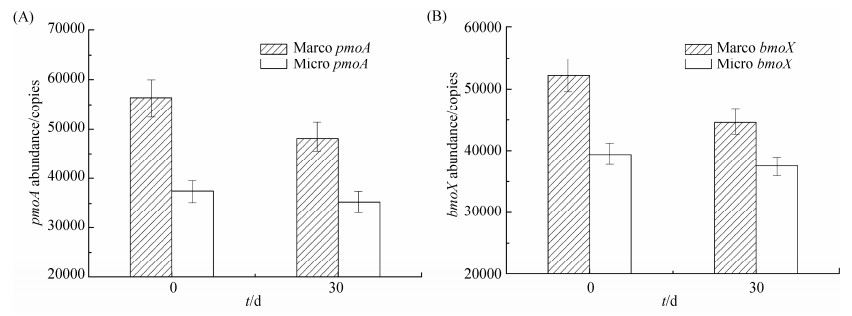 |
| 图 11. 无轻烃供给条件下pmoA与bomX基因丰度变化 Figure 11. Variation of functional gene at none hydrocarbon inducing condition. |
| 图选项 |
3 结论 在较短周期的高浓度阳性对照条件下,油气指示基因比之微渗漏条件生长发育较快,增幅较大,但若轻烃停止供给或者渗漏结束,高浓度阳性对照条件下的油气指示基因比之微渗漏条件降幅较大。和之前的培养法计数结果对比,吹脱实验中油气指示基因丰度的下降幅度比油气指示微生物数量的下降幅度较少,这是因为在培养法中,油气指示微生物一旦缺少轻烃底物的供给,其生长代谢会迅速降低或停止,导致油气指示微生物快速死亡;而死亡后的油气指示微生物的DNA不会在短时期内分解,因此,在无底物供给的相同周期内,油气指示基因丰度的降幅小于平板法中油气指示微生物数量的降幅,然而DNA分解殆尽所需的时间我们暂时还不能给出明确的答案。这从另一方面也表明油气基因定量在油气微生物勘探实验检测分析上的时间维度检测上优于数量检测法。此外,在实际油气勘探过程中土壤生境差异极大,部分实验区微生物普遍较晚发育,因此光使用单指标考察微生物异常情况往往不能反映完整的信息,需要配合多尺度多维度的检测体系,这也是作者所在项目组不停努力攻关的研究方向。
参考文献
| [1] | Wagner M, Piske J, Smit R. Case histories of microbial prospection for oil and gas, onshore and offshore in northwest Europe//Schumacher D, LeSchack LA, eds. Surface Exploration Case Histories:Applications of Geochemistry, Magnetics, and Remote Sensing. American Association of Petroleum Geologists, Studies in Geology No. 48, and Society of Exploration Geophysicists, Geophysical Reference Series No. 11, 2002:453-479. |
| [2] | Zhang CL, Pang XQ, Mei H, Li MW, Xu ZY, Mei BW, Hitzman D. Application of microbial oil surveying to exploration of lithologic gas reservoirs:a case from the Sanhu depression, Qaidam Basin, NW China.Petroleum Exploration and Development, 2010, 37(3): 310–315(in Chinese).张春林, 庞雄奇, 梅海, 黎茂稳, 徐子远, 梅博文, HitzmanD. 微生物油气勘探技术在岩性气藏勘探中的应用--以柴达木盆地三湖坳陷为例.石油勘探与开发, 2010, 37(3): 310–315. |
| [3] | Tucker J, Hitzman D. Detailed microbial surveys help improve reservoir characterization.Oil and Gas Journal, 1994, 92: 65–69. |
| [4] | Suo XD, Shi DY. Present situation and development trend of geochemical exploration for oil and gas.Natural Gas Geoscience, 2008, 19(2): 286–292(in Chinese).索孝东, 石东阳. 油气地球化学勘探技术发展现状与方向.天然气地球科学, 2008, 19(2): 286–292. |
| [5] | Xu FY, Peng DH, Hou EK. Hydrocarbon accumulation and exploration potential in Qaidam Basin.Acta Petrolei Sinica, 2003, 24(4): 1–6(in Chinese).徐凤银, 彭德华, 侯恩科. 柴达木盆地油气聚集规律及勘探前景.石油学报, 2003, 24(4): 1–6. |
| [6] | Zhang CL, Pang XQ, Mei H, Mei BW, Lin RZ, Zhang YP. Identification of microseepage from macroseepage and exploration practice in Changling-Longwanggou area of Zhenba block.Natural Gas Geoscience, 2009, 20(5): 794–800(in Chinese).张春林, 庞雄奇, 梅海, 梅博文, 林壬子, 张艳萍. 烃类微渗漏与宏渗漏的识别及镇巴长岭-龙王沟地区勘探实践.天然气地球科学, 2009, 20(5): 794–800. |
| [7] | Mei BW, Yuan ZH, Wang XY. Microbiological prospecting of oil and gas.China Petroleum Exploration, 2002, 7(3): 42–54(in Chinese).梅博文, 袁志华, 王修垣. 油气微生物勘探法.中国石油勘探, 2002, 7(3): 42–54. |
| [8] | Yuan ZH, Zhang YQ, Zhao Q, Jiang HF, Liu YY, Luo ZH, Li X, Wang ST, Li B, Pan GH, Gao XY, Zhang GL. Progress of microbial oil surveying to exploration of oil and gas in China:a case from Daqing oilfield.Science in China (Series D):Earth Sciences, 2008, 38(S2): 139–145(in Chinese).袁志华, 张玉清, 赵青, 姜洪福, 刘云燕, 罗中华, 李雪, 王石头, 李波, 潘国辉, 高兴友, 张国良. 中国油气微生物勘探技术新进展--以大庆卫星油田为例.中国科学D辑:地球科学, 2008, 38(S2): 139–145. |
| [9] | Mei H, Lin RZ, Mei BW, Hitzman D. Microbial oil-gas detection technologies:theory, practice and application prospect.Natural Gas Geoscience, 2009, 19(6): 888–893(in Chinese).梅海, 林壬子, 梅博文, HitzmanD. 油气微生物检测技术:理论、实践和应用前景.天然气地球科学, 2009, 19(6): 888–893. |
| [10] | Rasheed MA, Lakshmi M, Rao PLS, Kalpana MS, Dayal AM, Patil DJ. Geochemical evidences of trace metal anomalies for finding hydrocarbon microseepage in the petroliferous regions of the Tatipaka and Pasarlapudi areas of Krishna Godavari Basin, India.Petroleum Science, 2013, 10(1): 19–29DOI:10.1007/s12182-013-0245-x. |
| [11] | Yuan ZH, Zhang YQ, Zhao Q, Jiang HF, Liu YY, Luo ZH, Li X, Wang ST, Li B, Pan GH, Gao XY, Zhang GL. New progress of microbial prospecting of oil and gas in China:taking the satellite oilfield in Daqing as an example.Science in China Series D:Earth Sciences, 2009, 52(S1): 152–158DOI:10.1007/s11430-009-5016-6. |
| [12] | Yuan ZH, Fu XN. Microbial prospecting of oil and gas (MPOG) in Taichang-hesheng area of Ordos Basin.Inner Mongolia Petrochemical Industry, 2008, 34(20): 75–76(in Chinese).袁志华, 付晓宁. 鄂尔多斯盆地太昌-和盛区块油气微生物勘探研究.内蒙古石油化工, 2008, 34(20): 75–76. |
| [13] | Deng P, Wang GJ, Liu YL. Experimental study of microbiological oil and gas exploration techniques.Natural Gas Industry, 2003, 23(1): 18–21(in Chinese).邓平, 王国建, 刘运黎. 微生物油气勘探技术的试验研究.天然气工业, 2003, 23(1): 18–21. |
| [14] | Chen ZY, Min H, Chen MC, Zhao YH. Studies on relationships among methane emission and methane-oxidizing and methanogenic bacteria in three types of rice-field soil.Acta Ecologica Sinica, 2001, 21(9): 1498–1505(in Chinese).陈中云, 闵航, 陈美慈, 赵宇华. 不同水稻土甲烷氧化菌和产甲烷菌数量与甲烷排放量之间相关性的研究.生态学报, 2001, 21(9): 1498–1505. |
| [15] | Luesken FA, Zhu BL, Van Alent TA, Butler MK, Diaz RM, Song B, Op den Camp HJM, Jetten MSM, Ettwig KF. pmoA primers for detection of anaerobic methanotrophs.Applied and Environmental Microbiology, 2011, 77(11): 3877–3880DOI:10.1128/AEM.02960-10. |
| [16] | Kotani T, Kawashima Y, Yurimoto H, Kato N, Sakai Y. Gene structure and regulation of alkane monooxygenases in propane-utilizing Mycobacterium sp. TY-6 and Pseudonocardia sp. TY-7.Journal of Bioscience and Bioengineering, 2006, 102(3): 184–192DOI:10.1263/jbb.102.184. |
