郑宇1, 王晓琼1, 赵阳国1,2

 , 冯巩1, 申志聪1
, 冯巩1, 申志聪1 1.中国海洋大学环境科学与工程学院, 山东 青岛 266100;
2.中国海洋大学, 山东省海洋环境地质工程重点实验室, 山东 青岛 266100
收稿日期:2015-12-15;修回日期:2016-02-24;网络出版日期:2016-03-30
基金项目:新世纪优秀人才支持计划(NCET-12-0501);国家水体污染控制与治理科技重大专项(2013ZX07202-007)
*通信作者:赵阳国,Tel:+86-532-66782390;E-mail:ygzhao@ouc.edu.cn
摘要: [目的]为探讨包埋法固定化过程对硫氧化菌群硫化物去除能力及菌群微生物群落结构的影响,[方法]以聚乙烯醇-海藻酸钠-活性炭为载体,对硫氧化菌群进行了固定化,并采用富含硫化物的无机盐培养基,对比固定化与非固定化硫氧化菌群对硫化物的氧化去除能力。同时,利用PCR-DGGE技术,探讨硫氧化菌群在固定化前后以及在硫化物氧化去除过程中微生物群落结构变化。[结果]在对硫氧化菌群进行固定化之后,12 h之内对硫化物的最大去除能力从1000 mg/L下降为600 mg/L。硫氧化菌群的微生物群落结构发生了明显变化,但菌群中的硫氧化菌Catenococcus thiocycli未受影响,硫氧化菌Thioclava pacifica在菌群中的地位反而得到了强化。[结论]受制于底物在载体材料中的扩散迁移效率,硫氧化菌群对硫化物的氧化去除能力在固定化之后有所下降。由于不同微生物对固定化形成的微环境的适应能力以及对载体附着能力的不同,固定化对硫氧化菌群的微生物群落结构产生较大影响。
关键词: 固定化 硫氧化菌群 硫化物消除 微生物群落结构
Effects of immobilization on community structure and function of sulfide oxidizing microbiota
Yu Zheng1, Xiaoqiong Wang1, Yangguo Zhao1,2

 , Gong Feng1, Zhicong Shen1
, Gong Feng1, Zhicong Shen1 1.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, Shandong Province, China;
2.Shandong Provincial Key Laboratory of Marine Environment and Geological Engineering(MEGE), Ocean University of China, Qingdao 266100, Shandong Province, China
Received 15 December 2015; Revised 24 February 2016; Published online 30 March 2016
*Corresponding author: Yangguo Zhao,Tel:+86-532-66782390;E-mail:ygzhao@ouc.edu.cn
Supported by the Program for New Century Excellent Talents in University (NCET-12-0501), and by the National Water Pollution Control and Management Technology Major Project of China (2013ZX07202-007)
Abstract: [Objective]To study the effects of cell immobilization on sulfide degradation ability and microbial community structure.[Methods]Sulfide oxidizing microbiota was immobilized by entrapment on polyvinyl alcoholsodium alginate-activated carbon carrier. Sulfide degradation ability of the immobilized and free sulfide oxidizing microbiota was compared in sulfide-rich minimal medium. PCR-DGGE technique was used to reveal the effects of immobilization on microbial community structure.[Results]The maximum sulfide degradation ability of the sulfide oxidizing microbiota in 12 h decreased from 1000 to 600 mg/L after immobilization. Community structure of the sulfide oxidizing microbiota changed after immobilization, but Catenococcus thiocycli was little affected. Thioclava pacifica was even strengthened in the microbiota after immobilization and sulfide degrading.[Conclusion]In conclusion, limited by substrate diffusion and transfer in carrier material, sulfide degradation ability of the sulfide oxidizing microbiota under high sulfide concentration decreased after immobilization. Also, immobilization could affect the microbial community structure of sulfide oxidizing microbiota due to different adaptation ability to the microenvironment and adhesion ability to the carrier material.
Key words: immobilization sulfide oxidizing microbiota sulfide degradation microbial community structure
在近海养殖区,沉积物中硫化物的浓度与有机质的含量呈显著的正相关性[1]。在养殖过程中,有机饵料的大量投放导致养殖区沉积物甚至上覆水体中硫化物的含量明显高于非养殖区,严重威胁养殖区的生态系统的功能和结构[2]。目前,煤渣颗粒吸附[3]以及三价铁氧化[4]等硫化物的物理化学控制方法存在费用高、持久性差、二次污染等缺点。相比之下,硫化物的生物控制具有环保、高效、持久等优点,是一种较有前景的硫化物控制技术。
微生物固定化技术是利用物理或化学的方法将游离的微生物细胞固定在载体上,使其保持活性并可反复利用的方法[5],现已成功应用于水体、大气、土壤污染防治领域,取得了较好的效果。在细胞固定化技术中,包埋法是使细胞分散到多孔性载体内部,或利用高聚物在形成凝胶时将细胞包埋在内部,从而达到固定细胞的目的,是目前应用最广泛的细胞固定化方法[6]。与游离态微生物相比,固定化微生物更能够耐受海水的冲刷[7],对外界干扰具有较强的抵抗能力[8],沉降性能进一步改善,而且操作更加便捷[9]。目前,硫化物氧化菌的固定及应用多集中于对纯菌的研究,并主要针对气体硫化氢进行处置[10-11]。然而,在海水养殖环境硫化物的整治过程中,关于硫氧化菌群的固定化,以及固定化过程对菌群结构和功能的影响研究还未见报道。
为此,本研究采用包埋法固定化硫氧化菌群,对比固定化与非固定化硫氧化菌群对硫化物去除能力的差异,并探讨固定化过程对硫氧化菌群结构的影响,从而对硫氧化菌群的固定化及其应用提供数据支撑。
1 材料和方法 1.1 材料
1.1.1 硫氧化菌群来源 试验中的硫氧化菌群为本实验室采用液体选择性培养基,从胶州湾海水养殖区沉积物中富集筛选获得,富集培养物使用甘油法保存于-80 ℃。该菌群对硫化物氧化去除的最佳pH为7,最适温度为30 ℃,最佳接种量为10%。
1.1.2 培养基 选择性培养基(g/L):Na2S 1.5,NaHCO3 2.0,KH2PO4 1.2,K2HPO4 1.2,NH4Cl 0.4,MgCl2 0.2,FeC6H5O7 0.01,pH 7.0,使用灭菌的陈海水进行配制。 无机盐培养基:在选择性培养基中,由于Na2S容易被氧化且浓度不容易准确测量,故用不同浓度的Na2S2O3代替选择性培养基中的Na2S[12],制成无机盐培养基,用于菌群对硫化物氧化去除效率的测试,其它成分保持不变。
1.1.3 引物及相关试剂 微生物总DNA提取试剂盒为美国Mobio公司产品,Taq DNA聚合酶、dNTPs、pMD19-T载体、PCR 产物回收试剂盒等分子生物学试剂均购自大连宝生物公司。细菌群落DGGE分析引物为BA101F: 5′-TGGCGGACG GGTGAGTAA-3′和BA534R: 5′-ATTACCGCGG CTGCTGG-3′,对应于E. coli 16S rRNA基因的101-534 bp;其中引物BA101F的5′端带有GC夹,引物由哈尔滨博仕生物合成。 1.2 固定化菌剂的制备 采用包埋法对硫氧化菌群进行固定化,包埋载体中各组分的含量采用本实验室前期试验确定的比例,即聚乙烯醇(polyvinyl alcohol,PVA) 60 g/L,海藻酸钠30 g/L,粉末活性炭4 g/L,交联剂为30 g/L的CaCl2饱和硼酸溶液。固定化方法参考文献[13]进行,具体如下:(1) 将PVA和海藻酸钠溶解于蒸馏水中配制包埋剂,并加入终浓度为4 g/L的粉末活性炭,经121 ℃高温高压灭菌20 min后冷却至室温;(2) 将-80 ℃保存的硫氧化菌群按照10%的接种量接种到选择性培养基中活化,30 ℃,150 r/min培养10 h;(3) 低速离心收集活化好的硫氧化菌群,用0.85%的生理盐水洗涤2-3次,收集湿菌体并称重。按照1∶1的质量比例将湿菌体与冷却至室温的包埋剂进行混合,混合搅匀,使菌体在包埋剂中均匀分布;(4) 用注射器将混合液匀速滴入CaCl2饱和硼酸溶液中并置于4 ℃固定。24 h后将固定好的载体小球使用生理盐水冲洗2-3次,并保存于生理盐水中备用。
1.3 固定化硫氧化菌剂对硫化物去除能力分析 分别接种10 g固定化的硫氧化菌剂以及相同微生物当量的硫氧化菌群到100 mL无机盐培养基,30 ℃、150 r/min振荡培养,12 h后测定培养基中硫化物的浓度。通过固定化与非固定化菌群进行对比,探讨固定化过程对硫氧化菌群硫化物氧化去除能力的影响。无机盐培养基中硫化物起始浓度分别设置为200、400、600、800、1000 mg/L。硫化物的浓度采用碘量法[14]进行测定,测定过程中每组设置3个平行。
1.4 硫氧化菌群结构分析 使用扫描电子显微镜(SEM)对硫氧化菌群在载体上固定化之后的微生物形态进行观察。取少量固定化的硫氧化菌剂,按照参考文献[15]的方法进行预处理之后采用SEM (JEM-1200EX,JEOL Japan)观察硫氧化菌群在载体上的固定情况。
分别取-80 ℃保存的硫氧化菌群的菌液,活化之后的硫氧化菌群的菌液,以及非固定化硫氧化菌群处理600 mg/L的硫化物之后的菌液,离心收集沉淀。将固定化的硫氧化菌剂,以及处理600 mg/L的硫化物之后的菌剂,应用生理盐水冲刷2-3次,置于30 ℃烘箱烘干并碾碎,与离心收集的菌体沉淀一起用于微生物总DNA提取。按照试剂盒说明书,提取上述样品总DNA,使用1%的琼脂糖凝胶电泳和Nanodrop (2000c,Thermo,USA)对DNA的纯度和浓度进行检验。以提取的菌群总DNA为模板,采用细菌16S rRNA基因通用引物BA101F/BA534R进行PCR扩增。PCR扩增以及PCR产物的DGGE分析按照参考文献[16]中的方法进行。为保证PCR扩增的准确性,采用3管平行法进行扩增。DGGE电泳结束后剥胶银染并对图谱进行扫描,使用SPSS软件(SPSS Inc.,Chicago IL)对DGGE图谱进行聚类分析。同时,将DGGE图谱中优势条带进行回收并克隆测序,之后采用RDP数据库(http://rdp.cme.msu.edu/)中的SeqMatch程序进行分类并下载相似序列,以MEGA 5.1构建系统发育树。
1.5 DNA序列登录号 DGGE条带序列已经递交GenBank数据库中,登录号:KU315729-KU315739。
2 结果和讨论 2.1 硫氧化菌群的固定化 以PVA-海藻酸钠-活性炭为载体,采用包埋的方法对硫氧化菌群进行了固定。固定之后的硫氧化菌剂具有良好的凝胶效果,直径约为5 mm,如图 1所示,密度大于水,沉降性好,利于海水养殖区沉积物-水界面层硫化物污染的生态修复。对固定化菌剂的强度测试表明,固定之后的硫氧化菌剂具有一定的弹性,能够耐受一定程度的水力冲刷,这对于复杂的沉积物动力环境是非常必须的。固定化之后的硫氧化菌剂的SEM照片(图 1)显示,载体有较多的孔隙,微生物多吸附在孔隙中载体表面,能够与外界环境进行物质交换,进而保持活性。微生物菌群形态较丰富,既有杆菌,也有球菌,表明硫氧化菌群被成功的固定在载体上。
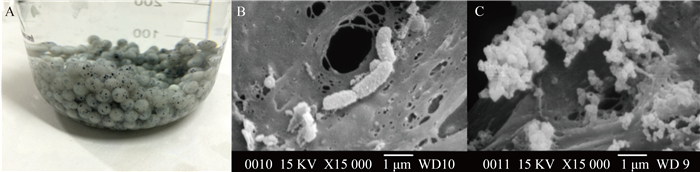 |
| 图 1. 固定化的硫氧化菌剂(A)及载体表面的杆菌(B)和球菌(C) Figure 1. Immobilized sulfide-oxidizing microbiota (A) and Bacillus (B) and Coccus (C) on the carrier. |
| 图选项 |
2.2 固定化过程对硫氧化菌群功能的影响 非固定化与固定化硫氧化菌剂在pH 7.0、30 ℃的条件下对不同起始浓度硫化物的氧化去除能力如图 2。当起始硫化物浓度在600 mg/L以内时,无论是非固定化还是固定化硫氧化菌剂,都能够在12 h之内将硫化物完全氧化去除。而当起始硫化物浓度为800 mg/L和1000 mg/L时,固定化硫氧化菌剂在12 h之内对硫化物的氧化去除率分别下降为75.84%和61.54%,也相当于去除了600 mg/L的硫化物。相比之下,非固定化硫氧化菌群对800 mg/L和1000 mg/L分别为98.06%和95.66%,几乎能够在12 h之内将1000 mg/L的硫化物完全去除。
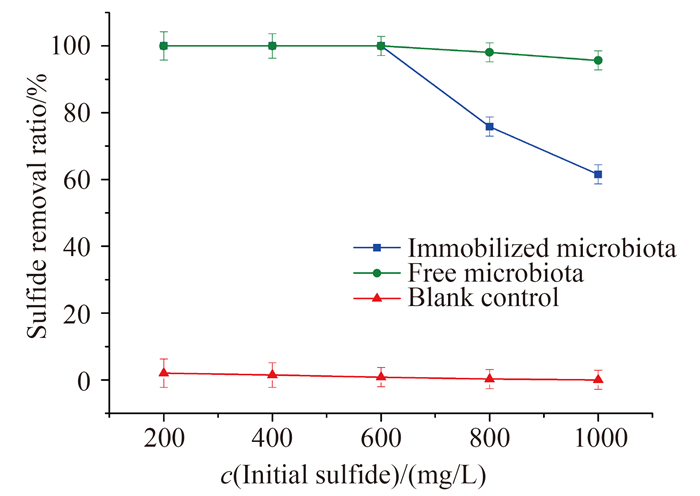 |
| 图 2. 非固定化硫氧化菌群和固定化硫氧化菌剂对不同起始浓度硫化物的氧化去除能力 Figure 2. Sulfide removal efficiency of the free and immobilized microbiota under different initial sulfide concentration. |
| 图选项 |
以上结果表明,当硫化物起始浓度在600-1000 mg/L时,固定化硫氧化菌剂在12 h之内对硫化物的最大氧化去除能力均为600 mg/L,明显低于相同微生物当量的非固定化硫氧化菌群的1000 mg/L,600 mg/L成为固定化硫氧化菌群去除硫化物的最大阈值。非固定化硫氧化菌群能够氧化1000 mg/L硫化物而不受限制,可见对于固定化硫氧化菌群而言,出现最大硫化物去除阈值应该不是电子受体受限。之所以出现该最大阈值,可能是由于硫化物在载体材料中扩散迁移受限[17],导致硫氧化菌群能够接触并氧化的硫化物底物有限,在固定化之后生长速率降低[18]。Omar[19]认为,固定化微生物在培养过程中载体内部底物会呈现梯度浓度,在固定化颗粒内部由于底物的耗尽,微生物停止生长。也有研究表明,在载体对底物的扩散限制较低的实验条件下,固定化微生物的生长速率仍低于游离细胞。除了固定化微生物底物的浓度降低外,固定化微生物微环境的变化,如渗透压和水活度的改变,也可导致微生物生长速率下降[18],从而导致微生物对底物利用能力的下降。
自养型硫氧化微生物通过氧化低价态的硫或硫化物获得能量,当氧气存在时以氧气为电子受体,将硫化物氧化为硫单质或硫酸盐,同时将氧气还原为水[10]。在缺氧状态下,将以硝酸盐为电子受体,将硫化物氧化为硫单质,同时将硝酸盐还原为氮气[20]。硫化物还原性强,极易被氧化性物质氧化,根据图 2,当不加硫氧化微生物菌群时,硫化物浓度几乎没有变化,表明硫化物的去除是通过微生物介导完成的。然而,在本研究中,微生物介导的硫氧化电子受体类型还有待进一步研究。
2.3 固定化对硫氧化微生物群落结构的影响 为研究固定化对硫氧化菌群微生物群落结构的影响,利用PCR-DGGE技术解析固定化和非固定化的硫氧化菌群群落结构的变化,并对DGGE图谱各泳道所代表的群落进行聚类分析,结果如图 3。
 |
| 图 3. 微生物群落的DGGE图谱(A)与聚类分析(B) Figure 3. DGGE profiles of microbial communities (A) and cluster analysis for DGGE profiles (B). Pr, preserved microbial communities; Cl, cultured microbial communities; Re, microbial communities removing sulfide; Im, immobilized microbial communities; Ir, immobilized microbial communities removing sulfide. The marks beside the bands of panel A indicate the bands are following sequenced; the scale on the right of panel B is the divergence distance (%). |
| 图选项 |
根据DGGE及聚类分析图谱发现,-80 ℃保存的硫氧化菌群(Pr),选择性培养基活化之后的硫氧化菌群(Cl)以及去除硫化物后的非固定化硫氧化菌群(Re)之间的微生物群落结构差异较小。这表明已经驯化获得的硫氧化菌剂中微生物群落结构具有很好的稳定性,不会随着外界环境条件的改变而发生较大波动。固定化之后的硫氧化菌剂(Im)以及固定化并进行硫氧化的菌剂(Ir)与上述3种微生物群落结构存在较大的不同,Im与Ir之间也存在着较小的微生物群落结构差异。这表明,通过PVA-海藻酸钠-活性炭包埋的方式固定化硫氧化菌群会对菌群的微生物群落结构产生显著影响,包埋过程具有很强的选择性。这可能是由于固定化过程中不同微生物细胞对载体的附着力不同[21],以及固定化之后不同微生物对微环境的适应能力不同[18],进而导致不同微生物生物量的变化[22],并在微生物群落结构上表现出来。另外,在固定化过程中交联剂中的饱和硼酸也会对微生物产生一定不利影响[23],从而导致不同微生物生物量的差异。还有研究表明,固定化过程也会影响到原核微生物细胞内总核酸的含量,会使特定微生物种群细胞内的DNA含量增加或减少[24],反应在DGGE图谱上也会体现为微生物群落结构的变化。可见,固定化过程对微生物群落的影响是确实存在的,这一结论也得到了国内外研究的佐证,例如解丰波等[21]以活性炭固定微生物之后,活性炭柱上的微生物的群落结构、种类以及数量都具有时序动态性变化;Pramanik等[25]以聚乙烯醇、海藻酸钠、卡拉胶等载体对微生物进行包埋之后,不同载体固定化后的微生物群落的变化也不尽相同。当然,我们也应该注意到,虽然DGGE能够直观地比较和分析微生物群落结构的变化规律,但其仅能够反映有限的优势微生物类群,不能够全面的反映微生物群落的物种组成[26]。
选取DGGE图谱中优势菌群的条带进行回收并克隆测序,将所得序列在RDP数据库进行分类和同源性分析,并与相似序列构建系统发育树如图 4。在测序的11个优势条带中,条带8在5个泳道中均有出现,在微生物群落稳定存在,通过相似序列检索发现其与链状球菌属(Catenococcus)中的C. thiocycli相似性达到99.8%。C. thiocycli是一种从富含硫化物的近海热液区分离出来的硫氧化菌,能够在有机物存在的条件下将包括硫代硫酸盐在内的还原性硫化物氧化为连四硫酸盐[27],连四硫酸盐再被群落中的其他硫氧化菌进一步氧化为硫酸盐。本研究中,C. thiocycli 可能是微生物群落中硫化物氧化去除的主要贡献者,由于养殖海水中往往含有大量的有机物,并富含硫化物,因此C. thiocycli能够在微生物群落稳定存在。同时,由于C. thiocycli能够耐受的pH范围为5.6-7.8[27],因此能够耐受固定化过程中硼酸的酸性环境,固定化对其的影响较小。
 |
| 图 4. DGGE图谱中部分优势条带序列的系统发育树 Figure 4. Phylogenetic tree based on bacterial 16S rRNA gene sequences from DGGE profiles with the closest matches and representative sequences of the GenBank database. |
| 图选项 |
条带10序列与硫膨大杆菌属(Thioclava)中的T. pacifica相似性最高(96.9%)。T. pacifica也是一种从富含硫化物的近海热液区分离出来的硫氧化菌,既能够通过利用多种简单有机物进行异养型代谢来进行生长繁殖,也能够以无机碳为碳源、通过氧化还原性硫化物进行自养型代谢获得能量[28]。从DGGE图谱可以发现,条带10仅在氧化硫化物之后的固定化菌剂(Ir)中占优势,表明T. pacifica在固定化并氧化硫化物之后其在微生物群落中的地位得到强化,这可能是因为其具备较为广泛的代谢途径因而能够更好的适应固定化之后的微环境[18]。另外,从系统发育树可以发现,在硫氧化菌群中存在着大量的非硫氧化菌,主要包括弧菌属(Vibrio),假单胞菌属(Pseudomonas)和海源菌属(Idiomarina)等微生物,这些微生物在海水中广泛存在并能够耐受一定的极端条件[29-31],例如弧菌属的某些类群可以在pH 5.0-10.0的条件下生长[31],海源菌属的某些类群能够耐受最高15%的NaCl盐度[30],因此可以解释其在本研究所富集的硫氧化菌群中存在的原因。同时,某些好氧菌如假单胞菌属(Pseudomonas)[29]和海源菌属(Idiomarina)[30]等微生物可以进一步消耗水中的溶解氧,从而为硫氧化菌氧化代谢硫化物创造条件。
总的说来,结合固定化前后菌群的功能和结构变化,包埋法固定化对硫氧化菌在硫氧化菌群中的生态地位是有利的,当然,若能进一步改善硫化物在载体材料中的迁移扩散效率,将更有利于提高硫氧化能力。但由于养殖环境中硫化物浓度一般均较低[32],未达到载体扩散最高阈值,因此,在实际应用中,底物扩散限制可能较少遇到。总之,固定化硫氧化菌群表现出较好的硫氧化去除能力,将能够适应更苛刻的海洋环境,将是一种非常有前景的沉积物硫化物生态控制方法。
3 结论 本研究以PVA-海藻酸钠-活性炭为载体,采用包埋的方法对具有高效硫化物氧化去除能力的硫氧化菌群进行了固定化,并在实验室条件下研究了固定化对硫氧化菌群功能以及群落结构的影响,得出以下结论:
(1) 固定化之后,硫氧化菌群对硫化物的氧化去除能力有所降低。由于底物在载体材料中会呈现梯度浓度,从载体表面向载体内部底物浓度逐渐降低,因此固定化之后微生物能够利用到的底物的量相比游离态的微生物要少。
(2) 固定化过程对硫氧化菌群的微生物群落结构产生了一定的影响,其主要表现对菌群中的非硫氧化菌影响较大,固定化对硫氧化菌群中的硫氧化菌C. thiocycli影响较小,甚至加强了T. pacifica在菌群中的地位。
参考文献
| [1] | Gao XL, Li PM, Chen CTA. Assessment of sediment quality in two important areas of mariculture in the Bohai Sea and the northern Yellow Sea based on acid-volatile sulfide and simultaneously extracted metal results.Marine Pollution Bulletin, 2013, 72(1): 281–288DOI:10.1016/j.marpolbul.2013.02.007. |
| [2] | Chen KK, Zhu MX, Yang GP, Fan DJ, Huang XL. Spatial distribution of organic and pyritic sulfur in surface sediments of eutrophic Jiaozhou Bay, China: clues to anthropogenic impacts.Marine Pollution Bulletin, 2014, 88(1/2): 284–291. |
| [3] | Asaoka S, Yamamoto T, Yoshioka I, Tanaka H. Remediation of coastal marine sediments using granulated coal ash.Journal of Hazardous Materials, 2009, 172(1): 92–98DOI:10.1016/j.jhazmat.2009.06.140. |
| [4] | Sun JL, Zhou JM, Shang C, Kikkert GA. Removal of aqueous hydrogen sulfide by granular ferric hydroxide-kinetics, capacity and reuse.Chemosphere, 2014, 117: 324–329DOI:10.1016/j.chemosphere.2014.07.086. |
| [5] | Fu N, Peiris P, Markham J, Bavor J. A novel co-culture process with Zymomonas mobilis and Pichia stipitis for efficient ethanol production on glucose/xylose mixtures.Enzyme and Microbial Technology, 2009, 45(3): 210–217DOI:10.1016/j.enzmictec.2009.04.006. |
| [6] | Yu X, Chai LY, Gan XP. Present state and prospect of cell immobilization technique and its applications to wastewater treatment.Industrial Water Treatment, 2001, 21(10): 9–12, 40(in Chinese).于霞, 柴立元, 甘雪萍. 细胞固定化技术及其在废水处理中的应用研究.工业水处理, 2001, 21(10): 9–12, 40. |
| [7] | Hou DY, Shen XR, Luo Q, He Y, Wang QR, Liu Q. Enhancement of the diesel oil degradation ability of a marine bacterial strain by immobilization on a novel compound carrier material.Marine Pollution Bulletin, 2013, 67(1/2): 146–151. |
| [8] | Sekaran G, Karthikeyan S, Gupta VK, Boopathy R, Maharaja P. Immobilization of Bacillus sp. in mesoporous activated carbon for degradation of sulphonated phenolic compound in wastewater.Materials Science and Engineering: C, 2013, 33(2): 735–745DOI:10.1016/j.msec.2012.10.026. |
| [9] | Miranda JS, Silva NCA, Bassi JJ, Corradini MCC, Lage FAP, Hirata DB, Mendes AA. Immobilization of Thermomyces lanuginosus lipase on mesoporous poly-hydroxybutyrate particles and application in alkyl esters synthesis: isotherm, thermodynamic and mass transfer studies.Chemical Engineering Journal, 2014, 251: 392–403DOI:10.1016/j.cej.2014.04.087. |
| [10] | Tang K, Baskaran V, Nematil M. Bacteria of the sulphur cycle: an overview of microbiology, biokinetics and their role in petroleum and mining industries.Biochemical Engineering Journal, 2009, 44(1): 73–94DOI:10.1016/j.bej.2008.12.011. |
| [11] | Tsang YF, Wang L, Chua H. Simultaneous hydrogen sulphide and ammonia removal in a biotrickling filter: crossed inhibitory effects among selected pollutants and microbial community change.Chemical Engineering Journal, 2015, 281: 389–396DOI:10.1016/j.cej.2015.06.107. |
| [12] | Luo JF, Tian GL, Lin WT. Enrichment, isolation and identification of sulfur-oxidizing bacteria from sulfide removing bioreactor.Journal of Environmental Sciences, 2013, 25(7): 1393–1399DOI:10.1016/S1001-0742(12)60179-X. |
| [13] | Cheng Y, Lin HY, Chen ZL, Megharaj M, Naidu R. Biodegradation of crystal violet using Burkholderia vietnamiensis C09V immobilized on PVA-sodium alginate-kaolin gel beads.Ecotoxicology and Environmental Safety, 2012, 83: 108–114DOI:10.1016/j.ecoenv.2012.06.017. |
| [14] | Pawlak Z, Pawlak AS. Modification of iodometric determination of total and reactive sulfide in environmental samples.Talanta, 1999, 48(2): 347–353DOI:10.1016/S0039-9140(98)00253-7. |
| [15] | Chung K, Okabe S. Continuous power generation and microbial community structure of the anode biofilms in a three-stage microbial fuel cell system.Applied Microbiology and Biotechnology, 2009, 83(5): 965–977DOI:10.1007/s00253-009-1990-z. |
| [16] | Zhao YG, Feng G, Bai J, Chen M, Maqbool F. Effect of copper exposure on bacterial community structure and function in the sediments of Jiaozhou Bay, China.World Journal of Microbiology and Biotechnology, 2014, 30(7): 2033–2043DOI:10.1007/s11274-014-1628-x. |
| [17] | Ma C, Qin D, Sun Q, Zhang FF, Liu HQ, Yu CP. Removal of environmental estrogens by bacterial cell immobilization technique.Chemosphere, 2016, 144: 607–614DOI:10.1016/j.chemosphere.2015.09.014. |
| [18] | Wang JL. The effect of immobilization on microbial physiology.Progress in Biotechnology, 2003, 23(7): 62–66(in Chinese).王建龙. 固定化对微生物生理变化的影响.中国生物工程杂志, 2003, 23(7): 62–66. |
| [19] | Omar SH. Oxygen diffusion through gels employed for immobilization. Part 2. In the presence of microorganisms.Applied Microbiology and Biotechnology, 1993, 40(2/3): 173–181. |
| [20] | Cardoso RB, Sierra-Alvarez R, Rowlette P, Flores ER, Gómez J, Field JA. Sulfide oxidation under chemolithoautotrophic denitrifying conditions.Biotechnology and Bioengineering, 2006, 95(6): 1148–1157DOI:10.1002/(ISSN)1097-0290. |
| [21] | Xie FB, Li WG, Zhang DY, Wang GZ, Gao YN, Zhang SM. Analysis of microbial community dynamics and population stability in BEAC procedure.Journal of Harbin Institute of Technology, 2010, 42(12): 1874–1878(in Chinese).解丰波, 李伟光, 张多英, 王广智, 郜玉楠, 张淑梅. BEAC工艺中微生物群落变化和种群稳定性.哈尔滨工业大学学报, 2010, 42(12): 1874–1878. |
| [22] | Lozinsky VI, Plieva FM. Poly (vinyl alcohol) cryogels employed as matrices for cell immobilization. 3. Overview of recent research and developments.Enzyme and Microbial Technology, 1998, 23(3/4): 227–242. |
| [23] | Wang YJ, Yang XJ, Li HY, Tu W. Immobilization of Acidithiobacillus ferrooxidans with complex of PVA and sodium alginate.Polymer Degradation and Stability, 2006, 91(10): 2408–2414DOI:10.1016/j.polymdegradstab.2006.03.015. |
| [24] | Kiy T, Tiedtke A. Effects of immobilization on growth, morphology, and DNA content of the ciliated protozoon Tetrahymena thermophila.FEMS Microbiology Letters, 1993, 106(1): 117–122DOI:10.1111/fml.1993.106.issue-1. |
| [25] | Pramanik S, McEvoy J, Siripattanakul S, Khan E. Effects of cell entrapment on nucleic acid content and microbial diversity of mixed cultures in biological wastewater treatment.Bioresource Technology, 2011, 102(3): 3176–3183DOI:10.1016/j.biortech.2010.10.133. |
| [26] | Xia WW, Jia ZJ. Comparative analysis of soil microbial communities by pyrosequencing and DGGE.Acta Microbiologica Sinica, 2014, 54(12): 1489–1499(in Chinese).夏围围, 贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价.微生物学报, 2014, 54(12): 1489–1499. |
| [27] | Sorokin DY. Catenococcus thiocyclus gen. nov. sp. nov. -a new facultatively anaerobic bacterium from a near-shore sulphidic hydrothermal area.Journal of General Microbiology, 1992, 138(11): 2287–2292DOI:10.1099/00221287-138-11-2287. |
| [28] | Sorokin DY, Tourova TP, Spiridonova EM, Rainey FA, Muyzer G. Thioclava pacifica gen. nov. , sp. nov. , a novel facultatively autotrophic, marine, sulfur-oxidizing bacterium from a near-shore sulfidic hydrothermal area.International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt 3): 1069–1075. |
| [29] | Romanenko LA, Zhukova NV, Lysenko AM, Mikhailov VV, Stackebrandt E. Assignment of ‘Alteromonas marinoglutinosa’ NCIMB 1770 to Pseudoalteromonas mariniglutinosa sp. nov. , nom. rev. , comb. nov..International Journal of Systematic and Evolutionary Microbiology, 2003, 53(Pt 4): 1105–1109. |
| [30] | Wu YH, Shen YQ, Xu XW, Wang CS, Oren A, Wu M. Pseudidiomarina donghaiensis sp. nov. and Pseudidiomarina maritima sp. nov. , isolated from the East China Sea.International Journal of Systematic and Evolutionary Microbiology, 2009, 59(6): 1321–1325DOI:10.1099/ijs.0.005702-0. |
| [31] | Yoshizawa S, Tsuruya Y, Fukui Y, Sawabe T, Yokota A, Kogure K, Higgins M, Carson J, Thompson FL. Vibrio jasicida sp. nov. , a member of the Harveyi clade, isolated from marine animals (packhorse lobster, abalone and Atlantic salmon).International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt 8): 1864–1870DOI:10.1099/ijs.0.025916-0. |
| [32] | Zhu MX, Liu J, Yang GP, Li T, Yang RJ. Reactive iron and its buffering capacity towards dissolved sulfide in sediments of Jiaozhou Bay, China.Marine Environmental Research, 2012, 80: 46–55DOI:10.1016/j.marenvres.2012.06.010. |
