于浩1,2, 刘俊杰2

 , 范国权3, 王光华2
, 范国权3, 王光华2

1.黑龙江八一农垦大学农学院, 黑龙江 大庆 163319;
2.中国科学院黑土区农业生态重点实验室, 中国科学院东北地理与农业生态研究所, 黑龙江 哈尔滨 150081;
3.黑龙江省农业科学院植物脱毒苗木研究所, 黑龙江 哈尔滨 150086
收稿日期:2016-07-01;修回日期:2016-09-20;网络出版日期:2016-10-27
基金项目:国家自然科学基金(41301259)
*通信作者:刘俊杰,Tel:+86-451-86602745,Fax:+86-451-86603736,E-mail:liujunjie@iga.ac.cn
王光华,E-mail:wanggh@iga.ac.cn
摘要: [目的]揭示苜蓿根瘤菌噬菌体的形态学特征及主要壳蛋白g23基因的分布地位,为根瘤菌噬菌体的生态学研究提供数据支持。[方法]以中华苜蓿根瘤菌(Sinorhizobium meliloti USDA1002T)为宿主,采用双层平板法分离土壤环境中的苜蓿根瘤菌噬菌体,利用电子显微镜观察纯化的噬菌体形态特征;提取噬菌体DNA,PCR扩增编码噬菌体壳蛋白的g23基因,构建系统进化树,以形态学鉴定和分子生物学相结合的方法,明确分离获得的苜蓿根瘤菌噬菌体g23基因的系统进化地位。[结果]分离获得了3株噬菌体,头部均呈二十面体,直径大小为81-86 nm,尾部有收缩尾鞘,长度大约为54-70 nm。克隆测序结果显示,获得的3株噬菌体g23基因株间相似度较高,但与可培养的ExoT-、SchizoT-、T-、PseudoT-evens相似度较低。系统进化分析表明,获得的3株噬菌体不隶属于目前已划分的不同环境噬菌体g23基因的分类类群中。[结论]3株噬菌体均属于肌尾噬菌体科的裂性噬菌体,与目前获得的所有噬菌体g23基因相似性较低,属于新的侵染中华苜蓿根瘤菌的噬菌体株。
关键词: 中华苜蓿根瘤菌 根瘤菌噬菌体 g23基因 系统进化
Isolation and phylogenetic analysis of major capsid gene (g23) of bacteriophages infecting Sinorhizobium meliloti
Yu Hao1,2, Liu Junjie2

 , Fan Guoquan3, Wang Guanghua2
, Fan Guoquan3, Wang Guanghua2

1.College of Agronomy, Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang Province, China;
2.Key Laboratory of Mollisols Agroecology, Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Harbin 150081, Heilongjiang Province, China;
3.Virus-free Seedling Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, Heilongjiang Province, China
Received 01 July 2016; Revised 20 September 2016; Published online 27 October 2016
*Corresponding author: Junjie Liu, Tel: +86-451-86602745, Fax: +86-451-86603736, E-mail:liujunjie@iga.ac.cn
Guanghua Wang,. E-mail:wanggh@iga.ac.cn
Supported by the National Natural Science Foundation of China(41301259)
Abstract: [Objective] In order to provide scientific data for studying the ecology of phage infecting Sinorhizobium meliloti, we examined morphological characteristics of rhizobiophages and their phylogenetic status of the major captain protein g23.[Methods] Rhizobiophages were isolated by the double-layer plate method with host Sinorhizobium meliloti USDA1002T. The morphological characteristic of rhizobiophages were studied by transmission electron microscope. Meanwhile, rhizobiophage DNA was extracted, and the g23 that encodes the major capsid protein of bacteriophages was chosen as objective gene in PCR amplification.[Results] Three rhizobiophages were isolated, all had an icosahedral head with approximately 81 to 86 nm in diameter and a long contractile tail with 54 to 70 nm in length. Basic local alignment search tool searches in website of national center for biotechnology information (NCBI) revealed that the g23 amino acid sequences obtained in this study had high identity with each other, but had very lower identity with those from T-evens, PseudoT-evens, SchizoT-evens and ExoT-evens. Phylogenetic analysis showed that the isolated g23 sequences formed a unique clade with those clones obtained from different ecosystem.[Conclusion] All results indicated that the isolated rhizobiophages belong to family Myoviridae, a new group of T4 phages, which had lower identity with the g23 clones obtained in different environment.
Key words: Sinorhizobium meliloti rhizobiophage g23 phylogenetic analysis
根瘤菌(rhizobia)是一类广泛分布于土壤中的革兰氏阴性细菌,它可以侵染植物根部形成根瘤,固定空气中的分子态氮形成氨。根瘤菌固氮不仅提高作物产量,节约氮肥,降低生产成本,而且能够提高土壤肥力、改善土壤结构。根瘤菌-豆科植物共生体系是生物固氮中效率最高的,固定的氮素约占生物固氮总量的65%,在农业生产中起着重要的作用[1]。紫花苜蓿作为重要的豆科牧草,随着我国农业结构的调整,其种植面积不断增加,对苜蓿根瘤菌共生体系的研究有助于减少对工业氮肥的依赖,对环境可持续发展有积极意义。
噬菌体是侵染细菌的病毒,是地球上数量最多的生命体,仅在海洋生态系统中数量就高达1030以上。噬菌体在自然生态系统中广泛存在,其数量一般是宿主细菌的10倍左右,被认为是地球上数量最多的病毒类型[2]。噬菌体侵染根瘤菌后可导致根瘤菌的退化与死亡,从而导致固氮效率和作物产量的下降[3-4]。研究表明噬菌体通过直接和间接的作用对根瘤菌产生了影响,噬菌体通过对根瘤菌的侵染产生了大量的无效根瘤菌[5],侵染作用直接导致了根瘤菌数量明显下降[6]。然而,目前关于噬菌体与宿主间侵染关系和噬菌体的遗传基因特征研究较少。原因在于,到目前为止在噬菌体中没有发现诸如细菌的16S rRNA基因保守序列可以设计引物,解析噬菌体基因多样性[7]。其次,由于以目标菌株为诱饵,从环境中直接分离噬菌体和噬菌体纯化过程中发生的侵染能力退化原因[8],导致噬菌体的研究进展相对滞后于宿主细菌。
最近研究表明,某些噬菌体家族的结构和功能蛋白质氨基酸片段序列高度保守,利用这些保守片段氨基酸序列设计简并性引物,可以通过PCR扩增不同家族噬菌体基因序列,用于研究噬菌体的基因多样性[9]。目前报道较多的是g23基因,该基因编码肌尾噬菌体科T4型噬菌体主要壳蛋白[10],利用引物MZIA1Bis和MZIA6,采用PCR技术从海洋[10]、湖泊[11-12]、稻田[13-17]和旱地黑 土[18]等环境中已经扩增出许多噬菌体的g23基因,并发现不同环境中获得的g23基因差别很大[19],表明g23基因对T4型噬菌体的分子学鉴定具有很好的指示作用。鉴于此,本文以苜蓿根瘤菌模式菌株USDA1002T (16S rRNA基因核苷酸登录号X67222)为宿主,采用双层平板培养法从土壤环境中分离根瘤菌噬菌体,利用电镜观察噬菌体形态特征,采用PCR-克隆测序技术,解析噬菌体g23基因序列组成及进化地位,为根瘤菌噬菌体基因多样性研究提供数据支持。
1 材料和方法 1.1 供试材料
1.1.1 供试菌株及土壤病毒溶液: 供试菌株中华苜蓿根瘤菌(Sinorhizobium meliloti USDA1002T)由中国农业大学农业部农业微生物资源及其应用重点开放实验室提供。供试土壤采自中国科学院东北地理与农业生态研究所试验田(45°41′N,126°38′E),混匀后取5 g新鲜土壤与5 mL NA (葡萄糖15 g,酵母粉1 g,胰蛋白胨5 g,牛肉浸膏 3 g,pH 7.2)液体培养基混合,置于50 mL离心管涡旋混匀,30 °C静置过夜,混合液12000xg离心15 min,上清用0.22 μm滤膜过滤,收集过滤液为土壤病毒溶液。 1.2 噬菌体的获得、纯化和浓缩 噬菌体的侵染实验参照文献[20]方法进行。将过滤后的土壤病毒液1.0 mL与0.2 mL对数生长期的宿主菌液混合,然后注入5 mL YMA (KH2PO4 0.25 g,K2HPO4 0.25 g,MgSO4·7H2O 0.20 g,pH 7.0)液体培养基中振荡培养48 h,12000xg离心15 min,上清液经0.22 μm滤膜过滤后获得根瘤菌噬菌体原液。取1.0 mL噬菌体原液与0.2 mL对数生长期的宿主菌液混匀,室温放置15 min,再与6 mL冷却至47 °C的琼脂浓度为0.4%的YMA半固体培养基混匀,倒入已凝固的YMA固体培养基平板上制成双层平板,待上层培养基凝固后,置于28 °C培养箱中倒置培养24-48 h,双层平板出现噬菌斑,即获得苜蓿根瘤菌噬菌体。采用重复挑取单个噬菌斑连续与目的宿主细菌悬液培养的方法进行噬菌体纯化。即从长出噬菌斑平板中挑取1个较大的,边缘光滑的噬菌斑溶于2 mL过夜培养的根瘤菌悬液(OD600≈0.6),30 °C、220 r/min振荡培养6 h,8000 r/min离心10 min,上清用0.22 μm微孔滤膜过滤除菌,双层琼脂平板培养重新获 得噬菌斑。如此重复5次即可得到纯化的噬菌体。在双层平板上挑取纯化后的单个噬菌斑溶于 SM [0.1 mol/L NaCl,8 mmol/L MgSO4·7H2O,50 mmol/L Tris-HCl,0.005% (W/V)甘油,pH 7.0]溶液中,置于4 °C冰箱中静置过夜,8000 r/min离心10 min,取上清液1 mL接种于50 mL预培养的对数生长期的宿主菌中,振荡培养12 h,即获得噬菌体的大量培养液。向富集得到的噬菌体液中加入12%的氯仿,涡旋5 min,静置1 h取上清,上清过0.22 μm滤膜,滤液中加入PEG 8000和NaCl到终浓度为10%和0.6%,混匀,置于4 °C冰箱静置24 h后,12000xg离心30 min,弃上清,用300 μL SM缓冲液悬浮沉淀,加入100 μL 1 mol/L KCl。冰浴30 min,离心后,上清即为噬菌体的浓缩液。
1.3 噬菌体的电镜观察 参照文献[21]的研究方法,取10 μL含噬菌体浓缩颗粒的液体滴于铜网上,自然沉淀20 min,用干净滤纸从侧面吸去多余液体,将铜网浸入10 μL 0.2%的磷钨酸(PTA)中对噬菌体染色10 s,滤纸吸去多余染色液,将铜网铺在干净的滤纸片上,待样品干燥后用透射电子显微镜(JEM-1400,JEOL)观察噬菌体形态。
1.4 噬菌体DNA提取 噬菌体DNA的提取方法参照文献[22]。向噬菌体浓缩液中加入DNase和RNase酶,浓度分别达到10 μg/mL后,在37 °C水浴条件下培养4-5 h以消解游离的宿主DNA和RNA。混合液85 °C水浴15 min,以灭活DNase和RNase酶活性,然后再向离心管中分别加入38 μL的10% SDS,7.5 μL的1 mol/L Tris-HCl,15 μL的0.5 mol/L EDTA和2 μL的蛋白酶K (10 mg/mL)。混匀后在55 °C条件下水浴30 min,然后再加入140 μL的 5 mol/L NaCl和150 μL的CTAB/NaCl溶液,65 °C水浴10 min。噬菌体DNA采用PCI溶液和CIA溶液萃取,萃取的水相加入0.6倍体积的异戊醇溶液,放在冰上冰浴1 h,再在12000xg、4 °C条件下离心20 min获得DNA沉淀,DNA沉淀经70%乙醇洗净后,干燥、溶于TE缓冲液中。
1.5 g23基因PCR扩增、纯化及克隆测序 采用简并引物MZIA1bis (5′-GATATTTGIG GIGTTCAGCCIATGA-3′)和MZIA6 (5′-CGCGGTT GATTTCCAGCATGATTTC-3′)[10]扩增g23基因片断。PCR反应条件为:94 °C 3 min;94 °C 45 s,55 °C 45 s,72 °C 1 min,35个循环。将PCR产物全部注入2%的琼脂糖凝胶孔中进行电泳,切下PCR产物的目的条带,将切下的凝胶采用QIAEX Agarose Gel Extraction Kit (QIAGEN)试剂盒进行DNA回收和纯化,然后将纯化后的PCR产物连接到质粒pMD18-T (TaKaRa,大连)上,导入大肠杆菌Escherichia coli DH5α上,PCR反应鉴定阳性克隆,将阳性克隆提交测序公司测序。
1.6 数据分析 对获得的基因序列,利用EMBOSS Transeq Program (http://www.ebi.ac.uk)翻译成氨基酸序列后,在NCBI (http://www.ncbi.nlm.nih.gov/)上进行氨基酸序列比对,检测是否是目的基因序列并进行同源性分析。用ClustalX 1.81软件将本研究获得的g23基因同来源于不同环境的细菌病毒相关基因(已上传于GenBank)进行同源性分析[23],并用MEGA 5.1软件绘制系统进化树[24]。用于本研究构建系统进化树的参考噬菌体g23基因包括已报道的苜蓿根瘤菌噬菌体Meliloti phage ΦM12 g23基因[25]、可培养的T-evens、PseudoT-evens、SchizoT-evens和ExoT-evens的g23基因和来自海洋[10]、南极湖[11]、贝加尔湖[12]、湿地[26]、稻田[17]及旱地[18]不同生态系统中获得的g23基因。本研究获得的g23基因序列提交至NCBI数据库的登陆号为KX456215-KX456217。
2 结果和分析 2.1 苜蓿根瘤菌噬菌体的分离与纯化 通过土壤悬浮液与苜蓿根瘤菌液共培养和双层平板分离得到3株噬菌体。挑取单个噬菌斑经过5次双层平板分离纯化后,得到单一均匀的噬菌斑。3株噬菌体的噬菌斑均为圆形、清晰透明、边缘光滑、不存在同心圆噬菌斑现象,呈现出裂性噬菌体的噬菌斑特征。噬菌斑直径分别约为 0.7、1.2和2.0 mm。3株噬菌体分别命名为MelilotiUSDA1002T phage SMM-1 (图 1-A1)、MelilotiUSDA1002T phage SMM-2 (图 1-A2)和MelilotiUSDA1002T phage SMM-3 (图 1-A3)。
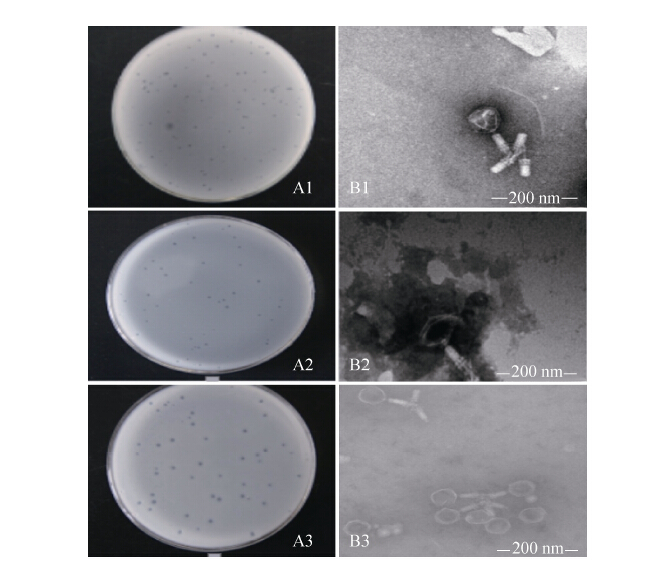 |
| 图 1. 中华苜蓿根瘤菌USDA1002T噬菌体噬菌斑(A)及噬菌体形态电镜照片(B) Figure 1. Plaques (A) and morphological characteristics of rhizobiophagesobserved under transmission electronic microscope (B). |
| 图选项 |
2.2 苜蓿根瘤菌噬菌体形态 纯化后噬菌体经负染后,在透射电镜下的形态如图 1-B所示。3株苜蓿根瘤菌噬菌体的形态均为蝌蚪状,头部呈二十面体立体结构,SMM-1、SMM-2和SMM-3头部直径分别为(85±6)、(81±4)和(86±5) nm。3株噬菌体均含有1个无弯曲的长尾,长度分别约为(62±3)、(54±5)和(70±5) nm (图 1-B1、B2、B3)。根据国际病毒分类委员会制定的噬菌体分类标准,3株噬菌体均属于有尾噬菌体目(Caudovirales),判断可能属于肌尾噬菌体科(Myoviridae)噬菌体。
2.3 噬菌体DNA提取,g23基因的PCR扩增、纯化及克隆分析 苜蓿根瘤菌噬菌体的总DNA的提取如图 2-A所示,3株噬菌体DNA浓度均大于50 ng/μL,条带亮度和纯度可用于PCR扩增。PCR扩增产物如图 2-B所示,由于MZIA1bis和MZIA6引物专一性并不强,3株噬菌体的PCR产物均出现非特异性条带,而g23基因目的条带的位置在300-700 bp[17],本研究将PCR扩增产物片段大小在600 bp左右的产物进行切胶回收(图 2-C)。回收产物经克隆测序后,每株噬菌体各取5个阳性克隆进行测序分析(图 2-D),将翻译获得的氨基酸序列经BLASTp对比分析发现,从3株噬菌体获得的氨基酸序列均属于肌尾噬菌体科gp23蛋白,且重复样品中的5株阳性克隆测序结果相同,表明来源于同1株噬菌体,从而证明本研究噬菌体的纯化效果好。
 |
| 图 2. 根瘤菌噬菌体总DNA (A)、PCR扩增(B)、胶纯化(C)和克隆(D)图谱 Figure 2. Profiles of extracted DNA (A),PCR amplification (B),gel purification (C) and positive clone (D) of rhizobiophages. |
| 图选项 |
2.4 苜蓿根瘤菌噬菌体g23基因的系统进化分析 获得的3株噬菌体的核苷酸序列长度均为462 bp,株间最大有7个核苷酸存在差异,相似度为98% (SMM-1与SMM-2)和99% (SMM-1,-2与SMM-3)。3株噬菌体与文献报道的苜蓿根瘤菌噬菌体Meliloti phage ΦM12 g23基因的相似度仅为54%。噬菌体氨基酸序列在NCBI网站上BLASTp比对后发现,3株噬菌体均与北极冰川环境中获得的g23克隆PR066 (AFN73152)相似度最大,达到72%;与海洋、湖泊、湿地、稻田和旱地黑土不同生态系统中的g23基因的相似性范围分别为34% (AAZ17589-Clone-3754) -57% (AAZ17574-Clone-37323)、22% (ACZ73358) -66% (ACZ73376)、28% (C.laW-Jul28-7)-58% (C.anW- May28-5)、38% (PS-QF-Jun25-1) -62% (PS-AC- Jun25-5)和23% (BLSoil-DH-7) -61% (BLSoil-LS-7)之间;而与可培养的T-evens、PseudoT-evens、SchizoT-evens和ExoT-evens的T4型噬菌体相似性为30%-57%。图 3为本研究获得的3株苜蓿根瘤菌噬菌体和Brewer等[26]报道的Meliloti phage ΦM12 g23基因,与海洋、湖泊和湿地的环境中获得的g23基因构建的系统进化发育树。由图可知,3株苜蓿根瘤菌噬菌体和Meliloti phage ΦM12 g23基因未分布在培养获得的T-evens、PseudoT-evens、SchizoT-evens和ExoT-evens的g23类群中。获得的3株苜蓿根瘤菌噬菌体与未分类的湖泊克隆(ACT78899、ACT78896和ACT78889)和湿地克隆(C.anS-Jul28-8和C.laW-Jul28-7)聚在独立的分支中,而Meliloti phage ΦM12 g23基因和湿地克隆(C.anW-Jul28-15)聚在独立的分支中,但Bootstrap值均低于50,说明本研究获得的苜蓿根瘤菌噬菌体的g23基因不属于海洋、湖泊、湿地中的任一类群中,亲缘关系较远。此外,进一步与中国东北旱地和稻田环境中的g23基因构建的系统进化树分析发现(图 4),3株苜蓿根瘤菌噬菌体分别与旱地黑土g23克隆(BLSoil-HB-14)和稻田g23克隆(PS-AC-Jun25-5)分布在独立的分支中(Bootstrap值<50),而Meliloti phage ΦM12 g23基因单独分布在独立的分支中,说明3株获得的噬菌体g23基因与中国旱地和稻田环境中的g23基因相似度较低,独立于目前已获得的g23基因分类系统中。
 |
| 图 3. 3株噬菌体和Meliloti phage ΦM12 g23基因与海洋、湖泊和湿地g23基因构建的系统进化树 Figure 3. Unrooted phylogenetic tree of g23 amino acid sequencesof three rhizobiophages and Meliloti phage ΦM12[26] with those obtained from marine waters[10],lake waters[11] and wetlands[25]. |
| 图选项 |
 |
| 图 4. 3株噬菌体和Meliloti phage ΦM12 g23基因与中国东北旱地和稻田环境中的g23基因构建的系统进化树 Figure 4. Neighbor-joining phylogenetic tree of g23 gene sequences of three rhizobiophages and Meliloti phage ΦM12[26] with those obtained from upland black soil[18] and paddy field[17] in Northeast China. |
| 图选项 |
3 结论和讨论 根瘤菌噬菌体广泛存在于土壤环境中,通过对寄主的裂解可导致根瘤菌的退化与死亡,对共生固氮体系产生显著影响。Gerretsen等[27]首次从根瘤中分离得到侵染根瘤菌的噬菌体,尽管根瘤菌噬菌体与宿主间的侵染和进化关系还不清楚,但对根瘤菌噬菌体转导作用的研究结果表明,噬菌体在宿主菌之间的遗传物质交换方面起到了重要的桥梁作用[28-29]。Abebe等[4]对噬菌体、根瘤菌以及豆科作物三者之间的关系研究发现,根瘤菌被噬菌体侵染后,有效根瘤菌数量明显降低、结瘤量减少、固氮作用减弱、作物产量也呈明显下降的趋势。我国****徐恒等[30]从我国部分大豆产区分离得到7株侵染大豆根瘤菌的噬菌体,这些噬菌体均是dsDNA病毒,电镜观察呈现4种不同形态,以上的研究结果表明噬菌体对根瘤菌有影响,但关于噬菌体与根瘤间的侵染关系和根瘤菌噬菌体的遗传基因特征研究较少。
微生物基因多样性分布特征是微生物生态学研究的重要内容之一,利用噬菌体某些家族中结构和功能基因的保守氨基酸序列设计引物,研究不同环境中噬菌体基因多样性成为微生物生态学研究的热点。Filée等[10]首次揭示g23基因可以作为有效划分肌尾噬菌体科T4型噬菌体类群的分子标记以来,大量的针对环境噬菌体的研究结果显示,噬菌体基因多样性丰富,其分布受到地理分割和生态进程的双重影响[17]。然而,鉴于噬菌体与细菌间侵染关系的专一性并不强,一种噬菌体可以侵染多种细菌宿主而一种细菌也可被多种噬菌体侵染,所以单纯依靠分子生物学的研究方法也无法明确噬菌体与宿主间的相互关系。为此,通过纯培养获得噬菌体株,利用形态学鉴定与分子生物学相结合的方法可明晰噬菌体与宿主间的侵染关系及揭示其在复杂生态系统中的功能。
细菌病毒按照形态特征划分为21种类型,其中具有尾部特征的被归为有尾噬菌体目(Caudovirales)。90%以上分离获得的可培养噬菌体为有尾噬菌体[31]。有尾噬菌体目按尾部特征可分为肌尾噬菌体科(Myoviridae)、长尾噬菌体科(Siphoviridae)和短尾噬菌体科(Podoviridae)[32]。通常在电镜观察条件下,长尾噬菌体尾部长且弯曲,而肌尾噬菌体相对短且不弯曲(因为具有伸缩结构)。本研究获得3株裂性噬菌体电镜观察显示均呈现出肌尾噬菌体科噬菌体的特征。另外,采用针对肌尾噬菌体科T4型噬菌体的特异引物扩增并获得g23基因,从而从形态和分子角度证明获得的3株噬菌体属于肌尾噬菌体科噬菌体。
获得的3株噬菌体g23基因的株间相似度为98%-99%,与文献报道的苜蓿根瘤菌噬菌体Meliloti phage ΦM12 g23基因的相似度仅为54%,与可培养的T-evens、PseudoT-evens、SchizoT-evens和ExoT-evens的g23基因相似性仅为30%-57%,说明本研究所获得的噬菌体完全不同于目前分离获得的g23基因类群,属于新的噬菌体类群。本研究通过培养获得的3株噬菌体株间相似性较高,可能是因为噬菌体对苜蓿根瘤菌的特异选择性导致的。有研究证明土壤噬菌体的宿主范围非常广,但通过特异宿主在实验室进行分离培养后,噬菌体所侵染的宿主范围变窄,噬菌体反复侵染特异宿主后可能会降低噬菌体侵染其他宿主的能力[33]。Vos等[34]也证明了噬菌体存在“局部适应性(Local adaptation)”现象,噬菌体容易感染来自同一块土壤的细菌,而对其他土壤中的细菌感染能力弱。
本研究获得的噬菌体g23基因与海洋、湖泊、湿地、稻田和旱地黑土不同生态系统中的g23基因的相似性范围仅为22%-66%,表明3株噬菌体与环境中的g23基因亲缘关系较远,不属于任何目前已知的g23基因分类类群。Brewer等[26]对中华苜蓿根瘤菌噬菌体Meliloti phage ΦM12 g23的全基因组测序分析也得到相同的结果,其g23基因组成完全不同于目前通过PCR扩增获得的g23基因类群,说明细菌病毒存在巨大的遗传基因多样性,通过特异宿主分离培养的方法可获得新的噬菌体株。此外,李伟等[35]通过g20基因和pol基因对以鱼腥藻(Anabaena PCC7120)为宿主的噬菌体基因分类进行研究,首次确定了可培养的噬藻体g20基因和pol基因的归属范围。以上的研究证明以目的菌株为“诱饵”,分离培养侵染该宿主的噬菌体株,以编码噬菌体结构或功能的保守蛋白为特异扩增引物,可揭示其与宿主间的侵染关系,解析噬菌体相关基因的系统分类地位,明确噬菌体在环境中发挥的作用。
致谢: 感谢中国农业大学农业部农业微生物资源及其应用重点开放实验室提供的中华苜蓿根瘤菌(Sinorhizobium. meliloti USDA1002T)菌株。
参考文献
| [1] | Chen DM, Zeng SH, Sui XH, Hu YG, Chen WX. Screening of high efficient symbiontic rhizobium on Alfalfa.Pratacultural Science, 2002, 19(6): 27–31(in Chinese).陈丹明, 曾昭海, 隋新华, 胡耀高, 陈文新. 紫花苜蓿高效共生根瘤菌的筛选.草业科学, 2002, 19(6): 27–31. |
| [2] | Breitbart M, Rohwer F. Here a virus, there a virus, everywhere the same virus? Trends in Microbiology, 2005, 13(6):278-284.Trends in Microbiology, 2005, 13(6): 278–284DOI:10.1016/j.tim.2005.04.003. |
| [3] | Hashem FM, Angle JS. Rhizobiophage effects on nodulation, nitrogen fixation, and yield of field-grown soybeans (Glycine max L.Biology and Fertility of Soils, 1990, 9(4): 330–334DOI:10.1007/BF00634110. |
| [4] | Abebe HM, Sadowsky MJ, Kinkle BK, Schmidt EL. Lysogeny in Bradyrhizobium japonicum and its effect on soybean nodulation.Applied and Environmental Microbiology, 1992, 58(10): 3360–3366. |
| [5] | Evans J, Barnet YM, Vincent JM. Effect of a bacteriophage on colonisation and nodulation of clover roots by paired strains of Rhizobium trifolii.Canadian Journal of Microbiology, 1979, 25(9): 974–978DOI:10.1139/m79-149. |
| [6] | Vidor C, Miller RH. Relative saprophytic competence of Rhizobium japonicum strains in soils as determined by the quantitative fluorescent antibody technique (FA).Soil Biology and Biochemistry, 1980, 12(5): 483–487DOI:10.1016/0038-0717(80)90084-X. |
| [7] | Wang GH, Liu JJ, Kimura M. Genetic diversity of major capsid genes (g23) of T4-type bacteriophages in natural environments-a review.Acta Microbiologica Sinica, 2011, 51(6): 732–739(in Chinese).王光华, 刘俊杰, KimuraM. 自然环境中T4型噬菌体g23基因多样性研究进展.微生物学报, 2011, 51(6): 732–739. |
| [8] | Zhang QY. Advances in studies on biodiversity of cyanophages.Microbiology China, 2014, 41(3): 545–559(in Chinese).张奇亚. 噬藻体生物多样性的研究动态.微生物学通报, 2014, 41(3): 545–559. |
| [9] | Rohwer F, Edwards R. The phage proteomic tree:a genome-based taxonomy for phage.Journal of Bacteriology, 2002, 184(16): 4529–4535DOI:10.1128/JB.184.16.4529-4535.2002. |
| [10] | Filée J, Tétart F, Suttle CA, Krisch HM. Marine T4-type bacteriophages, a ubiquitous component of the dark matter of the biosphere.Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(35): 12471–12476DOI:10.1073/pnas.0503404102. |
| [11] | López-Bueno A, Tamames J, Velázquez D, Moya A, Quesada A, Alcamí A. High diversity of the viral community from an Antarctic lake.Science, 2009, 326(5954): 858–861DOI:10.1126/science.1179287. |
| [12] | Butina TV, Belykh OI, Maksimenko SY, Belikov SI. Phylogenetic diversity of T4-like bacteriophages in Lake Baikal, East Siberia.FEMS Microbiology Letters, 2010, 309(2): 122–129. |
| [13] | Jia ZJ, Ishihara R, Nakajima Y, Asakawa S, Kimura M. Molecular characterization of T4-type bacteriophages in a rice field.Environmental Microbiology, 2007, 9(4): 1091–1096DOI:10.1111/emi.2007.9.issue-4. |
| [14] | Fujii T, Nakayama N, Nishida M, Sekiya H, Kato N, Asakawa S, Kimura M. Novel capsid genes (g23) of T4-type bacteriophages in a Japanese paddy field.Soil Biology and Biochemistry, 2008, 40(5): 1049–1058DOI:10.1016/j.soilbio.2007.11.025. |
| [15] | Nakayama N, Asakawa S, Kimura M. Comparison of g23 gene sequence diversity between Novosphingobium and Sphingomonas phages and phage communities in the floodwater of a Japanese paddy field.Soil Biology and Biochemistry, 2009, 41(2): 179–185DOI:10.1016/j.soilbio.2008.06.008. |
| [16] | Wang GH, Hayashi M, Saito M, Tsuchiya K, Asakawa S, Kimura M. Survey of major capsid genes (g23) of T4-type bacteriophages in Japanese paddy field soils.Soil Biology and Biochemistry, 2009, 41(1): 13–20DOI:10.1016/j.soilbio.2008.07.008. |
| [17] | Liu JJ, Wang GH, Wang Q, Liu JD, Jin J, Liu XB. Phylogenetic diversity and assemblage of major capsid genes (g23) of T4-type bacteriophages in paddy field soils during rice growth season in Northeast China.Soil Science and Plant Nutrition, 2012, 58(4): 435–444DOI:10.1080/00380768.2012.703610. |
| [18] | Liu JJ, Wang GH, Zheng CY, Yuan XH, Jin J, Liu XB. Specific assemblages of major capsid genes (g23) of T4-type bacteriophages isolated from upland black soils in Northeast China.Soil Biology and Biochemistry, 2011, 43(9): 1980–1984DOI:10.1016/j.soilbio.2011.05.005. |
| [19] | Liu JJ, Yu ZH, Wang XZ, Jin J, Liu XB, Wang GH. The distribution characteristics of the major capsid gene (g23) of T4-type phages in paddy floodwater in Northeast China.Soil Science and Plant Nutrition, 2016, 62(2): 133–139DOI:10.1080/00380768.2016.1163507. |
| [20] | Nakayama N, Okumura M, Inoue K, Asakawa S, Kimura M. Abundance of bacteriophages of common heterotrophic bacteria in the floodwater of a Japanese paddy field.Soil Science and Plant Nutrition, 2007, 53(5): 595–605DOI:10.1111/j.1747-0765.2007.00189.x. |
| [21] | B?rsheim KY, Bratbak G, Heldal M. Enumeration and biomass estimation of planktonic bacteria and viruses by transmission electron microscopy.Applied and Environmental Microbiology, 1990, 56(2): 352–356. |
| [22] | Wilson WH, Joint IR, Carr NG, Mann NH. Isolation and molecular characterization of five marine cyanophages propagated on Synechococcus sp.Applied and Environmental Microbiology, 1993, 59(11): 3736–3743. |
| [23] | Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools.Nucleic Acids Research, 1997, 25(24): 4876–4882DOI:10.1093/nar/25.24.4876. |
| [24] | Tamura K, Dudley J, Nei M, Kumar S. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.Molecular Biology and Evolution, 2007, 24(8): 1596–1599DOI:10.1093/molbev/msm092. |
| [25] | Zheng CY, Wang GH, Liu JJ, Song CC, Gao HX, Liu XB. Characterization of the major capsid genes (g23) of T4-type bacteriophages in the wetlands of northeast China.Microbial Ecology, 2013, 65(3): 616–625DOI:10.1007/s00248-012-0158-z. |
| [26] | Brewer TE, Stroupe ME, Jones KM. The genome, proteome and phylogenetic analysis of Sinorhizobium meliloti phage ΦM12, the founder of a new group of T4-superfamily phages.Virology, 2014(450/451): 84–97. |
| [27] | Gerretsen FC, Gryns A, Sack J, Sohngen NL. Das vorkommen eines bakteriophagen in den wurzelkn?llchen der leguminosen.Bakt. Parasitenk II, 1923, 60(311): 316. |
| [28] | Casadesús J, Olivares J. General transduction in Rhizobium meliloti by a thermosensitive mutant of bacteriophage DF2.Journal of Bacteriology, 1979, 139(1): 316–317. |
| [29] | Martin MO, Long SR. Generalized transduction in Rhizobium meliloti.Journal of Bacteriology, 1984, 159(1): 125–129. |
| [30] | Xu H, Wang ZF, Cen YH. Isolation and characterization of seven soybean rhizobiophages.Chinese Journal of Virology, 1993, 9(1): 93–99(in Chinese).徐恒, 王子芳, 岑英华. 7株大豆根瘤菌噬菌体的分离及生物学特性的检测.病毒学报, 1993, 9(1): 93–99. |
| [31] | Ackermann HW. 5500 Phages examined in the electron microscope.Archives of Virology, 2007, 152(2): 227–243DOI:10.1007/s00705-006-0849-1. |
| [32] | Ackermann HW. Bacteriophage observations and evolution.Research in Microbiology, 2003, 154(4): 245–251DOI:10.1016/S0923-2508(03)00067-6. |
| [33] | Ali FS, Loynachan TE, Hammad AMM, Aharchi Y. Polyvirulent rhizobiophage from a soybean rhizosphere soil.Soil Biology and Biochemistry, 1998, 30(14): 2171–2175DOI:10.1016/S0038-0717(98)00048-0. |
| [34] | Vos M, Birkett PJ, Birch E, Griffiths RI, Buckling A. Local adaptation of bacteriophages to their bacterial hosts in soil.Science, 2009, 325(5942): 833DOI:10.1126/science.1174173. |
| [35] | Li W, Li RR, Jing RY, Zhang HJ, Hu PF, Wang LY. Isolation and phylogenetic analysis of related genes of cultivable cyanophages in Daqing Wetland.Acta Microbiologica Sinica, 2016, 56(5): 824–834(in Chinese).李伟, 李睿瑞, 荆瑞勇, 张海军, 胡鹏飞, 王丽艳. 大庆湿地可培养噬藻体的分离及其相关基因的系统进化分析.微生物学报, 2016, 56(5): 824–834. |
