陈国忠1, 张燕娇1, 陈师勇1,2


1.青岛农业大学生命科学学院, 山东省应用真菌重点实验室, 山东 青岛 266109;
2.青岛大学山东省海洋生物质纤维材料及纺织品协同创新中心, 山东 青岛 266071
收稿日期:2016-12-20;修回日期:2017-04-04;网络出版日期:2017-05-02
基金项目:国家自然科学基金(31372564,31300005);山东省自然科学基金(ZR2013CM028);青岛农业大学高层次引进人才计划(6631113310,6631113308)
*通信作者:陈师勇, E-mail: shiyongchen@hotmail.com
摘要:细菌脂蛋白是细胞膜的重要组成成分,在革兰氏阴性菌的生理及致病性中扮演着重要的角色。革兰氏阴性菌中已知负责胞内脂蛋白转运的是Lol(Localization of lipoprotein)系统。该系统识别成熟脂蛋白的分泌信号,将外膜脂蛋白转运并定位于细胞外膜内侧。近年来的研究发现,跨细胞外膜进行表面展示的脂蛋白实际上在革兰氏阴性菌中广泛存在,其分泌机制开始成为研究热点。为了对革兰氏阴性菌中脂蛋白分泌机制的研究现状有一个系统全面的了解,本文概述了脂蛋白转运过程中Lol系统5个转运蛋白的功能与保守性、不同细菌中脂蛋白分泌信号的差异以及表面展示脂蛋白可能的分泌机制。
关键词: 革兰氏阴性菌 细菌脂蛋白 脂蛋白转运 Lol系统 表面展示
Functions of Lol system proteins and surface-exposed mechanisms of lipoproteins in gram-negative bacteria
Chen Guozhong1, Zhang Yanjiao1, Chen Shiyong1,2


1.Shandong Province Key Laboratory of Applied Mycology, School of Life Sciences, Qingdao Agricultural University, Qingdao 266109, Shandong Province, China;
2.Collaborative Innovation Center for Marine Biomass Fibers, Materials and Textiles of Shandong Province, Qingdao University, Qingdao 266071, Shandong Province, China
Received 20 December 2016; Revised 4 April 2017; Published online 2 May 2017
*Corresponding author: Shiyong Chen, E-mail: shiyongchen@hotmail.com
Supported by the National Natural Science Foundation of China (31372564, 31300005), by the Natural Science Foundation of Shandong Province (ZR2013CM028) and by the Research Foundation for Advanced Talents of Qingdao Agricultural University (6631113310, 6631113308)
Abstract: Bacterial lipoproteins are important components of cell membrane. They play important roles in bacterial physiology and virulence in gram-negative bacteria. The Lol (localization of lipoprotein) pathway discovered from E. coli is responsible for the transport of lipoprotein in gram-negative bacteria. Recent research found that surface-exposed lipoproteins are widespread in gram-negative bacteria. To better understand the current studies of lipoprotein secretion mechanisms in gram-negative bacteria, we reviewed functions and conservation of five Lol proteins, the difference of lipoprotein secretion signals in variant bacteria and possible transport mechanisms of surface-exposed lipoproteins.
Key words: gram-negative bacteria bacterial lipoprotein lipoprotein transport Lol system surface-exposed
细菌脂蛋白是一种脂质修饰的膜锚定蛋白,具有由Leu-(Ala/Ser)-(Gly/Ala)-Cys组成的称为“Lipobox”的共识序列,是细胞膜的重要组成成分。脂蛋白以前体形式在细胞质中合成,通过Sec或Tat分泌系统被首先转运到细胞内膜的外表面上[1]。经过磷脂酰甘油转移酶(Lgt)、脂蛋白信号肽酶(Lsp)和磷脂酰基转移酶(Lnt)的催化作用,脂蛋白前体被切除信号肽及将N-末端的Cys残基N-酰化,成为成熟的脂蛋白[2]。成熟脂蛋白停留在内膜或被特定的脂蛋白转运系统转运到细胞外膜上,通过N端脂基团锚定在膜上发挥其正常功能。
脂蛋白具有多种功能,如在细胞膜的合成、信号转导、细菌黏附、抗生素抗性和物质转运等重要生理过程中发挥关键作用[3]。对于病原菌来说,脂蛋白是细菌在复杂环境中生存和致病不可或缺的毒力因子,直接参与病原菌的多种致病机制,如细菌定殖、入侵、逃避宿主防御和影响宿主免疫系统等[3]。脂蛋白也是重要的免疫刺激因子,不仅能够触发宿主的先天性免疫系统,而且也能够引起适应性免疫应答反应。研究表明脂蛋白尤其是表面展示脂蛋白能够有效激活TLR2信号通路,从而激发炎症反应和各种细胞因子的产生,是性能优异的候选疫苗[4-5]。
脂蛋白正确的细胞定位是其发挥正常生理功能的基础,这依赖于细胞内脂蛋白转运系统的正常运转。革兰氏阴性菌中已知负责胞内脂蛋白转运的系统为Lol系统,只有少数菌中的个别表面展示脂蛋白的转运途径不依赖于Lol系统(见“脂蛋白的表面展示”部分)。这个普遍存在的Lol脂蛋白转运系统包括LolA–E 5个组分[6]。以大肠杆菌(Escherichia coli)为模型的研究表明,成熟后的外膜脂蛋白被LolCDE 3个蛋白组成的跨内膜ATP结合转运子(ABC transporter)复合物识别并传送给细胞间质中的穿梭蛋白载体LolA,由LolA转运至外膜受体LolB,LolB则协助蛋白以一种未知机制定位到细胞外膜内侧[6]。
除了大肠杆菌,近年来对伯氏疏螺旋体(Borrelia burgdorferi)、脑膜炎奈瑟氏菌(Neisseria meningitidis)、布鲁氏菌(Brucella)、铜绿假单胞菌(Pseudomonas aeruginosa)、幽门螺杆菌(Helicobacter pylor)等一些细菌的脂蛋白及其转运系统已经有不少报道,对表面展示脂蛋白的研究开始成为一个热点。本文主要对革兰氏阴性菌中普遍存在的Lol系统、脂蛋白分泌信号以及表面展示脂蛋白分泌机制的研究进展进行了综述。
1 脂蛋白转运Lol系统的成员及功能 1.1 内膜ABC型转运蛋白复合物LolCDE 在Lol系统介导的脂蛋白转运过程中,成熟外膜脂蛋白首先被内膜上LolCDE复合物所识别,LolCDE复合物消耗1个ATP的能量,将其传递至伴侣蛋白LolA。Narita等人发现lolCDE基因的敲除阻止了脂蛋白从内膜的释放,这对细菌的生长是致命的[7]。
内膜复合物LolCDE属于ABC超家族(ATP-binding cassette superfamily)成员,其底物转运与ATP的水解偶联,具有ABC超家族成员一些保守的特征:Walker A、Q-loop、Signature、Walker B、D-loop及Switch H-loop。但它与其他ABC超家族成员功能不同,并不涉及到物质的跨膜运输[8]。在基因结构上,lolCDE属于同一个操纵子。细胞膜上的LolCDE蛋白复合物包括ATPase亚基LolD、膜整合蛋白LolC和LolE,组成比例为2:1:1。酶活检测发现LolD具有ATPase酶的活性,减少ATP会取消或减弱LolE与脂蛋白之间的相互作用[9]。相反,外膜脂蛋白的结合使LolD与ATP的亲和力上升。ATP与LolD结合会导致LolCDE和脂蛋白的相互作用减弱,ATP水解则提供能量使脂蛋白从LolCDE传递给LolA。LolCDE复合物可以识别外膜脂蛋白N端的分泌信号,然而内膜脂蛋白却不会被识别[8]。研究表明,LolC与LolE的序列相似性为26%,却具有相似的膜拓扑结构[10]。光交联反应表明LolA与LolC发生相互作用,脂蛋白则与lolE有相互作用[11]。这表明LolE接收成熟的外膜脂蛋白,传递给LolC,LolC再将脂蛋白转移给LolA。但LolE到LolC之间脂蛋白的确切的转移机制尚不清楚。
1.2 周质空间伴侣蛋白LolA Tokuda等在研究大肠杆菌主要外膜脂蛋白Lpp时,发现一种以单体形式存在的伴侣蛋白可以将疏水性脂蛋白从细胞内膜穿越亲水性的周质空间转运到外膜上,将其命名为LolA[12]。进一步实验证实敲除lolA基因对细菌生长是致命的[13]。
LolA结晶结构表明它具有一个与脂蛋白的结合和转移相关的疏水性口袋[14],LolA蛋白依赖一个氧化还原开关来调节此疏水性口袋的打开与关闭[15-16]。研究表明,蛋白突变体LolA(I93C/F140C)通过形成二硫键使疏水性口袋关闭,阻断了脂蛋白的转运,从而抑制大肠杆菌的生长,并触发细胞Cpx应激反应[15]。
LolA蛋白具有一段由6个高度保守氨基酸组成的短肽序列(Lys-Arg-Pro-Asn-Leu-Phe)。将其中的Arg突变为Leu后,突变蛋白LolA(R43L)与脂蛋白不可逆结合,导致脂蛋白不能被转移至外膜的LolB受体蛋白上,最终形成脂蛋白-LolA(R43L)复合物积累在周质空间。该现象说明LolA蛋白构象的改变与脂蛋白的转运有着密不可分的关系[17]。另外,保守短肽中的Phe位点参与了LolA与LolCDE的相互作用,其突变成Glu后的蛋白LolA(F47E)与LolCDE蛋白紧密结合,导致脂蛋白不能从脂质体中释放[18]。
1.3 外膜脂蛋白受体LolB LolB是一个外膜脂蛋白,通过脂基团锚定在细胞外膜内表面,接收并协助来自于LolA的脂蛋白定位到外膜上[19]。蛋白结构研究表明,LolB与LolA具有类似的开放β折叠结构[20]。Tokuda等用表面等离子共振技术实时检测到脂蛋白从LolA转运到LolB[21-22]。利用光敏交联技术,他们还证实LolA与LolB之间的脂蛋白转移属于一种口对口模式[10],此过程不消耗能量ATP。
在革兰氏阴性菌中,lolB基因高度保守,它的敲除将抑制大肠杆菌的生长[23]。过表达缺少了N端脂基团的LolB蛋白(mLolB)可以代偿细胞缺失野生型LolB的功能并支持细胞生长,说明脂基团对LolB功能并不是必需的。缺少了脂基团修饰的mLolB无法定位于外膜上,使得它对脂蛋白的膜定位作用无内外膜的偏好性,从而将LolA携带的脂蛋白定位到细胞外膜及内膜上。这些研究表明LolB在脂蛋白结合、细胞膜靶向及脂蛋白锚定方面扮演着重要的角色[24]。LolB如何将脂蛋白整合到细胞外膜上的机制尚不清楚,同源基因比对发现LolB具有5个保守的Trp,蛋白突变体的功能研究说明这5个高度保守的Trp涉及到脂蛋白定位[25]。研究还发现LolB蛋白68位的Leu在脂蛋白锚定到细胞外膜上发挥了重要的作用[26]。
1.4 Lol系统的保守性 革兰氏阴性菌脂蛋白转运模型(Lol系统)的建立主要基于在大肠杆菌中所获得的实验数据。Lol组分基因在大肠杆菌中都是必需基因,可以从几乎所有的革兰氏阴性菌中找到Lol系统组分的同源异构基因。虽然Lol系统基因在革兰氏阴性菌中广泛分布,但不同的lol基因保守性则又不同。
大肠杆菌中的LolC与LolE有同源性但执行不同的功能,并不能相互代替。而在一些细菌(如Francisella tularensis)中只发现了一种LolC/E的同源基因LolF,2个LolF的二聚体代替了LolC与LolE的功能,实现了脂蛋白的正确定位[27]。
研究发现,lolB基因仅在双层膜(diderm)细菌中的β-变形菌纲和γ-变形菌纲中是保守的[6]。lolA基因在细菌中的存在与lolB相比相对广泛,但是仍然在一些具有双层膜的细菌门中(如Cyanobacteria、Fusobacteria和Thermotoga等)发现无lolA同源基因存在的细菌[28]。在这些没有发现lolA或lolB同源基因的菌中,仍然存在其他Lol组分的同源基因,这意味着可能存在其他序列不同但功能一致的蛋白,或是脂蛋白通过其他未知途径进行转运。
2 脂蛋白的分泌信号 Yamaguchi等首次提出,在大肠杆菌中,脂蛋白N末端第二氨基酸(+2)对于脂蛋白的膜定位至关重要。当+2位为天冬氨酸Asp时,该脂蛋白滞留在细胞内膜上,而Asp突变为其他氨基酸时,该脂蛋白将被分泌到细胞外膜,这个规则被称为“+2规则”[29]。+2规则适用于大多数脂蛋白。但是当His和Lys出现在+3位时,能够降低+2位Asp所导致的脂蛋白内膜滞留的严谨程度,出现+2位为Asp的脂蛋白分泌到外膜的现象。肠杆菌科细菌(Enterobacteriaceae)的脂蛋白分泌信号普遍遵循“+2规则”。
并非所有革兰氏阴性细菌的脂蛋白分泌都遵循“+2规则”。例如,P. aeruginosa脂蛋白分泌并不完全遵循“+2规则”。在P. aeruginosa中,+2位的Asp可作为内膜保留信号,但+3和+4的残基也是决定脂蛋白膜定位特异性的天然信号[30]。P. aeruginosa中的内膜锚定脂蛋白MexA,其+2、+3及+4位置分别是Gly、Lys和Ser,但该脂蛋白却滞留在细胞内膜上。此外,细菌B. burgdorferi的脂蛋白分泌完全不遵循“+2规则”,它所分泌的脂蛋白默认情况下都转运到细胞外膜并多数是表面展示蛋白[31]。
笔者课题组对创伤弧菌(Vibrio vulnificus)脂蛋白转运系统的研究结果表明,V. vulnificus部分脂蛋白的分泌并不遵守“+2规则”。如表面展示脂蛋白IlpA,当其+2位的Gly被代替为Asp后,该脂蛋白仍然被分泌到外膜上;另外还发现两个V. vulnificus的内膜结合脂蛋白,它们的N末端第二位(+2)并非Asp(未发表数据)。由此可见,脂蛋白分泌信号在不同细菌中具有其特异性。
3 脂蛋白的表面展示 在Lol系统模型中,外膜脂蛋白最终被转运并停留在细胞外膜的内侧。然而这并非是脂蛋白转运的最后一步,一些细菌通过某些特殊的机制将脂蛋白部分或全部展示到细胞外膜的外表面。最近一些研究数据表明,虽然跨细胞外膜进行表面展示的脂蛋白的数量相对停留在胞内的脂蛋白较少,但它们实际上在革兰氏阴性菌中广泛存在[32-33]。最近在拟杆菌门(Bacteroidetes)中发现部分菌的表面展示脂蛋白N端具有一段特异的分泌信号(LES,lipoprotein export signal),但其他种属的细菌尚未发现存在类似的能引导脂蛋白进行表面展示的共同信号特征[34]。
Hooda等在N. meningitidis中发现了一种表面展示脂蛋白调控因子(Slam),该因子在特异脂蛋白(如TbpB)被Lol系统转运到外膜内侧后,通过与脂蛋白相互作用,协助其跨细胞膜进行表面展示[35](图 1)。在一些致病菌如淋病奈瑟氏菌(Neisseria gonorrhoeaec)及鲍氏不动杆菌(Acinetobacter baumannii)中,都发现了Slam调控蛋白的同源基因。N. meningitidis中脂蛋白表面展示过程的具体机制及其是否有其他因子参与尚需进一步研究。
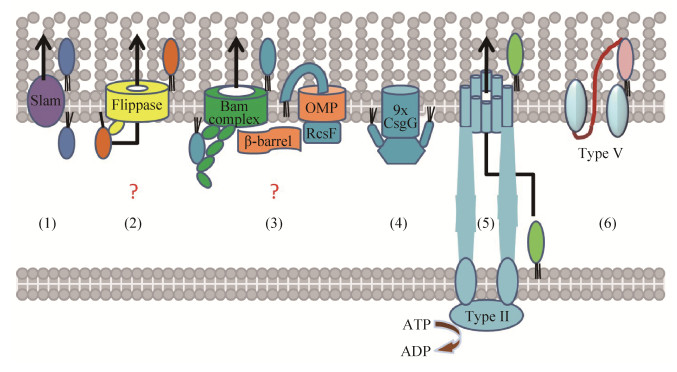 |
| 图 1 表面展示脂蛋白的构象及可能的分泌机制图(修改自文献[32-33]) Figure 1 Topologies and possible secretion mechanisms of the surface-exposed lipoproteins (Figure cited from [32-33] with modification). (1) In N. meningitidis, an outer membrane protein Slam mediates the surface display of lipoproteins (e.g., TbpB). (2) A proposed module mediates complete surface localization of spirochetal lipoproteins such as B. burgdorferi OspA by interaction with a holding chaperone and an outer membrane lipoprotein 'flippase' complex. (3) The Bam complex, a hetero-oligomer that catalyzes the insertion of β-barrel proteins (outer membrane proteins, OMP) into the OM, might directly mediate the surface exposure of lipoproteins or indirectly mediate the exposure of lipoproteins that piggyback onto β-barrel proteins during their assembly (e.g., lipoprotein RcsF). (4) Lipoprotein CsgG form oligomeric complexes with hydrophobic transmembrane domains, large periplasmic domains and the C-terminus exposed on the cell surface. (5) Some lipoproteins might reach the extracellular space by type Ⅱ pathway that recruit substrates from the IM. (6) The C-terminal translocator domain of lipoproteins form a β-barrel in the OM to mediate self-sufficient transport (autotransport, Type V secretion) to the surface. |
| 图选项 |
笔者研究的B. burgdoferi是迄今为止表面展示脂蛋白转运机制研究得最为系统的一株细菌。脂蛋白外膜锚定方式的拓扑结构研究表明,该菌表面展示脂蛋白(如OspA)的蛋白整体被完全分泌到了细胞外部并由脂基团锚定在表面[36]。实验数据表明,表面展示的转运信息包含在成熟蛋白N端无序区间。脂蛋白在被转运至细胞外部之前,在外膜内侧短暂停留,期间需与伴侣蛋白结合,以维持一种特殊的非折叠构象,然后在一未知的反转酶(flippase)的帮助下,以C末端为起始跨膜后完成表面展示[37-38](图 1)。B. burgdoferi的Lol系统在脂蛋白转运过程中所起的作用尚未确定。
另一种表面展示脂蛋白分泌途径假说认为,细胞外膜上的Bam复合物直接或间接介导了脂蛋白的全部或部分表面展示[32](图 1)。Bam复合物是普遍存在于革兰氏阴性菌中的一种异源寡聚体,负责催化β-barrel膜蛋白的外膜插入过程。已证实大肠杆菌RcsF蛋白通过Lol系统转运至外膜内侧后,通过与β-barrel膜蛋白(Bam复合物的底物)的相互作用,将其N端部分展示到细胞表面,但其C端蛋白主体通过跨膜的肽链连接停留在细胞间质内[39]。目前尚未有证据表明Bam复合物直接介导了脂蛋白的完全表面展示,但B. burgdorferi中BamA基因(Bam复合物中关键蛋白)敲除后,表面脂蛋白OspA与CspA的表达水平受到了影响,尚不清楚这种影响是BamA敲除的直接还是间接结果[40]。
此外,部分脂蛋白还能通过单体聚合形成跨膜结构来实现蛋白的部分表面展示(图 1)。如大肠杆菌的CsgG和Wza通过蛋白的N末端脂基团锚定于外膜内侧,而多个单体C末端聚合形成类似α-helical或β-barrel同源多聚物的疏水性结构插入外膜,导致脂蛋白C末端部分表面展示[41-42]。
通常情况下,革兰氏阴性菌依赖Lol系统将脂蛋白转运至细胞外膜上发挥其生理功能,但是研究发现Lol系统并不是脂蛋白合成后分泌的唯一途径。在奥克西托克雷白杆菌(Klebsiella oxytoca)中,表面展示脂蛋白PulA是第一个被确认转运途径的外膜展示蛋白[43]。PulA包含了Lol系统的滞留信号,却通过Ⅱ型分泌系统从细胞内膜转运到细胞表面(图 1)。肠致病性E. coli的SslE蛋白同样依赖Ⅱ型分泌系统转运到细胞表面[44]。
另一种不依赖Lol系统进行细胞定位的表面脂蛋白分泌机制是通过五型(Type V)分泌途径进行脂蛋白的转运(图 1)。多种细菌中发现了这类脂蛋白的存在,例如N. meningitidis的NalP和百日咳博德特氏菌(Bordetella pertussis)的SphB1等蛋白的序列既包含脂蛋白的分泌信号,又具有典型的自转运蛋白结构,实验证明它们都是通过五型分泌途径运输到外膜[45-46]。
4 小结和展望 脂蛋白在细菌生理中许多方面起到了重要作用,脂蛋白转运Lol系统基因因此成为细菌在环境及宿主中生存的必需基因。对脂蛋白转运系统的研究有助于人们了解细菌基本的膜生物合成机制及病原菌致病因子分泌过程。目前对大肠杆菌的Lol系统研究比较深入,但是仍然有不少问题尚待解决。例如,随着研究的深入,发现多个原来认为是在大肠杆菌细胞内定位的脂蛋白仍然有部分在外膜表面展示,其机理尚不清楚;不同病原菌的脂蛋白转运信号并不一致;一些病原菌的Lol系统缺乏重要组分(如LolA或LolB),其脂蛋白转运机制尚不清楚;多种细菌发现表面展示脂蛋白,但其脂蛋白表面展示的机制尚不清楚等等。
由于脂蛋白Lol系统在病原菌中的重要性,对脂蛋白转运分子机制的理解将为感染性疾病的治疗提供更多的药物靶点。Nayar等报道通过一种细胞壁报告基因反应(Cell wall reporter assay)筛选到一个针对大肠杆菌Lol系统的小分子抑制剂,利用大肠杆菌球状体(Spheroplast)进行的实验证实,该抑制剂可以阻断脂蛋白从细胞内膜的释放[47]。进一步的研究表明,这种脂蛋白Lol转运途径的抑制导致了多个膜应激反应途径(Envelope stress pathway)的转录激活,严重影响了细胞外膜的合成及细胞生存能力[48]。由于Lol转运系统在细菌中的重要性和独特性,预计今后将会有更多的研究团队建立模型,尝试开发针对脂蛋白转运Lol系统的新型抗菌药物。
另一方面,细菌脂蛋白可以通过TLR2信号通路刺激宿主免疫反应,因此是良好的疫苗开发对象。伯氏疏螺旋体的重组脂蛋白OspA是人类首个抗莱姆病疫苗,研究表明含脂基团的OspA可以有效地诱导宿主抗原抗体反应并提供了针对伯氏疏螺旋体的免疫保护,而无脂基团修饰的OspA则无保护效果[49-50]。创伤弧菌的重组IlpA脂蛋白被证实通过TLR1/TLR2介导的信号通路在人单核细胞THP-1中诱导细胞因子TNF-α的产生,此过程中3种MAPK激酶(p38、ERK1/2与JNK)也被激活,而无脂基团修饰的IlpA突变体蛋白在小鼠及人细胞模型中均未检测到细胞因子的产生[51]。抗生素滥用造成的环境污染促使研究者们逐渐重视疫苗的开发,由于脂蛋白的特性,针对重组脂蛋白疫苗的设计开发也将逐渐成为热点[5]。而对于多种细菌表面展示脂蛋白分泌机制的进一步阐明,不但有助于人们了解细菌基本的膜生物合成机制,针对致病因子分泌过程筛选新型药物,也有助于寻求高效抗原成分,开发便捷的抗原菌体表面展示系统,以解决日益严重的抗生素污染问题。
References
| [1] | Pugsley AP. The complete general secretory pathway in Gram-negative bacteria. Microbiological Reviews, 1993, 57(1): 50-108. |
| [2] | Hayashi S, Wu HC. Lipoproteins in bacteria. Journal of Bioenergetics and Biomembranes, 1990, 22(3): 451-471. DOI:10.1007/BF00763177 |
| [3] | Kovacs-Simon A, Titball RW, Michell SL. Lipoproteins of bacterial pathogens. Infection and Immunity, 2011, 79(2): 548-561. DOI:10.1128/IAI.00682-10 |
| [4] | Brightbill HD, Libraty DH, Krutzik SR, Yang RB, Belisle JT, Bleharski JR, Maitland M, Norgard MV, Plevy SE, Smale ST, Brennan PJ, Bloom BR, Godowski PJ, Modlin RL. Host defense mechanisms triggered by microbial lipoproteins through toll-like receptors. Science, 1999, 285(5428): 732-736. DOI:10.1126/science.285.5428.732 |
| [5] | Basto AP, Leit?o A. Targeting TLR2 for vaccine development. Journal of Immunology Research, 2014, 2014: 619410. |
| [6] | Okuda S, Tokuda H. Lipoprotein sorting in bacteria. Annual Review of Microbiology, 2011, 65: 239-259. DOI:10.1146/annurev-micro-090110-102859 |
| [7] | Narita SI, Tanaka K, Matsuyama SI, Tokuda H. Disruption of lolCDE, encoding an ATP-binding cassette transporter, is lethal for Escherichia coli and prevents release of lipoproteins from the inner membrane. Journal of Bacteriology, 2002, 184(5): 1417-1422. DOI:10.1128/JB.184.5.1417-1422.2002 |
| [8] | Yakushi T, Masuda K, Narita SI, Matsuyama SI, Tokuda H. A new ABC transporter mediating the detachment of lipid-modified proteins from membranes. Nature Cell Biology, 2000, 2(4): 212-218. DOI:10.1038/35008635 |
| [9] | Mizutani M, Mukaiyama K, Xiao J, Mori M, Satou R, Narita SI, Okuda S, Tokuda H. Functional differentiation of structurally similar membrane subunits of the ABC transporter LolCDE complex. FEBS Letters, 2013, 587(1): 23-29. DOI:10.1016/j.febslet.2012.11.009 |
| [10] | Yasuda M, Iguchi-Yokoyama A, Matsuyama SI, Tokuda H, Narita SI. Membrane topology and functional importance of the periplasmic region of ABC transporter LolCDE. Bioscience, Biotechnology, and Biochemistry, 2009, 73(10): 2310-2316. DOI:10.1271/bbb.90451 |
| [11] | Okuda S, Tokuda H. Model of mouth-to-mouth transfer of bacterial lipoproteins through inner membrane LolC, periplasmic LolA, and outer membrane LolB. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5877-5882. DOI:10.1073/pnas.0900896106 |
| [12] | Matsuyama S, Tajima T, Tokuda H. A novel periplasmic carrier protein involved in the sorting and transport of Escherichia coli lipoproteins destined for the outer membrane. The EMBO Journal, 1995, 14(14): 3365-3372. |
| [13] | Tajima T, Yokota N, Matsuyama SI, Tokuda H. Genetic analyses of the in vivo function of LolA, a periplasmic chaperone involved in the outer membrane localization of Escherichia coli lipoproteins. FEBS Letters, 1998, 439(1/2): 51-54. |
| [14] | Oguchi Y, Takeda K, Watanabe S, Yokota N, Miki K, Tokuda H. Opening and closing of the hydrophobic cavity of LolA coupled to lipoprotein binding and release. The Journal of Biological Chemistry, 2008, 283(37): 25414-25420. DOI:10.1074/jbc.M804736200 |
| [15] | Tao K, Watanabe S, Narita SI, Tokuda H. A periplasmic LolA derivative with a lethal disulfide bond activates the Cpx stress response system. Journal of Bacteriology, 2010, 192(21): 5657-5662. DOI:10.1128/JB.00821-10 |
| [16] | Watanabe S, Oguchi Y, Takeda K, Miki K, Tokuda H. Introduction of a lethal redox switch that controls the opening and closing of the hydrophobic cavity in LolA. The Journal of Biological Chemistry, 2008, 283(37): 25421-25427. DOI:10.1074/jbc.M804737200 |
| [17] | Miyamoto A, Matsuyama SI, Tokuda H. Mutant of LolA, a lipoprotein-specific molecular chaperone of Escherichia coli, defective in the transfer of lipoproteins to LolB. Biochemical and Biophysical Research Communications, 2001, 287(5): 1125-1128. DOI:10.1006/bbrc.2001.5705 |
| [18] | Miyamoto A, Matsuyama SI, Tokuda H. Dominant negative mutant of a lipoprotein-specific molecular chaperone, LolA, tightly associates with LolCDE. FEBS Letters, 2002, 528(1/3): 193-196. |
| [19] | Matsuyama SI, Yokota N, Tokuda H. A novel outer membrane lipoprotein, LolB (HemM), involved in the LolA (p20)-dependent localization of lipoproteins to the outer membrane of Escherichia coli. The EMBO Journal, 1997, 16(23): 6947-6955. DOI:10.1093/emboj/16.23.6947 |
| [20] | Taniguchi N, Matsuyama SI, Tokuda H. Mechanisms underlying energy-independent transfer of lipoproteins from LolA to LolB, which have similar unclosed β-barrel structures. The Journal of Biological Chemistry, 2005, 280(41): 34481-34488. DOI:10.1074/jbc.M507388200 |
| [21] | Nakada S, Sakakura M, Takahashi H, Okuda S, Tokuda H, Shimada I. Structural investigation of the interaction between LolA and LolB using NMR. The Journal of Biological Chemistry, 2009, 284(36): 24634-24643. DOI:10.1074/jbc.M109.001149 |
| [22] | Tsukahara J, Narita SI, Tokuda H. Real time analysis of lipoprotein transfer from LolA to LolB by means of surface Plasmon resonance. FEBS Letters, 2009, 583(18): 2987-2990. DOI:10.1016/j.febslet.2009.08.032 |
| [23] | Tanaka K, Matsuyama SI, Tokuda H. Deletion of lolB, encoding an outer membrane lipoprotein, is lethal for Escherichia coli and causes accumulation of lipoprotein localization intermediates in the periplasm. Journal of Bacteriology, 2001, 183(22): 6538-6542. DOI:10.1128/JB.183.22.6538-6542.2001 |
| [24] | Tsukahara J, Mukaiyama K, Okuda S, Narita SI, Tokuda H. Dissection of LolB function-lipoprotein binding, membrane targeting and incorporation of lipoproteins into lipid bilayers. FEBS Journal, 2009, 276(16): 4496-4504. DOI:10.1111/ejb.2009.276.issue-16 |
| [25] | Wada R, Matsuyama SI, Tokuda H. Targeted mutagenesis of five conserved tryptophan residues of LolB involved in membrane localization of Escherichia coli lipoproteins. Biochemical and Biophysical Research Communications, 2004, 323(3): 1069-1074. DOI:10.1016/j.bbrc.2004.08.200 |
| [26] | Hayashi Y, Tsurumizu R, Tsukahara J, Takeda K, Narita SI, Mori M, Miki K, Tokuda H. Roles of the protruding loop of factor B essential for the localization of lipoproteins (LolB) in the anchoring of bacterial triacylated proteins to the outer membrane. The Journal of Biological Chemistry, 2014, 289(15): 10530-10539. DOI:10.1074/jbc.M113.539270 |
| [27] | LoVullo ED, Wright LF, Isabella V, Huntley JF, Pavelka MS Jr. Revisiting the Gram-negative lipoprotein paradigm. Journal of Bacteriology, 2015, 197(10): 1705-1715. DOI:10.1128/JB.02414-14 |
| [28] | Sutcliffe IC, Harrington DJ, Hutchings MI. A phylum level analysis reveals lipoprotein biosynthesis to be a fundamental property of bacteria. Protein&Cell, 2012, 3(3): 163-170. |
| [29] | Yamaguchi K, Yu F, Inouye M. A single amino acid determinant of the membrane localization of lipoproteins in E.coli. Cell, 1988, 53(3): 423-432. DOI:10.1016/0092-8674(88)90162-6 |
| [30] | Narita SI, Tokuda H. Amino acids at positions 3 and 4 determine the membrane specificity of Pseudomonas aeruginosa lipoproteins. The Journal of Biological Chemistry, 2007, 282(18): 13372-13378. DOI:10.1074/jbc.M611839200 |
| [31] | Schulze RJ, Zückert WR. Borrelia burgdorferi lipoproteins are secreted to the outer surface by default. Molecular Microbiology, 2006, 59(5): 1473-1484. DOI:10.1111/j.1365-2958.2006.05039.x |
| [32] | Konovalova A, Silhavy TJ. Outer membrane lipoprotein biogenesis:Lol is not the end.Philosophical Transactions of the Royal Society of London. Series B-Biological Sciences, 2015, 370(1679): 20150030. DOI:10.1098/rstb.2015.0030 |
| [33] | Wilson MM, Bernstein HD. Surface-exposed lipoproteins:an emerging secretion phenomenon in gram-negative bacteria. Trends in Microbiology, 2016, 24(3): 198-208. DOI:10.1016/j.tim.2015.11.006 |
| [34] | Lauber F, Cornelis GR, Renzi F. Identification of a new lipoprotein export signal in gram-negative bacteria. mBio, 2016, 7(5): e01232-16. |
| [35] | Hooda Y, Lai CC, Judd A, Buckwalter CM, Shin HE, Gray-Owen SD, Moraes TF. Slam is an outer membrane protein that is required for the surface display of lipidated virulence factors in Neisseria. Nature Microbiology, 2016, 1: 16009. DOI:10.1038/nmicrobiol.2016.9 |
| [36] | Chen SY, Kumru OS, Zückert WR. Determination of Borrelia surface lipoprotein anchor topology by surface proteolysis. Journal of Bacteriology, 2011, 193(22): 6379-6383. DOI:10.1128/JB.05849-11 |
| [37] | Schulze RJ, Chen SY, Kumru OS, Zückert WR. Translocation of Borrelia burgdorferi surface lipoprotein OspA through the outer membrane requires an unfolded conformation and can initiate at the C-terminus. Molecular Microbiology, 2010, 76(5): 1266-1278. DOI:10.1111/mmi.2010.76.issue-5 |
| [38] | Chen SY, Zückert WR. Probing the Borrelia burgdorferi surface lipoprotein secretion pathway using a conditionally folding protein domain. Journal of Bacteriology, 2011, 193(23): 6724-6732. DOI:10.1128/JB.06042-11 |
| [39] | Konovalova A, Perlman DH, Cowles CE, Silhavy TJ. Transmembrane domain of surface-exposed outer membrane lipoprotein RcsF is threaded through the lumen of β-barrel proteins. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(41): E4350-E4358. DOI:10.1073/pnas.1417138111 |
| [40] | Lenhart TR, Akins DR. Borrelia burgdorferi locus BB0795 encodes a BamA orthologue required for growth and efficient localization of outer membrane proteins. Molecular Microbiology, 2010, 75(3): 692-709. DOI:10.1111/j.1365-2958.2009.07015.x |
| [41] | Cao BH, Zhao Y, Kou YJ, Ni DC, Zhang XC, Huang YH. Structure of the nonameric bacterial amyloid secretion channel. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(50): E5439-E5444. DOI:10.1073/pnas.1411942111 |
| [42] | Dong CJ, Beis K, Nesper J, Brunkan-LaMontagne AL, Clarke BR, Whitfield C, Naismith JH. Wza the translocon for E.coli capsular polysaccharides defines a new class of membrane protein. Nature, 2006, 444(7116): 226-269. DOI:10.1038/nature05267 |
| [43] | d'Enfert C, Ryter A, Pugsley AP. Cloning and expression in Escherichia coli of the Klebsiella pneumoniae genes for production, surface localization and secretion of the lipoprotein pullulanase. The EMBO Journal, 1987, 6(11): 3531-3538. |
| [44] | Baldi DL, Higginson EE, Hocking DM, Praszkier J, Cavaliere R, James CE, Bennett-Wood V, Azzopardi KI, Turnbull L, Lithgow T, Robins-Browne RM, Whitchurch CB, Tauschek M. The type Ⅱ secretion system and its ubiquitous lipoprotein substrate, SslE, are required for biofilm formation and virulence of enteropathogenic Escherichia coli. Infection and Immunity, 2012, 80(6): 2042-2052. DOI:10.1128/IAI.06160-11 |
| [45] | Roussel-Jazédé V, Grijpstra J, van Dam V, Tommassen J, van Ulsen P. Lipidation of the autotransporter NalP of Neisseria meningitidis is required for its function in the release of cell-surface-exposed proteins. Microbiology, 2013, 159: 286-295. DOI:10.1099/mic.0.063982-0 |
| [46] | Coutte L, Willery E, Antoine R, Drobecq H, Locht C, Jacob-Dubuisson F. Surface anchoring of bacterial subtilisin important for maturation function. Molecular Microbiology, 2003, 49: 529-539. DOI:10.1046/j.1365-2958.2003.03573.x |
| [47] | Nayar AS, Dougherty TJ, Ferguson KE, Granger BA, McWilliams L, Stacey C, Leach LJ, Narita SI, Tokuda H, Miller AA, Brown DG, McLeod SM. Novel antibacterial targets and compounds revealed by a high-throughput cell wall reporter assay. Journal of Bacteriology, 2015, 197(10): 1726-1734. DOI:10.1128/JB.02552-14 |
| [48] | Lorenz C, Dougherty TJ, Lory S. Transcriptional responses of Escherichia coli to a small-molecule inhibitor of LolCDE, an essential component of the lipoprotein transport pathway. Journal of Bacteriology, 2016, 198(23): 3162-3175. DOI:10.1128/JB.00502-16 |
| [49] | Fikrig E, Barthold SW, Kantor FS, Flavell RA. Protection of mice against the Lyme disease agent by immunizing with recombinant OspA. Science, 1990, 250(4980): 553-556. DOI:10.1126/science.2237407 |
| [50] | Johnson BJB, Sviat SL, Happ CM, Dunn JJ, Frantz JC, Mayer LW, Piesman J. Incomplete protection of hamsters vaccinated with unlipidated OspA from Borrelia burgdorferi infection is associated with low levels of antibody to an epitope defined by mAb LA-2. Vaccine, 1995, 13(12): 1086-1094. DOI:10.1016/0264-410X(95)00035-Y |
| [51] | Lee NY, Lee HY, Lee KH, Han SH, Park SJ. Vibrio vulnificus IlpA induces MAPK-mediated cytokine production via TLR1/2 activation in THP-1 cells, a human monocytic cell line. Molecular Immunology, 2011, 49(1/2): 143-154. |
