郭云学, 李百元, 王晓雪


中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东 广州 510301
收稿日期:2017-04-28;修回日期:2017-07-04;网络出版日期:2017-07-24
基金项目:国家自然科学基金(31290233,31625001,31500025)
作者简介:王晓雪,中国科学院南海海洋研究所,研究员,博导,国家青年千人、****。2000年在中国海洋大学获得学士学位,2006年在美国Texas A & M University获得遗传学博士学位,2007年至2011年先后在美国Rutgers University与Texas A & M University从事博士后研究。2011年底加入中国科学院南海海洋所,先后主持国家自然科学基金****基金、国家自然科学基金重大项目课题和面上项目、“973项目”课题、国家青年千人基金等国家级课题,主要围绕微生物的可移动遗传元件的功能和调控机制开展研究工作。先后以第一作者和通讯作者身份在自然子刊和微生物学权威杂志上报道累计发表SCI论文20余篇,他引537次。其中,Nature子刊3篇,环境微生物权威杂志ISME J 3篇,Nucleic Acids Research 1篇。先后受邀为环境微生物权威杂志Applied Environmental Microbiology及药物权威杂志Drug Resistance Updates撰写综述文章,成果多次被Nature Reviews Microbiology及Nature Biotechnology等选为专题评论或作为重要成果予以高度评价。目前担任《中国科学地球科学》与Frontiers in Marine Science等杂志编委,并于2016年被评为“优秀编委”
*通信作者:王晓雪, Tel:+86-20-89235490, E-mail:xxwang@scsio.ac.cn
摘要:毒素-抗毒素系统(Toxin-antitoxin system,TA)在细菌和古菌的染色体和可移动遗传元件中广泛分布,目前分为六大类型(Ⅰ型-Ⅵ型)。研究发现TA能够促进多重耐药菌群的形成,同时参与细菌的程序性死亡、调控生物被膜形成、介导细菌环境适应过程等多个重要的生命过程。TA的研究主要集中在肠道细菌和病原菌中,其中Ⅱ型TA研究最为深入和广泛。本文综述了近年来新型TA的鉴定、毒素新型作用靶点、抗毒素的调控功能以及TA间的相互作用等进展,并对未来的TA领域的潜在发展趋势和应用前景也进行了评述。
关键词: 毒素-抗毒素系统 mRNA水解酶 生物被膜 多重耐药菌 环境胁迫
Bacterial toxin-antitoxin systems:yin and yang of death and persistence
Yunxue Guo, Baiyuan Li, Xiaoxue Wang


Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, Guangdong Province, China
Received 28 April 2017; Revised 4 July 2017; Published online 24 July 2017
*Corresponding author: Xiaoxue Wang, Tel:+86-20-89235490, E-mail:xxwang@scsio.ac.cn
Supported by the National Natural Science Foundation of China (31290233, 31625001, 31500025)
Abstract: Toxin-Antitoxin Systems (TA) are prevalent in mobile genetic elements and chromosomes of prokaryotes. They have been classified into six different types based on the nature of the antitoxin and the way of activating the toxin. TA systems have been shown to play roles in the formation of dormancy and persister cell formation, and they have also been shown to participate in other important physiological processes such as programmed cell death, biofilm formation and general stresses responses. In the last three decades, the cellular targets and the regulation of TA systems have been revealed in both commensal and pathogenic bacteria; however, they have been largely unexplored in environmental microbes. In addition, most studies have focused on Type Ⅱ TA systems, and more efforts need to be devoted to other types of TA systems. This review focused on recent discoveries of novel TA systems, their novel targets, the interaction among different TA systems, and the regulatory roles of the antitoxins. Moreover, we discussed the potential future directions for research in the TA field as well as their applications in biotechnology and in medicine.
Key words: toxin-antitoxin system mRNA endoribonuclease biofilm persistence environmental stresses
毒素-抗毒素系统(Toxin-antitoxin system,TA)在环境微生物和致病微生物中广泛存在,目前研究集中在肠道细菌和致病菌。在模式微生物大肠杆菌中已发现40对TA[1-5]。TA通常由2个共转录的基因组成,其中1个基因编码不稳定的抗毒素分子(Antitoxin),另一个基因编码稳定的毒素蛋白(Toxin)。****曾将TA形象地比喻为细菌内的“定时炸弹”,弹药为稳定的毒素,而定时器则为不稳定的抗毒素分子[6]。在单独缺失抗毒素分子的情况下毒素表达失控,导致细菌死亡[6-7]。TA调控细胞内多个重要的细胞过程,包括DNA复制[8]、mRNA稳定性[7]、翻译[9]、细胞骨架的形成[2]、细胞膜的完整性[3, 10]以及细胞壁的形成[11],从而改变细胞的生理代谢状态,比如休眠细胞的形成[12]、抗生素的耐受性或耐药性[13]、细胞的程序性死亡[6]以及噬菌体感染[14]等。本文综述了TA的鉴定方法、毒素和抗毒素功能研究的新突破以及不同TA间的相互作用和TA的应用等方面的新进展,评述了TA领域的潜在发展趋势和应用前景。
1 TA的鉴定 根据抗毒素的类型(RNA或蛋白)以及抗毒素拮抗毒素毒性的机制,可以将TA分为6种不同的类型(Ⅰ-Ⅵ型) (图 1)。其中,针对Ⅱ型TA的研究最为深入和广泛,该类型TA具有如下典型的特征:(1) 编码毒素和抗毒素的基因通常为共转录的,两者均编码小蛋白(一般少于150个氨基酸);(2) 毒素具有抑菌或杀菌作用,抗毒素可通过蛋白-蛋白相互作用抑制毒素的毒性;(3) 毒素蛋白结构稳定,而抗毒素蛋白易被蛋白酶水解;(4) 毒素和抗毒素基因部分重叠或间距较短(≤60碱基),且抗毒素通常位于毒素的上游;(5) 抗毒素或毒素-抗毒素复合物可结合自身的启动子进行反馈调控。基于上述特征,研究人员开发了预测Ⅱ型TA的在线软件[15-16]和生物信息学分析方法[17],促进了TA的发现及鉴定。生物信息学分析发现,高等真核生物和原核生物核苷酸结合超家族(Higher eukaryotes and prokaryotes nucleotide-binding,HEPN)和最小核苷酸转移酶(Minimal nucleotidyltransferase,MNT)在真核和原核生物中广泛存在,其中HEPN家族蛋白由多样的核糖核酸酶组成,主要发挥防御功能[18]。HEPN主要存在于限制修饰系统和CRISPR系统(如Csm6和Csx1) 中,Yao等首次实验证明HEPN和MNT组成一对典型的Ⅱ型TA[19]。其中,HEPN为毒素蛋白,具有抑菌但非杀菌作用,而MNT则能够通过蛋白间相互作用完全拮抗HEPN的毒性。HEPN均具有保守的RX4-6H结构域,突变此结构域显著降低毒素的毒性。HEPN家族蛋白的作用靶点及毒性机制仍不清楚。此外,霍乱弧菌的非编码RNA MtlS具有细胞毒性,这种毒性作用可被反义链编码的蛋白MtlA拮抗[20],是非编码RNA可作为TA中毒素组分的新发现。Ⅰ型和Ⅲ型的抗毒素均为非编码RNA,但作用方式不同[21]。其中Ⅰ型抗毒素与毒素mRNA相互作用抑制毒素翻译或促进毒素mRNA被RNase等降解,而Ⅲ型中抗毒素直接与毒素蛋白相互作用抑制毒素的毒性,然而对这两种类型的相关研究受到RNA鉴定手段与研究手段的限制。Ⅵ型中抗毒素作用于毒素的靶点,干扰毒素与靶点的结合[2]。Ⅴ型中抗毒素与CRISPR-associated酶有结构相似性并具有mRNA切离酶的功能,通过特异性降解毒素mRNA的方式直接抑制毒素的翻译[3]。Ⅵ型型中抗毒素与毒素结合后促进毒素被蛋白酶的降解[22]。随着分子生物学研究技术的发展,以及研究手段的不断更新,相信会有更多具有新颖作用方式的TA被发现。
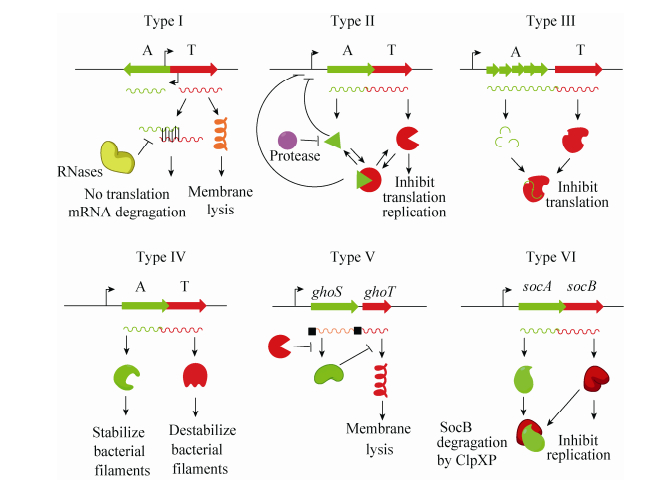 |
| 图 1 Ⅰ型–Ⅵ型型TA Figure 1 Types of TA systems. Antitoxin (A) and toxin (T) are shown in light green and red respectively. |
| 图选项 |
2 毒素和抗毒素的新功能 2.1 毒素功能的新发现 经过30多年的研究,不同类型毒素的功能及作用机制得到较为全面的阐释。这些胞内的蛋白通过水解mRNA、抑制DNA促旋酶活性、结合核糖体、抑制细胞分裂等,发挥抑菌或杀菌作用。我们近期的研究发现,大肠杆菌中Ⅰ型TA RalR-RalA中的毒素RalR为DNase,它非特异性水解甲基化和非甲基化的DNA,但不水解RNA,拓宽了毒素蛋白的功能[4]。此外,TA作为限制修饰系统中的重要成员之一,毒素在DNA或蛋白修饰方面的功能也逐渐被揭示。结核分支杆菌(Mycobacterium tuberculosis)和大肠杆菌中均发现乙酰基转移酶超家族的毒素,但它们的修饰方式又有明显区别。结核分支杆菌中的Ⅱ型毒素DarT含有N-乙酰基转移酶结构域,通过ADP核糖基化方式特异性修饰胸腺嘧啶核苷[23]。而大肠杆菌中的毒素AtaT为GNAT (Gcn5-related N-acetylatranferase)超家族的成员,能够将乙酰基从乙酰辅酶A特异性地转移到起始Met-tRNAfMet,进而使其不能与起始因子-2结合,导致不能形成翻译起始复合物,最终抑制细胞的生长[5]。除此之外,磷酸化修饰影响蛋白的活性,部分毒素也通过磷酸化过程对细胞产生毒性,比如Ⅱ型毒素HipA为磷酸化丝氨酸或苏氨酸的磷酸激酶,可以磷酸化一系列的底物,包括谷氨酰-tRNA合成酶GltX第239位的丝氨酸,而此氨基酸也为GltX的ATP结合位点,其磷酸化导致细胞内累积过量的不带电荷的tRNAGlu,而引起急性应激反应,使细胞进入多重耐药菌的休眠状态[24]。研究还发现,Ⅱ型毒素Doc磷酸化翻译延伸因子EF-Tu,导致其不能识别氨酰化的tRNA,从而抑制翻译的进程并降低细胞的代谢速率[25]。除了参与上述两种修饰外,毒素还参与甲基化修饰过程。天蓝色链霉菌A(3)2[Streptomyces coelicolor A(3)2]中的N6-腺嘌呤DNA甲基转移酶PglX与PglZ构成一对Ⅱ型TA。在没有噬菌体感染时,二者通过蛋白相互作用抑制PglX毒性。当DNA未被修饰的噬菌体感染时,PglX-PglZ复合物被激活,通过对噬菌体DNA的甲基化修饰来抑制噬菌体的感染[26]。细胞中还存在多种DNA和蛋白的修饰,如磷硫修饰、琥珀酰化修饰、泛素化修饰等,随着研究的不断开展和深入,TA在这些修饰过程中的功能及作用机制将会逐渐被发现。
2.2 抗毒素独立于毒素的调控功能 传统研究集中在抗毒素分子对毒素蛋白毒性的拮抗机制以及对自身启动子的调控作用上。在对正常生长条件下大肠杆菌的蛋白进行定量分析中发现,虽然Ⅱ型的毒素和抗毒素共同转录,但对于12对Ⅱ型TA,胞内的抗毒素蛋白含量远高于毒素蛋白[27]。另外,比对分析显示TA在进化过程中出现毒素发生失活而与之相对应的抗毒素分子得以保留的现象,暗示抗毒素分子可能具有不依赖于毒素的功能。Ⅱ型抗毒素作为DNA结合蛋白,对DNA结合具有序列依赖性,多数结合特定的回文序列。近期研究发现,大肠杆菌中的抗毒素MqsA作为依赖于“回文序列”的DNA结合蛋白,除了能够结合自身启动子实现对TA的反馈调节之外,也能够结合宿主关键转录因子Sigma因子RpoS的启动子,以抑制细菌的普遍应激反应。在环境胁迫条件下,蛋白水解酶Lon可迅速水解抗毒素蛋白MqsA,解除其对毒素蛋白MqsR的抑制作用;同时,因抗毒素蛋白MqsA水解释放的RpoS能够调控胞外多糖、过氧化氢酶、环二鸟苷酸等物质的合成,从而促进了生物被膜的形成[7]。由此可见,抗毒素MqsA是细菌从浮游状态转为生物被膜生长状态的重要“分子开关”,这表明TA在细菌应激状态下的生理功能调节方面发挥着非常重要的作用。此外,MqsA也可以结合在生物被膜合成关键调控因子csgD基因的启动子区,抑制其表达,进而阻碍菌毛的生成[28]。在rpoS和csgD的调控区域均发现MqsA结合的“回文序列”,这种结合随着特定条件下MqsA蛋白的水解失活而解除,证明TA可以精细调控细菌对环境胁迫的应答。我们最近还发现环境模式菌株恶臭假单胞菌KT2440 (Pseudomonas putida KT2440) 中的MqsA抗毒素不但可以与抗毒素MqsA的启动子区结合,也可以与宿主Sigma因子AlgU和普遍应激反应蛋白PP_3288的启动子区结合,发挥广泛的调控作用[29]。
3 不同类型TA间的相互作用 研究发现,毒素MqsR可以通过特异性识别mRNA的5′-GCU-3′序列降解mRNA,而对大肠杆菌的全基因扫描发现仅有14个基因的mRNA不存在5′-GCU-3′序列[30],其中包括ghoT和ralR。通过体外mRNA降解实验和体内转录表达研究,发现GhoT-GhoS为首个Ⅴ型的TA。结构解析发现,抗毒素GhoS是以单体形式发挥作用,其与CRISPR结合蛋白具有类似的结构。GhoS特异性地降解毒素GhoT的mRNA,从而抑制毒素的毒性[3]。此外,我们也发现RalR-RalA为新颖的Ⅰ型TA,RalR反义链非编码RNA RalA通过碱基互补配对结合于RalR mRNA编码区域,抑制RalR的翻译延伸,这种拮抗作用受非编码RNA分子伴侣Hfq的严格控制,在缺失hfq基因的宿主中RalA的拮抗功能完全消失[4],这也是首个受Hfq调控的RNA抗毒素[21]。进一步研究阐明了不同类型TA间的级联反应,即细菌在正常生长条件下,不同类型毒素的毒性均被各自的抗毒素拮抗(图 2-A),不能发挥任何细胞毒性作用;而氧化胁迫等胞外刺激信号激活了蛋白水解酶对抗毒素的降解作用,从而启动了Ⅱ型毒素MqsR (图 2-B),Ⅱ型毒素进而降解Ⅴ型抗毒素ghoS mRNA,导致Ⅴ型毒素GhoT累积并发挥作用;Ⅴ型毒素能够迅速减弱胞内的代谢活性,使宿主进入生长停滞状态。此外,由于Ⅰ型抗毒素非编码RNA RalA含有GCU序列可以被MqsR特异性降解,而在MqsR被累积的环境胁迫条件下,我们推测RalA被水解而RalR得到积累,进而发挥DNA水解功能,从而产生细胞毒性。所以,Ⅱ型TA可通过mRNA水解酶的活性调控类型Ⅴ型和Ⅰ型TA,从而揭示细菌代谢调节的级联反应。鉴于Ⅱ型和Ⅴ型TA均与细菌的多重耐药性直接相关,Ⅰ型TA能够增强细菌对广谱性抗生素磷霉素的耐药性,该研究对于细菌耐药性机制的阐释具有重要的指导意义。除此之外,不同的Ⅱ型TA间也存在相互激活作用,但具体的机制仍不清楚。Ⅱ型毒素MqsR可诱导relE-relB操纵子的表达[31-32]。反之,毒素HipA和RelE也可以诱导mqsR-mqsA操纵子表达[32-34]。过表达Ⅱ型毒素VapC也可以诱导不同菌中包括YoeB-YefM在内的多对TA的表达[35-36]。
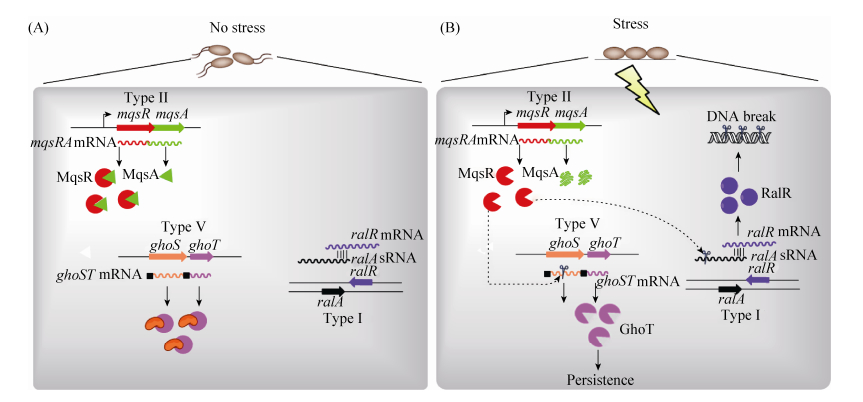 |
| 图 2 大肠杆菌中Ⅰ型TA (RalR-RalA)、Ⅱ型TA (MqsR-MqsA)和Ⅴ型TA (GhoS-GhoT)间的相互作用 Figure 2 Cross-talk among type Ⅰ(RalR-RalA), type Ⅱ (MqsR-MqsA) and type Ⅴ (GhoS-GhoT) TA systems. |
| 图选项 |
4 TA的潜在应用价值 工业发酵及分子克隆试剂盒研发均较好地应用了TA稳定质粒的作用。依据Ⅱ型毒素AtaT等在DNA和蛋白修饰方面的特异性,可以将其开发为阻断特定生物学过程(如翻译起始)的试剂,为相关研究提供较好材料。多重耐药菌的治疗已经成为医学界的攻坚难题之一,开发靶向毒素的药物来抑制多重耐药菌群的产生为治疗反复性细菌感染提供新的思路。但靶向单个毒素的方法具有一定的局限性,TA多重耐药菌群的形成作用中的冗余性(Redundency)尚未有清晰的阐释。所以也可以通过靶向TA的激活过程进而抑制多个毒素的表达[37-38]。已有研究表明细菌的TA在真核细胞中也发挥作用,其中Ⅱ型TA MazF-MazE中的毒素MazF经诱导表达可有效抑制肿瘤细胞的生长,这为肿瘤的治疗提供新的可能性[39]。
5 展望 目前TA的研究集中在模式菌株和致病菌中,在环境微生物尤其是极端环境微生物中的研究明显不足。微生物组(Micrbiome)计划的启动将为从群落水平研究TA的功能提供新的契机,而对TA类型和功能的预测是开展相关领域研究的基石。从1984年第一个TA被发现,历经30多年,TA作用方式的复杂性和作用靶点的多样化已远超出我们的预期。但国际上对TA的生理功能仍存在争议,尤其TA能否引发“程序性死亡”和在多重耐药菌群形成中的作用这两个“矛盾”的方面。TA究竟是作为“定时炸弹”导致细菌自身死亡,还是作为细菌对抗抗生素的“免死金牌”,仍需要更为深入和系统的基础研究。
References
| [1] | Yamaguchi Y, Inouye M. Regulation of growth and death in Escherichia coli by toxin-antitoxin systems. Nature Reviews Microbiology, 2011, 9(11): 779-790. DOI:10.1038/nrmicro2651 |
| [2] | Masuda H, Tan Q, Awano N, Wu KP, Inouye M. YeeU enhances the bundling of cytoskeletal polymers of MreB and FtsZ, antagonizing the CbtA (YeeV) toxicity in Escherichia coli. Molecular Microbiology, 2012, 84(5): 979-989. DOI:10.1111/mmi.2012.84.issue-5 |
| [3] | Wang XX, Lord DM, Cheng HY, Osbourne DO, Hong SH, Sanchez-Torres V, Quiroga C, Zheng K, Herrmann T, Peti W, Benedik MJ, Page R, Wood TK. A new type Ⅴ toxin-antitoxin system where mRNA for toxin GhoT is cleaved by antitoxin GhoS. Nature Chemical Biology, 2012, 8(10): 855-861. DOI:10.1038/nchembio.1062 |
| [4] | Guo YX, Quiroga C, Chen Q, McAnulty MJ, Benedik MJ, Wood TK, Wang XX. RalR (a DNase) and RalA (a small RNA) form a type Ⅰ toxin-antitoxin system in Escherichia coli. Nucleic Acids Research, 2014, 42(10): 6448-6462. DOI:10.1093/nar/gku279 |
| [5] | Jur?nas D, Chatterjee S, Konijnenberg A, Sobott F, Droogmans L, Garcia-Pino A, van Melderen L. AtaT blocks translation initiation by N-acetylation of the initiator tRNAfMet. Nature Chemical Biology, 2017, 13(6): 640-646. DOI:10.1038/nchembio.2346 |
| [6] | Yarmolinsky MB. Programmed cell death in bacterial populations. Science, 1995, 267(5199): 836-837. DOI:10.1126/science.7846528 |
| [7] | Wang XX, Kim Y, Hong SH, Ma Q, Brown BL, Pu MM, Tarone AM, Benedik MJ, Peti W, Page R, Wood TK. Antitoxin MqsA helps mediate the bacterial general stress response. Nature Chemical Biology, 2011, 7(6): 359-366. DOI:10.1038/nchembio.560 |
| [8] | Bernard P, Couturier M. Cell killing by the F plasmid CcdB protein involves poisoning of DNA-topoisomerase Ⅱ complexes. Journal of Molecular Biology, 1992, 226(3): 735-745. DOI:10.1016/0022-2836(92)90629-X |
| [9] | Prysak MH, Mozdzierz CJ, Cook AM, Zhu L, Zhang YL, Inouye M, Woychik NA. Bacterial toxin YafQ is an endoribonuclease that associates with the ribosome and blocks translation elongation through sequence-specific and frame-dependent mRNA cleavage. Molecular Microbiology, 2009, 71(5): 1071-1087. DOI:10.1111/mmi.2009.71.issue-5 |
| [10] | Cheng HY, Soo VWC, Islam S, McAnulty MJ, Benedik MJ, Wood TK. Toxin GhoT of the GhoT/GhoS toxin/antitoxin system damages the cell membrane to reduce adenosine triphosphate and to reduce growth under stress. Environmental Microbioloby, 2014, 16(6): 1741-1754. DOI:10.1111/emi.2014.16.issue-6 |
| [11] | Silvaggi JM, Perkins JB, Losick R. Small untranslated RNA antitoxin in Bacillus subtilis. Journal of Bacteriology, 2005, 187(19): 6641-6650. DOI:10.1128/JB.187.19.6641-6650.2005 |
| [12] | Lewis K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology, 2007, 5(1): 48-56. DOI:10.1038/nrmicro1557 |
| [13] | Lewis K. Persister cells. Annual Review of Microbiology, 2010, 64: 357-372. DOI:10.1146/annurev.micro.112408.134306 |
| [14] | Pecota DC, Wood TK. Exclusion of T4 phage by the hok/sok killer locus from plasmid R1. Journal of Bacteriology, 1996, 178(7): 2044-2050. DOI:10.1128/jb.178.7.2044-2050.1996 |
| [15] | Shao YC, Harrison EM, Bi DX, Tai C, He XY, Ou HY, Rajakumar K, Deng ZX. TADB:a web-based resource for type 2 toxin-antitoxin loci in bacteria and archaea. Nucleic Acids Research, 2011, 39(D1): D606-D611. |
| [16] | Sevin EW, Barloy-Hubler F. RASTA-Bacteria:a web-based tool for identifying toxin-antitoxin loci in prokaryotes. Genome Biology, 2007, 8: R155. DOI:10.1186/gb-2007-8-8-r155 |
| [17] | Leplae R, Geeraerts D, Hallez R, Guglielmini J, Drèze P, Van Melderen L. Diversity of bacterial type Ⅱ toxin-antitoxin systems:a comprehensive search and functional analysis of novel families. Nucleic Acids Research, 2011, 39(13): 5513-5525. DOI:10.1093/nar/gkr131 |
| [18] | Koonin EV, Zhang F. Coupling immunity and programmed cell suicide in prokaryotes:life-or-death choices. BioEssays, 2017, 39(1): 1-9. DOI:10.1002/bies.201670013 |
| [19] | Yao JY, Guo YX, Zeng ZS, Liu XS, Shi F, Wang XX. Identification and characterization of a HEPN-MNT family type Ⅱ toxin-antitoxin in Shewanella oneidensis. Microbial Biotechnology, 2015, 8: 961-973. DOI:10.1111/1751-7915.12294 |
| [20] | Mustachio LM, Aksit S, Mistry RH, Scheffler R, Yamada A, Liu JM. The Vibrio cholerae mannitol transporter is regulated posttranscriptionally by the MtlS small regulatory RNA. Journal of Bacteriology, 2012, 194(3): 598-606. DOI:10.1128/JB.06153-11 |
| [21] | Brantl S, Jahn N. sRNAs in bacterial type Ⅰ and type Ⅲ toxin-antitoxin systems. FEMS Microbiology Reviews, 2015, 39(3): 413-427. DOI:10.1093/femsre/fuv003 |
| [22] | Aakre CD, Phung TN, Huang D, Laub MT. A bacterial toxin inhibits DNA replication elongation through a direct interaction with the β sliding clamp. Molecular Cell, 2013, 52(5): 617-628. DOI:10.1016/j.molcel.2013.10.014 |
| [23] | Jankevicius G, Ariza A, Ahel M, Ahel I. The toxin-antitoxin system DarTG catalyzes reversible ADP-ribosylation of DNA. Molecular Cell, 2016, 64(6): 1109-1116. DOI:10.1016/j.molcel.2016.11.014 |
| [24] | Kaspy I, Rotem E, Weiss N, Ronin I, Balaban NQ, Glaser G. HipA-mediated antibiotic persistence via phosphorylation of the glutamyl-tRNA-synthetase. Nature Communications, 2013, 4: 3001. |
| [25] | Castro-Roa D, Garcia-Pino A, de Gieter S, van Nuland NA, Loris R, Zenkin N. The Fic protein Doc uses an inverted substrate to phosphorylate and inactivate EF-Tu. Nature Chemical Biology, 2013, 9(12): 811-817. DOI:10.1038/nchembio.1364 |
| [26] | Hoskisson PA, Sumby P, Smith MCM. The phage growth limitation system in Streptomyces coelicolor A(3)2 is a toxin/antitoxin system, comprising enzymes with DNA methyltransferase, protein kinase and ATPase activity. Virology, 2015, 477: 100-109. DOI:10.1016/j.virol.2014.12.036 |
| [27] | Li GW, Burkhardt D, Gross C, Weissman JS. Quantifying absolute protein synthesis rates reveals principles underlying allocation of cellular resources. Cell, 2014, 157(3): 624-635. DOI:10.1016/j.cell.2014.02.033 |
| [28] | Soo VWC, Wood TK. Antitoxin MqsA represses curli formation through the master biofilm regulator CsgD. Scientific Reports, 2013, 3: 3186. DOI:10.1038/srep03186 |
| [29] | Sun CL, Guo YX, Tang KH, Wen ZL, Li BY, Zeng ZS, Wang XX. MqsR/MqsA toxin/antitoxin system regulates persistence and biofilm formation in Pseudomonas putida KT2440. Frontiers in Microbiology, 2017, 8: 840. DOI:10.3389/fmicb.2017.00840 |
| [30] | Wang XX, Lord DM, Hong SH, Peti W, Benedik MJ, Page R, Wood TK. Type Ⅱ toxin/antitoxin MqsR/MqsA controls type Ⅴ toxin/antitoxin GhoT/GhoS. Environmental Microbiology, 2013, 15(6): 1734-1744. DOI:10.1111/emi.2013.15.issue-6 |
| [31] | Kim Y, Wang XX, Zhang XS, Grigoriu S, Page R, Peti W, Wood TK. Escherichia coli toxin/antitoxin pair MqsR/MqsA regulate toxin CspD. Environmental Microbiology, 2010, 12(5): 1105-1121. DOI:10.1111/emi.2010.12.issue-5 |
| [32] | Kasari V, Mets T, Tenson T, Kaldalu N. Transcriptional cross-activation between toxin-antitoxin systems of Escherichia coli. BMC Microbiology, 2013, 13: 45. DOI:10.1186/1471-2180-13-45 |
| [33] | Kasari V, Kurg K, Margus T, Tenson T, Kaldalu N. The Escherichia coli mqsR and ygiT genes encode a new toxin-antitoxin pair. Journal of Bacteriology, 2010, 192(11): 2908-2919. DOI:10.1128/JB.01266-09 |
| [34] | Garcia-Pino A, Christensen-Dalsgaard M, Wyns L, Yarmolinsky M, Magnuson RD, Gerdes K, Loris R. Doc of prophage P1 is inhibited by its antitoxin partner Phd through fold complementation. Journal of Biological Chemistry, 2008, 283(45): 30821-30827. DOI:10.1074/jbc.M805654200 |
| [35] | Winther KS, Gerdes K. Ectopic production of VapCs from Enterobacteria inhibits translation and trans-activates YoeB mRNA interferase. Molecular Microbiology, 2009, 72(4): 918-930. DOI:10.1111/mmi.2009.72.issue-4 |
| [36] | Guo YX, Yao JY, Sun CL, Wen ZL, Wang XX. Characterization of the deep-sea Streptomyces sp. SCSIO 02999 derived VapC/VapB toxin-antitoxin system in Escherichia coli. Toxins, 2016, 8(7): 195. DOI:10.3390/toxins8070195 |
| [37] | Page R, Peti W. Toxin-antitoxin systems in bacterial growth arrest and persistence. Nature Chemical Biology, 2016, 12(4): 208-214. DOI:10.1038/nchembio.2044 |
| [38] | Wang XX, Wood TK. Cryptic prophages as targets for drug development. Drug Resistance Updates, 2016, 27: 30-38. DOI:10.1016/j.drup.2016.06.001 |
| [39] | Shimazu T, Mirochnitchenko O, Phadtare S, Inouye M. Regression of solid tumors by induction of MazF, a bacterial mRNA endoribonuclease. Journal of Molecular Microbiology and Biotechnology, 2014, 24(4): 228-233. DOI:10.1159/000365509 |
