 ,1,2, 陈笑芸1, 彭城1, 徐俊锋1, 沈洁3, 李玥莹
,1,2, 陈笑芸1, 彭城1, 徐俊锋1, 沈洁3, 李玥莹 ,2, 汪小福
,2, 汪小福 ,1
,1Establishment of a field visual detection method for genetically modified maize ‘Shuangkang’12-5 by fluorescence RPA
Yu Chen ,1,2, Xiaoyun Chen1, Cheng Peng1, Junfeng Xu1, Jie Shen3, Yueying Li
,1,2, Xiaoyun Chen1, Cheng Peng1, Junfeng Xu1, Jie Shen3, Yueying Li ,2, Xiaofu Wang
,2, Xiaofu Wang ,1
,1通讯作者: 汪小福,博士,副研究员,研究方向:转基因安全评价与检测。E-mail:yywxf1981@163.com李玥莹,博士,教授,研究方向:植物基因工程。E-mail:yueyinglicn@163.com
编委: 宋任涛
收稿日期:2021-03-24修回日期:2021-07-6网络出版日期:2021-08-20
| 基金资助: |
Received:2021-03-24Revised:2021-07-6Online:2021-08-20
| Fund supported: |
作者简介 About authors
陈欲,在读硕士研究生,专业方向:植物基因工程。E-mail:

摘要
转基因玉米双抗12-5具有良好的抗虫性和除草剂耐受性,是我国第一批获得安全证书的转基因玉米之一,具有广阔的应用前景。本研究利用重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)建立转基因玉米双抗12-5的现场快速检测方法。针对转基因玉米双抗12-5的转化体特异性序列片段,设计引物和探针,通过引物筛选实验得到最佳引物与探针组合。荧光RPA扩增结果可以在蓝光下直接进行可视化分析。结果表明,建立的转基因玉米双抗12-5可视化检测体系特异性强,检测灵敏度达到10拷贝。进一步研究发现RPA的扩增体系对温度有很强的适应性,样品在34℃~46℃之间都能得到扩增,据此,本研究利用市面上常见的自发热暖贴代替常规的加热仪器来激发RPA。结果表明,自发热暖贴满足RPA扩增体系对温度的需要。最终,本研究将自发热暖贴加热法与RPA可视化检测体系结合,对转基因玉米双抗12-5进行现场检测,并与qPCR方法检测结果作比较,检测结果表明,本研究建立的现场可视化检测方法与qPCR方法检测结果一致,并且可视化检测方法时间短,检测结果清晰易分辨。本研究建立的转基因玉米双抗12-5现场快速可视化检测方法,其特异性强、灵敏度高、方便、快捷,不仅满足了转基因玉米双抗12-5的现场快速检测的需要,也为其他现场快速检测方法的开发提供了新思路。
关键词:
Abstract
The genetically modified (GM) maize ‘Shuangkang’12-5 has good insect resistance and herbicide tolerance, which is one of the first series of GM maizes obtained a safety certificate in China, and it has broad application prospect in the future. This study established an on-site rapid detection method for GM ‘Shuangkang’12-5 based on recombinase polymerase amplification (RPA) technology, which primes and probe were designed according to the specific flank sequence. Then the best combination of primers and probe was obtained through a screeing process. The amplification results of fluorescence RPA can be directly visualized under blue light. The results showed that the visual detection system of GM ‘Shuangkang’12-5 with high specificity, and the detection sensitivity of the method could reached 10 copies. Further research found that the RPA amplification system had a wide range of temperature (34℃-46℃). According to this property, the common self-heating warm pastes on the market were used replace the traditional heating instruments to stimulate the RPA.The results showed that the self-heating warm paste meets the temperature requirement of the RPA system. Finally, we combined the self-heating warm pastes with the RPA visual detection system to conduct on-site detection of GM ‘Shuangkang’12-5, and compared the results with the detection results of qPCR. The detection showed that the results of on-site visual detection method established in this study were consistent with the detection results of the qPCR. Moreover, the visual detection method was more shorter in time and the final detection result was clear and easy to distinguish. The rapid on-site visual detection method for GM ‘Shuangkang’ 12-5 established in this study has high specificity, high sensitivity and convenience. It not only meets the needs of on-site rapid detection of GM ‘Shuangkang’12-5, but also provides highlight for the development of other on-site rapid detection methods.
Keywords:
PDF (1072KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
陈欲, 陈笑芸, 彭城, 徐俊锋, 沈洁, 李玥莹, 汪小福. 转基因玉米双抗12-5荧光RPA现场可视化检测方法的建立. 遗传[J], 2021, 43(8): 802-812 doi:10.16288/j.yczz.21-110
Yu Chen.
玉米是全球三大粮食作物之一[1],具有很高的营养价值和良好的耐旱、耐寒、耐贫瘠性,是用途最为广泛的粮食作物[2],对粮食安全和保障农业产业结构稳定具有重要作用[3]。随着转基因技术的发展和满足粮食安全保障的需要,自1990年起,世界各国开始广泛种植转基因作物[4]。转基因玉米是全球种植面积第二大的转基因作物,2019年种植面积达到了6090万公顷,占全球玉米种植面积的31%。转基因玉米的种植为粮食安全、环境保护等方面起到了积极的作用。
我国对于粮食的需求随着人口的增长而递增,玉米作为我国主要的粮食作物和加工原料,其市场需求更大[5]。自2010年以来,我国转变为玉米净进口国,目前我国批准进口的转基因玉米转化体有20多种,为保证我国的粮食安全,国内也在进行转基因玉米的研发。2019年12月我国自主研发的两个玉米转化体首次获得安全证书[6],其中转基因玉米双抗12-5是由浙江大学研发,拥有我国自主产权的转基因玉米品系。该品系中导入了两个基因表达框,分别是pUbi-Cry1Ab/Cry2Aj-T(PEPC)和p(35S/Ubi)- EPSPS-T(35S),融合Bt基因由玉米泛素启动子和PEPC终止子调控,而EPSPS (5-enolpyruvylshikimate- 3-phosphate synthase gene)基因由CaMV35S和玉米泛素启动子组成的复合启动子及35S终止子调控。由于EPSPS基因具有除草剂耐受性,可以作为筛选标记基因,后期可以用草甘膦进行阳性植株的筛选。该转基因玉米表现出良好的抗虫性和除草剂耐受性,具有广阔的应用前景[3,6],今后可能会商业化大范围种植。为了对其进行更好的监控和管理,迫切需要建立现场快速检测方法。
目前转基因作物的检测主要有基于蛋白质和基于核酸两种方法。基于蛋白质的检测方法多需要制备抗体,其周期长、成本高,而且只能检测外源蛋白,检测靶标有限;另一方面,基于蛋白质的检测方法,只能检测作物的新鲜样品或初加工样品,对于加工品或深加工品的检测存在局限性。而基于核酸的检测方法更加准确、稳定,应用范围也更加广泛[7]。在诸多核酸检测方法中,PCR技术(如普通PCR、qPCR)等是目前国内外已开发的数量最多的一类转基因检测方法,结果准确、灵敏度高、特异性强[8],被许多国家作为有关食品法规的标准检验方法[9]。但PCR检测法依赖于精密仪器,且耗时长,限制了其在现场检测中的使用[10]。
重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)是一种新型恒温扩增技术[11],利用重组酶、单链结合蛋白、DNA聚合酶在恒温条件下可实现对核酸的快速、特异性扩增,短时间(5~ 20 min)内即可完成核酸的扩增[12]。扩增条件一般为恒温39℃,不需要大型仪器,而且RPA对模板的纯度要求不高,适合不同样品的扩增检测。本研究结合RPA的这些特性,首先筛选出针对转基因玉米双抗12-5转化体特异性检测的RPA引物对与探针组合,并利用蓝光灯照射直接判断其扩增结果,再结合RPA对扩增温度的耐受性,利用自发热暖贴代替仪器加热,从而建立一种针对转基因玉米双抗12-5的现场快速可视化检测方法。
1 材料与方法
1.1 材料
转基因玉米双抗12-5种子,转基因玉米NK603、BT176、T25和BT11,转基因大豆A5547-127、356043、GTS40-3-2和FG72,转基因油菜MS1×RF1、MS2× RF2、MS8×RF3和OXY235,转基因棉花LLcotton25、MON15985和GHB119的DNA均来自本实验室。1.2 DNA提取
按照植物DNA提取试剂盒(杭州新景生物试剂开发有限公司)说明书提取各样品的基因组DNA,所提取的DNA用核酸蛋白测定仪NanoDrop2000C (美国Thermo公司)进行核酸质量分析,并置于-20℃贮存备用。1.3 荧光RPA
参照RPA (荧光型)试剂盒(潍坊安普未来生物科技有限公司)说明书进行体系配置,荧光RPA反应体系为50 μL:Buffer A 12.5 μL,10 μmol/L正、反向引物各2 μL,10 μmol/L探针0.6 μL,模板DNA 2 μL,加ddH2O补齐到47.5 μL,充分混匀后加入Buffer B 2.5 μL,再次混匀。荧光RPA反应条件:39℃扩增20 min。荧光RPA的实时荧光信号用荧光定量PCR仪CFX96 (美国伯乐公司)观察,荧光RPA的可视化结果用手持蓝光灯(LUYOR-3415RG,路阳仪器)照射并在黄色滤镜下拍照观察。1.4 引物与探针设计
荧光RPA体系包括2条引物和1条探针,转基因玉米双抗12-5的载体示意图及扩增的转化体特异性序列信息见图1A。利用Vector NTI软件在外源插入位点的左侧即转基因玉米基因组序列设计上游引物8条,在外源插入位点的右侧即外源插入片段序列设计下游引物8条。所设计的上、下游引物分别处于外源插入位点的两侧,以保证对转基因玉米双抗12-5的特异性扩增。引物长度30~35 bp,GC含量占30%~70%[13]。所设计探针包含玉米基因组和外源片段的序列,长度46~52 bp,并避免回文序列、内部二级结构和连续重复碱基。探针共有4个修饰位点,在探针中间部位,用一个四氢呋喃(THF)碱基类似物代替第31个碱基G,作为核酸外切酶的识别位点;在THF位点的上游,第30个碱基T处标记一个荧光基团6-羧基荧光素(FAM:6-carboxy- fluorescein),在THF位点的下游,第33个碱基T处标记一个黑洞淬灭基团(BHQ:black hole quencher),两基团的间距为1~5 bp;THF位点距离3ʹ末端至少15 bp长度,并在探针3ʹ末端标记一个封闭基团。只有当探针与序列成功配对时,THF位点才会被外切酶切割,使荧光基团与淬灭基团分离,从而产生荧光信号(图1B)。图1
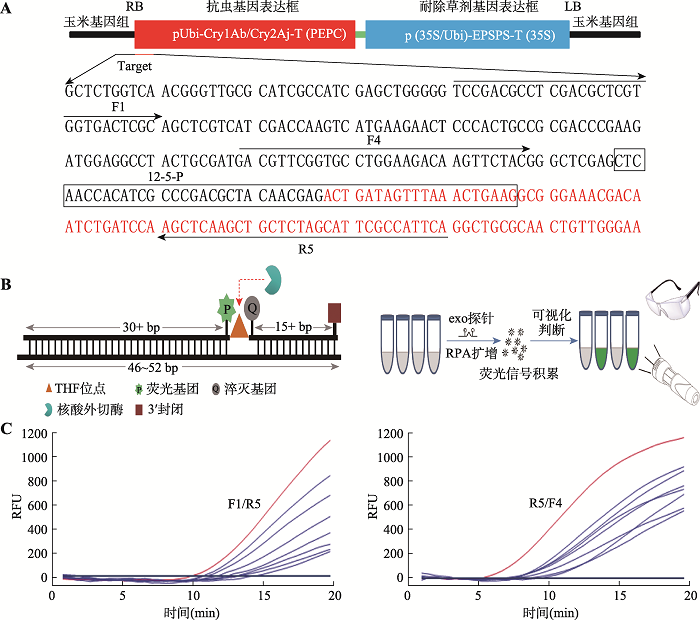 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1荧光RPA引物和探针的设计与筛选
A:转基因玉米12-5载体示意图及扩增的特异性序列。黑色字母为玉米基因组序列;红色字母为外源插入片段序列;带箭头的横线为引物F1、F4以及R5所在位置;黑色框内为探针所在位置。B:探针设计原理与可视化检测示意图。C:引物筛查扩增结果。左图为上游引物F1与所有下游引物扩增结果,右图为下游引物R5与所有上游引物扩增结果。RFU:相对荧光强度。
Fig. 1Design and screening of the primers and probe of fluorescence RPA
转基因玉米双抗12-5的普通PCR引物和qPCR引物引用国家标准[14],本研究所用的引物和探针配制为10 μmol/L。所有引物和探针均由生工生物工程(上海)股份有限公司合成,引物和探针信息见表1。
Table 1
表1
表1本文所用引物与探针序列
Table 1
| 目的 | 名称 | 序列(5ʹ→3ʹ) | 扩增产物长度(bp) | 啊啊啊啊 |
|---|---|---|---|---|
| 荧光RPA | 12-5-F1 | TCCGACGCCTCGACGCTCGTGGTGACTCGC | 本研究 | |
| 12-5-F2 | CGACCAAGTCATGAAGAACTCCCACTGCCG | |||
| 12-5-F3 | CGACCCGAAGATGGAGGCCTACTGCGATGA | |||
| 12-5-F4 | GACGTTCGGTGCCTGGAAGACAAGTTCTAC | |||
| 12-5-F5 | CGTCATCGACCAAGTCATGAAGAACTCCCA | |||
| 12-5-F6 | CAGCTCGTCATCGACCAAGTCATGA | |||
| 12-5-F7 | CCGACGCCTCGACGCTCGTGGTGACTCGCAGC | |||
| 12-5-F8 | CATCGACCAAGTCATGAAGAACTCCCACTGCCG | |||
| 12-5-R1 | ATGCTAGAGCAGCTTGAGCTTGGATCAGAT | |||
| 12-5-R2 | CCGATCGCCCTTCCCAACAGTTGCGCAGCC | |||
| 12-5-R3 | CCAGCTGGCGTAATAGCGAAGAGGCCCGCA | |||
| 12-5-R4 | TAATAGCGAAGAGGCCCGCACCGATCGCCC | |||
| 12-5-R5 | TGAATGGCGAATGCTAGAGCAGCTTGAGCT | |||
| 12-5-R6 | CTGAATGGCGAATGCTAGAGCAGCT | |||
| 12-5-R7 | CTTGAGCTTGGATCAGATTGTCGT TTCCCGCC | |||
| 12-5-R8 | CCCAACAGTTGCGCAGCCTGAATGGCGAATGC | |||
| 12-5-P | AACCACATCGCCCGACGCTACAACGAGAC[FAM-dT][THF]A [BHQ-dT]AGTTTAAACTGAA[3'-block] | |||
| 普通PCR | 12-5-PCR-F | CAACGTCGTGACTGGGAAAA | 256 | [14] |
| 12-5-PCR-R | TGGAAGACAAGTTCTACGGGCT | |||
| qPCR | 12-5qPCR-F | GTCGTTTCCCGCCTTCAGTT | 94 | |
| 12-5qPCR-R | GGTGCCTGGAAGACAAGTTCTA | |||
| 12-5qPCR-P | [FAM]AGCTCAACCACATCGCCCGACGC[BHQ1] |
新窗口打开|下载CSV
1.5 引物筛查
用上游引物F1分别与所有下游引物组合,结合探针,对转基因玉米双抗12-5进行实时荧光RPA检测实验,分析结果,选出其中扩增效率最高的下游引物,再用这条下游引物分别与所有上游引物组合,结合探针,对转基因玉米双抗12-5进行实时荧光RPA检测实验,选择扩增效率最高的一组,作为最终的检测引物组合。1.6 普通PCR与qPCR
普通PCR体系25 µL:10×PCR buffer 2.5 µL,dNTPs 0.2 mmol/L,上、下游引物各0.2 µmol/L,rTaq酶0.025 U/µL。使用德国Biometra公司TgradientPCR仪进行扩增。普通PCR扩增程序:98℃预变性2 min;98℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸2 min,4℃保存。配制2%的琼脂糖凝胶,GelRed染色,对扩增产物进行电泳检测,凝胶成像仪上观察与拍照。凝胶电泳系统为美国GE公司的EPS301;紫外凝胶成像分析仪购自美国伯乐公司。qPCR体系25 µL:2×qPCR Master Mix 12.5 μL,上、下游引物各0.4 μmol/L,探针0.2 μmol/L。qPCR扩增程序:95℃预变性5 min;95℃变性15 s,58℃退火1 min,40个循环。荧光定量PCR仪为美国伯乐公司的CFX96,反应结束使用Bio-Rad CFX Manager 3.1进行数据分析。
1.7 荧光RPA特异性实验
用筛选出的最佳引物对,根据上述荧光RPA扩增体系,以转基因玉米12-5 DNA作为阳性对照,以转基因玉米NK603、BT176、T25、BT11,转基因大豆A5547-127、356043、GTS40-3-2、FG72,转基因油菜MS1×RF1、MS2×RF2、MS8×RF3、OXY235以及转基因棉花LLcotton25、MON15985、GHB119样品DNA作为其他作物模板进行检测,以评价所建立的荧光RPA检测方法的特异性。1.8 灵敏度实验
核酸蛋白测定仪测定所提取转基因玉米双抗12-5的DNA浓度,计算拷贝数,并稀释提取的DNA至640拷贝/μL,再2倍系列稀释,分别得到320、160、80、40、20、10、5拷贝/μL共7个浓度。以上述8个浓度DNA为模板,以无菌水作为阴性对照,进行实时荧光RPA检测,同时可视化观察结果,并用qPCR检测法和普通PCR检测法对上述8个浓度转基因玉米双抗12-5的DNA进行检测,以评估比较所建立荧光RPA方法的灵敏度。1.9 荧光RPA温度适应性及暖贴加热法可行性分析
为探究荧光RPA可视化检测法的温度适应性范围,本研究共设12个扩增温度,分别是26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃、42℃、44℃、46℃和48℃。根据上述荧光RPA扩增体系,进行荧光RPA扩增实验,扩增结束后可视化观察分析结果。为优化荧光RPA现场扩增方式,本研究尝试用市面上一种可以自发热的暖贴对样品进行加热,对暖贴自发热后50 min内的温度进行测定,分析温度随时间的变化情况,初步判定该尝试是否可行;并使用暖贴加热法和加热块39℃加热法分别对转基因玉米双抗12-5和非转基因玉米进行荧光RPA扩增实验,可视化观察结果并使用多标记微孔板系统Cytation5 (美国伯腾公司)测定荧光值大小,进一步评价暖贴加热法的可行性。1.10 实际检测
为实现高通量的现场检测,本研究尝试用96孔板完成现场可视化扩增和检测。用上述建立的转基因玉米双抗12-5可视化荧光RPA检测体系,结合暖贴加热法,对96个实际样品进行检测,并同时使用qPCR检测法对上述96个实际样品进行检测。通过分析和对比两种检测方法所得结果,判断本研究建立的转基因玉米12-5荧光RPA现场检测方法是否可行。本研究模拟实际样品检测时,对96个样品只进行了一次检测,其他实验如没有特别说明,都是3次重复,每次3个平行。2 结果与分析
2.1 荧光RPA引物筛选结果
引物筛选过程见图1C。图1C中左图为上游引物F1与所有下游引物组合结合探针,对转基因玉米双抗12-5进行实时荧光RPA扩增的结果,可以看到上游引物F1与下游引物R5组合扩增效率最高,10 min开始出现荧光信号,荧光信号曲线起峰时间最早,且最终荧光值达到最高,为1200左右,其他引物组合最终达到荧光值最高仅800,说明下游引物中,R5的扩增能力最强。图1C中右图为下游引物R5与所有上游引物组合结合探针,对转基因玉米双抗12-5进行实时荧光RPA检测的结果,可以看到下游引物R5与上游引物F4组合的扩增效率最高,5 min开始起峰,且最终荧光值最高,为1200左右,而其他引物组合最早8 min开始起峰,最终达到荧光值也未超过1000,说明上游引物中,F4的扩增能力最强。最终选定上游引物F4与下游引物R5组合,作为最终建立荧光RPA检测转基因玉米双抗12-5的引物。2.2 荧光RPA特异性检验
实时荧光RPA特异性检测结果见图2A,仅样品为转基因玉米双抗12-5时出现扩增曲线,其他样品均无扩增曲线产生,表明转基因玉米双抗12-5实时荧光RPA检测方法特异性良好。可视化观察荧光RPA扩增结果见图2B,可以明显看到仅转基因玉米双抗12-5样品所在离心管有绿色荧光,明亮且可辨识度强。其他管内均未见绿色荧光,可视化观察的特异性实验结果与实时荧光结果一致,表明转基因玉米双抗12-5可视化荧光RPA检测方法特异性良好。图2
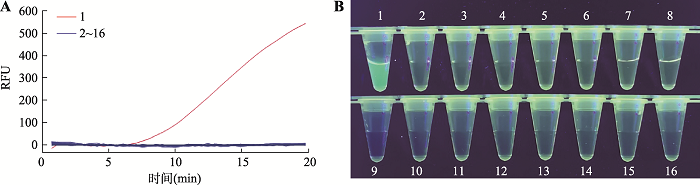 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2荧光RPA特异性检测
A:实时荧光RPA检测。RFU:相对荧光强度。B:可视化荧光RPA检测。1:转基因玉米双抗12-5;2~16:转基因玉米NK603、BT176、T25、BT11,转基因大豆A5547-127、356043、GTS40-3-2、FG72,转基因油菜MS1×RF1、MS2×RF2、MS8×RF3、OXY235,转基因棉花LLcotton25、MON15985、GHB119。
Fig. 2Specificity experiment of fluorescence RPA
2.3 灵敏度实验
灵敏度检测结果见图3。实时荧光RPA灵敏度实验结果见图3A,结果显示随模板拷贝数降低,扩增曲线的起峰时间逐渐推迟,达到的最终荧光强度随之减弱,模板为1280拷贝数时,5 min开始出现扩增,最终荧光信号达2000。模板为10拷贝数时,13 min开始出现扩增,虽然最终产生的荧光信号较弱,但可以与阴性对照区分开。荧光RPA灵敏度实验的可视化检测观察结果见图3B:1~4号管拷贝数依次为1280、640、320、160,管内样品荧光强度用肉眼观察相差无几;5~8号管拷贝数依次为80、40、20、10,可以观察到绿色荧光逐渐减弱;10拷贝数模板扩增结果,荧光最弱,但是肉眼观察其结果可以与阴性对照区分开,与实时荧光RPA检测结果一致,说明拷贝数为10时,荧光RPA检测技术可以准确检测得到结果。qPCR灵敏度实验结果见图3C,随拷贝数降低,扩增曲线起峰循环数逐渐增加,除1280拷贝数的模板外,最终达到荧光信号强度依次减弱,1280拷贝数的荧光信号强度与20拷贝数的荧光信号强度相差不多,可能是因为高浓度模板内的杂质或者盐离子对扩增产生影响。图3D为普通PCR的灵敏度实验,随着模板拷贝数降低,条带亮度逐渐减弱。图3
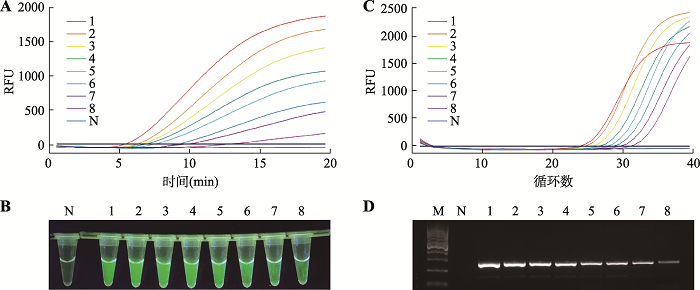 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3转基因作物灵敏度检测
A:实时荧光RPA;B:可视化荧光RPA;C:qPCR;D:普通PCR。M:Marker;N:阴性对照;1~8:分别是1280、640、320、160、80、40、20、10拷贝。RFU:相对荧光强度。
Fig. 3Sensitivity experiment for genetically modified crops
2.4 温度适应性及暖贴加热法可行性分析
暖贴激发RPA的实验结果见图4。在12个温度下进行荧光RPA扩增可视化观察,结果显示在34℃~46℃范围内均可观察到荧光,说明可用于可视化荧光RPA扩增实验的温度范围广,为34℃~46℃。温度为42℃时,荧光最亮,说明42℃为本可视化荧光RPA检测法的最适温度。暖贴自发热后50 min内对样品进行加热,对样品的温度进行测定(图4B)。结果可以看到0~18 min,样品温度从室温24℃逐渐升高到40℃。随后的18~50 min,样品温度保持40℃几乎不变。样品温度从第10 min达到35℃,开始满足荧光RPA扩增的温度条件,说明本研究尝试暖贴加热方式实现可视化荧光RPA现场检测的方法或许可行。另外建议提前10 min撕开暖贴包装用于加热样品,保证扩增顺利。测定样品温度方式见图4B。图4
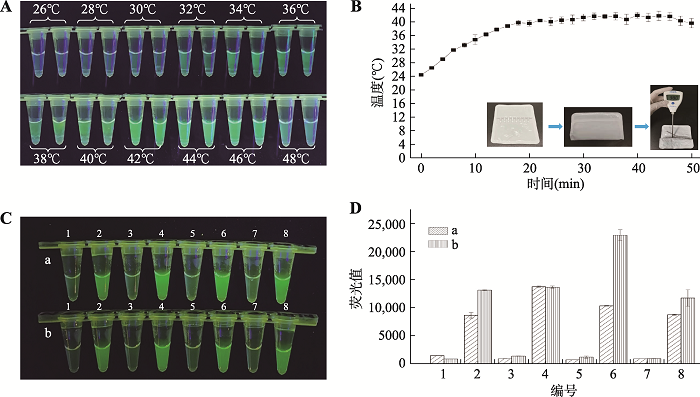 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4荧光RPA温度适应性及暖贴加热法可行性实验
A:可视化荧光RPA温度适应性结果。B:暖贴加热8连管50 min内管中样品温度变化情况。C:两种加热方法扩增荧光RPA产物可视化观察结果。a:加热块39℃加热20 min;b:暖贴加热20 min;1、3、5、7为阴性对照;2、4、6、8为转基因玉米12-5。D:两种加热方法扩增荧光RPA产物荧光值测定结果。
Fig. 4Temperature adaptability experiment of fluorescence RPA and feasibility experiment of heating method of warm paste
用暖贴加热法和加热块39℃加热法分别激发转基因玉米双抗12-5和非转基因玉米的荧光RPA,其可视化观察的结果见图4C。两种加热方式均使样品得到扩增,产生明显荧光,且荧光强度无明显差异,易与阴性结果区分。使用多标记微孔板系统测定暖贴加热法和加热块39℃加热的发应管中的荧光值的结果见图4D。可以发现除4号管两种加热方法得到荧光值结果基本相同以外,2、6、8号管由暖贴加热得到的荧光值明显高于加热块39℃加热得到的荧光值,这或许因为暖贴加热温度约为40℃,相较于加热块的39℃更接近最适温度42℃,进一步说明用暖贴替代传统加热块实现便携式的现场荧光RPA检测实验可行。
2.5 实际检测
用两片暖贴加热96孔板内样品进行荧光RPA扩增示意图见图5A,用两片暖贴分别附在96孔板上、下两面,简单方便。图5B为用所建立的荧光RPA体系实际检测96个样品可视化观察结果,共观察到24个样品有荧光产生,且荧光十分明显。qPCR法检测上述96个样品结果见图5C,共有24条扩增曲线产生。qPCR法检测结果与荧光RPA可视化检测结果相同,说明本研究建立的荧光RPA可视化检测准确。荧光RPA与qPCR检测结果和检测所用时间的比较见表2 (表中只显示转基因玉米双抗12-5样品的阳性结果比对),荧光RPA可视化检测所用时间均为20 min,qPCR的Ct值在26.82~29.76之间,忽略PCR仪器升降温时间,qPCR检测时间范围为58.64~64.54 min,耗时远高于荧光RPA。实际检测结果表明,所建立的可视化荧光RPA检测方法快速、准确、易分辨。
图5
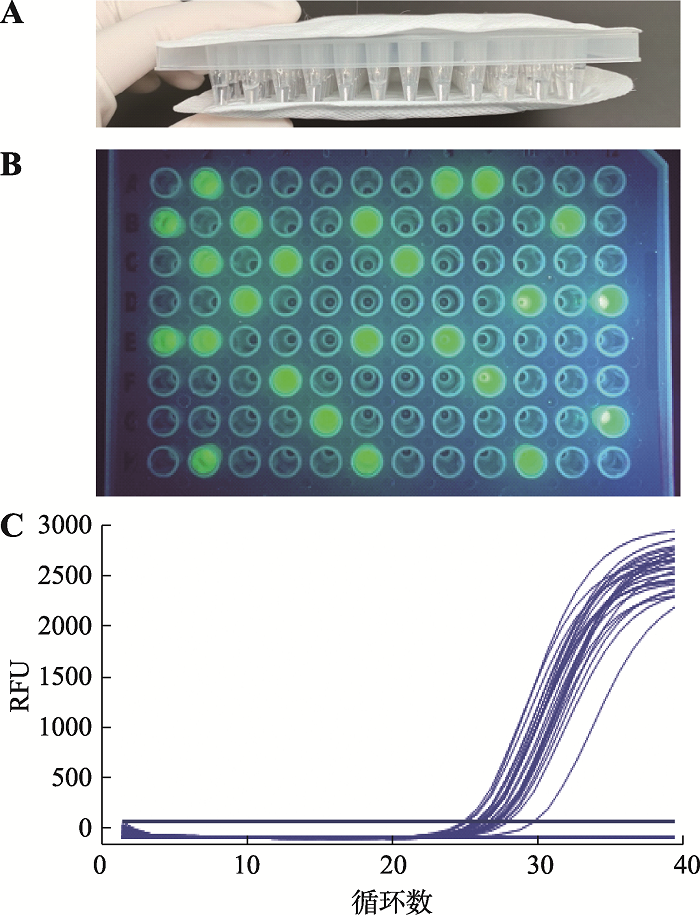 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5实际检测结果
A:暖贴加热96孔板方式;B:荧光RPA实际检测可视化观察结果;C:qPCR检测结果。RFU:相对荧光强度。
Fig. 5The actual detection results
3 讨论
近年来,RPA技术得到迅速的发展,与传统PCR相比,RPA技术无需昂贵的PCR仪,可以短时间内对靶片段进行快速扩增,具有简便、灵敏、快速等优点,适用于现场检测,目前已在病毒[15,16]、细菌[17]等临床检测中得到了广泛应用。Table 2
表2
表2荧光RPA和RT-PCR对实际样品的检测
Table 2
| 样品 | 检测结果 | 检测时间(min) | ||
|---|---|---|---|---|
| 荧光RPA | qPCR | 荧光RPA | qPCR | |
| 1 | + | + | 20 | 60.9 (Ct=27.95) |
| 2 | + | + | 20 | 60.1 (Ct=27.55) |
| 3 | + | + | 20 | 64.52 (Ct=29.76) |
| 4 | + | + | 20 | 60.48 (Ct=27.74) |
| 5 | + | + | 20 | 60.94 (Ct=27.97) |
| 6 | + | + | 20 | 63.18 (Ct=29.09) |
| 7 | + | + | 20 | 62.84 (Ct=28.92) |
| 8 | + | + | 20 | 63.64 (Ct=29.32) |
| 9 | + | + | 20 | 60.62 (Ct=27.81) |
| 10 | + | + | 20 | 60.58 (Ct=27.79) |
| 11 | + | + | 20 | 62.48 (Ct=28.74) |
| 12 | + | + | 20 | 62.66 (Ct=28.83) |
| 13 | + | + | 20 | 62.92 (Ct=28.96) |
| 14 | + | + | 20 | 59.8 (Ct=27.40) |
| 15 | + | + | 20 | 59.86 (Ct=27.43) |
| 16 | + | + | 20 | 62.9 (Ct=28.95) |
| 17 | + | + | 20 | 63.92 (Ct=29.46) |
| 18 | + | + | 20 | 62.36 (Ct=28.68) |
| 19 | + | + | 20 | 58.94 (Ct=26.97) |
| 20 | + | + | 20 | 58.64 (Ct=26.82) |
| 21 | + | + | 20 | 60.98 (Ct=27.99) |
| 22 | + | + | 20 | 61.02 (Ct=28.01) |
| 23 | + | + | 20 | 61.6 (Ct=28.30) |
| 24 | + | + | 20 | 61.84 (Ct=28.42) |
| 其他 | - | - | / | / |
新窗口打开|下载CSV
引物是影响扩增效率的关键因素,引物过长可能容易产生引物二聚体或发夹结构,而过短会降低重组率和检测灵敏度。RPA引物一般在30~35 bp[13],目前没有专门针对RPA的引物设计软件,为了获得更加高效的引物组合,本研究根据RPA引物设计原理,设计上、下游引物各8条,先用任意一条上游引物与所有下游引物组合结合探针,对样品进行扩增,观察结果筛选出扩增效率最高的下游引物,再用筛选出的下游引物与所有上游引物组合结合探针,对样品进行扩增,观察筛选出扩增效率最高的上游引物。采取这种方法,仅两次就可以筛选出其中扩增效率最高的引物对。
目前根据RPA建立的现场检测方法多是基于RPA与侧向流动免疫技术结合或与荧光检测技术结合的检测方法。其中RPA与侧向流动免疫技术结合的检测方法操作简便、肉眼可观察结果、无需特殊检测设备,但检测时需要开盖,存在气溶胶污染的风险,且相应标记抗体试纸条的制备,也增加了检测成本。基于RPA与荧光检测技术结合的检测方法,多为实时荧光RPA,近年来许多商用便携式实时荧光RPA检测设备问世,为实时荧光RPA现场检测技术的推广提供了设备支持,但同时也增加了检测的成本投入。本研究通过RPA在不同温度下的扩增反应,发现RPA的荧光可视化检测具有很宽的温度适应性(34℃~46℃)。据此,本研究利用市场上很普通的暖贴作为热源替代仪器加热,暖贴成本可忽略不计,而且其便于保存,方便携带。在检测结果判别方面,检测人员利用小型手持蓝光灯,佩戴护目镜即可完成现场的可视化检测。目前,蛋白质试纸条是转基因成分现场检测最常用的方法,蛋白质试纸条市场价格大概在10~20元/条,而RPA目前一个反应的费用大概在15~30元。但随着RPA技术的推广和应用,其检测费用会得到进一步的减少。
(责任编委: 宋任涛)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1371/journal.pbio.0040204URL [本文引用: 1]
DOI:10.16250/j.32.1374.2020071PMID:32935505 [本文引用: 1]

To establish a nucleic acid assay for detection of based on recombinase-aided isothermal amplification (RAA) assay.The gene of was selected as the target gene, and the specific primers and fluorescent probes for RAA assay were designed, screened and synthesized to establish a fluorescent RAA assay for detection of. The sensitivity of the fluorescent RAA assay was evaluated using different copy numbers of target gene sequence-contained recombinant plasmids and various concentrations of genomic DNA as templates, and the specificity of the fluorescent RAA assay was evaluated using the genomic DNA from,,,,,,, and as templates.A fluorescent RAA assay was successfully established for detection of, which achieved specific amplification of genomic DNA within 20 min at 39 ℃. The lowest detection limit of the fluorescent RAA assay was 10 copies/μL of recombinant plasmids and 0.1 ng/μL genomic DNA, which exhibited a high sensitivity, and the fluorescent RAA assay was all negative for the genomic DNA from,,,,,, and, which exhibited a high specificity. In addition, this fluorescent RAA assay successfully detected genomic DNA from cysts.A rapid, sensitive and specific fluorescent RAA assay is successfully established for nucleic acid detection of.
DOI:10.16250/j.32.1374.2020071PMID:32935505 [本文引用: 1]

To establish a nucleic acid assay for detection of based on recombinase-aided isothermal amplification (RAA) assay.The gene of was selected as the target gene, and the specific primers and fluorescent probes for RAA assay were designed, screened and synthesized to establish a fluorescent RAA assay for detection of. The sensitivity of the fluorescent RAA assay was evaluated using different copy numbers of target gene sequence-contained recombinant plasmids and various concentrations of genomic DNA as templates, and the specificity of the fluorescent RAA assay was evaluated using the genomic DNA from,,,,,,, and as templates.A fluorescent RAA assay was successfully established for detection of, which achieved specific amplification of genomic DNA within 20 min at 39 ℃. The lowest detection limit of the fluorescent RAA assay was 10 copies/μL of recombinant plasmids and 0.1 ng/μL genomic DNA, which exhibited a high sensitivity, and the fluorescent RAA assay was all negative for the genomic DNA from,,,,,, and, which exhibited a high specificity. In addition, this fluorescent RAA assay successfully detected genomic DNA from cysts.A rapid, sensitive and specific fluorescent RAA assay is successfully established for nucleic acid detection of.
DOI:10.1016/j.trac.2017.10.015URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
