 ,1,3
,1,3Advances in precise regulation of CRISPR/Cas9 gene editing technology
Junxia Cao1, Youliang Wang2, Zhengxu Wang ,1,3
,1,3通讯作者: 王征旭,博士,副主任医师,硕士生导师,研究方向:生物治疗。E-mail:zhxuwang@qq.com
编委: 谷峰
收稿日期:2020-03-13修回日期:2020-11-2网络出版日期:2020-12-20
| 基金资助: |
Received:2020-03-13Revised:2020-11-2Online:2020-12-20
| Fund supported: |
作者简介 About authors
曹俊霞,博士,助理研究员,研究方向:生物治疗。E-mail:

摘要
基因编辑(gene editing)是一种能对细胞和生物体基因组一小段DNA进行定点修饰或者删除、插入的基因工程技术。基因编辑技术在疾病治疗、基因功能调控、基因检测、药物研发和作物育种等方面具有广阔的应用前景,但在应用中也逐渐显现出脱靶、基因毒性等副作用问题。CRISPR (clustered regularly interspaced short palindromic repeats)系统中核酸酶Cas9蛋白能通过与gRNA (guide RNA)结合特异性识别靶DNA并进行酶切反应,由于Cas9蛋白和gRNA在其自身活性、识别位点及结合能力等方面具有不同的特性,因此在应用中可以通过对Cas9蛋白酶的活性以及与靶DNA在时间和空间上的结合进行精准调控,主要调控方法包括使用光、温度和药物等调节Cas9融合蛋白、抗CRISPR蛋白、核酸类和小分子类化合物抑制剂的使用等,从而能有效地防范基因编辑技术的风险和增强精准调控基因编辑技术的实际应用性。本文就目前如何精准调控基因编辑技术,尤其是精准调控CRISPR/Cas9基因编辑技术的方法进行了综述,以期为人类疾病治疗、作物育种、家畜遗传改良和防范生物技术缪用等提供借鉴和研究思路。
关键词:
Abstract
Gene editing is a genetic engineering technology that can modify, delete, or insert a small piece of DNA at a specific point in the genome of cells and organisms. Gene editing technology holds great promises in the fields of disease treatment, gene function regulation, gene detection, drug research and development, and crop breeding. However, side effects, such as off-target editing, genotoxicity and other issues, have gradually emerged in the application. In the CRISPR (clustered regularly interspaced short palindromic repeats) system, the Cas9 nuclease can specifically recognize the target DNA by the base pairing of a guide RNA (gRNA) with the target DNA. Upon target recognition, the two DNA strands are cleaved by distinct domains of the Cas9 nuclease. Since both Cas9 nuclease and gRNA possess different characteristics in their own activities, recognition sites and binding ability to specific target, it is essential to precisely regulate the activity of Cas9 nuclease and gRNA in both time and space manners, thus preventing the risk of side effects and enhancing the precise regulation of the CRISPR/Cas9 gene editing technology. In this review, we summarize the advances in the precise control of gene editing, especially CRISPR/cas9 over several dimensions using fusion Cas9 proteins regulated by light, temperature and drugs, exploiting and screening anti-CRISPRs proteins, synthesizing and identifying small molecules- inhibitors, and developing other therapeutic agents, thereby providing a reference and research ideas for human disease treatment, crop and livestock improvement and prevention of biotechnology misuse.
Keywords:
PDF (586KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
曹俊霞, 王友亮, 王征旭. 精准调控CRISPR/Cas9基因编辑技术研究进展. 遗传[J], 2020, 42(12): 1168-1177 doi:10.16288/j.yczz.20-069
Junxia Cao.
Science每年年底评选年度世界十大科学进展,其中基因编辑技术分别于2012、2013和2015年3次登上Science年度十大科学突破,对此Science编辑部表示“前所未有”[1,2]。2019年12月,Nature列出近10年最具影响力的5个重大科学事件,其中CRISPR基因编辑技术入选,可见基因编辑技术对人类生活的巨大影响力[3]。2020年10月7日,诺贝尔化学奖授予法国生物化学家埃玛纽埃尔·沙尔庞捷(Emmanuelle Charpentier)和美国生物化学家珍妮弗·道德纳(Jennifer Doudna),以表彰她们对新一代基因编辑技术CRISPR的贡献。尽管如此,基因编辑技术目前在应用中还存在脱靶、基因毒性等副作用,Cas9蛋白具有潜在致癌性[4],以及基因编辑技术缪用等问题[5,6],因此需要对基因编辑技术进行精准调控,减少潜在的治疗风险。目前已经发现自然界中存在一些基因编辑抑制蛋白[7],能够抑制Cas9蛋白酶的活性;另外,也可以通过人工合成的方法,通过融合蛋白、小分子等调控Cas9酶的活性;此外还有光、核酸小分子抑制剂等。本文就目前如何精准调控基因编辑技术,尤其是精准调控CRISPR/ Cas9基因编辑技术的方法[8]进行回顾及分析,以期对基因编辑技术的防控策略提供借鉴和参考。
1 基因编辑技术及应用
基因编辑技术主要包括3种:锌指核酸内切酶(zinc finger endonuclease, ZFN)技术,类转录激活因子样效应物核酸酶(transcription activator-like effectornucleases, TALEN)技术,RNA引导的CRISPR/Cas核酸酶技术(clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins, CRISPR/ Cas)[9,10]。因ZFN和TALEN技术存在脱靶效应或组装复杂性等缺陷,限制了这类技术在基因编辑领域中的广泛应用[9]。近年来,以CRISPR/Cas9系统为代表的基因编辑技术迅速发展,并已经在生命科学诸多领域中得到广泛应用[11]。基因编辑技术在疾病治疗、基因功能调控、基因检测、药物研发和作物育种等方面有着广阔的应用前景[11,12,13],目前已经应用到多种人类疾病治疗的临床试验中,如HIV治疗[14]、遗传性疾病治疗[15]、肿瘤免疫治疗[16]等。Xu等[14]通过CRISPR/Cas9基因编辑技术,使CD34+造血干细胞表面HIV-1病毒进入细胞的辅助受体CCR5基因功能性失活,进而阻止HIV病毒进入细胞内。用经基因改造的造血干细胞移植治疗HIV感染的急性淋巴细胞白血病患者,可见CCR5功能缺失的造血干细胞在患者体内形成嵌合体,能存活19个月以上,患者白血病症状得到缓解,未见明显治疗相关的并发症。Wu等[15]使用CRISPR/Cas9基因编辑技术改造造血干细胞,使BCL11A基因幼红细胞增强子核蛋白结合位点突变,进而减少BCL11A蛋白的表达和诱导胎儿γ球蛋白的表达。该研究表明经基因改造的镰状细胞贫血和β地中海贫血患者的造血干细胞能表达内源性治疗水平的胎儿血红蛋白(fetal hemoglobin,HbF),提示基因编辑造血干细胞具有临床治疗镰状细胞贫血和β地中海贫血的潜在应用前景。Qasim等[16]使用TALEN技术功能性敲除靶向CD19嵌合抗原受体(chimeric antigen receptor, CAR)基因修饰T细胞(CAR-T)的PD-1和T细胞受体(T cell receptor, TCR)基因,使用这些经基因改造异体来源的通用型CAR-T细胞治疗急性淋巴细胞白血病(acute lymphoblastic leukaemia, ALL),结果显示患儿体内的白血病肿瘤细胞消退,提示该异体来源的通用型CAR-T细胞可用于临床治疗ALL。基因编辑技术在应用中也存在一些急需解决的问题[5,17],如脱靶效应[18]、染色体易位、基因毒性等,同时存在生物技术缪用的风险[5],甚至可能被恐怖分子所利用,用于制备新型生物战剂[19,20]。CRISPR/Cas9系统作为目前最主要的基因编辑技术被广泛应用到生物、医疗等领域,本文重点介绍了CRISPR/Cas9基因编辑技术,针对精准调控CRISPR/ Cas9技术进展进行了总结。鉴于基因编辑技术在应用中尚存在的一些缺陷,有必要在CRISPR/Cas9基因编辑技术的应用中,通过对Cas9酶活性的剂量、发挥作用的时间等进行精确控制[21],减少脱靶效应[6,22]等毒副作用,甚至用于阻止生物技术缪用等问题。另外,也可以通过天然和人工合成的多种蛋白、小分子化合物等Cas9蛋白抑制剂,进行基因编辑的精准调控(图1)。精准调控基因编辑技术具有重要的生物学意义:(1)在生殖系统基因编辑时,将Cas9酶活性限制在一个非常窄的时空窗口非常重要,可以降低分裂细胞中嵌合体的产生;(2)通过抑制Cas9蛋白的活性来暂时开关某些基因的驱动功能,将在林业、畜牧业等领域发挥重要作用;(3)小分子抑制剂可以以器官特异性的方式给予,以抑制组织中的脱靶效应;(4) Cas9抑制剂有助于从生物安全的角度考虑阻止基因编辑技术的双重用途问题;(5) Cas9抑制剂将促进对内源性Cas9抑制蛋白生物学功能的理解,为精确的抗感染治疗奠定基础[6,21,23~27]。
图1
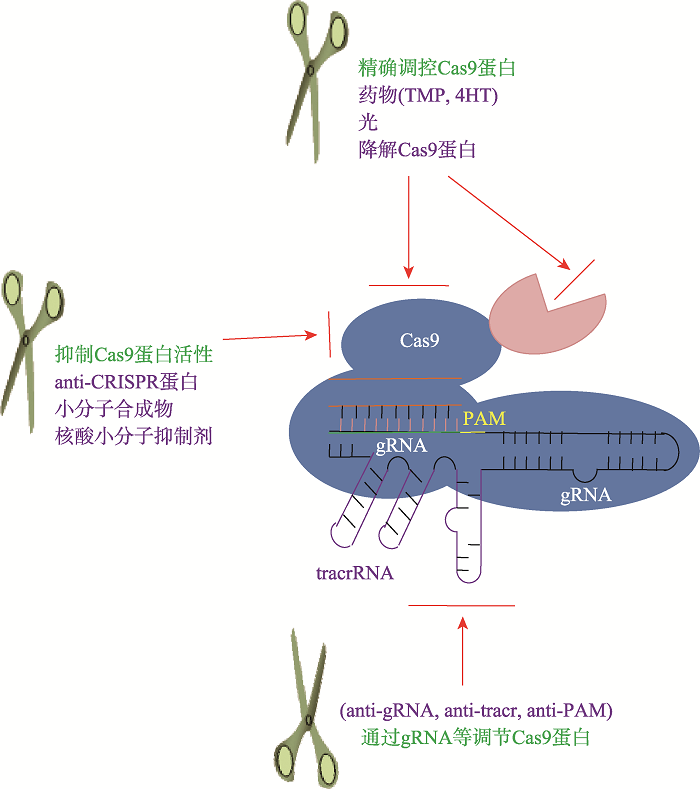 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1精准调控CRISPR/Cas9策略
tracrRNA: transactivating CRISPR RNA (转录激活crRNA);PAM: protospacer adjacent motif (前间区序列邻近基序);gRNA: guide RNA (向导RNA)。
Fig. 1Strategy of precise control of CRISPR/Cas9 gene editing
2 CRISPR/Cas9基因编辑调控技术
2.1 精准调控Cas9蛋白活性
Cas9酶活性大小能导致毒性的产生,伴随着Cas9酶活性的升高可以观察到明显的脱靶效应、染色体易位和基因毒性等。由于脱靶效应的发生率通常低于靶效应,因此人们希望将核酸酶活性限制在一个狭窄的时间窗内。同时,为了逃避宿主对这种来源于细菌Cas9蛋白的免疫监视,在编辑目标基因时也需要能快速地降解Cas9蛋白。调控Cas9通常有两种方法:通过人工改造的Cas9蛋白的方法,如通过融合小分子药物、光等结合元件,可以条件性激活Cas9蛋白;或者通过抑制或降解Cas9蛋白,运用小分子调控翻译后Cas9蛋白的功能等[6,21,23~27],能够在剂量、时间和空间上精确调控Cas9蛋白的功能。2.1.1 药物调控Cas9蛋白活性
科研人员已开发出多种化学诱导的小分子开关系统来调控Cas9蛋白的活性[21,28]。Davis等[28]在Cas9 特定位点插入4-羟基他莫昔芬(4-hydroxytamoxifen, 4-HT)内含肽,在4-HT存在的情况下可以调控Cas9酶的活性,且Cas9酶的活性依赖4-HT的剂量。尽管这种经人工改造的Cas9酶的活性比野生型Cas9酶低,但是能明显提高靶基因的编辑效率。通过使用雌激素受体结合结构域(hormone-binding domain of the estrogen receptor, ERT2)融合Cas9开发的小分子诱导的CRISPR/Cas9系统(iCas9)[28],4-HT能够有效地在时间和空间上调控Cas9酶的活性。在4-HT缺乏的情况下,ERT2将Cas9蛋白固定在细胞质中,一旦加入4-HT,融合蛋白能快速地转移到细胞核内,4 h后就能观察到iCas9的酶切活性,且具备较高的DNA酶切效率。同时,iCas9系统的活性状态是可逆的,Cas9酶的活性可以在移除4-HT 72 h内被逆转,但是人工改造的iCas9系统仅保留了野生型Cas9酶活性的60%。
2017年,Maji等[29]利用小分子调节的蛋白降解子实现了对不同Cas9系统进行多维调控。通过在小分子不稳定区域融合二氢叶酸还原酶(dihydrofolate reductase, DHFR)、雌激素受体(estrogen receptor, ER),分别加入甲氧苄啶(trimethoprim, TMP)、4-HT后,能在剂量、时间、基因目标和特异性等方面多维度调控Cas9酶的活性,实现了对全基因组的调控,极大地改善了基因编辑的酶切效率。这类小分子具有价廉、无毒等特征,能比较容易地在其他细胞和复杂的有机体中使用[29]。
通过植物激素相关蛋白质降解信号途径,制备融合蛋白来调控Cas9蛋白的表达。例如:脱落酸(abscisic acid, ABA)信号级联反应通路ABI蛋白和ABA受体蛋白PYL1信号通路、以及赤霉素(gibberellin, GA)受体GID1 (gibberellin insensitive Dwarf 1)通路、GID1底物DELLA蛋白家族成员之一的GAI蛋白通路,分别通过ABA、GA诱导的ABI-PYL1、GID1-GAI结构域异二聚体化[21,30],也能产生小分子药物的剂量依赖效应,进而调控Cas9蛋白的转录激活和抑制。失活Cas9蛋白的两个位点D10AH和H840A,能导致Cas9蛋白不具有核酸酶活性,成为dCas9 (dead Cas9)。2016年,Gao等[30]在哺乳动物细胞中采用ABA和GA可以实现对Cas9的转录调控。分别将异二聚体结构域克隆到表达载体PiggyBac中,分别与dCas9和3种激活因子(VP64-p65-Rta, VPR)融合,这些异二聚体结构域包括 ABI-PYL1、GID1-GAI、FKBP-FRB、PHYB-PIF、CRY2PHR- CIBN和FKF1-GI六种,在HEK293T细胞中经过ABA和GA诱导,筛选获得了化学诱导的dCas9系统,该调控具有剂量依赖效应和逆转录激活、转录抑制等功能[30]。
根据雷帕霉素(Rapamycin)能够调节哺乳动物靶点(mTOR) FK506结合蛋白12 (FK506-binding protein, FKBP),以及FKBP雷帕霉素结合域(FRB)二聚化的特性,设计在缺乏雷帕霉素时能够使Cas9产生较低水平酶活性的基因编辑系统,当加入雷帕霉素时其活性可以被逆转激活,并且该系统没有明显的脱靶现象[31]。2020年,Chiarella等[32]使用化学表观遗传修饰剂(chemical epigenetic modifiers, CEMs),通过招募内源染色体激活的特异组分,调节靶基因的表达。在复合物中用FKBP催化dCas9,CEMs可以提高靶基因表达20倍以上,同时提示CEM具有转录激活的剂量依赖性特性,可以作用于多种靶基因,具有可逆转的特性,并且具有基因修饰的特异性[32]。2018年,Shrimp等[33]使用dCas9-p300 (包含KAT结构域)融合蛋白作为赖氨酸乙酰转移酶(lysine acetyltransferases,KATs)活性报告分子,筛选可以调控KAT基因表达的小分子,发现3个具有明显作用的抑制分子KATi、CBP30和JQ1,能够影响CRISPR/Cas9乙酰转移酶的活性。2017年,Rose等[21,34]通过BCL-xL和BH3肽段之间的相互作用,破坏蛋白结构域的二聚化,制备出一种快速诱导的Cas9 (inducible Cas9, ciCas9)系统。Cas9结构域REC2 (recognition lobe, 螺旋状的识别瓣叶)被BCL-xL所替代而产生Cas9·BCL,并且BH3肽段被粘附到Cas9·BCL的N-端和C-端。BCL-xL和BH3肽段之间的分子内相互作用使Cas9保持在一个非激活状态,当加入BCL-xL的小分子抑制剂(A-385358, A3)时,因破坏了BH3和BCL-xL之间的相互作用,因此Cas9酶被激活。这种ciCas9系统显示出比4-HT诱导的intein-Cas9和iCas9系统更好的剂量依赖的核酸酶活性。ciCas9系统还显示了比较低的脱靶效应,但蛋白酶活性仍比野生型Cas9低。2019年,Kang等[35]通过Tet-on系统来调控Cas9蛋白,使用优化的Tet-on载体构建可诱导Cas9系统,当加入不同剂量的Dox时,能调控Cas9蛋白的表达水平。
2.1.2 光调控Cas9蛋白活性
近年来,光作为调控蛋白活性的研究已取得较大的进展,能够提供时空调控和非侵入性调控,因此具有明显的调控优势。目前已有几种使用光调控Cas9的表达系统调控Cas9蛋白的活性。Nihongaki等[36]发明了一种光调控CRISPR/Cas9系统,该系 统依赖于拟南芥(Arabidopsis thaliana)隐花色素2 (cryptochrome 2, CRY2)和其结合蛋白钙整合素结合蛋白1 (calcium and integrin binding protein, CIB1),在蓝光的照射下可以异二聚化。通过将dCas9与CIB1融合,CRY2结构域与转录激活结构域(VP64或p65)融合,结果显示可以用光进行时空调控和多重调控内源基因的表达,蓝光照射1 h既可检测到报告基因的表达。Nihongaki等[36]也设计了一种光激活分离Cas9 (photo-activatable split Cas9, paCas9)策略。Cas9 蛋白的N端和C端分别融合光应答结构域阳性磁铁(positive magnet, pMag)和阴性磁铁(negative magnet, nMag),当蓝光照射时,pMag和nMag二聚化,从而诱导更高活性的Cas9。光调控Cas9系统,也可以通过基因gRNA调控Cas9蛋白的活性来实现[37]。Jain等[38]研究显示,使用光降解保护寡核苷酸与gRNA杂交以阻止gRNA: DNA的结合,在光照的条件下能保护寡核苷酸降解产生短片段,从而降低与gRNA的亲和力。因此,光可以通过gRNA调控Cas9蛋白的活性,但是这种调控方式是不可逆的。
2.1.3 gRNA调控Cas9蛋白活性
CRISPR/Cas9系统也可以通过gRNA调控Cas9酶的活性,如通过将适体(aptamers)和适体酶(aptazymes)融合到gRNA上进行配体依赖的控制。适体酶是一种人工合成的寡核苷酸,既具有适体与靶物质结合的高特异性和高亲和力,又有核酸或脱氧核酶的催化活性,适体酶与目标配体结合从而发生结构改变,激活相关核酸酶结构域,启动RNA 剪切活性。2017年,美国哈佛大学Tang等[39]将aptazymes融合到gRNAs中开发了一套适体酶嵌入的agRNAs (aptazyme-embedded guide RNAs)系统,通过在体外和体内筛选和优化不同的gRNA,设计出氨茶碱调控的agRNAs系统,调控Cas9蛋白的活性。2018年,美国芝加哥大学Pu等[40]开发出一种依赖于RNA聚合酶(RNA polymerase, RNAP)的生物感应器来调控gRNA。研究显示RNAP生物感应器可以检测到相关蛋白的相互作用,激发相关基因的敲除,能多维度对Cas9蛋白进行调控。
2.1.4 降解Cas9蛋白
进行基因编辑时,及时降解Cas9蛋白可能比完全抑制其活性更有效、更便捷。科研人员已经开发出一些小分子进行转录后蛋白水平的调控。将Cas9蛋白融合到一个或多个降解结构域中,并在加入相应的小分子或光后Cas9蛋白被降解。Cas9的小分子抑制剂也可以转换成含有泛素连接酶的降解剂,这些小分子降解剂与Cas9抑制剂相比具有催化作用,并且分子量相对较小[41]。其他的策略包括将一个降解因子融合到目标蛋白中,在加入小分子或暴露在光等条件时就会引起蛋白降解。如细胞蛋白快速降解及可逆调控技术(Degron技术),通过在Cas9蛋白中融合条件性蛋白降解子(degrons),degrons可以通过小分子配体、光、温度等变化,使Cas9蛋白激活或者失活[42]。2018年,美国丹娜法伯癌症研究院Nabet等[43]报道了一种降解剂dTAG系统(the degradation tag, dTAG),该系统能对特异性靶蛋白进行降解。研究人员将靶蛋白与降解剂FKBP12F36V (FK506- and rapamycin-binding protein)突变体融合在一起表达,FKBP12F36V可以招募CRBN (Cereblon)配体进一步形成E3泛素化连接酶复合体,其中CRBN配体可以与化学小分子dTAG-7、dTAG-13、dTAG-48和dTAG-51等识别,筛选可以使靶蛋白降解的小分子。利用类似的策略可以降解Cas9蛋白,其中包括生长素诱导的降解系统、配体诱导(ligand-induced degradation, LID)结构域、B-LID结构域和小分子辅助关闭(small molecule-assisted shutoff, SMASh)系统[44,45]。LID结构域通过在FKBP12的C端融合19个氨基酸degron,化学小分子Shield-1用来调控蛋白降解。在鸟氨酸脱羧酶(ornithine decarboxylase, ODC)和抗酶(antizyme, AZ)中鉴定出另一个泛素非依赖的蛋白酶降解技术,目的蛋白与ODC融合后可以以一种泛素非依赖形式,在共表达抗酶存在的情况下被降解[46]。
2017年,中国科学院遗传与发育生物学研究所李晓江团队在猴子(Cynomolgus monkey)胚胎中通过泛素破坏降解(split ubiquitin for the rescue of function, SURF),调控Cas9蛋白的半衰期,从而减少嵌合体的突变。该研究将泛素化蛋白酶降解信号(Ubiquitin- RGKEQKLISEEDL-CAS9, UPS)连接到Cas9的N端(Ubi-Cas),在猴子胚胎中该降解信号不影响Cas9酶切割DNA的效率,缩短Cas9半衰期确实可以降低胚胎嵌合体突变的形成[47]。2019年,美国斯坦福大学Charlesworth等[48]发表的一项研究显示,在人体内发现存在Cas9的抗体,Cas9的特异性免疫应答在应用Cas9进行人体治疗时,可能会成为一个主要的治疗障碍,通过降低Cas9的半衰期可以减轻免疫应答反应。Cas9降解分子也对降低Cas9基因编辑所导致的基因毒性反应有益。异源双功能分子(heterobifunctional molecules)也称之为降解剂(degraders),可以使靶蛋白和特异性泛素连接酶共定位,从而参与蛋白酶体降解途径。
2.2 抑制Cas9蛋白活性
2.2.1 抗CRISPR蛋白随着CRISPR天然遗传编码拮抗剂(抗CRISPR蛋白)不断被发现,人们对选择这些蛋白质来实现对Cas9蛋白的抑制产生了极大的兴趣。目前,已在细菌噬菌体基因组中发现可以结合和抑制CRISPR- Cas9活性的多种抗CRISPR蛋白,这类蛋白质大多在200 aa左右,能允许噬菌体在细菌内繁殖和逃避细菌的免疫监视[21]。2019年,南昌大学刘琼等[49]对目前已经发现的40多种抗CRISPR蛋白(anti-CRISPRs, Acr)进行总结分析,将其分为I型(I-E、I-F、I-D、I-C)、II型(AcrIIA1-10、AcrIIC1-5)、III型(III-B)和V型(AcrVA1、AcrVA4、AcrVA5)。早在2013年人们已发现5种Acr蛋白(AcrIF1-5),随后又发现4种AcrIE1-4蛋白,这些都属于I型抗CRISPR蛋白。I-E型和I-F型Acr基因在5′端存在一个保守的启动子序列,在3′端存在一个保守基因,但是抗CRISPR蛋白之间几乎无序列同源性。抗CRISPR蛋白可以以多种方式干扰CRISPR/Cas系统,例如通过结合到gRNA负载的CRISPR/-Cas复合物并且阻止与DNA的结合;结合到Cas效应蛋白阻止它们招募到活性级联复合物(active cascade complexes)(I型系统);直接抑制Cas9蛋白核酸酶的活性,等等。虽然抗CRISPR蛋白之间几乎没有同源性,但通常在抗CRISPR位点(称之为anti-CRISPR associated protein, ACA)中存在HTH(helix-turn-helix)调节结构域,因此可以通过关联分析推断新的ACA同源蛋白。鉴于抗CRISPR蛋白对于噬菌体抵抗细菌防御的重要作用,可以通过生物信息学策略来发现其余未知的抗CRISPR蛋白,包括靶向RNA的VI CRISPR核酸酶Cas13[6,21,23~27]。抗CRISPR蛋白提供了一种天然的策略来减轻CRISPR基因编辑所引起的脱靶效应和基因毒性等问题,另外一些抗CRISPR蛋白也可能起到抑制某些转录因子活性的作用。但哺乳动物细胞中的抗CRISPR蛋白的特异性还需要进一步地评价和研究[6,21,23~27]。随着越来越多的抗CRISPR蛋白被发现,科研人员已建立一个不断更新的数据库,该数据库包含抗CRISPR蛋白名称、蛋白亚型、参考文献和氨基酸序列等信息[50]。2019年,中国科学院生物物理研究所高璞团队[51]研究结果显示,抗CRISPR蛋白AcrIIC2和AcrIIC3能通过多种机制抑制CRISPR/Cas9的活性,AcrIIC2二聚体与Cas9蛋白相互作用可以干扰其与RNA的结合,并且阻止DNA组装到Cas9蛋白质内。AcrIIC3能结合到Cas9蛋白HNH结构域的一个非保守区,也可以与Cas9的REC叶形成相互作用,并导致AcrIIC3-Cas9复合物的二聚化,也能特异性地抑制NmeCas9的活性。2019年,美国加利福尼亚大学Jiang等[52]报道了温度可以调节抗CRISPR蛋白的活性。该研究表明在室温22℃和人体温度37℃条件下,AcrIIA2和其同源物AcrIIA2b,由于其蛋白结构和蛋白相互结合环境的变化,导致其在不同温度下显示出不同的抗CRISPR蛋白活性,可以通过条件变化来调节抗CRISPR蛋白的活性。
2.2.2 小分子化合物抑制剂
Cas9小分子化合物抑制剂可以通过被动扩散较容易地进入细胞内,对蛋白酶稳定,没有免疫原性,可以批量生产制备成为性质均一稳定的化合物,具有剂量依赖和时空调控等特性,能够克服上述抗CRISPR蛋白可能存在的一些问题,因此具有更加广阔的开发和应用前景。但是,由于目前此类小分子化合物筛选方法等条件限制,开发出具有抑制Cas9酶活性的小分子化合物还十分困难,原因包括:(1) Cas9具有新的蛋白质折叠结构,限制了目前已知的设计方法的应用;(2) Cas9小分子抑制剂的鉴定需要多种敏感、特异性、高通量的分析方法,这些筛选方法目前尚不成熟和稳定;(3) Cas9是一种单一的转换酶,它以皮摩尔(picomolar)亲和力固定在底物上,使高通量分析变得更加复杂;(4)抑制Cas9酶的活性需要两种核酸酶结构域同时失活;(5) Cas9属于DNA结合蛋白类,通常认为在化学上难以被处理。2019年,美国哈佛大学Maji等[22]通过高通量筛选平台获得一个能抑制化脓性链球菌Cas9 (SpCas9)活性的小分子化合物,其分子量小于500 Da,具有细胞可渗透性、可逆性结合和性质稳定等特性。研究人员使用两种方法对CRISPR/Cas9的活性进行高通量筛选:第一种方法首先监测SpCas9蛋白能否与荧光标记DNA相互结合;第二种方法是通过评估荧光强度发生的变化,来说明SpCas9完成了对DNA的剪切作用。若某种小分子能干扰SpCas9与DNA的结合或对目标DNA的剪切,则说明这种小分子对CRISPR/Cas9系统产生了有效的抑制作用。研究人员通过筛选大约1.5万种化合物,成功地筛选出两种对SpCas9有抑制活性的化合物,并确定了一个具有SpCas9抑制作用的药效团结构。根据药效团结构人工合成的小分子化合物,也具有与天然化合物类似的功能[22]。
2.2.3 核酸小分子抑制剂
2019年,美国南伊利诺伊大学Barkau等[53]报道了他们设计的SpCas9核酸小分子抑制剂(small nucleic acid-based inhibitors, SNuBs)。根据CRISPR/ Cas9的作用机理,设计特异性2-O-甲基修饰的寡核苷酸,通过寡核苷酸特异性结合到CRISPR的RNA引导序列(anti-guide)、重复序列(anti-tracr)或者spCas9间隔基序(PAM) (anti-PAM),抑制Cas9的生物学活性。该研究显示,当使用核酸小分子同时结合到anti-PAM和anti-tracr分子时,具有更好的协同抑制作用,能够以较高的亲和力、有效地抑制Cas9酶对靶DNA的切割活性。在anti-tracr分子中掺入2′F-RNA和锁定特异性核苷酸,会产生更大的抑制活性,并且能够在人类细胞中以剂量依赖的方式抑制基因编辑效率。抗CRISPR核酸代表了一类新的CRISPR/Cas9抑制剂,有助于CRISPR依赖的基因编辑技术的安全应用。美国加利福尼亚大学Dowdy[54]对该项研究给予高度评价,将其与RNA治疗中的siRNA相比较,认为反义寡核苷酸可以结合和抑制CRISPR-Cas9 sgRNA,是一种提高基因编辑安全性使用的有效方法,也是使Cas9蛋白失活最为简单的方法,具有较好的应用前景[54]。
2.2.4 组织特异性microRNA
为了使CRISPR/Cas9能在靶器官中发挥其基因编辑活性,在非靶组织和细胞中不能编辑目的基因,科研人员尝试使用特异性启动子、具有靶器官特异性血清型的腺相关病毒载体(adenovirus associated virus, AAV)进行组织和细胞的靶向性基因编辑。但是目前已知的细胞特异性启动子还十分有限,不同血清型的AAV的器官特异性也不强,因此不能解决基因编辑技术在靶细胞和靶器官中发挥其基因编辑活性的问题。2019年,美国马萨诸塞大学研究人员通过组织特异性microRNA(miRNA)的方法来尝试解决组织特异性问题[55]。该研究构建了重组AAV载体,含引导RNA、Cas9酶和Cas9酶抑制蛋白(anti- CRISPR protein, Acr) AcrIIC3,但是在Acr的3′UTR区插入内源性的组织特异性miRNA结合序列,当靶细胞表达特异性miRNA时,能够抑制该重组AAV载体中Acr的表达,因此Cas9蛋白表达和发挥基因编辑活性,从而达到组织特异性编辑靶基因的目的。早在2002年人们就发现了在特定组织中特异性表达的miRNAs,例如在肝脏组织中特异性表达miR-122,将miR-122结合序列插入含Acr基因的CRISPR/Cas9系统后,只能在肝脏组织中发挥基因编辑功能,在其他组织和细胞中无Cas9活性[55]。2019年,Hoffmann等[56]也通过miRNA调控CRISPR/ Cas9基因编辑活性。该研究将两个分别在肝脏和心脏表达的miR-122或miR-1调控序列,分别插入到Acr基因的3′UTR,将其与含Cas9和sgRNAs的载体共转染到肝脏或心肌细胞,观察到在肝细胞和心肌细胞中Cas9酶的活性,从而发挥基因编辑作用,以解决组织特异性及脱靶问题。同时,该研究在含AcrIIA4、AcrIIC1和AcrIIC3等多种抗CRISPR系统中验证了该组织特异性基因编辑系统的有效性。
3 结语与展望
精准调控Cas9蛋白活性的方法主要包括:通过药物、光等调控Cas9蛋白活性和降解Cas9蛋白;通过抗CRISPR蛋白、小分子化合物抑制剂、核酸小分子抑制剂及组织特异性microRNA等,抑制Cas9蛋白酶的活性。其中抗CRISPR蛋白应用前景非常广阔。自2013年发现第一个抗CRISPR蛋白以来,目前已发现40多个抗CRISPR蛋白,其中11个已知其作用机制[6]。但是大多数CRISPR系统目前没有明确其抗CRISPR蛋白,有待进一步被发现。抗CRISPR蛋白的作用机制也需要进一步被解析,多数已知的抗CRISPR蛋白的作用机制仍不清楚。可以根据抗CRISPR蛋白的作用机制,设计出新的调控CRISPR/Cas9基因编辑技术的策略及方法。抗CRISPR/Cas9小分子化合物具有易精准控制、使用方便等特点,因此也具有非常广阔的应用前景,但是,目前由于缺乏高通量、敏感、低成本的筛选方法,以及Cas9蛋白酶与底物的亲和力较低、酶催化效率低等原因,寻找这样的小分子化合物还非常困难[22]。随着筛选方法的不断完善,寻找新的能抑制Cas9酶活性的小分子化合物,设计出能同时靶向多个靶点的小分子化合物,是调控基因编辑技术的主要发展方向之一[57]。随着基因编辑技术的快速发展,新的基因编辑技术也在不断涌现,因此需要不断面对新的基因编辑技术所带来的挑战,需要不断设计出低免疫原性、靶向多种作用机制的合成分子,以及能在时间和空间上精准调控基因编辑技术的多种抗CRISPR技术和手段[8,57]。精准、高效调控CRISPR/ Cas9系统也需要多种调控方法的联合应用,通过不同的作用机制,在不同层面上进行精准调控CRISPR/ Cas9的生物学作用。总之,随着CRISPR/Cas9调控技术的不断成熟和完善,可以有效地保证基因编辑技术的合理应用和防范基因编辑技术缪用,为解决生物恐怖威胁等生物安全问题提供技术方法。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 7]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
Sci Transl Med,
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 9]
[本文引用: 4]
[本文引用: 4]
[本文引用: 4]
[本文引用: 3]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
