Online:2020-12-20

PDF (280KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王邦, 谷峰. CRISPR-Cas9对人类线粒体基因组微同源区切割后产生新生变异. 遗传[J], 2020, 42(12): 1221-1222 doi:
温州医科大学附属眼视光医院,眼视光学和视觉科学国家重点实验室,温州 325027线粒体是真核细胞的一种细胞器,其含有线粒体基因组(mtDNA, mitochondrial DNA),是细胞能量制造、多种信号转导及重要代谢物合成的中心。人类mtDNA长约16.6 kb,编码13个呼吸链所必需的蛋白以及24个蛋白翻译必需的RNA。人类mtDNA的突变会导致很多种重大疾病,比如神经退行性疾病、糖尿病、癌症、心血管疾病等[1]。因此,线粒体相关疾病是人类重大疾病的重要组成部分。细胞由于有氧呼吸作用产生的氧自由基簇(reactive oxygen species, ROS),无时无刻不在损伤mtDNA,进而诱发mtDNA突变。目前利用靶向突变mtDNA的核酸酶(如mito-ZFNs/TALENs, mitochondria-targeted zinc finger nucleases/transcription activator-like effector nucleases)可以有效去除带有突变的线粒体。这在线粒体疾病临床治疗方面具有重要应用前景[2~4]。这个过程具体包括:利用mito-ZFNs/TALENs切割突变的mtDNA,从而产生DNA双链断裂,由此导致突变的mtDNA降解,这样达到去除致病mtDNA的目的。例如,Carlos T. Moraes团队利用AAV9进行在体递送mito-TALENs到线粒体,其可特异性切割含有突变m.5024C>T (tRNA Ala基因)的小鼠mtDNA,实现了在肌肉和心脏细胞线粒体中tRNA Ala表达量的恢复[3],有望能治疗该突变导致的心脏疾病。与此类似,另一个相似工作,同样是修复能导致心脏疾病的突变m.5024C>T,只是使用了mito-ZFNs [4]。说明多种核酸酶均可以在哺乳动物线粒体中发挥活性切割。而在水稻和油菜中,利用特异性切割mtDNA上胞质雄性不育相关基因ofr79和orf125,实现了以同源重组方式对mtDNA进行编辑,恢复了雄性可育性[5]。同样在TALE (transcription activator-like effector)基础上,融合来自于新洋葱伯克霍尔德菌(Burkholderia cenocepacia)的毒素蛋白——胞嘧啶核苷脱氨酶DddA (double-stranded DNA deaminase toxin A),使DddA能在TALE的引导下靶向人类mtDNA,催化胞嘧啶碱基(C)转换为尿嘧啶(U),并在其后mtDNA复制中转为胸腺嘧啶(T),从而实现mtDNA的定点碱基转换[6]。
然而曝露在ROS的人类mtDNA不仅有碱基官能团的损伤,还有双链断裂的损伤。在产生双链断裂后,除了目前被领域广泛认可的mtDNA丢失以外,切割后的mtDNA是否能够以某种方式留在细胞中,目前仍然不清楚。该问题是线粒体生物学中一个非常重要的基础科学问题,因为该问题关系到线粒体基因组到底有没有DNA修复。如果有,是如何修复的?同时,该问题的回答也具有重要临床意义,因为其关系到以基因组编辑为基础的线粒体临床治疗可能存在潜在的副作用。针对上述问题,本团队利用线粒体靶向的信号肽融合了来自金黄色葡球菌(Staphylococcus aureus)的Cas9 (mito-SaCas9)[7],测试了多个mtDNA位点,令人惊讶地发现有些位点会产生小片段缺失或插入(图1)。进一步的分析发现这些序列具有一定的序列特异性,即具有微同源序列(5~25 bp)的区域在经过切割后可以形成突变。随后通过限制性内切酶将突变的序列进行富集,利用一代测序能够检测到缺失或插入突变。且由此导致的mtDNA突变随着细胞分裂,可以稳定地遗传给子代细胞。但是,利用只能对DNA双链中产生缺口的缺口酶Cas9 (Cas9 nickase)进行作用,结果显示不能使mtDNA产生突变,这些结果提示突变是由于线粒体中双链断裂修复途径诱发所导致(图1)。
图1
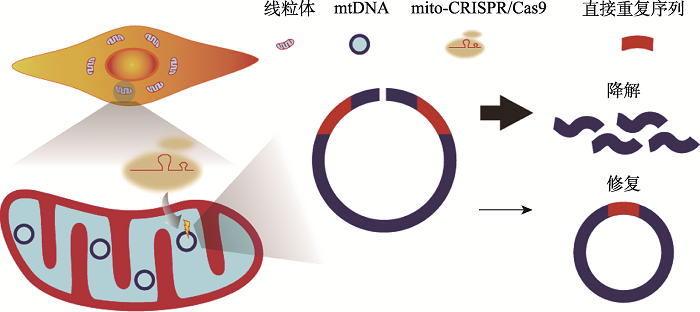 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1线粒体基因组微同源区域双链断裂诱发的新生突变
线粒体基因组微同源区域(由5~25 bp直接重复序列构成,图中红色标记片段)在mito-CRISPR/Cas9切割产生双链断裂后,大部分会走入线粒体降解途径;少量在线粒体基因组双链断裂修复机制的作用下,被修复,同时可能产生缺失或插入的新生突变。
Fig. 1De novo mutagenesis induced by double-stranded breaks at the microhomologous regions of mtDNA
如何进一步提高突变的发生率呢?通过联合多重单向导RNA (single guide RNA, sgRNA)以及使用双链断裂修复的小分子抑制剂,可以显著提高突变的发生率(0.01%~0.03%),显示mtDNA双链断裂修复过程中,突变发生的可塑性。此项工作为线粒体基因组DNA修复机制提供了新的认识,并对目前利用基因编辑技术治疗线粒体遗传病具有重要参考价值。需要指出的是,本研究中mtDNA突变的效率远低于前文所提及的DddA介导的单碱基编辑效率[6],表明在线粒体中mtDNA双链断裂诱导的修复活性不如碱基切除修复。未来开发高效、简便的mtDNA编辑工具仍然是线粒体基因编辑的重要研究内容。该工作于2020年11月26日提前在线发表在Science China Life Sciences (
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
