 ,1,21.
,1,21. 2.
Heterogenous expression and enzymatic property analysis of microbial-derived pectinases in pig PK15 cells
Jianxin Mo1, Haoqiang Wang2, Guangyan Huang2, Gengyuan Cai1,2, Zhenfang Wu1,2, Xianwei Zhang ,1,21.
,1,21. 2.
通讯作者:
编委: 任军
收稿日期:2019-03-27修回日期:2019-07-18网络出版日期:2019-08-20
| 基金资助: |
Received:2019-03-27Revised:2019-07-18Online:2019-08-20
| Fund supported: |
作者简介 About authors
莫健新,硕士研究生,专业方向:动物遗传育种与繁殖E-mail:2696064146@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (1247KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
莫健新, 王豪强, 黄广燕, 蔡更元, 吴珍芳, 张献伟. 微生物源果胶酶在猪PK15细胞中异源表达及其酶学性质分析[J]. 遗传, 2019, 41(8): 736-745 doi:10.16288/j.yczz.19-087
Jianxin Mo, Haoqiang Wang, Guangyan Huang, Gengyuan Cai, Zhenfang Wu, Xianwei Zhang.
果胶是畜禽饲料中主要的抗营养物质,阻碍动物对饲料中营养物质的消化吸收。有研究显示,在30 kg“杜长大”生长猪日粮中添加8%果胶,显著降低日粮的能量表观消化率、表观消化能和氮表观消化率,极显著降低能量表观代谢率和表观代谢能[1];在每千克日粮中添加62.2 g果胶,显著降低白罗曼鹅(White Roman Geese)日增重和饲料转化率[2];在每千克玉米日粮中添加30 g甲基化程度为60%的果胶,使1~21日龄肉鸡的饲料利用率下降37%,增重下降19%[3]。
果胶在结构上主要由D-半乳糖醛酸(D-Galacturonic acid)通过α-1,4糖苷键连接构成,同时含有DL-鼠李糖、D-半乳糖和D-阿拉伯糖等中性糖[4,5],是一类广泛存在于植物细胞初生壁和细胞中间片层的杂多糖[6],占双子叶植物和非禾本科单子叶植物初生壁的35%、草类初生壁的2%~10%、木本植物细胞壁的5%[4,7]。在植物细胞壁中,果胶对纤维素和半纤维素起到包裹和粘连的作用,降低了畜禽对植物性饲料细胞壁物质的可消化性。此外,果胶具有较强的持水性,溶于水后使肠道中食糜粘性增大,阻碍消化酶与营养物接触和减缓营养小分子向小肠粘膜扩散[8]。果胶酶在自然界中广泛存在细菌、酵母和丝状真菌等微生物中,在线虫和昆虫中也有少量分布[9,10],是可特异性降解果胶的一类非淀粉多糖酶。在饲料中添加果胶酶对解除果胶的抗营养作用、提高饲料利用率和改善畜禽的生长性能具有显著的效果[8,9,11]。高玉红等[12]研究显示,在“杜长大”三元杂交仔猪基础日粮中添加含有1%果胶酶的复合酶制剂使日增重提高14.50%,料肉比降低17.8%。郑腾[13]研究显示,在“长大”二元杂交猪的基础日粮中添加含有活性为5195 U/kg果胶酶的复合酶制剂,对36~56日龄仔猪和57~98日龄生长猪的日增重、料肉比和饲料利用率都有显著的改善作用。
尽管果胶酶以饲料添加剂的方式使用可有效解除果胶的抗营养作用,但是其酶活力容易受环境温度、湿度和酸碱度等条件影响,饲用效果极不稳定[14,15]。随着基因编辑技术的不断发展,创制能在消化道分泌非淀粉多糖酶的节粮环保转基因畜禽新品种为解决非淀粉多糖的抗营养作用提供了新方案[16,17]。2001年,Golovan等[18]利用转基因方法首次获得在唾液腺中表达大肠杆菌(Escherichia coli)植酸酶EsAPPA (GenBanK登录号:M58708.1)的转基因猪,该猪对饲料磷的消化率提高88%~99%,粪磷排放量降低75%。2018年,本课题组利用PiggyBac转座子介导的转基因技术成功得到在唾液腺中特异性表达葡聚糖酶、木聚糖酶和植酸酶的转基因猪,与非转基因猪相比,该猪在生长-育成阶段粪氮排放显著减少24.0%,粪磷排放显著减少45.8%,对饲料磷的表观消化率显著提高119.3%,对饲料氮的表观消化率显著提高7.8%,对饲料钙的表观消化率显著提高41.2%,日增重显著提高30.69%,料肉比显著下降12.03%,育成所需饲料减少12.18%,育成周期缩短22.58%,具有明显的环保和经济价值[19]。但到目前为止,表达果胶酶的转基因动物模型尚未见报道。
猪消化道有其本身特殊的环境条件,温度较为稳定,一般在38.5~40℃之间波动[20]。pH处于动态变化中:正常情况下胃液pH在1.7~4.9间波动,小肠液pH在6.1~6.7间波动,盲肠液pH在6.0~6.4间波动,结肠液pH在6.1~6.6间波动。果胶酶的活力极容易受到温度与酸碱度影响,温度过高或者过低、pH偏酸或偏碱均会抑制果胶酶的活性,甚至使其失活。因此,筛选作用条件与猪消化道环境条件相适应的果胶酶是成功制备转果胶酶基因猪的关键。目前已有数条微生物源果胶酶基因被挖掘出来。Wang等[21]报道,黑曲霉(Aspergillus niger ZJ5) pga-zj5a基因(GenBank登录号:KU896780,简写为pg5a)编码的果胶酶在毕赤酵母(Pichia pastoris)中异源表达,最高酶活为10436 U/mL,最适温度为25~45℃,最适pH为4.5~6.5。Tu等[22]研究表明,无毛毛壳属微生物(Achaetomium sp. Xz8) pgI基因(GenBank登录号:KC633130)编码的果胶酶在毕赤酵母中异源表达,最高酶活为49934 U/mL,最适温度为30~60℃,最适pH为4.0~6.5。Zhou等[23]研究表明,黑曲霉(Aspergillus niger SC323) pga3a基因(GenBank登录号:KP265703)编码的果胶酶在酿酒酵母(Saccharomyces cerevisiae)中异源表达,最大酶活为1448.48 U/mg,最适温度为35~70℃,最适pH为3.0~6.0。Liu等[24]报道,黑曲霉(Aspergillus niger JL-15) pgaA基因(GenBank登录号:KF157661)编码的果胶酶在毕赤酵母中异源表达,最高酶活为2091 U/mg,最适温度为30~60℃,最适pH为4.0~6.0。以上4种果胶酶在酵母中异源表达均能获得高酶活,且其最适作用温度和最适作用pH与猪消化道条件较为接近,具备作为制备转果胶酶基因猪候选基因的条件。
本课题组前期研究显示,猪肾细胞系PK15 (porcine kidney 15,PK15)能很好地模拟外源非淀粉多糖酶基因在猪唾液腺分泌细胞中的表达模式,用猪PK15细胞筛选得到的外源非淀粉多糖酶基因可有效地在猪腮腺分泌细胞中表达[19]。本研究根据猪遗传密码子使用偏好,对微生物源果胶酶基因pg5a、pgI、pga3A和pgaA的编码序列进行优化,通过脂质体转染法导入猪PK15细胞中进行异源表达,参照国家行业标准《QB 1502-92 食品添加剂果胶酶制剂》,利用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)法测定这些基因编码的果胶酶在猪PK15细胞中表达的酶活力,并分析它们的最适作用pH范围和对酸碱度以及消化蛋白的耐受能力,旨在筛选出作用条件与猪消化道环境条件相适应的果胶酶,为创制分泌果胶酶的新型节粮环保转基因猪提供候选基因和理论依据。
1 材料与方法
1.1 候选果胶酶基因密码子优化、真核表达载体构建及在猪PK15细胞中表达
果胶酶基因pg5a、pgI、pga3A和pgaA经SignalP 4.1 Server预测信号肽后,去掉其原有信号肽,利用OptimumGeneTM基因设计软件根据猪密码子使用偏好进行优化(由南京金斯瑞生物科技公司完成)。将牛源的腮腺分泌蛋白信号肽编码序列添加到密码子优化后的候选基因上,在其5′端添加HindⅢ酶切位点,3′端添加NotⅠ酶切位点,利用南京金斯瑞生物科技公司的Gene-on-DemandTM技术平台合成基因并分别克隆到pcDNA3.1(+)真核表达载体上(由南京金斯瑞生物科技公司完成),分别得到果胶酶真核表达载体pCD-pg5a、pCD-pgI、pCD-pga3A和pCD-pgaA。将上述质粒转化E. coil DH5α感受态细胞,扩大培养。用无内毒素质粒抽提试剂盒Endo-free Plasmid Mini KitⅡ (OMEGA,广州)提取质粒,保存于-20℃冰箱中备用。复苏猪PK15细胞,培养至密度为80%左右。以pcDNA3.1(+)作为空白对照,利用脂质体转染试剂盒LipofectamineTM LTX + PLUSTM Reagent (Thermo Fisher Scientific,美国)将无内毒素的果胶酶基因真核表达载体导入猪PK15细胞,每个反应转染4 μg质粒,每个质粒进行3次重复。48 h后收集细胞培养液,90 g离心3 min,取上清液作为粗酶液,保存于-20℃冰箱中备用。收集剩余细胞,用RNA抽提试剂盒Total RNA Kit Ⅰ (OMEGA,广州)抽提RNA,通过RT-PCR法检测果胶酶基因mRNA水平的表达情况(引物序列见表1)。
Table 1
表1
表1 RT-PCR扩增引物
Table 1
| 引物名称 | 序列(5′→3′) | 复性温度(℃) | 产物长度(bp) |
|---|---|---|---|
| pg5a-F | GGAGCTAGGTGGTGGGA | 60 | 155 |
| pg5a-R | ATGGTCAGGTGGTCGGC | ||
| pgI-F | GCAATGGAGCTAAATGGTGG | 60 | 190 |
| pgI-R | GCGGAGTTATCGAGGTGGAC | ||
| pga3a-F | ACCTCCTGCTCCGACATCGT | 60 | 132 |
| pga3A-R | GTCCCACTCCTCGTACTCCC | ||
| pgaA-F | CTGCTGGCGAAACACTGAA | 60 | 121 |
| pgaA-R | TCTTTCCCGCTGATTCGGAG | 60 | |
| β-actin F | CCACGTTACTACCTTCTTCTC | 60 | 131 |
| β-actin R | TGATCTCCTTCTGCATCCTGT |
新窗口打开|下载CSV
1.2 果胶酶酶学性质分析
1.2.1 标准曲线绘制取150 μL磷酸二氢钠-柠檬酸缓冲溶液于2 mL离心管中,加入450 μL DNS试剂,混匀,沸水加热5 min。冷却至室温,用双蒸水定容至1 mL,10 000 g离心1 min,取上清液作为标准空白样。
取7个洁净的100 mL容量瓶,依次加入1~7 mL 1%的半乳糖醛酸溶液,用磷酸氢二钠-柠檬酸缓冲溶液定容至100 mL,摇匀,获得浓度为0.10~0.70 mg/mL的半乳糖醛酸标准溶液。
分别吸取50 μL半乳糖醛酸标准溶液 (每个浓度梯度进行3次重复) 到2 mL离心管中,依次加入100 μL磷酸二氢钠-柠檬酸缓冲溶液和450 μL DNS试剂,混匀,沸水浴5 min。冷却至室温,用双蒸水定容至1 mL,10 000 g离心1 min。用标准空白样调零,在540 nm处测定标准液的吸光度OD值。
以半乳糖醛酸标准液浓度为Y轴,吸光度OD值为X轴,绘制标准曲线:y = 3.3889x + 0.2707 (相关系统R2=0.997)。对应的果胶酶酶活计算公式为:果胶酶活力(U/mL)=D×((A1-A0)×3.3889+0.2707)/ 6483.6×1000;其中,A1为酶反应液吸光度,A0为灭活组吸光度,D为酶液稀释倍数。
1.2.2 果胶酶活性测定方法
以1%多聚半乳糖醛酸溶液作为底物,以转染质粒pcDNA3.1(+)的猪PK15细胞培养液作为空白对照,分别测定质粒pCD-pg5a、pCD-pgI、pCD-pga3A和pCD-pgaA表达果胶酶的酶活性。测定方法参考国行业标准《QB 1502-92 食品添加剂果胶酶制剂》,具体如下:
灭活组:取50 μL粗酶液放入2 mL离心管中,加入450 μL DNS试剂,混匀。加入100 μL底物,39.5℃处理30 min,沸水浴加热5 min。冷却至室温,用双蒸水定容到1 mL,混匀,10 000 g离心1 min,吸取上清液,测定540 nm处的吸光度OD值。
酶活测定组:取50 μL粗酶液(设置3个重复)放入2 mL离心管中,加入100 μL底物,混匀,39.5℃反应30 min。加入450 μL DNS试剂,沸水浴加热5 min。冷却至室温,用双蒸水定容到1 mL,混匀,10 000 g离心1 min,测定540 nm处吸光度OD值。
1.2.3 最适pH测定
配制pH梯度(pH2.5~7.0)的1%多聚半乳糖醛酸溶液作为底物,分别与粗酶液进行酶促反应(设置3个重复),测定果胶酶的最适pH。
1.2.4 pH稳定性测定
配制pH梯度(pH2.0~8.0)的缓冲液,分别取200 μL不同pH的缓冲液与50 μL粗酶液混合(设置3个重复),39.5℃孵育2 h,加入1.2.3中测得的最适pH多聚半乳糖醛酸溶液100 μL,39.5℃反应30 min,加入450 μL DNS试剂,沸水浴5 min,以最高酶活为100%,测定不同pH缓冲液处理后果胶酶的剩余酶活。
1.2.5 胃蛋白酶和胰蛋白酶耐受能力测定
果胶酶胃蛋白酶和胰蛋白酶耐受性测定参考Tu等[25]和孙悦[26]报道的方法,具体如下:
胃蛋白酶耐受性分析:取50 μL粗酶液与200 μL猪胃蛋白酶溶液(1 mg/mL,pH4.3)混合(设置3个重复),39.5℃处理2 h,加入1.2.3中测得的最适pH多聚半乳糖醛酸溶液100 μL,39.5℃反应30 min,视粗酶液经pH4.3谷氨酸-盐酸缓冲液处理2 h后测得的酶活力为100%,测定果胶酶的剩余酶活。
胰蛋白酶耐受性分析:取50 μL粗酶液与200 μL猪胰蛋白酶(1 mg/mL,pH8.0)混合, 39.5℃处理2 h,加入1.2.3中测得的最适pH多聚半乳糖醛酸溶液100 μL,视粗酶液经pH7.0 Tris-HCl缓冲液处理2 h后测得的酶活力为100%,测定其剩余酶活。
2 结果与分析
2.1 果胶酶基因对猪细胞表达系统适应性提高
根据猪基因表达系统的密码子使用偏好,对果胶酶基因pg5a、pgI、pga3A和pgaA的编码序列进行优化。结果显示,4种果胶酶基因优化后的密码子适应指数(codon adaptation index, CAI)分别为0.98、0.81、0.97和0.82,均大于0.8 (一般认为CAI> 0.8时,基因即可得到较高水平的表达) (表2);4种基因评分为0~50的低频率使用的密码子和稀有密码子被完全剔除,猪高频使用的密码子比例均显著提高(图1 A);4种基因的GC含量均在30%~70%理想范围内,统计区域60 bp以内的GC%峰被移除(图1 B)。以上结果表明,4种果胶酶基因经密码子优化后对猪基因表达系统的适应性提高,有利于它们在猪细胞中表达。Table 2
表2
表2 4种果胶酶基因密码子适应指数优化结果
Table 2
| 果胶酶基因 | CAI | |
|---|---|---|
| 优化后 | 优化前 | |
| pg5a | 0.98 | 0.80 |
| pgI | 0.81 | 0.80 |
| pga3A | 0.97 | 0.79 |
| pgaA | 0.82 | 0.77 |
新窗口打开|下载CSV
图1
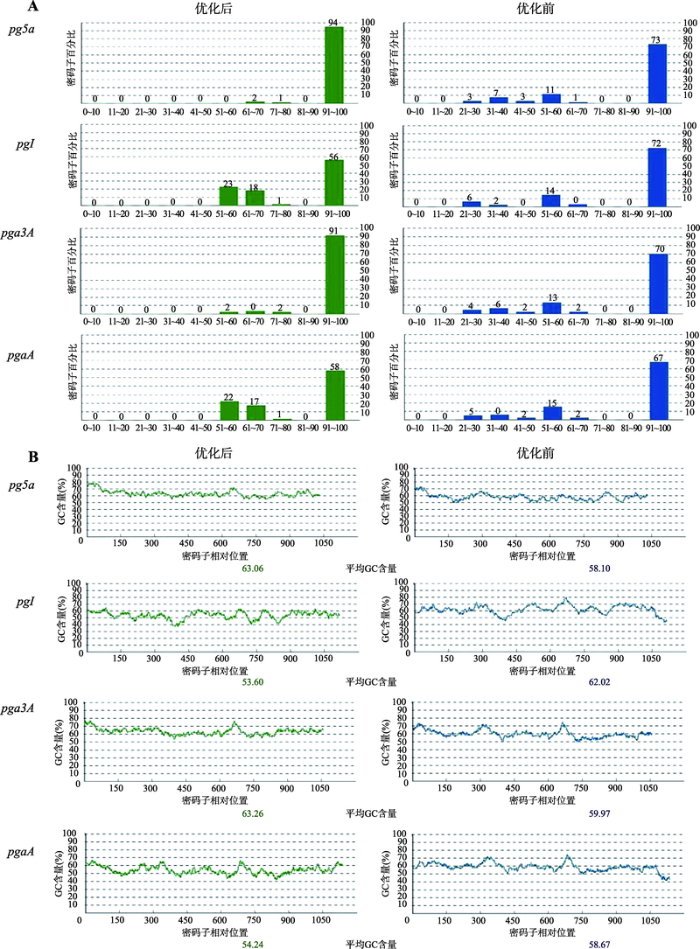 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图14种果胶酶基因最优密码子频率和GC含量优化结果
A:最优密码子频率优化结果;B:GC含量优化结果。
Fig. 1Frequency of optimal codon and GC content optimization results of the four pectinase genes
2.2 果胶酶基因在猪PK15细胞中成功转录
以空白载体pcDNA3.1(+)为对照,分别将果胶酶基因表达载体通过脂质体转染法导入猪PK15细胞。48 h后,利用RT-PCR检测4种果胶酶基因mRNA水平的表达情况。结果显示,果胶酶基因pg5a、pgI、pga3A和pgaA均能成功转录出mRNA (图2)。图2
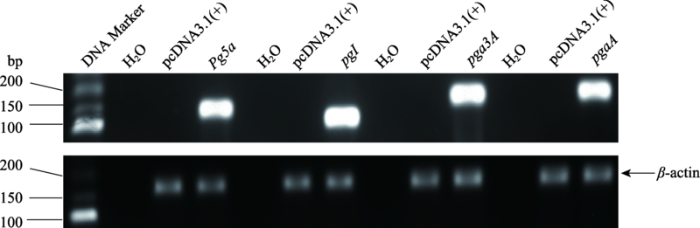 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图24种果胶酶基因mRNA水平表达检测
Fig. 2mRNA expression level detection of the four pectinase genes
2.3 果胶酶PG5A和PGI的酶活力较PGA3A和PGAA强
以转染pcDNA3.1(+)空载体的细胞培养液作为对照组,根据猪消化道的温度条件和4种果胶酶在酵母细胞中表达的最适pH,测定它们在39.5℃和pH5.0条件下的果胶酶活力。结果显示,果胶酶PG5A的活性最高,为0.48 U/mL;其次是PGI,为0.37 U/mL;PGA3A的果胶酶活性极低;PGAA与对照组酶活差异不显著(P>0.05) (图3)。果胶酶PGAA进行完酶活力比较实验后被淘汰,不再进行后续的实验。图3
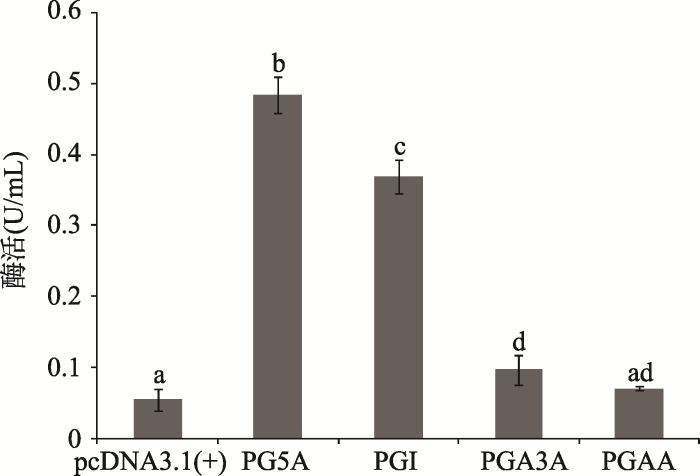 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图34种果胶酶酶活力比较
不同字母标注表示组间差异显著(P<0.05)。
Fig. 3Comparison of the four pectinase activities
2.4 果胶酶PG5A和PGI最适pH与猪消化道pH相近
分别用pH梯度(pH2.5~7.0)底物溶液与果胶酶PG5A、PGI和PGA3A进行酶促反应,测定它们的最适作用pH,结果如图4所示。PG5A在pH4.0处获得最高酶活,为0.95 U/mL,在pH3.0和pH5.0处的酶活分别为0.51 U/mL和0.57 U/mL,当底物pH低于pH2.5或者大于pH6.0时,其活性受到了极大的抑制。PGI在pH5.0处获得最大活性,为0.30 U/mL,在pH4.0处和pH6.0处的活性分别为0.25 U/mL和0.19 U/mL,当底物pH小于pH3.0或者大于pH7.0时几乎不表现出酶活力。PGA3A在pH2.5~7.0范围内均没有检测到果胶酶活性。综上所示,果胶酶PG5A和PGI的最适pH范围分别为pH3.0~5.0和pH3.0~6.0,均在猪消化道pH波动范围(pH1.7~6.7)内。果胶酶PGA3A进行完最适pH测定后被淘汰,不再进行后续实验。图4
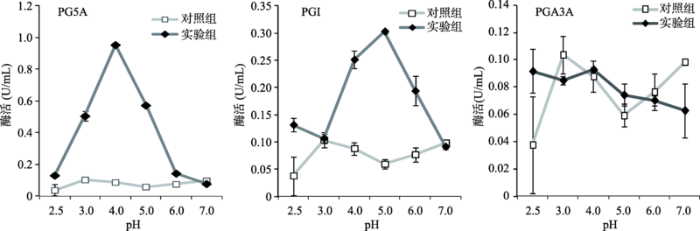 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4果胶酶PG5A、PGI和PGA3A的最适作用pH测定
Fig. 4Optimal pH determination of pectinase PG5A, PGI, and PGA3A
2.5 果胶酶PG5A和PGI对酸碱度和消化蛋白酶耐受能力强
利用不同pH (pH2.0~8.0)的磷酸二氢钠-柠檬酸缓冲液处理2 h后,测定果胶酶PG5A和PGI的剩余酶活力,分析它们的酸碱度耐受能力,结果如图5A所示。PG5A在pH4.0~6.0范围内维持46%以上的活性,当pH低于pH3.0或高于pH7.0时,pH对其活性的具有明显的抑制作用;PGI在pH4.0~6.0范围内维持35%以上的活性,而当pH低于pH3.0或者高于pH7.0时,其活性同样受到极大的抑制。利用猪胃蛋白酶和胰蛋白酶处理PG5A和PGI,测定它们对消化蛋白酶的耐受能力。胃蛋白酶耐受性试验结果显示,PG5A和PGI对胃蛋白酶均具有较强的耐受能力,处理后剩余酶活分别为76%和71% (图5 B);胰蛋白酶耐受性试验结果显示,PGI对胰蛋白酶的耐受能力较强,处理后保留93%的剩余酶活,而PG5A仅保留44%的剩余酶活(图5 B)。以上结果表明,果胶酶PG5A和PGI对酸碱度和消化蛋白酶具有较强的耐受能力。图5
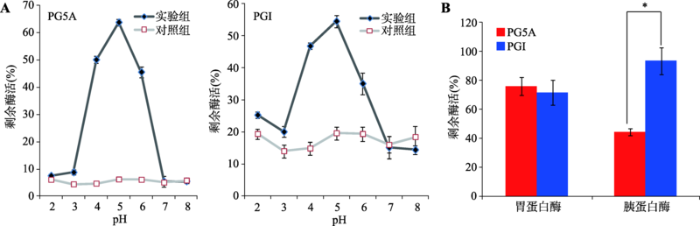 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5果胶酶PG5A和PGI的pH稳定性和消化蛋白酶耐受性测定
A:pH稳定性;B:消化蛋白酶耐受性。*表示组间差异显著(P<0.05)。
Fig. 5pH stability and digestive protease tolerance assays of pectinase PG5A and PGI
3 讨论
果胶酶基因pg5a、pgI、pga3A和pgaA在酵母中高效表达,其编码果胶酶发挥最大酶活力的温度和pH范围与猪消化道温度和pH范围相似[21,22,23,24]。本文根据猪基因表达系统遗传密码使用偏好,对pg5a、pgI、pga3A和pgaA的编码序列进行优化,并导入猪PK15细胞中异源表达,探究它们在猪细胞中表达的可行性,为创制转果胶酶基因猪提供候选基因。研究结果显示,pg5a在猪PK15细胞表达果胶酶活力最高,其次为pgI。而pga3A和pgaA虽然能正常转录,但在其细胞培养液中没能检测到果胶酶活力。pg5a和pgI在猪PK15细胞表达获得果胶酶的最适作用pH范围分别在3.0~5.0和4.0~6.0之间,与它们在毕赤酵母中表达获得果胶酶的最适pH范围相似。在PK15细胞中,pg5a编码果胶酶的最大酶活在pH4.0处测得,为0.95 U/mL,pgI编码果胶酶的最大酶活在pH5.0处测得,为0.30 U/mL,二者均与它们在毕赤酵母中表达获得的最大酶活存在较大差异(pg5a为10 436 U/mL,pgI为49 934 U/mL),与孙悦[26]报道的结果相似。原因可能与果胶酶基因在两种细胞中的表达效率差异导致的单位体积培养基内含有酶数量的不同有关。首先,pg5a和pgI在毕赤酵母中的表载体是pPIC9K,该载体允许基因多拷贝插入[27],而在PK15细胞中的表达载体是pcDNA3.1(+),只含有单拷贝的外源基因,导致二者在PK15细胞中表达量远低于它们在毕赤酵母中的表达量。其次,毕赤酵母在培养罐中可进行高密度发酵,外源基因的表达量可随细胞密度的增加而呈指数式增加,而PK15细胞在培养皿中为单层细胞贴壁生长,细胞愈合之后停止生长,导致PK15细胞介导pg5a和pgI表达的能力远低于毕赤酵母。
经密码子优化后,pga3A和pgaA的CAI分别为0.97和0.82,均大于0.8,GC含量分别为63.26%和54.24%,密码子均分布在评分为51~100之间的高频使用密码子间,优化结果与pg5a和pgI相似,说明优化结果利于pga3A和pgaA在猪细胞中表达。但在它们的细胞培养液中没有检测到果胶酶活性,与它们在酵母中表达的结果不同。pga3A在酿酒酵母中表达获得果胶酶的最大酶活为1448.48 U/mg[23],pgaA在毕赤酵母中表达获得果胶酶的最大酶活为2091.0 U/mg[24],均远小于pg5a和pgI在酵母细胞中表达获得果胶酶的最大酶活。结合pg5a和pgI在猪PK15细胞中表达获得果胶酶的最大酶活仅为0.95 U/mL和0.30 U/mL的结果,我们推测PGA3A和PGAA不表现出果胶酶活性的原因可能与二者的活性低有关,在PK15细胞的表达量可能不足以使它们表现出酶活力。此外,动物细胞表达系统与酵母表达系统对目标蛋白翻译后修饰方式存在明显差异。PGA3A和PGAA不表现果胶酶活性也可能是它们无法适应猪细胞表达系统导致的。PG5A和PGI在猪细胞表达系统获得最大酶活力(PG5A>PGI)与酵母表达系统(PG5A<PGI)相反,可能也与此有关,需进一步研究证实。
猪的消化道有其独特的生理条件,其消化液一般为酸性,且处于动态变化中。猪胃液pH在1.7~4.9间变化,平均水平为4.4,小肠液pH在6.1~6.7间变化,盲肠液pH在6.0~6.4间变化,结肠pH在6.1~ 6.6间变化。因此,果胶酶必须含有较宽的适宜pH范围且对酸碱度有较强的耐受能力才能在猪消化道内发挥作用。本研究筛选得到的果胶酶PG5A和PGI的最适pH范围在3.0~5.0和4.0~6.0之间,在猪消化道pH的波动范围内。PG5A和PGI在pH4.0~6.0条件下处理2 h后分别维持46%和35%以上的酶活,说明二者对酸碱度有较强的耐受能力,适应猪消化道的pH条件。另外,猪消化道还含有高浓度的消化蛋白酶。果胶酶能在猪消化道发挥作用的另一个条件是对消化蛋白酶具有较强的耐受能力。消化蛋白酶耐受性实验显示,PG5A和PGI在1 mg/mL胃蛋白酶溶液中分别维持76%和71%的酶活,在1 mg/mL胰蛋白酶溶液中分别维持着93%和44%的酶活,对消化道的消化蛋白酶具有较强的耐受能力。
综上所述,果胶酶基因pg5a和pgI能在猪细胞中高效表达。其编码果胶酶的最适作用pH在猪消化道pH变化范围内,且对酸碱度和猪消化蛋白酶具有较强的耐受能力,可作为创制新型节粮环保转基因猪的功能基因。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
