 ,南方科技大学生物系,生命科学实验教学中心,深圳 518055
,南方科技大学生物系,生命科学实验教学中心,深圳 518055Laboratory design and practice for undergraduates: Using RNAi to modulate gene expression
Yakun Song, Min Zhang, Qiaochu Wang, Yuli Peng, Fangxing Jia, Chunhong Yu ,Life Science Experimential Teaching Center, Department of Biology, Southern University of Science and Technology, Shenzhen 518055, China
,Life Science Experimential Teaching Center, Department of Biology, Southern University of Science and Technology, Shenzhen 518055, China通讯作者:
编委: 陈德富
收稿日期:2019-01-18修回日期:2019-05-12网络出版日期:2019-07-20
| 基金资助: |
Received:2019-01-18Revised:2019-05-12Online:2019-07-20
| Fund supported: |
作者简介 About authors
宋亚坤,硕士,实验员,研究方向:生物实验教学E-mail:songyk@sustech.edu.cn。

摘要
关键词:
Abstract
Keywords:
PDF (549KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
宋亚坤, 张敏, 王翘楚, 彭玉荔, 贾方兴, 余春红. 利用RNA干扰技术沉默基因表达在本科实验教学中的设计与实践[J]. 遗传, 2019, 41(7): 653-661 doi:10.16288/j.yczz.18-343
Yakun Song, Min Zhang, Qiaochu Wang, Yuli Peng, Fangxing Jia, Chunhong Yu.
经典的RNA干扰是由双链小RNA介导的靶基因表达下降的现象,早期在植物[1]、真菌[2]、线虫[3,4]等生物中被发现,后来被证实是一种高度保守的机制,广泛存在于生物界[5,6,7]。2006年,RNAi机制的发现者Andrew Fire和Craig Mello被授予诺贝尔生理及医学奖。RNA干扰技术已成为一个很好的反向遗传学研究工具,被广泛用于基因功能的研究[5,6,7]和基因治疗方式的研发[8,9,10]。其原理是双链RNA (double strand RNA, dsRNA)在细胞质内被一种称为Dicer的酶特异识别并剪切成长度为20~23 bp的双链小分子干扰RNA (small interference RNA, siRNA)[11,12];然后siRNA被组装到RNA诱导沉默复合体(RNA- induced silencing complex, RISC)中。该复合体含有多种蛋白成分,如核糖核酸酶、解旋酶。RISC被激活后,siRNA双链被解链成正义链与反义链,反义siRNA链按照碱基互补的原则与靶标mRNA完全互补结合,引导RISC对mRNA进行切割。切割位点发生在与反义siRNA完全互补结合的mRNA区,距离反义siRNA 5°末端10~12 bp处。mRNA被切割后降解,基因表达因此受到抑制[5,6,7]。
经历20年的发展,RNA干扰技术日渐成熟,从科研实验室走进了本科实验教学。常见的教学内容是学生将教师设计和准备好的小干扰RNA或表达载体转入细胞或机体中,检测靶基因(如荧光蛋白)的表达或观察机体的变化[13,14,15,16,17]。虽然教学效果良好,但这样的设计让学生动手操作的实验主要是细胞转染和结果观察或检测。虽然教师会讲RNA干扰的原理,但学生对RNA干扰原理和过程的理解可能不深刻或不全面。为了让学生更好地理解该技术,本教学实践在现代生物技术实验课里,以敲低3T3-L1细胞中基因的表达为目的,让学生自己选择靶基因、设计siRNA、分析siRNA结合靶基因mRNA的区域和验证siRNA介导的基因沉默效果。该项目将序列分析、siRNA的设计和验证等实验融合成一个小项目“利用RNA干扰技术沉默基因表达”,要求学生全程自己动手完成所有实验,强调对学生能力的培养和强化学生对RNA干扰机制和过程的理解。本文介绍了该课程的主要内容,以及本实验设计的目的和意义,为RNA干扰在分子遗传学实验课、现代分子生物学实验课或现代生物技术实验课等相关实验课程的教学提供参考。
1 课程内容设计
该课为现代生物技术实验课,自2014年开始教学,授课对象为三年级的本科生,是生物技术专业的必修课,生物科学和生物信息专业的选修课。整个实验课程的内容是一个小设计型实验项目“利用RNA干扰技术沉默基因的表达”。首先让学生选择感兴趣的靶基因,查找相关信息,并分析序列、结构等,让学生参与实验的设计。其次,由于RNA干扰的作用机制中介导基因沉默的是siRNA,化学合成的siRNA也用于基因功能的研究[18,19]和siRNA药物的研发[8,9,10],本课程就让学生设计siRNA,然后由公司合成,待收到合成的siRNA后,将其转染进细胞,然后检测siRNA对靶基因表达的影响,从而增加学生对RNA干扰机制的理解。该课让学生全程自己操作完成所有实验,更好地锻炼学生的动手能力和分析能力。课程的主要内容包括靶基因的挑选和分析、siRNA和引物设计、引物扩增效率检测、细胞培养、转染、细胞总RNA的提取和检测、cDNA合成和基因表达检测等(图1)。图1
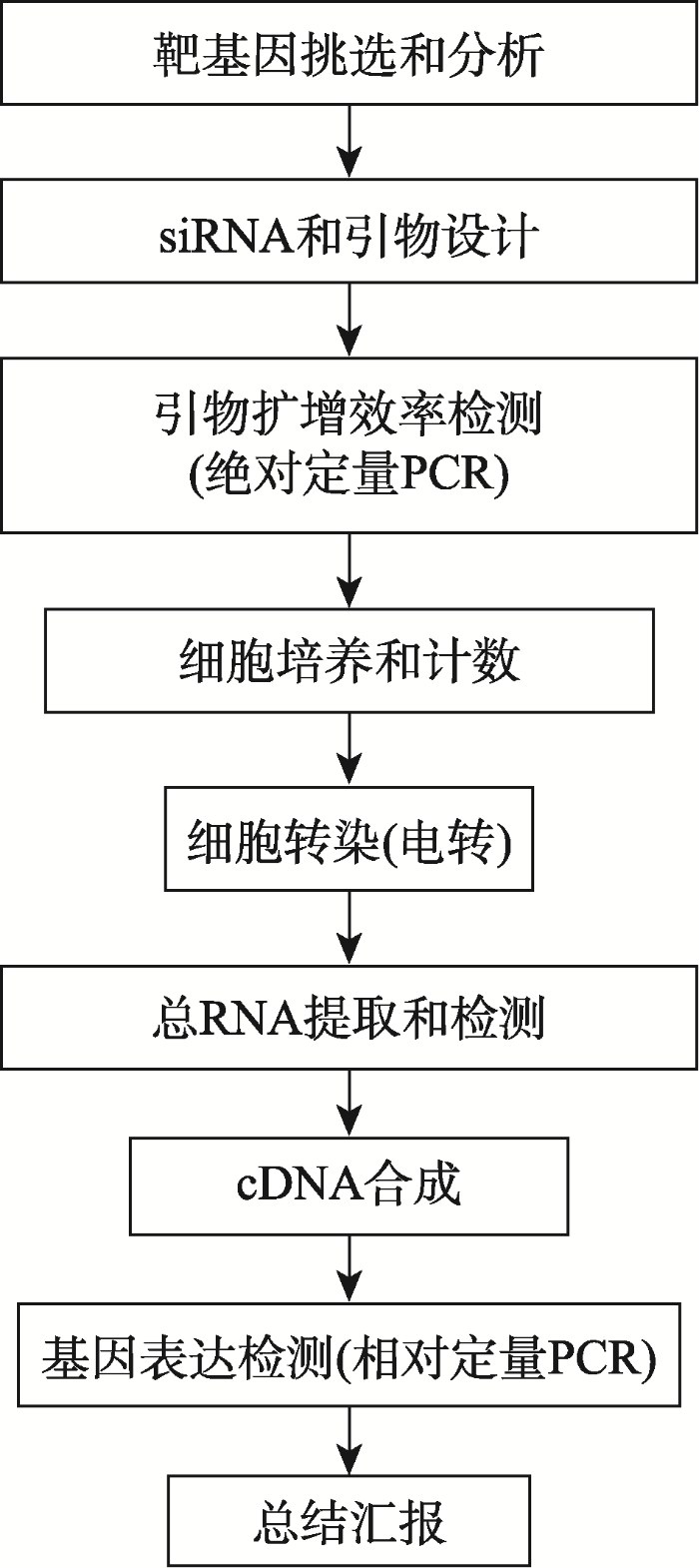 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1课程实验流程图
Fig. 1Flow chart of experiments in the course
学生设计的siRNA是利用在线算法预测的,未必真正有效。为了让学生验证自己的实验操作没问题,课程提供了一对阴性对照siRNA和一对靶向Gapdh且已验证过的siRNA作为阳性对照siRNA。若学生敲低了阳性对照基因(Gapdh)的表达,敲低效率在30%以上,且P<0.05,说明学生的实验操作是成功的。课程对学生设计的siRNA能否起到介导沉默的作用不做要求,但设定靶基因表达被敲低30%以上才说明siRNA有效。若学生设计的siRNA有很好的沉默效果,有兴趣继续往下研究,可以跟教师商量实验方案后,利用课后时间继续深入实验。
考虑到本科生的上课时段是固定的,课程将项目内容分解成了8次课,包括7次实验课和1次总结汇报课,基本上每次都可以在固定的4学时教学时段内完成教学,共约32~36学时,适合本科生的时间安排。为了增强教学效果,课程实行小班教学,每个班10~12人,2人一组,共5~6组,如果学生人数多会多开几个班级。具体课程内容和安排见表1。
Table 1
表1
表1 课程内容和安排
Table 1
| 课次 | 实验内容 | 学时数 | 课程内容 | 教师准备工作 |
|---|---|---|---|---|
| 1 | 靶基因挑选和 分析 | 4(也可以2学时, 让学生在 课后分析) | (1)介绍项目内容及相关背景知识 (2)介绍如何应用数据库和工具分析基因的表 达、序列、结构等信息 (3)指导学生查找感兴趣的靶基因并分析其 表达、序列和结构等信息 | (1)检查在线资源和工具的正常使用 (2)提醒学生带笔记本电脑 |
| 2 | SiRNA和 引物设计 | 4 | (1)介绍siRNA和qPCR引物的设计原则,以 及如何应用在线资源设计siRNA和引物 (2)介绍如何分析siRNA和引物的特异性;并 分析其对应基因结构的位点 (3)指导学生当堂完成设计和分析 | (1)检查在线资源和工具的正常使用 (2)提醒学生带笔记本电脑 (3)课后一一检查学生交上来的分析 结果,并把siRNA和引物发给 公司合成 |
| 3 | 引物扩增 效率检测 | 4 | (1)介绍采用qPCR检测引物扩增效率的原理、 操作和相关数据分析 (2)指导学生溶解引物,梯度稀释cDNA模板 和完成qPCR实验 | (1)准备3T3-L1细胞的cDNA, 并预实验检测其质量 (2)准备试剂盒和灭菌水等 (3)预约定量PCR仪2~3台/班 (4)课后及时分析学生数据;安排结果 不好的学生补做或重新设计引物或 换靶基因(如果表达量不高的话) |
| 4 | 细胞培养和 计数 | 4 | (1)介绍细胞培养的原理和常规操作, 细胞生长状态分析 (2)指导学生熟练完成细胞的消化、计数和 传代等操作 (3)第2天指导学生观察细胞生长状态 | (1)准备3T3-L1细胞 (2)准备培养液、胰酶、PBS和培养 皿等 (3)准备细胞计数仪 |
| 课次 | 实验内容 | 学时数 | 课程内容 | 教师准备工作 |
| 5 | 细胞转染 | 4 | (1)介绍电穿孔法转染细胞的原理、 影响因素和操作 (2)指导学生完成细胞转染实验 (3)指导学生第3天用Trizol试剂裂解细胞, 收集细胞裂解液,置-80℃冰箱保存 | (1)准备3T3-L1细胞 (2)准备细胞培养液、胰酶、PBS、 培养板、电转试剂盒、Trizol试剂、 12孔板等 (3)准备1~2台电转仪/班 |
| 6 | 细胞总RNA的 提取和检测; 以及cDNA 合成 | 6 | (1)介绍细胞总RNA提取和检测的原理、 操作、注意事项和结果分析 (2)介绍逆转录反应的原理和操作步骤; (3)指导学生完成所有实验 备注:学生做最后一次定量PCR,未必都能一次成功。为防止RNA反复冻融导致cDNA质量不好,本次实验直接合成双份cDNA,一份cDNA预备给学生重做最后一次定量PCR | (1)准备RNA提取和检测的常规试剂 和耗材,如氯仿-异戊醇、70%乙醇、 DEPC水、胶染料、逆转录试剂盒 等;无菌、无DNA酶、无RNA酶 的枪头和1.5 ml离心管等 (2)准备高速冷冻离心机、电泳仪、 凝胶成像系统、PCR仪等 |
| 7 | 基因表达检测 | 6 | (1)介绍相对定量PCR原理、操作步骤和 注意事项、数据分析等 (2)指导学生完成实验 | (1)准备qPCR试剂盒 (2)预约至少2~3台定量PCR仪/班 (3)课后及时分析学生数据;安排结 果不好的学生重做qPCR |
| 8 | 汇报 | 4(汇报时间缩短些 也可以2学时) | 学生总结汇报 | 提前熟悉每组学生的数据,教师点评 |
新窗口打开|下载CSV
2 代表性结果
以2018年第五组的实验为例,该组同学选择的基因为小鼠(Mus musculus)的长链脂酰辅酶A合成酶1 (acyl-CoA synthetase long-chain family member 1, Acsl1),与细胞内长链脂肪酸代谢有关。由NCBI数据库查得该基因的mRNA (transcript variant 2)序列编号为NM_ 007981.4。由UniProt的Genevisible数据库查得该基因在3T3-L1细胞系中高表达(图2),适合进行后续的RNA干扰实验。图2
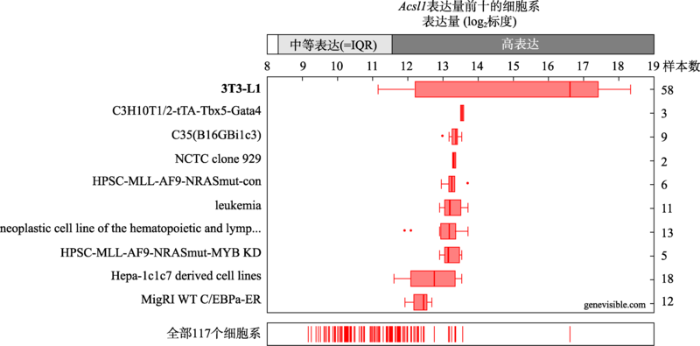 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2Acsl1基因在不同细胞中的表达水平
来源于UniProt基因表达的Genevisible数据库P41216。
Fig. 2Expression levels of the Acsl1 gene in different cell lines
首先应用Thermo Fisher Scientific公司提供的免费在线资源BLOCK-iTTM RNAi Designer设计2对siRNA,序列如表2。用NCBI 上的Primer-BLAST[20]设计定量PCR引物1对,从PrimerBank[21]中查找引物1对,序列见表3。找出siRNA和引物对应基因结构上的位置见图3。
Table 1
表2
表2 siRNA序列
Table 1
| siRNA | 基因 | 序列(5°→3°) | 来源 |
|---|---|---|---|
| ACSL1 siRNA 1 | Acsl1 | s: CCAGCCCUAUGAGUGGAUUTT | 第五组设计 |
| as: AAUCCACUCAUAGGGCUGGTT | |||
| ACSL1 siRNA 2 | Acsl1 | s: GGAUGCUUCUCUUACUCAATT | 第五组设计 |
| as: UUGAGUAAGAGAAGCAUCCTT |
新窗口打开|下载CSV
Table 3
表3
表3 RT-PCR引物序列
Table 3
| 引物 | 基因 | 序列(5°→3°) | 来源 |
|---|---|---|---|
| mACSL1-1 | Acsl1 | F: TGCCAGAGCTGATTGACATTC | PrimerBank ID: 31560705a1 |
| R: GGCATACCAGAAGGTGGTGAG | |||
| mACSL1-2 | Acsl1 | F: AGCTCTGGAGGACCTTGGAA | 第五组设计 |
| R: CATTGCTCCTTTGGGGTTGC |
新窗口打开|下载CSV
图3
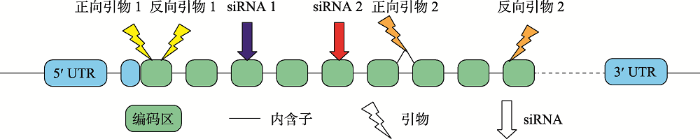 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3小鼠Acsl1基因结构示意图
引物和siRNA对应基因结构的位点分别用不同图形标记。
Fig. 3Schematic diagram of the mouse Acsl1 gene structure
接下来采用定量PCR检测引物的扩增效率和特异性。先将引物稀释到工作浓度,置冰上备用。然后将小鼠3T3-L1细胞的cDNA (教师预先准备)进行浓度梯度的稀释:1;1:5;1:10;1:25;1:125;1:625;1:3125 (选做),做实时定量PCR实验,最后做数据分析。以lg cDNA的相对浓度为横坐标,荧光强度达到阈值的PCR循环数CT值为纵坐标,做标准曲线。再根据公式E=10-1/slope-1计算引物的扩增效率。该公式中E为扩增效率;slope为标准曲线的斜率。代表性结果如图4。
图4
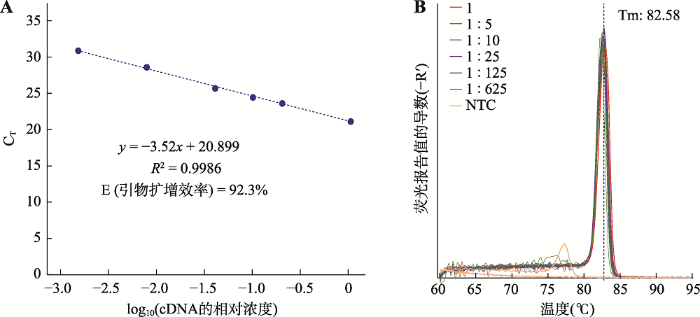 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4定量PCR引物检测结果
A:引物mACSL1-2扩增标准曲线,E为计算的引物扩增效率;B:mACSL1-2扩增熔解曲线。
Fig. 4Results for qPCR primer testing
在熟练掌握细胞消化、计数等操作的基础上,将4对siRNA (阴性对照siRNA、阳性对照RNA和2对设计的siRNA)分别转染到3T3-L1细胞。每对siRNA做3个复孔,共12个孔。电转后将细胞培养约48h。用Trizol试剂裂解细胞,然后参照Trizol试剂的说明书提取细胞总RNA,通过非变性琼脂糖凝胶电泳检测RNA的完整性(曾试过甲醛变性胶检测RNA,但配制甲醛变性胶时甲醛刺鼻,不利于学生健康,后来改用琼脂糖凝胶电泳) (图5),同时利用超微量紫外/可见分光光度计检测RNA的浓度和纯度,随后将RNA逆转录成cDNA,置于-20℃冰箱保存。
图5
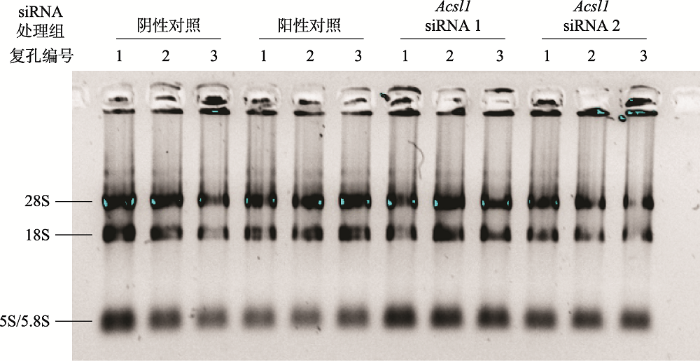 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5细胞总RNA非变性琼脂糖凝胶电泳图
Acsl1 siRNA1,2:为转染Acsl1 siRNA 的编号;阴性对照:为转染NC siRNA 组;阳性对照:为转染 Gapdh siRNA组;1、2、3:各处理组复孔编号。
Fig. 5Non-denaturing agarose gel electrophoresis of total RNAs
最后采用相对定量PCR检测mRNA的表达量,应用2-ΔΔCT方法计算mRNA的表达情况[22]。根据结果做柱形图,并做单因素方差分析,结果如图6。
图6
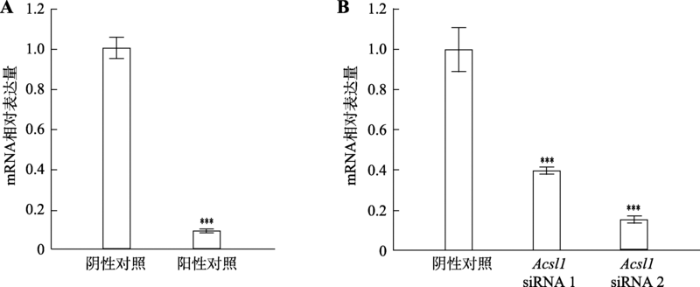 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6敲低效果比较图
A:Gapdh mRNA在阴性对照和阳性对照中的相对表达情况;B:Acsl1 mRNA在阴性对照和实验组中的相对表达情况。
***:P<0.001,差异极显著。
Fig. 6The comparison of expression levels between knockdown and control groups
3 实验教学总结
该课程从2014年开展至今5年,教学细节逐步完善。我们统计了近3年(2016~2018年)同学们的实验结果(表4),大多数学生都能从头到尾顺利完成所有实验,少数同学需要换靶基因和重做定量PCR。50%的实验组设计的2对siRNA均能有效敲低靶基因的表达;约83%的实验组至少有1对设计的siRNA有明显敲低效果。筛选到有效siRNA的实验组一般阳性对照siRNA的敲低效果也很明显(代表性结果见图6)。教学实践结果表明项目的难易程度适合高年级本科生。Table 4
表4
表4 近3年(2016~2018年)学生实验结果统计
Table 4
| 年度 | 组数 | |||
|---|---|---|---|---|
| A+ | A | B | C | |
| 2016 | 4 | 3 | 3 | 1 |
| 2017 | 7 | 6 | 4 | 0 |
| 2018 | 15 | 8 | 0 | 1 |
| 小计 | 26 | 17 | 7 | 2 |
新窗口打开|下载CSV
学生必须在第八次课上做一次总结汇报,然后写一份实验报告,检测他们对实验的理解情况,也锻炼他们的口头和书面表达能力。从汇报和实验报告中发现,学生对项目背景、材料与方法、实验操作过程和各阶段的实验结果都有清楚的认识和自己的感悟。
4 教学效果
4.1 增强了学生对序列和RNA干扰机制的理解
与以往RNA干扰实验的教学设计不同的是,本实验课程让学生参与实验的设计。学生选择靶基因,利用免费的在线资源设计siRNA,然后自己全程动手完成所有实验验证其设计。课后学生反馈该实验课的设计感和参与感都很强。在这个过程中,学生学会了查找基因的相关信息和使用一些序列分析工具和数据库。这些分析让学生印象深刻,很有收获,对序列、外显子和内含子等概念有了更深刻和直观的认识,也加深了对小分子RNA介导RNA干扰的机制的理解。还有学生在分析一篇已发表的科技论文时,惊奇地发现文中的序列跟实验材料的物种不相符,数据不可信!21世纪是基因组信息爆发的时代。作为新时代的本科生,非常有必要了解和掌握一些常见的基因序列分析技术和数据库的应用能力。本课程是一个将生物信息分析基础技术与实验课程相结合教学的一个有益探索,相信这也是现代生物实验教改与时俱进的一个方向。
4.2 通过项目型实验课程锻炼学生的动手能力和分析能力
本科生的上课时段是固定的,较难在实验课中引入一个较为完整的项目,因此常规本科实验课程中每个实验大都是独立、相互不影响的。该课程以项目型实验课程的形式开设,融合进来的知识和技术有RNA干扰、电穿孔、定量PCR技术及其应用、RNA提取、检测和逆转录、如何应用数据库或在线资源查找基因序列、分析基因结构、设计siRNA和定量PCR的引物,等等。该实验教学将这些整合成一个小项目“利用RNA干扰技术沉默基因的表达”。项目内任何一个实验的失败都会影响最终的实验结果,学生需要准确地完成所有实验,非常锻炼动手能力。该项目还设计了阴性和阳性siRNA对照,qPCR中必须有内参基因的扩增,对照和内参若做失败了,实验就失败了。这些让学生深刻体会到对照和内参都是不可或缺的,也增加了学生严谨的思维分析能力和数据分析能力。课后学生反馈希望以后有更多类似的、结合现代技术的项目型实验课程。该课结束后,还有少数同学在以后的课题研究中碰到问题来求助任课教师。如有的同学采用化学试剂转染细胞效果不佳,返回教学实验室自己利用电转仪转染细胞;有的同学在课题中需要设计siRNA构建载体来请任课教师帮忙看看;有的同学在做定量PCR时碰到问题来咨询任课教师等等。这些说明本科生阶段有必要设立这样的实验课程,然而仅仅通过一次实验课程的学习还不能让他们全部都精通这些实验技术以应变各种应用中碰到的问题,本科生在这方面的实验教学训练还需要进一步加强。
4.3 该实验教学的推广性分析
该实验教学对学生的要求是学过生物化学与分子生物学实验课,最好修完细胞生物学实验课(内容应包含哺乳动物细胞培养)。历经几年的教学实践,我们发现未学习生物化学与分子生物学实验的同学做定量PCR实验很有难度,从未接触过哺乳动物细胞培养的同学,操作细胞需要多练练,以防止操作带来的污染和提高电转细胞的存活率。很多高校,尤其是开展高水平和双一流建设的大学,都具备该实验实施的软件和硬件。首先用于设计siRNA的在线工具是商家网站上免费提供的;分析序列的数据库和工具都是科研上常用的。其次是该课涉及的设备设施都是现代生物实验常用的。一个12人的小班需要的仪器有2台小型台式高速冷冻离心机、2台定量PCR仪、1台电转仪(也可以不用)和1个容纳8人以上的细胞培养房,很多高校都具备这个条件。如果学生人数多,教学设施设备数量不够,建议借用科研公共平台和科研实验室的设备;另外还可以采用学生错峰使用和春秋两季滚动开课等方式解决。有的高校若设施设备较多,可以设立人数多一些的班级。该实验教学采用了电穿孔法转染细胞,该方法常用于转染难转染的细胞。如果电转条件不具备,采用化学试剂转染细胞也可以取得较好的效果[18]。另外也可以换其他易于转染的细胞株。不同的教学实验室可以根据自己的条件调整该实验内容和安排,让更多学生受益。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 3]
URL [本文引用: 3]
[本文引用: 3]
[本文引用: 2]
URL [本文引用: 2]
URL [本文引用: 2]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
