 ,*南京农业大学食品科学技术学院, 南京 210095
,*南京农业大学食品科学技术学院, 南京 210095Changes of Protein N-glycosylation in the Growth of Arabidopsis thaliana and Effects of Enzymatic Deglycosylation on Root Development
Ting Wang?, Huanhuan Yang?, Hongwei Zhao, Josef Voglmeir, Li Liu ,*College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
,*College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China通讯作者: *E-mail:lichen.liu@njau.edu.cn
责任编辑: 白羽红
收稿日期:2020-09-29接受日期:2020-12-25网络出版日期:2021-05-01
| 基金资助: |
Received:2020-09-29Accepted:2020-12-25Online:2021-05-01

摘要
蛋白质N-糖基化修饰在植物生长发育中发挥重要作用。为探究蛋白质N-糖基化在拟南芥(Arabidopsis thaliana)整个生长周期中的变化规律以及去N-糖基化对拟南芥生根发育的影响, 通过N-糖链酶解和HPLC与MALDI-TOF-MS分析解析了不同生长时期的拟南芥Col-0植株的N-糖链组成(结构和含量)变化。以BSA溶液为阴性对照, 无菌去离子水为空白对照, 用N-糖酰胺酶(PNGase Rz)溶液处理拟南芥幼苗8小时; 然后继续在MS培养基中培养5天、10天, 测量主根长度并检测N-糖链组成的变化。结果显示, 从拟南芥中解析出12种N-糖链结构, 其中包括4个高甘露糖型和8个复杂型。在拟南芥整个生长周期中, 复杂型N-糖链含量始终高于高甘露糖型, 其中含木糖和岩藻糖的复杂型结构是N-糖链的主要组成, 而Man3XylFucGlcNAc2含量最高。高甘露糖型N-糖链含量由幼苗期的13.87%缓慢上升至抽薹期的19.02%, 盛花期回落至17.98%, 而在长角果成熟期快速下降至最低点2.36%, 衰老期再度小幅回升至5.23%。用高浓度糖酰胺酶液PNGase Rz处理后, 可观察到幼苗主根生长受到显著抑制, 且培养10天后仍然无法恢复正常; 而低浓度酶液处理组与阴性对照组差异不显著, 根长和生长状态基本正常。糖链分析结果显示, 与对照组相比, 高、低浓度酶液处理组的N-糖链组成均发生显著变化, 主要表现为高甘露糖型含量显著低于空白对照组, 同时随生长时间的延长该差异逐渐减小, 最终消失。研究表明, 拟南芥N-糖基化组成随着生长发育发生周期性变化, 且去糖基化酶处理能够瞬时影响拟南芥蛋白质N-糖基化修饰, 进而抑制根的发育。
关键词:
Abstract
N-glycosylation of proteins plays an important role in plant growth and development. This study explored the changes in protein N-glycosylation in Arabidopsis thaliana at different growth stages and its role in the root development. N-glycans of Arabidopsis Col-0 plants at different growth stages were enzymatically released with N-glycanase and analyzed by HPLC and MALDI-TOF-MS. In addition, Arabidopsis seedlings were treated with N-glycanase, PNGase Rz, for 8 hours before further cultivation in MS medium for five and ten days. The group treated with BSA solution was used as the negative control and the group treated with sterile deionized water was used as blank control. The changes in the primary root length and N-glycosylation composition of the seedlings were measured after treatment. A total number of 12 N-glycan structures were deduced from Arabidopsis, including 4 high-mannose types and 8 complex types. Throughout the entire period, the content of complex type N-glycan was always higher than that of high-mannose; the complex structures modified with xylose and fucose were the dominant component, among which Man3XylFucGlcNAc2 is the highest. The changes of high-mannose N-glycan were as follows: the content steadily increased from 13.87% (seedling stage) to 19.02% (bolting stage), slightly decreased to 17.98% (flowering stage), and dramatically dropped to 2.36% (longhorn ripening stage), then returned 5.23% (aging stage). After treatment with PNGase Rz at high concentration, a significant inhibition of the primary root’s growth was observed, which could not be recovered after cultivation in MS medium for ten days. However, no statistical differences of root length and growth state were found in the treatment group of low concentration (0.05 mg·mL -1), compared with the negative group. N-glycan analysis of seedlings revealed that compared with the control, both treatment groups showed significant changes in the composition of N-glycans. Especially, the total content of high-mannose N-glycans was dramatically lower than that of the blank control group. Meanwhile, these glycoform differences shrank with prolonged time of cultivation and finally disappeared. In conclusion, Arabidopsis thaliana has unique pattern of N-glycosylation during the whole growing period; and glycanase treatment could intermediately alter the N-glycosylation pattern and subsequently inhibit the development of root.
Keywords:
PDF (2123KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
王婷, 羊欢欢, 赵弘巍, JosefVoglmeir, 刘丽. 蛋白质N-糖基化在拟南芥生长周期中的变化规律及去糖基化对根发育的影响. 植物学报, 2021, 56(3): 262-274 doi:10.11983/CBB20163
Wang Ting, Yang Huanhuan, Zhao Hongwei, Voglmeir Josef, Liu Li.

N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链。根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (Ghazarian et al., 2011)。在植物中, 蛋白质N-糖基化修饰影响蛋白质的生物合成和功能(Bao et al., 2001)、免疫过程 (Saijo, 2010)、细胞壁生物合成(Wei et al., 2011)和耐盐胁迫(Shen et al., 2014; Wang et al., 2015)、激素水平或转运的组织特异性(Kang et al., 2008; Nagashima et al., 2018)以及个体的生长发育(Lindner, 2015)等, 而植物复杂型N-糖链中包含的核心α-1,3岩藻糖还与过敏反应相关(Altmann, 2007)。
N-糖基化修饰在植物N-糖链的重要生理作用与其结构密切相关。在植物发育的各阶段, 从种子萌发、生长到果实成熟, 植物N-糖链组均会发生特征性的结构和含量变化, 形成特征性的指纹图谱。Kimura和Matsuo (2000)研究表明, 银杏(Ginkgo biloba)种子在萌芽阶段, N-糖链是以Man3Xyl1Fuc1GlcNAc2为主的复杂型结构, 且不含高甘露糖型。Nakamura等(2008)发现在果实成熟阶段, 高甘露型游离N-聚糖含量随着果实成熟而增加, 且N-糖链Man8-9GlcNAc1含量上升最显著。虽然一些拟南芥N-糖基化的位点和结构特征已有研究报道(Xu et al., 2016; Zeng et al., 2018), 但是对于拟南芥整个生命周期N-糖基化指纹图谱的系统研究尚属空白。本研究以拟南芥为对象, 研究其5个生长阶段(幼苗期、抽薹期、盛花期、长角果成熟期和衰老期)的N-糖链组成变化规律。
以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(Strasser et al., 2006; Liebminger et al., 2011; Kimura et al., 2011; Kato et al., 2018)。Shen等(2014)比较了糖基化位点突变型和野生型拟南芥原生质体中液泡蛋白转运作用的差异, 发现无N-糖链修饰降低了VSR受体蛋白与货物蛋白的亲和能力, 进而影响货物蛋白转运进入液泡。Kang等(2008)通过比较拟南芥高尔基体N-乙酰氨基葡萄糖转移酶突变体cgl1与野生型在耐盐胁迫上的差异, 表明复杂型N-聚糖的成熟是植物抗逆性的必要条件。上述结果证明, N-糖链代谢途径的各种糖酶在植物生长发育中发挥至关重要的作用。然而, 研究表明某些糖酶基因的突变或缺失会影响植株早期发育, 导致畸形甚至死亡, 因此无法观察到该突变株生长中后期的变化情况。Koiwa等(2003)发现, 寡糖基转移酶STT3能够特异性调节拟南芥根系对盐胁迫的响应, 而STT3a-1、STT3b-1的双突变会导致拟南芥胚胎或配子体致死。由此可见, 使用基因突变的方法研究N-糖基化修饰对植物生长发育的影响具有一定的局限性, 尤其是对植物生长造成致死作用的糖酶基因。因此, 本研究采用一过性的N-糖酰胺酶(PNGase Rz)体外处理来去除N-糖基化, 在不阻断糖基化合成途径的前提下, 探讨N-糖基化修饰缺失对拟南芥幼苗的瞬时和后续生长的影响。
1 材料与方法
1.1 植物材料
幼苗期、抽薹期、盛花期、长角果成熟期和衰老期的拟南芥(Arabidopsis thaliana L.)植株(各时期对应发芽后10、25、40、55和70天)购于唯地生物科技有限公司。选用拟南芥Col-0生态型的种子, 置于含有8%次氯酸钠(95%乙醇稀释)的溶液中振荡, 表面灭菌10分钟, 吸除灭菌液, 加入1 mL 95%乙醇, 颠倒振荡2分钟, 重复5-6次, 洗净种子表面残留的次氯酸钠溶液, 吸除洗涤液, 在超净工作台上挥发掉残留乙醇, 随后将种子均匀撒播于MS培养基上。将培养基置于4°C避光冰箱中保存48小时完成种子的春化作用。春化的种子在温室继续培养4天。培养条件: 22°C光照14小时/21°C黑暗8小时, 相对湿度为40%-60%。取幼苗用于后续实验。
1.2 试剂处理
PNGase Rz的表达纯化参照王梦等(2017)的方法。纯化所得酶样先用PD-10脱盐柱脱盐, 再经透析袋冰浴透析12小时, 以去除酶液中的咪唑和三羟甲基氨基甲烷(Tris)等盐离子。22°C光照条件下将拟南芥幼苗分别在以下溶液中孵育8小时: 无菌去离子水(空白对照组), 0.05和0.5 mg·mL-1牛血清蛋白(bovine albumin, BSA)溶液(阴性对照组), 0.05和0.5 mg·mL-1 PNGase Rz溶液(实验组)。所有溶液均经过0.20 μm除菌膜过滤以确保无菌, 各组分别标记为Blank、BSA0.05、BSA0.5、E0.05和E0.5。孵育8小时后, 将幼苗转移到含有无菌液体MS培养基的24孔板上(每孔1 mL MS, 1-2株苗), 于温室继续培养5天和10天。分别收集孵育8小时、生长5天和10天的样本, 拍照, 于-80°C冰箱保存。
1.3 主根长的测量
收集培养8小时、5天和10天的幼苗。取含有刻度线的方形细胞培养皿, 倒入热琼脂水(琼脂浓度为6 g·L-1), 待琼脂水冷却凝固后, 将幼苗平铺并测量根长。1.4 N-糖链的制备
1.4.1 蛋白的制备取不同生长期植株和酶处理幼苗于研钵中加液氮研磨3次。将粉末立刻分装入3个EP管中, 每管装入100 mg。向EP管中加200 μL三氯乙酸(trichloroacetic acid, TCA)溶液(40%, m/v)并充分混匀以沉淀可溶性蛋白。在4°C、14 000 ×g离心20分钟, 弃上清, 沉淀用超纯水重悬。再次离心去上清, 用超纯水洗涤6次直至用pH试纸检测上清液pH值为7, 以去除所有游离糖。
1.4.2 N-糖链的酶解释放
向洗去游离糖的蛋白沉淀中加入240 μL超纯水和80 μL柠檬酸-磷酸缓冲液(500 mmol·L-1, pH6.0), 振荡混匀, 95°C变性10分钟。冷却后再向反应体系中加入80 μL PNGase Rz (3 mg·mL-1), 25°C、每分钟400转振荡酶解过夜, 95°C加热5分钟终止反应。
1.4.3 N-糖链的纯化、标记和UPLC检测
N-糖链的纯化、标记和UPLC检测方法参考文献Wang等(2017a)所述。将1.4.2节中所得酶解反应液于4°C、14 000 ×g离心20分钟, 收集上清, 沉淀用400 μL超纯水重悬后离心取上清, 合并所有上清液, 加入SupelcleanTm ENVI-CarbTM预装碳柱, 然后加入3 mL去离子水, 滴净, 再依次加入1.5 mL 20%乙腈和1.5 mL 40%乙腈溶液, 分别收集20%和40%乙腈洗脱液, 合并洗脱液并用真空离心旋干机旋干。在干燥样品中加入10 μL 2-AB标记液(35 mmol·L-1 2-AB、0.1 mol·L-1氰基硼氢化钠溶于DMSO-冰醋酸混合溶液(7:3, v/v), 充分混合), 65°C金属浴标记4小时。反应后加入30 μL乙腈, 12 500 ×g离心2分钟, 取上清, 使用超高效液相进行分析。色谱条件为Acquity BEH糖化柱(Waters, 1.7 μm, 2.1×150 mm), 柱温60°C, 流速为0.5 mL?min-1; 进样量为40 μL; 流动相A为50 mmol·L-1甲酸铵缓冲液(pH4.5); 流动相B为乙腈; 荧光检测器波长为Ex/Em=330/420 nm; 洗脱程序: 0-6分钟流动相A由5%线性升至12%, 6-45分钟, 流动相A比例进一步线性提升至44%, 46-49分钟, 流动相A提升为100%并维持1分钟, 51-58分钟流动相A比例降至5%并维持7分钟。以2-AB标记的葡聚糖(Dextran, 50 mmol·L-1)作为标准参照物。以2-AB标记的麦芽五糖为标准品, 以峰面积和浓度绘制标准曲线, 对所得N-糖链进行定量。
1.5 N-糖链的MALDI-TOF-MS检测
根据UPLC谱图, 对色谱峰进行收集, 使用真空离心干燥机干燥。在干燥样品中加入2 μL去离子水, 充分混匀, 取出1 μL与基质2,5-二羟基苯甲酸(DHB)混匀, 点样于靶板上, 自然风干后, 使用质谱检测。辅助激光解析电离飞行时间质谱(matrix assisted laser ionization time of flight mass spectrometry, MALDI- TOF-MS)的检测方法参照文献(Du et al., 2015; Wang et al., 2017b)所述, 使用Bruker Autoflex Speed instrument质谱仪进行检测。以马心肌肌红蛋白的胰蛋白酶酶解肽段为标准品校正标准物。正离子模式质谱条件为: 离子加速电压20 kV, 质荷比扫描范围为800-3 000 m/z, 采集数据所用激光能量为60%。1.6 数据分析
采用Bruker Flexanalysis 3.3分析软件对质谱数据进行处理, 并使用GlycoWorkbench糖结构分析软件对质谱结果进行推导。采用方差分析结合Duncan’s多重比较进行统计学分析, 按照多重比较标记方法标记字母, 不同字母代表差异显著(P<0.05)。用平均值±标准差对洗脱峰的相对峰面积进行比较, 每组3个平行重复。2 结果分析
2.1 拟南芥不同生长时期N-糖链组成的变化
2.1.1 N-糖链的结构根据液相检测结果(图1), 收集在15-40分钟之间的色谱峰, 并根据标准葡聚糖对各色谱峰的葡萄糖单位(GU)进行计算。我们共收集得到14个液相峰, 其GU值分别为4.86、5.03、5.39、5.56、5.90、6.10、6.35、6.58、6.82、6.97、7.47、7.86、8.73和9.44。将各峰GU值与已有数据进行比较, 并与质谱分析结果互相验证(Du et al., 2015; 王梦等, 2017), 得到12种不同的N-糖链结构(表1)。其中2号峰对应的质荷比为806.9, 其分子量低于N-糖链核心五糖的分子量, 为非N-糖链。3号峰由于含量较低未能检测到相应质谱信号, 但是根据其GU值以及实验室前期结果(王梦等, 2017), 推测其结构为GlcNAcMan3XylGlcNAc2。11号峰根据质荷比推测其N-糖链可能存在3种不同同分异构体, 其中2个是复杂型糖, 1个是杂合型糖。其中杂合型糖此前仅在番木瓜(Carica papaya)中检测到(Wilson et al., 2001; Du et al., 2015), 故推测11号峰是复杂型糖(GalGlcNAc2Man3GlcNAc2)。由于该色谱峰的计算GU值(7.47)与GalGlcNAc2Man3GlcNAc2对应的理论GU值(6.2)不符, 故推测该峰为非
N-糖链。综上, 我们从拟南芥中共鉴定出12个N-糖链结构, 分属高甘露糖型和复杂型2种结构, 其中高甘露糖型结构有4个, 复杂型结构有8个, 含木糖和岩藻糖结构5个, 只含木糖结构3个, 未检测到带有Lewis抗原决定簇的糖型或杂合型糖。
图1
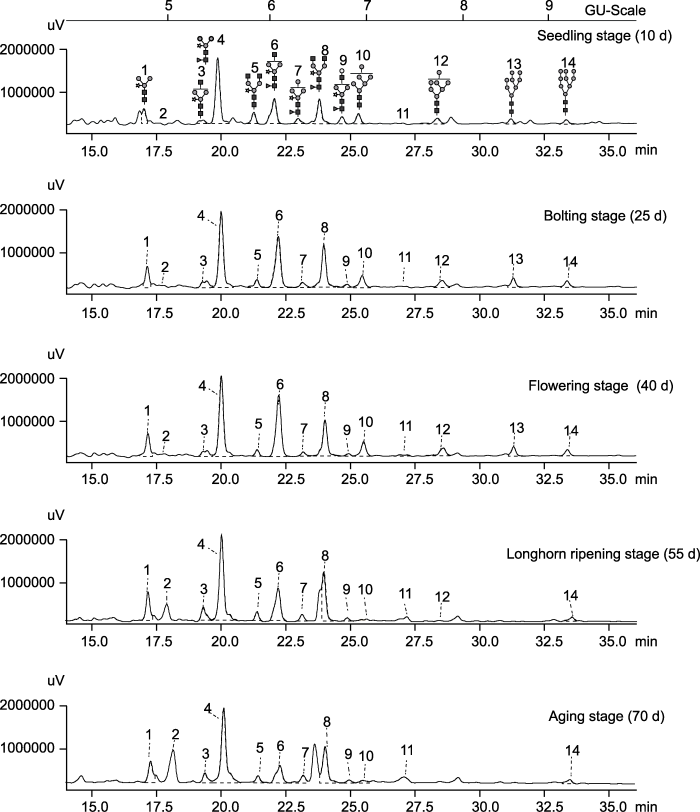 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同生长时期拟南芥N-糖链液相色谱图
Figure 1HPLC spectra of N-glycans of Arabidopsis thaliana at different growth stages
Table 1
表1
表1拟南芥糖蛋白N-糖链结构
Table 1
| Number | Retention time (min) | GU value | The theoretical electron charge-mass ratio (m/z) | Detection value of charge-mass ratio (m/z) | Name | Abbreviation |
|---|---|---|---|---|---|---|
| 1 | 17.2 | 4.86 | 1185.43 | 1185.51 | Man3XylGlcNAc2 | MMXF |
| 2 | 17.9 | 5.03 | - | 806.99 | Unknown | - |
| 3 | 19.4 | 5.39 | 1388.51 | - | GlcNAcMan3XylGlcNAc2 | GnMXF |
| 4 | 20.1 | 5.56 | 1331.49 | 1331.39 | Man3XylFucGlcNAc2 | MMX |
| 5 | 21.4 | 5.90 | 1591.558 | 1591.74 | GlcNAc2Man3XylGlcNAc2 | GnGnX |
| 6 | 22.3 | 6.10 | 1534.57 | 1534.70 | GlcNAcMan3XylFucGlcNAc2 | GnMX |
| 7 | 23.2 | 6.35 | 1493.53 | 1494.16 | Man4XylFucGlcNAc2 | M4XF |
| 8 | 24.0 | 6.58 | 1737.64 | 1737.93 | GlcNAc2Man3XylFucGlcNAc2 | GnGnXF |
| 9 | 24.9 | 6.82 | 1696.62 | 1697.37 | GalGlcNAcMan3XylFucGlcNAc2 | GGnXF |
| 10 | 25.5 | 6.97 | 1539.54 | 1540.16 | Man6GlcNAc2 | M6 |
| 11 | 27.3 | 7.47 | - | 1620.53 | Unknown | - |
| 12 | 28.6 | 7.86 | 1701.89 | 1701.74 | Man7GlcNAc2 | M7 |
| 13 | 31.4 | 8.73 | 1863.65 | 1863.86 | Man8GlcNAc2 | M8 |
| 14 | 33.4 | 9.44 | 2025.70 | 2025.88 | Man9GlcNAc2 | M9 |
新窗口打开|下载CSV
2.1.2 不同生长时期拟南芥N-糖链含量和组成
以麦芽五糖为外标对不同生长时期的拟南芥N-糖链总含量进行计算(图2A), 结果显示, 拟南芥幼苗期、抽薹期、盛花期、长角果成熟期和衰老期的N-糖链总量分别为6.69、11.97、15.81、12.69及8.73 nmol·g-1, 变化趋势呈先增后降, 在抽薹期达到峰值。为进一步比较不同N-糖型的组成变化, 以结构确定的12个峰的面积和为总面积, 计算各峰的相对含量(表2)。结果表明, 在整个生长发育阶段, 拟南芥N-糖链的结构种类未发生变化, 只含有复杂型和高甘露糖型两类。不同时期拟南芥的糖型组成变化趋势(图2B)表现为: 复杂型糖始终是主体成分(80.98%-97.64%), 其中含木糖和岩藻糖的结构始终是拟南芥N-糖谱的主要组分; 高甘露糖型和复杂型N-糖链之间的比例随生长时期呈规律性变化, 生长后期(长角果成熟期和衰老期)高甘露糖型含量显著低于前3个生长时期。其中高甘露糖型N-糖链的含量由幼苗期的13.87%缓慢上升到抽薹期的19.02%, 到成熟期快速下降至最低值2.36%, 到衰老期又小幅回升到5.23% (图2E)。相应的, 复杂型糖相对含量呈先下降后上升再下降的趋势, 即由幼苗期的86.13%下降到抽薹期的80.98%, 在长角果成熟期又上升到最高值97.64%, 到衰老期又下降到94.77% (图2C, D)。
图2
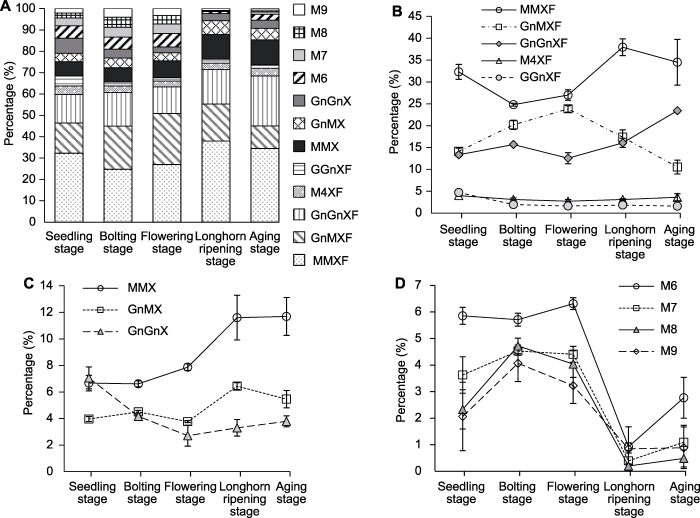 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同生长时期拟南芥N-糖链中不同糖型相对含量的变化
(A) N-糖链不同糖型的比例变化趋势; (B) 含木糖和岩藻糖复杂型N-糖链的比例变化趋势; (C) 仅含木糖复杂型N-糖链的比例变化趋势; (D) 高甘露糖型N-糖链的比例变化趋势。不同糖型缩写同
Figure 2The relative proportion of different N-glycans from Arabidopsis thaliana at different growth stages
(A) The changes of the proportions for each N-glycan structure; (B) The changes of the proportions of complex N-glycans with Xyl and Fuc; (C) The changes of the proportions of complex N-glycans only with Xyl; (D) The changes of the proportions of high-mannose N-glycans. The abbreviations of different N-glycans are the same as
Table 2
表2
表2拟南芥不同生长时期N-糖链中各类糖型的相对含量
Table 2
| N-glycans | Relative content (%) | ||||
|---|---|---|---|---|---|
| Seedling stage | Bolting stage | Flowering stage | Longhorn ripening stage | Aging stage | |
| Complex type with Xyl and Fuc | |||||
| Man3XylFucGlcNAc2 (MMXF) | 32.31±1.71 b | 24.79±0.33 c | 27.00±1.21 c | 37.96±1.92 a | 34.51±5.23 ab |
| GlcNAcMan3XylFucGlcNAc2 (GnMXF) | 14.11±0.75 d | 20.18±1.05 b | 23.83±0.74 a | 17.37±1.67 c | 10.53±1.58 e |
| Man4XylFucGlcNAc2 (M4XF) | 3.99±0.15 a | 3.11±0.36 ab | 2.70±0.40 b | 3.10±0.21 ab | 3.61±0.80 ab |
| GlcNAc2Man3XylFucGlcNAc2 (GnGnXF) | 13.33±0.42 b | 15.68±0.15 b | 12.55±1.26 b | 16.06±1.03 b | 23.44±0.12 a |
| GalGlcNAcMan3XylFucGlcNAc2 (GGnXF) | 4.69±0.36 a | 1.93±0.20 b | 1.61±0.29 b | 1.82±0.09 b | 1.58±0.36 b |
| Sum | 68.44±1.51 b | 65.69±0.98 b | 67.68±2.33 b | 76.31±3.13 a | 73.84±2.79 a |
| Complex type only with Xyl | |||||
| Man3XylGlcNAc2 (MMX) | 6.67±0.58 b | 6.62±0.23 b | 7.87±0.25 b | 11.59±1.68 a | 10.69±1.43 a |
| GlcNAcMan3XylGlcNAc2 (GnMX) | 3.96±0.18 cd | 4.51±0.10 c | 3.77±0.08 d | 6.44±0.26 a | 5.46±0.65 b |
| GlcNAc2Man3XylGlcNAc2 (GnGnX) | 7.06±0.82 a | 4.17±0.08 b | 2.71±0.79 bc | 3.30±0.62 bc | 3.80±0.41 c |
| Sum | 17.69±1.57 b | 15.29±0.41 bc | 14.34±0.70 c | 21.33±2.39 a | 20.94±2.79 a |
| Sum of complex | 86.13±2.95 b | 80.98±0.92 c | 82.02±1.65 c | 97.64±0.78 a | 94.77±0.94 a |
| High-mannose type | |||||
| Man6GlcNAc2 (M6) | 5.85±0.32 a | 5.71±0.24 a | 6.31±0.22 a | 0.92±0.15 c | 2.77±0.77 b |
| Man7GlcNAc2 (M7) | 3.63±0.69 b | 4.53±0.16 a | 4.41±0.30 ab | 0.39±0.30 c | 1.09±0.64 c |
| Man8GlcNAc2 (M8) | 2.33±0.74 b | 4.72±0.29 a | 4.04±0.50 a | 0.20±0.09 c | 0.48±0.32 c |
| Man9GlcNAc2 (M9) | 2.06±1.29 bc | 4.06±0.69 a | 3.23±0.67 ab | 0.84±0.83 c | 0.88±0.78 c |
| Sum of high-mannose | 13.87±2.95 b | 19.02±0.92 a | 17.98±1.65 a | 2.36±0.78 c | 5.23±0.94 c |
新窗口打开|下载CSV
2.2 PNGase Rz处理后植物表型的变化
用不同溶液对拟南芥幼苗孵育8小时后转入MS培养基中继续生长, 分别收集孵育8小时及继续生长5天和10天的幼苗, 拍照并统计主根长, 结果(图3A-C)显示, 处理后8小时, 各组间长势无显著差异, 而处理后第5天和第10天, 可观察到高浓度PNGase Rz酶液处理组(E0.5)的幼苗长势明显弱于其它4组。根据主根测量数据(图3D), 处理8小时, 低浓度BSA0.05对照组与去离子水对照组之间无显著差异; 而高浓度BSA0.5对照组与前两者相比, 根长较短且统计学差异显著, 表明短时间高浓度蛋白处理可能会对幼苗生长产生一定的抑制作用。此外, 虽然高、低浓度酶处理组(E0.5和E0.05)与对照组(Blank和BSA0.05)之间主根长存在显著差异, 但与高浓度蛋白对照组(BSA0.5)相比并无显著差异。继续培养5天, 低浓度处理组(E0.05)虽然根长略短于对照组, 但二者无显著差异; 而高浓度处理组(E0.5)的主根长度显著短于其余4组(包括所有对照组以及低浓度酶处理组), 且统计学差异显著(P<0.05)。处理后10天, 低浓度酶处理组(E0.05)主根长度与对照组(BSA0.05)基本一致, 且与其余对照组无显著差异; 而高浓度酶处理组(E0.5)仍可观察到主根长度明显短于其余4组(P< 0.05)。以上结果表明, 高浓度去糖基化酶处理幼苗能够明显抑制主根生长, 当浓度降低时, 抑制作用减弱。在后续生长阶段, 高浓度处理组(E0.5)在第5天可观察到明显的抑制现象, 继续生长至第10天, 差异依然存在, 表明幼苗无法在短时间内消除高浓度PNGase Rz去糖基化处理对幼苗主根生长的影响。图3
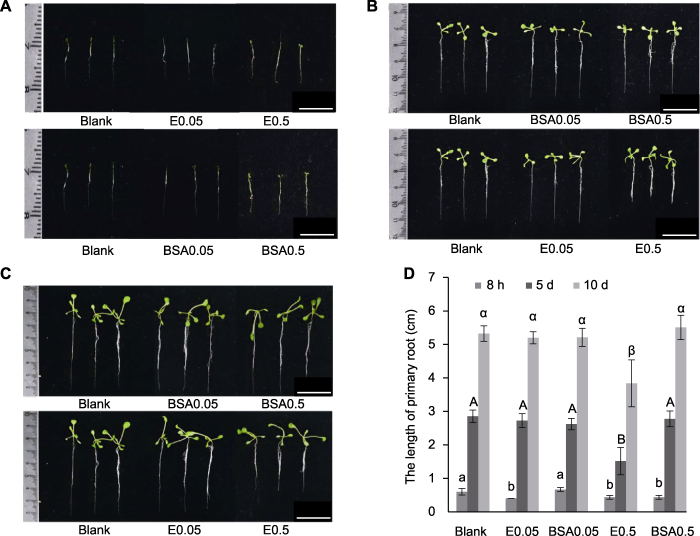 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同浓度PNGase Rz处理对拟南芥主根生长的影响
(A) 处理8小时的幼苗; (B) 第5天的幼苗; (C) 第10天的幼苗; (D) 用不同浓度PNGase RZ处理拟南芥8小时, 不同处理组各时间点主根长度的统计分析(不同字母表示差异显著)。Blank: 无菌去离子水; BSA0.05: 0.05 mg·mL-1 BSA溶液; BSA0.5: 0.5 mg·mL-1 BSA溶液; E0.05: 0.05 mg·mL-1 PNGase Rz溶液; E0.5: 0.5 mg·mL-1 PNGase Rz溶液。Bars=1 cm
Figure 3The influence of PNGase Rz with different concentrations on the growth of Arabidopsis primary root
(A) Seedlings cultured for 8 hours; (B) Seedlings in the fifth day of growth; (C) Seedlings in the tenth day of growth; (D) Statistical analysis of primary root length of Arabidopsis seedlings treated with different concentrations of PNGase Rz for 8 hours at different time points (different letters indicate significant dfferences). Blank: Sterile deionized water; BSA0.05: 0.05 mg·mL-1 BSA; BSA0.5: 0.5 mg·mL-1 BSA; E0.05: 0.05 mg·mL-1 PNGase Rz; E0.5: 0.5 mg·mL-1 PNGase Rz. Bars=1 cm
2.3 PNGase Rz处理后拟南芥N-糖链组成变化
分别收集孵育8小时、培养5天和10天的幼苗, 提取其蛋白质N-糖链, 使用2-AB标记并进行液相分析, 不同处理组的峰谱如图4所示。处理8小时后的各组样品液相色谱图显示, 各对照组之间未见明显差异, 与对照组(Blank、BSA0.05和BSA0.5)相比, PNGase Rz酶处理组(E0.05和E0.5)液相峰在保留27.5分钟以后其峰面积和峰高均出现一定程度的降低, 而在17.5-20.0分钟之间出现新的色谱峰; 处理后第5天, 除了个别峰的峰面积和峰高存在较小差异外, 酶处理组和对照组的HPLC谱图在峰数和保留时间上基本一致; 而处理后第10天, 对照组和酶处理组糖谱图之间的差异进一步缩小。图4
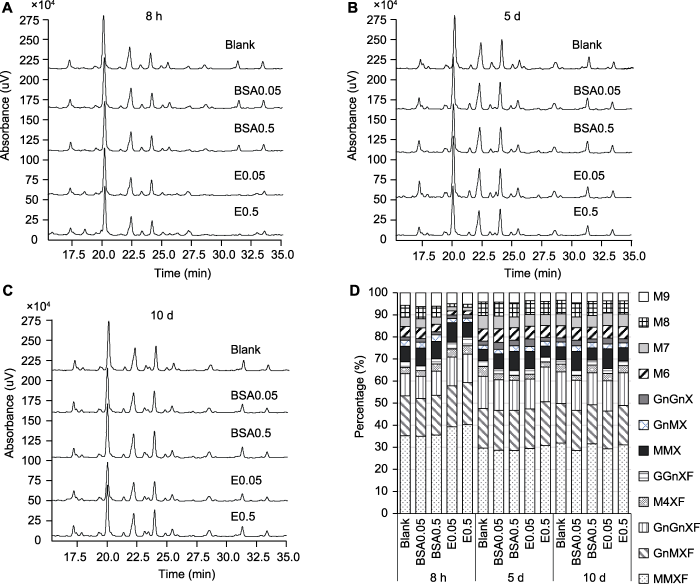 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4拟南芥不同处理组在3个生长点N-糖链液相色谱图和相对含量
(A) 8小时N-糖链HPLC色谱图; (B) 第5天N-糖链HPLC色谱图; (C) 第10天N-糖链HPLC色谱图; (D) N-糖链相对含量。不同糖型缩写同
Figure 4HPLC spectra of N-glycans from different groups at three growth points and the relative content of each N-glycan of Arabidopsis
(A) HPLC spectra of N-glycans at 8 h; (B) HPLC spectra of N-glycans at 5 d; (C) HPLC spectra of N-glycans at 10 d; (D) The relative content of different N-glycans. The abbreviations of dfferent N-glycans are the same as
为了量化不同时间点不同处理组之间拟南芥N-糖链组成的具体差异, 我们对各N-糖链液相色谱峰面积占比进行了分析, 结果(图4D)表明: 处理后8小时, 2个PNGase Rz酶处理组(E0.05和E0.5)含木糖和岩藻糖的复杂型N-糖链相对含量显著高于对照组, 而高甘露糖型相对含量显著低于对照组, 只含木糖的复杂型含量与对照组差异较小; 生长第5天, 2个酶处理组含木糖和岩藻糖的复杂型N-糖链的相对含量与对照组差异缩小, 高甘露糖型含量仍略低于对照组; 生长第10天, 2个酶处理组与对照组的糖型差异基本消失。不同糖型含量的变化(表3)表明, 在孵育8小时后, 3个对照组虽然在表型上相似, 但是其不同N-糖型含量存在一定差异, 尤其是高甘露糖型N-糖链的含量。高浓度BSA0.5对照组(17.69%)小于另外2个对照组(BSA0.05为20.74%, Blank为20.03%), 说明高浓度BSA处理对幼苗N-糖链组成产生一定的影响。相比之下, 2个PNGase Rz酶处理组间的N-糖型组成无显著差异(E0.05为10.05%, E0.5为9.90%)。酶处理组高甘露糖型含量(9.90%-10.05%)显著低于对照组BSA0.5、BSA0.05和Blank (17.69%-20.74%), 而相应的复杂型糖的含量(89.95%-90.10%)显著高于对照组(79.26%-82.31%)。上述结果表明, 用PNGase Rz处理幼苗后, 幼苗糖型特别是高甘露糖型组成发生改变, 且去糖基化对幼苗生长的影响显著大于BSA的影响。处理后第5天, 3个对照组的高甘露糖型N-糖链含量上升幅度较小, 对照组Blank从20.03%增加到21.90%, BSA0.05从20.74%增加到22.49%, BSA0.5从17.69%增加到21.48%。而2个PNGase Rz酶处理组高甘露糖型N-糖链含量上升明显, E0.05处理组从10.05%增加到20.95%, E0.5处理组从9.90%增加到20.20%, 且与各对照组间的差异显著缩小。处理后第10天, 3个对照组的高甘露糖型N-糖链含量仍有小幅上升, 且酶处理组和对照组之间的糖型组成差异基本消失, 高、低浓度酶处理组高甘露糖型N-糖链含量(E0.05为20.53%, E0.5为20.85%)与对照组BSA0.5 (20.94%)相比均无显著差异。
Table 3
表3
表3不同时间点拟南芥各处理N-糖链相对含量
Table 3
| N-glycans | The relative content of each N-glycan (%) | ||||
|---|---|---|---|---|---|
| Blank | BSA0.05 | BSA0.5 | E0.05 | E0.5 | |
| Culture for 8 hours | |||||
| Man3XylFucGlcNAc2 | 35.22±0.42 b | 35.00±0.07 b | 35.57±0.99 b | 39.29±0.14 a | 40.25±0.62 a |
| GlcNAcMan3XylFucGlcNAc2 | 18.12±0.07 bc | 17.10±0.07 b | 18.00±0.55 c | 18.51±0.05 b | 19.03±0.20 a |
| Man4XylFucGlcNAc2 | 2.83±0.20 c | 2.61±0.10 c | 3.24±0.16 b | 3.63±0.14 a | 3.86±0.18 a |
| GlcNAc2Man3XylFucGlcNAc2 | 9.98±0.13 c | 10.02±0.08 c | 10.95±0.79 b | 13.09±0.13 a | 12.89±0.55 a |
| GalGlcNAcMan3XylFucGlcNAc2 | 2.63±0.09 c | 2.35±0.11 d | 2.35±0.16 d | 3.06±0.05 b | 3.83±0.12 a |
| Man3XylGlcNAc2 | 6.98±0.16 c | 7.89±0.15 b | 7.86±0.19 b | 8.83±0.15 a | 6.66±0.32 c |
| GlcNAcMan3XylGlcNAc2 | 2.77±0.14 a | 2.60±0.16 a | 2.95±0.22 a | 1.88±0.24 b | 1.94±0.21 b |
| GlcNAc2Man3XylGlcNAc2 | 1.44±0.14 b | 1.69±0.10 a | 1.40±0.13 b | 1.67±0.21 ab | 1.64±0.11 ab |
| Sum of complex | 79.97±0.52 c | 79.26±0.48 d | 82.31±0.22 b | 89.95±0.12 a | 90.10±0.29 a |
| Man6GlcNAc2 | 4.78±0.10 a | 4.81±0.05 a | 3.41±0.27 b | 1.86±0.09 c | 1.70±0.16 c |
| Man7GlcNAc2 | 4.16±0.13 a | 4.16±0.11 a | 3.25±0.11 b | 1.87±0.11 c | 1.58±0.29 c |
| Man8GlcNAc2 | 5.37±0.10 a | 5.52±0.11 a | 4.90±0.20 b | 1.39±0.21 c | 1.44±0.18 c |
| Man9GlcNAc2 | 5.71±0.28 b | 6.25±0.29 a | 6.12±0.13 a | 4.93±0.30 c | 5.18±0.13 c |
| Sum of high-mannose | 20.03±0.52 b | 20.74±0.48 a | 17.69±0.22 c | 10.05±0.12 d | 9.90±0.29 d |
| Culture for 5 days | |||||
| Man3XylFucGlcNAc2 | 29.60±0.18 b | 28.68±0.15 c | 28.60±0.87 c | 29.51±0.24 b | 30.74±0.36 a |
| GlcNAcMan3XylFucGlcNAc2 | 17.97±0.10 b | 18.06±0.12 b | 18.15±0.61 b | 17.84±0.10 b | 19.85±0.28 a |
| Man4XylFucGlcNAc2 | 4.46±0.08 a | 2.71±0.12 b | 2.24±0.15 c | 2.23±0.12 c | 2.34±0.11 c |
| GlcNAc2Man3XylFucGlcNAc2 | 14.58±0.11 b | 13.80±0.15 c | 13.56±0.27 c | 13.54±0.18 c | 15.72±0.14 a |
| GalGlcNAcMan3XylFucGlcNAc2 | 2.62±0.13 a | 2.29±0.10 b | 2.29±0.12 b | 2.46±0.11 ab | 2.22±0.18 b |
| Man3XylGlcNAc2 | 5.17±0.07 d | 6.80±0.11 c | 8.56±0.26 a | 7.77±0.30 b | 5.00±0.16 d |
| GlcNAcMan3XylGlcNAc2 | 1.81±0.17 d | 2.02±0.10 cd | 2.58±0.11 a | 2.33±0.11 b | 2.19±0.07 bc |
| GlcNAc2Man3XylGlcNAc2 | 1.89±0.10 c | 3.14±0.05 a | 2.54±0.17 b | 3.36±0.25 a | 1.75±0.21 c |
| Sum of complex | 78.10±0.10 c | 77.51±0.15 d | 78.52±0.26 c | 79.05±0.18 b | 79.80±0.52 a |
| Man6GlcNAc2 | 5.46±0.09 c | 6.16±0.05 a | 5.64±0.15 bc | 5.81±0.30 ab | 5.38±0.32 c |
| Man7GlcNAc2 | 6.09±0.13 a | 5.78±0.15 b | 4.90±0.13 d | 5.33±0.22 c | 4.87±0.11 d |
| Man8GlcNAc2 | 6.22±0.15 b | 6.35±0.04 a | 6.41±0.09 a | 6.27±0.17 ab | 6.04±0.10 b |
| Man9GlcNAc2 | 4.12±0.11 b | 4.20±0.15 ab | 4.53±0.26 a | 3.55±0.25 c | 3.90±0.20 bc |
| Sum of high-mannose | 21.90±0.10 b | 22.49±0.15 a | 21.48±0.26 b | 20.95±0.18 c | 20.20±0.52 d |
| Culture for 10 days | |||||
| Man3XylFucGlcNAc2 | 31.88±0.19 a | 31.64±0.09 ab | 31.58±0.08 ab | 29.30±0.12 c | 31.11±0.12 b |
| GlcNAcMan3XylFucGlcNAc2 | 17.96±0.09 a | 17.66±0.10 a | 17.70±0.37 a | 17.07±0.09 b | 17.77±0.13 a |
| Man4XylFucGlcNAc2 | 3.46±0.57 a | 3.57±0.11 a | 3.43±0.13 a | 3.32±0.12 a | 3.28±0.12 a |
| GlcNAc2Man3XylFucGlcNAc2 | 14.34±0.07 ab | 13.88±0.10 bc | 14.50±0.58 a | 13.73±0.05 c | 14.85±0.16 a |
| GalGlcNAcMan3XylFucGlcNAc2 | 2.05±0.09 a | 2.21±0.17 a | 2.30±0.20 a | 2.25±0.09 a | 2.20±0.23 a |
| Man3XylGlcNAc2 | 5.81±0.23 c | 6.62±0.10 b | 5.48±0.38 c | 8.96±0.03 a | 5.86±0.14 c |
| GlcNAcMan3XylGlcNAc2 | 2.20±0.15 a | 2.27±0.12 a | 2.51±0.42 a | 2.20±0.07 a | 2.19±0.11 a |
| GlcNAc2Man3XylGlcNAc2 | 1.87±0.10 c | 2.23±0.13 b | 1.56±0.19 d | 2.64±0.07 a | 1.88±0.05 c |
| Sum of complex | 79.57±0.47 ab | 80.08±0.30 a | 79.06±0.64 b | 79.47±0.07 ab | 79.15±0.15 b |
| Man6GlcNAc2 | 5.47±0.09 a | 5.59±0.08 a | 5.39±0.32 a | 5.68±0.17 a | 5.52±0.10 a |
| Man7GlcNAc2 | 5.36±0.16 b | 5.27±0.09 b | 5.24±0.10 b | 5.69±0.17 a | 5.66±0.17 a |
| Man8GlcNAc2 | 6.20±0.07 a | 5.71±0.13 bc | 6.42±0.40 a | 5.52±0.21 c | 6.04±0.10 ab |
| Man9GlcNAc2 | 3.41±0.22 b | 3.35±0.23 b | 3.89±0.15 a | 3.64±0.22 ab | 3.64±0.11 ab |
| Sum of high-mannose | 20.43±0.47 ab | 19.92±0.30 b | 20.94±0.64 a | 20.53±0.07 a | 20.85±0.15 a |
新窗口打开|下载CSV
综合根长和N-糖链组成研究结果, 我们发现孵育8小时, 高、低浓度酶处理组拟南芥幼苗的N-糖链组成均发生明显变化, 但其生长状态和主根长度与对照组(尤其是对照组BSA0.5)相比无明显差异。结果表明, PNGase Rz短时处理能够改变幼苗糖型组成, 特别是高甘露糖型的比例, 但去糖基化并不能在短时间内引起拟南芥幼苗相应生长状态的改变。培养5天后, 可观察到高浓度PNGase Rz处理组(E0.5)出现生长受抑制现象, 而低浓度PNGase Rz处理组(E0.05)生长状态和主根长均与对照组BSA0.5无明显差异。结合处理8小时的结果, 表明PNGase Rz处理产生的生理效应远滞后于糖型的改变。此外, 不同浓度酶处理组的表型差异也表明该抑制效应具有量效关系, 去糖基化酶浓度越高, 幼苗生长受抑制越明显。培养第5天样本的糖链分析结果显示, PNGase Rz处理组与各对照组间的差异明显缩小, 说明为了保持正常生长, 拟南芥会通过自我修复或调整使各N-糖链占比保持在一定的水平。培养10天后, 各组间的糖型差异基本消失, 而对主根的抑制依然存在, 表明糖型差异恢复早于表型差异, 尽管PNGase Rz处理产生的糖型差异消除了, 但其对主根生长的抑制效应在一定时间内无法恢复。
3 讨论
3.1 N-糖链组成结构随拟南芥生长发育发生规律性改变
根据液相色谱和质谱结果, 我们共发现了12种N-糖链结构: 4个高甘露糖型和8个复杂型。复杂型N-糖链中含木糖和岩藻糖的结构5个, 只含木糖的结构3个。未检测到带有Lewis a抗原决定簇的糖型或者杂合型糖, 表明拟南芥的糖型组成与大多数植物的糖型一致(Wilson et al., 2001)。研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(Nakamura et al., 2008)。 本研究发现, 在拟南芥整个生长过程中, N-糖链的结构种类未发生变化, 只包括复杂型和高甘露糖型两类, 复杂糖始终是其中的主体成分, 含木糖和岩藻糖的结构是复杂糖的主要部分, 而Man3XylFucGlcNAc2是其中含量最高的糖型, 此结果与前人的研究结果相吻合(Kajiura et al., 2010)。但不同糖型相对含量变化显著; 在其它植物中也观察到类似的N-糖链组成变化(Misaki et al., 2001; Vi?tor et al., 2003; Dam et al., 2013)。糖型组成的变化可能与不同阶段植物的器官分化有关。然而以往的研究显示, 拟南芥不同器官, 如莲座叶、花和茎的N-糖链组成无明显差别, 但缺乏根、种子等器官的N-糖链结构数据(Zeng et al., 2018)。需要特别指出的是, 与其它植物器官相比, 种子具有特殊的糖型组成, 种子和幼芽N-糖链结构组成有明显区别(Horiuchi et al., 2015)。我们的研究表明, 高甘露糖型在长角果成熟期含量显著低于其它生长期, 仅为2.36%。拟南芥在长角果成熟期含有大量发育中的种子, 而种子在前3期中均不存在, 这可能是长角果成熟期糖型组成发生明显变化的原因之一。衰老期的高甘露糖型含量略高于长角果成熟期, 可能是由于细胞衰老引起控制机制恶化, 错误折叠糖蛋白的数量相应增加, 更多的糖链进入CNX-CRT循环后被再次糖基化形成高甘露糖型, 最终导致衰老期高甘露糖型的相对含量回升(Ihara et al., 2020)。
3.2 去糖基化酶处理改变拟南芥幼苗的N-糖链组成并影响根的生长
为了探明去糖基化对植物幼苗根发育的短期和长期效应, 本实验使用特异性去N-糖基化酶PNGase Rz体外处理拟南芥幼苗, 分别在孵育8小时、继续生长5天和10天3个不同时间点观察拟南芥样品的表型并检测N-糖链组成。根据不同时间点不同组间N-糖链数据的比较, 我们发现PNGase Rz处理主要影响N-糖链结构为高甘露糖型。而高甘露糖型N-糖链对植物根生长的影响也有文献报道。Liebminger等(2009)在外切α-甘露糖苷酶缺陷型拟南芥植株中发现, 高聚合度高甘露糖型N-糖链的富集通过影响细胞壁结构抑制根的发育。而在本研究中, 使用去N-糖基化酶PNGase Rz处理同样抑制拟南芥幼苗根的生长发育。发生抑制作用的原因可能是去糖基化影响植物细胞壁或细胞膜上某些酶的活性或蛋白功能。研究表明, 拟南芥KORRIGAN1纤维素酶的胞外区域存在8个N-糖基化位点, 其中N4和N7位N-糖链的缺失会极大地降低KORRIGAN1纤维素酶的活力, 干扰正常细胞壁合成(Rips et al., 2014)。游离的N-糖链具有类似植物激素的功能, 能够调节植物芽的发育和果实成熟。因此, 本研究中观察到的现象还有可能是PNGase Rz释放的N-糖链通过直接调节作用抑制根的生长, 具体原因还需要进一步验证(Maeda and Kimura, 2014)。此外, 为了消除溶液中蛋白对幼苗生长的影响, 本实验设置了不同浓度的BSA作为对照。由于植物中广泛存在内源性N-糖酰胺酶, 因此本研究以非糖基化蛋白BSA作为对照, 可避免引入外源N-糖链结构的干扰, 同时还能观察蛋白组分对拟南芥生长是否有影响(Wang and Voglmeir, 2014)。实验结果显示, PNGase Rz处理对幼苗的影响显著大于BSA处理, 说明酶的去糖基化作用引起幼苗表型和糖基化组成的变化大于蛋白本身。4 结论与展望
综上所述, 本研究鉴定了拟南芥不同生长阶段的N-糖基化指纹图谱, 并对其变化规律进行了探索。此外, 还发现通过一过性的体外去糖基化处理, 在短时间内即可引起拟南芥幼苗N-糖组(主要影响高甘露糖型)的可逆性变化, 且该糖型的改变对拟南芥根的生长发育产生长期的抑制作用, 具体作用机制还有待进一步研究。本研究为进一步阐明N-糖组在植物生长发育中的生理功能奠定了基础, 而体外酶法去糖基化也为相关研究提供了一种新的手段。(责任编辑: 白羽红)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 3]
DOI:10.1159/000096114URL [本文引用: 1]
DOI:10.1006/abbi.2000.2187URL [本文引用: 1]
DOI:10.1021/pr400224sURL [本文引用: 1]
DOI:10.1021/acs.jafc.5b03633URL [本文引用: 3]
DOI:10.1016/j.acthis.2010.02.004URL [本文引用: 1]
DOI:10.1016/j.carres.2015.09.008URL [本文引用: 1]
[本文引用: 1]
DOI:10.1093/glycob/cwp170URL [本文引用: 1]
DOI:10.1073/pnas.0800237105URL [本文引用: 2]
DOI:10.1042/BCJ20170106URL [本文引用: 1]
DOI:10.1271/bbb.64.562URL [本文引用: 1]
DOI:10.1271/bbb.110148URL [本文引用: 1]
DOI:10.1105/tpc.013862URL [本文引用: 1]
DOI:10.1105/tpc.109.072363URL [本文引用: 1]
DOI:10.1074/jbc.M110.178020URL [本文引用: 1]
DOI:10.1371/journal.pbio.1002139URL [本文引用: 1]
[本文引用: 1]
DOI:10.1271/bbb.65.2482URL [本文引用: 1]
DOI:10.1016/j.plantsci.2018.05.007URL [本文引用: 1]
DOI:10.1271/bbb.80414URL [本文引用: 2]
DOI:10.1105/tpc.114.129718URL [本文引用: 1]
DOI:10.1111/cmi.2010.12.issue-6URL [本文引用: 1]
DOI:10.1111/tpj.12696URL [本文引用: 2]
PMID:16460512 [本文引用: 1]

N-glycosylation is one of the major post-translational modifications of proteins in eukaryotes; however, the processing reactions of oligomannosidic N-glycan precursors leading to hybrid-type and finally complex-type N-glycans are not fully understood in plants. To investigate the role of Golgi alpha-mannosidase II (GMII) in the formation of complex N-glycans in plants, we identified a putative GMII from Arabidopsis thaliana (AtGMII; EC 3.2.1.114) and characterized the enzyme at a molecular level. The putative AtGMII cDNA was cloned, and its deduced amino acid sequence revealed a typical type II membrane protein of 1173 amino acids. A soluble recombinant form of the enzyme produced in insect cells was capable of processing different physiologically relevant hybrid N-glycans. Furthermore, a detailed N-glycan analysis of two AtGMII knockout mutants revealed the predominant presence of unprocessed hybrid N-glycans. These results provide evidence that AtGMII plays a central role in the formation of complex N-glycans in plants. Furthermore, conclusive evidence was obtained that alternative routes in the conversion of hybrid N-glycans to complex N-glycans exist in plants. Transient expression of N-terminal AtGMII fragments fused to a GFP reporter molecule demonstrated that the transmembrane domain and 10 amino acids from the cytoplasmic tail are sufficient to retain a reporter molecule in the Golgi apparatus and that lumenal sequences are not involved in the retention mechanism. A GFP fusion construct containing only the transmembrane domain was predominantly retained in the ER, a result that indicates the presence of a motif promoting ER export within the last 10 amino acids of the cytoplasmic tail of AtGMII.
PMID:14566560 [本文引用: 1]

We have investigated the structure of glycans N-linked to the proteins of the moss Physcomitrella patens. The structural elucidation was carried out by western blotting using antibodies specific for N-glycan epitopes and by analysis of N-linked glycans enzymatically released from a total protein extract by combination of MALDI-TOF and MALDI-PSD mass spectrometry analysis. Nineteen N-linked oligosaccharides were characterised ranging from high-mannose-type and truncated paucimannosidic-type to complex-type N-glycans harbouring core-xylose, core-alpha(1,3)-fucose and Lewis(a), as previously described for proteins from higher plants. This demonstrates that the processing of N-linked glycans, as well as the specificity of glycosidases and glycosyltransferases involved in this processing, are highly conserved between P. patens and higher plants. As a consequence, P. patens appears to be a new promising model organism for the investigation of the biological significance of protein N-glycosylation in the plant kingdom, taking advantage of the potential for gene targeting in this moss.
DOI:10.1021/acs.jafc.7b01690URL [本文引用: 1]
DOI:10.2174/0929866521666140626111237URL [本文引用: 1]
DOI:10.1016/j.foodchem.2017.05.026URL [本文引用: 1]
DOI:10.1104/pp.114.249268URL [本文引用: 1]
DOI:10.1016/j.jprot.2011.05.007URL [本文引用: 1]
PMID:11358875 [本文引用: 2]

The N-glycans from 27 "plant" foodstuffs, including one from a gymnospermic plant and one from a fungus, were prepared by a new procedure and examined by means of matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS). For several samples, glycan structures were additionally investigated by size-fractionation and reverse-phase high-performance liquid chromatography in conjunction with exoglycosidase digests and finally also (1)H-nuclear magnetic resonance spectroscopy. The glycans found ranged from the typical vacuolar "horseradish peroxidase" type and oligomannose to complex Le(a)-carrying structures. Though the common mushroom exclusively contained N-glycans of the oligomannosidic type, all plant foods contained mixtures of the above-mentioned types. Apple, asparagus, avocado, banana, carrot, celery, hazelnut, kiwi, onion, orange, pear, pignoli, strawberry, and walnut were particularly rich in Le(a)-carrying N-glycans. Although traces of Le(a)-containing structures were also present in almond, pistachio, potato, and tomato, no such glycans could be found in cauliflower. Coconut exhibited almost exclusively N-glycans containing only xylose but no fucose. Oligomannosidic N-glycans dominated in buckwheat and especially in the legume seeds mung bean, pea, peanut, and soybean. Papaya presented a unique set of hybrid type structures partially containing the Le(a) determinant. These results are not only compatible with the hypothesis that the carbohydrate structures are another potential source of immunological cross-reaction between different plant allergens, but they also demonstrate that the Le(a)-type structure is very widespread among plants.
DOI:10.1074/mcp.M115.056101URL [本文引用: 1]
DOI:10.1074/mcp.RA117.000165URL [本文引用: 2]
Solitalea canadensis源β-N-乙酰氨基己糖苷酶的基因克隆、异源表达和酶学特性
3
2017
... PNGase Rz的表达纯化参照
... 根据液相检测结果(
... 糖链.3号峰由于含量较低未能检测到相应质谱信号, 但是根据其GU值以及实验室前期结果(
The role of protein glycosylation in allergy
1
2007
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
The effects of the site-directed removal of N-glycosylation from cationic peanut peroxidase on its function
1
2001
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
Combined N-glycome and N-glycoproteome analysis of the Lotus japonicus seed globulin fraction shows conservation of protein structure and glycosylation in legumes
1
2013
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Rapid sample preparation methodology for plant N-glycan analysis using acid-stable PNGase H+
3
2015
... 根据UPLC谱图, 对色谱峰进行收集, 使用真空离心干燥机干燥.在干燥样品中加入2 μL去离子水, 充分混匀, 取出1 μL与基质2,5-二羟基苯甲酸(DHB)混匀, 点样于靶板上, 自然风干后, 使用质谱检测.辅助激光解析电离飞行时间质谱(matrix assisted laser ionization time of flight mass spectrometry, MALDI- TOF-MS)的检测方法参照文献(
... 根据液相检测结果(
... ;
A glycobiology review: carbohydrates, lectins and implications in cancer therapeutics
1
2011
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
Comparative analysis of N-glycans in the ungerminated and germinated stages of Oryza sativa
1
2015
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Calnexin/calreticulin and assays related to N-glycoprotein folding in vitro
1
2020
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Two Arabidopsis thaliana Golgi, α-mannosidase I enzymes are responsible for plant N-glycan maturation
1
2010
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Salt tolerance of Arabidopsis thaliana requires maturation of N-glycosylated proteins in the Golgi apparatus
2
2008
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
Degradation pathway of plant complex-type N-glycans: identification and characterization of a key α1,3-fucosidase from glycoside hydrolase family 29
1
2018
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
Changes in N-linked oligosaccharides during seed development of Ginkgo biloba
1
2000
... N-糖基化修饰在植物N-糖链的重要生理作用与其结构密切相关.在植物发育的各阶段, 从种子萌发、生长到果实成熟, 植物N-糖链组均会发生特征性的结构和含量变化, 形成特征性的指纹图谱.
Double-knockout of putative endo-β-N-acetylglucosaminidase (ENGase) genes in Arabidopsis thaliana: loss of ENGase activity induced accumulation of high- mannose type free N-glycans bearing N,N'-acetylchitobiosyl unit
1
2011
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
The STT3a subunit isoform of the Arabidopsis oligosaccharyltransferase controls adaptive responses to salt/osmotic stress
1
2003
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
Class I α-mannosidases are required for N-glycan processing and root development in Arabidopsis thaliana
1
2009
... 为了探明去糖基化对植物幼苗根发育的短期和长期效应, 本实验使用特异性去N-糖基化酶PNGase Rz体外处理拟南芥幼苗, 分别在孵育8小时、继续生长5天和10天3个不同时间点观察拟南芥样品的表型并检测N-糖链组成.根据不同时间点不同组间N-糖链数据的比较, 我们发现PNGase Rz处理主要影响N-糖链结构为高甘露糖型.而高甘露糖型N-糖链对植物根生长的影响也有文献报道.
β-N-acetylhexosaminidases HEXO1 and HEXO3 are responsible for the formation of paucimannosidic N-glycans in Arabidopsis thaliana
1
2011
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
TURAN and EVAN mediate pollen tube reception in Arabidopsis Synergids through protein glycosylation
1
2015
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
Structural features of free N-glycans occurring in plants and functional features of de-N-glycosylation enzymes, ENGase, and PNGase: the presence of unusual plant complex type N-glycans
1
2014
... 为了探明去糖基化对植物幼苗根发育的短期和长期效应, 本实验使用特异性去N-糖基化酶PNGase Rz体外处理拟南芥幼苗, 分别在孵育8小时、继续生长5天和10天3个不同时间点观察拟南芥样品的表型并检测N-糖链组成.根据不同时间点不同组间N-糖链数据的比较, 我们发现PNGase Rz处理主要影响N-糖链结构为高甘露糖型.而高甘露糖型N-糖链对植物根生长的影响也有文献报道.
Glycoproteins secreted from suspension -cultured tobacco BY2 cells have distinct glycan structures from intracellular glycoproteins
1
2001
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Function of N-glycosylation in plants
1
2018
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
Changes in structural features of free N-glycan and endoglycosidase activity during tomato fruit ripening
2
2008
... N-糖基化修饰在植物N-糖链的重要生理作用与其结构密切相关.在植物发育的各阶段, 从种子萌发、生长到果实成熟, 植物N-糖链组均会发生特征性的结构和含量变化, 形成特征性的指纹图谱.
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Multiple N-glycans cooperate in the subcellular targeting and functioning of Arabidopsis KORRIGAN1
1
2014
... 为了探明去糖基化对植物幼苗根发育的短期和长期效应, 本实验使用特异性去N-糖基化酶PNGase Rz体外处理拟南芥幼苗, 分别在孵育8小时、继续生长5天和10天3个不同时间点观察拟南芥样品的表型并检测N-糖链组成.根据不同时间点不同组间N-糖链数据的比较, 我们发现PNGase Rz处理主要影响N-糖链结构为高甘露糖型.而高甘露糖型N-糖链对植物根生长的影响也有文献报道.
ER quality control of immune receptors and regulators in plants
1
2010
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
N-linked glycosylation of AtVSR1 is important for vacuolar protein sorting in Arabidopsis
2
2014
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
Molecular cloning and characterization of Arabidopsis thaliana Golgi α-mannosidase II, a key enzyme in the formation of complex N-glycans in plants
1
2006
... 以往对蛋白质N-糖链功能的研究多通过基因改造技术获得各种缺陷/突变型的细胞或植株来探索糖基化修饰的相关功能, 以N-糖链合成和降解途径中的关键酶为研究对象, 构建相关酶的基因缺陷型细胞或完整植株, 从而验证相关酶的作用(
Protein N-glycosylation is similar in the moss Physcomitrella patens and in higher plants
1
2003
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
Qualitative and quantitative analysis of carbohydrate modification on glycoproteins from seeds of Ginkgo biloba
1
2017
... N-糖链的纯化、标记和UPLC检测方法参考文献
PNGases as valuable tools in glycoprotein analysis
1
2014
... 为了探明去糖基化对植物幼苗根发育的短期和长期效应, 本实验使用特异性去N-糖基化酶PNGase Rz体外处理拟南芥幼苗, 分别在孵育8小时、继续生长5天和10天3个不同时间点观察拟南芥样品的表型并检测N-糖链组成.根据不同时间点不同组间N-糖链数据的比较, 我们发现PNGase Rz处理主要影响N-糖链结构为高甘露糖型.而高甘露糖型N-糖链对植物根生长的影响也有文献报道.
Comparison of anti-pathogenic activities of the human and bovine milk N-glycome: fucosylation is a key factor
1
2017b
... 根据UPLC谱图, 对色谱峰进行收集, 使用真空离心干燥机干燥.在干燥样品中加入2 μL去离子水, 充分混匀, 取出1 μL与基质2,5-二羟基苯甲酸(DHB)混匀, 点样于靶板上, 自然风干后, 使用质谱检测.辅助激光解析电离飞行时间质谱(matrix assisted laser ionization time of flight mass spectrometry, MALDI- TOF-MS)的检测方法参照文献(
The Arabidopsis Vacuolar Sorting Receptor 1 is required for osmotic stress-induced abscisic acid biosynthesis
1
2015
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
N-glycoproteomics in plants: perspectives and challenges
1
2011
... N-糖基化修饰是重要的蛋白质翻译后修饰之一, 其通常含有特征性糖基化位点和相同的核心五糖结构(2个N-乙酰葡糖胺及3个甘露糖), 在此基础上衍生出多种结构各异的外周糖链.根据结构N-糖链又可细分为3种类型——高甘露糖(high-mannose)、杂合型糖(hybrid type)和复杂型糖(complex) (
Analysis of Asn -linked glycans from vegetable foodstuffs: widespread occurrence of Lewis a, core α1,3-linked fucose and xylose substitutions
2
2001
... 根据液相检测结果(
... 根据液相色谱和质谱结果, 我们共发现了12种N-糖链结构: 4个高甘露糖型和8个复杂型.复杂型N-糖链中含木糖和岩藻糖的结构5个, 只含木糖的结构3个.未检测到带有Lewis a抗原决定簇的糖型或者杂合型糖, 表明拟南芥的糖型组成与大多数植物的糖型一致(
N-glycopeptide profiling in Arabidopsis inflorescence
1
2016
... N-糖基化修饰在植物N-糖链的重要生理作用与其结构密切相关.在植物发育的各阶段, 从种子萌发、生长到果实成熟, 植物N-糖链组均会发生特征性的结构和含量变化, 形成特征性的指纹图谱.
N- linked glycan micro-heterogeneity in glycoproteins of Arabidopsis
2
2018
... N-糖基化修饰在植物N-糖链的重要生理作用与其结构密切相关.在植物发育的各阶段, 从种子萌发、生长到果实成熟, 植物N-糖链组均会发生特征性的结构和含量变化, 形成特征性的指纹图谱.
... 研究表明, N-糖链在植物生长发育中起重要作用, 影响诸如种子萌发和果实成熟等过程(
