 ,2,*, 陈学伟
,2,*, 陈学伟 ,1,*
,1,*Methods for Evaluation of Rice Resistance to Blast and Sheath Blight Diseases
Min He1, Junjie Yin1, Zhiming Feng2, Xiaobo Zhu1, Jianhua Zhao2, Shimin Zuo ,2,*, Xuewei Chen
,2,*, Xuewei Chen ,1,*
,1,*通讯作者: E-mail:smzuo@yzu.edu.cn;xwchen88@163.com
责任编辑: 孙冬花
收稿日期:2020-05-28接受日期:2020-07-21网络出版日期:2020-09-01
| 基金资助: |
Corresponding authors: E-mail:smzuo@yzu.edu.cn;xwchen88@163.com
Received:2020-05-28Accepted:2020-07-21Online:2020-09-01

摘要
水稻(Oryza sativa)是世界上最重要的粮食作物, 但稻瘟病和纹枯病等病害严重危害水稻的产量和品质, 给我国乃至全球粮食安全带来巨大威胁。鉴定水稻抗病资源、克隆抗病基因、揭示抗性机理并在育种中加以利用, 对抵御水稻病害和保障粮食安全具有十分重要的作用。准确评价水稻资源的抗病性, 是开展抗病机理研究和育种生产应用的关键环节。该文详述了水稻幼苗期人工喷雾接种、分蘖期和孕穗期田间注射接种与离体叶片戳伤接种的稻瘟病抗性鉴定方法, 以及水稻分蘖期田间接种、孕穗期温室接种和离体茎秆接种的纹枯病抗性鉴定方法, 以期为同行鉴定水稻资源、开展抗病理论和应用研究提供参考。
关键词:
Abstract
Rice is the most important crop in the world. However, rice blast caused by Magnaporthe oryzae and sheath blight caused by Rhizoctonia solani are two of diseases, which threaten both yield and quality of rice most severely. To ensure food security, it is very important to identify disease-resistant rice germplasm, clone disease resistant genes, uncover the molecular basis and apply them in rice breeding program. Accurate evaluation of the disease resistance of rice is fundamental to both uncover disease resistance mechanism and improve resistance in rice breeding. Here, we describe the common methods for evaluating rice blast disease resistance by spraying inoculation of seedlings with M. oryzae, injection inoculation at rice tillering and booting stage, and punch inoculation of detached rice leaves. We also describe the methods for evaluating rice sheath blight disease resistance by field inoculation with R. solani at rice tillering stage, greenhouse inoculation at rice booting stage, and inoculation of rice detached-stems in growth chamber. We believe these methods could provide useful protocols for colleagues who aim to identify rice disease-resistant resources, dissect the underlying molecular mechanism and breed elite rice varieties with improved disease resistance.
Keywords:
PDF (10846KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
贺闽, 尹俊杰, 冯志明, 朱孝波, 赵剑华, 左示敏, 陈学伟. 水稻稻瘟病和纹枯病抗性鉴定方法. 植物学报, 2020, 55(5): 577-587 doi:10.11983/CBB20100
He Min, Yin Junjie, Feng Zhiming, Zhu Xiaobo, Zhao Jianhua, Zuo Shimin, Chen Xuewei.
粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展。水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(Dean et al., 2012; Li et al., 2019; 高杜娟等, 2019)。稻瘟病被称为“水稻癌症”, 在我国水稻栽培区域常年爆发, 2013-2017年的年均危害面积高达7.5×107 hm2, 使水稻减产10%-30%, 有的地区甚至绝收(曹妮等, 2019; 杨德卫等, 2019)。纹枯病一般情况下可使水稻减产10%-30%, 严重时超过50% (Zheng et al., 2013)。近年来, 随着秸秆还田和高密栽插等栽培管理技术的推广, 田间纹枯病菌基数不断富积, 造成其发生与危害日趋加重(Wang et al., 2015)。
稻瘟病和纹枯病均属于真菌病害。稻瘟病由子囊菌稻瘟病菌(Magnaporthe oryzae)引起, 在水稻各生育期和不同部位均可发生, 其中以叶瘟和穗颈瘟最为常见。稻瘟病菌以菌丝体或分生孢子形式在病谷或病稻草上越冬, 作为下一年的侵染源。其侵染过程包括分生孢子黏附寄主表皮、萌发产生芽管、芽管末端分化形成附着胞、侵染钉刺穿寄主表皮、侵染菌丝增殖并杀伤植物组织和产孢及释放侵染单元等(Wilson and Talbot, 2009; 许有嫔等, 2017)。纹枯病致病菌为立枯丝核菌(Rhizoctonia solani), 该菌以菌核或病残体在土壤中越冬。环境条件适宜时, 菌核萌发出菌丝侵染水稻基部叶鞘, 并以菌丝体向植株上部叶鞘等其它部位扩展, 造成叶鞘叶片坏死。分蘖期通常是纹枯病发生和横向传播的重要阶段; 孕穗至籽粒灌浆中期则是纹枯病纵向扩展和造成重要经济损失的关键时期(左示敏等, 2010)。
实践证明, 挖掘水稻抗病资源并在育种中加以利用, 是控制病害流行和危害最经济有效的措施。长期以来, 育种家们投入了大量时间和精力, 从自然宝库中挖掘优异的抗病资源, 并将其应用于生产实践。抗病性鉴定上, 传统策略主要是在病害高发区进行自然鉴定。然而, 由于病害的自发程度受地理环境和气候条件限制, 加之病原菌高度变异, 流行的优势生理小种频繁更迭, 导致病害高发区的抗病性鉴定具有不可控性。此外, 育种基地一般远离病害高发区, 致使抗病性鉴定往往耗时费力, 因而抗病育种在实际操作中难以有效开展(陈锦文等, 2015)。为满足水稻抗病理论和应用研究的现实需求, 以及推广可控性好、一致性强并便于广泛应用的病害抗性鉴定方法, 我们详述了水稻稻瘟病和纹枯病的人工接种鉴定方法与流程, 供同行参考。
1 实验材料
稻瘟病菌(Magnaporthe oryzae B.C. Couch)为标准菌株Guy11, 纹枯病菌(Rhizoctonia solani Kühn)菌株为中强致病菌株YN-7; 水稻(Oryza sativa L.)材料为稻瘟病易感品种丽江新团黑谷和纹枯病易感品种Lemont。2 试剂
● 番茄燕麦培养基(oat tomato agar, OTA): 新鲜番茄(fresh tomato)和市售燕麦片(oatmeal)。● BD试剂: 马铃薯葡萄糖肉汤(potato dextrose broth, Cat No.M305-02)。
● Sigma试剂: 6-苄氨基嘌呤(6-benzylaminopurine, Cat No.B3408)。
● 生工生物试剂: 蛋白胨(peptone, Cat No.A505247)、酵母提取物(yeast extract, Cat No.A515245)、酪蛋白水解物(casamino acids, Cat No.A100851)、葡萄糖(glucose, Cat No. A610219)、氯化钾(KCl, Cat No.A100395)、硫酸镁七水(MgSO4·7H2O, Cat No. A610329)、磷酸二氢钾(KH2PO4, Cat No.A501211)、生物素(biotin, Cat No.A100340)、维生素B1 (thiamine, Cat No.A500986)、维生素B6 (pyridoxin, Cat No.A600797)、维生素B2 (riboflavin, Cat No.A600470)、对氨基苯甲酸(p-aminobenzoic acid, Cat No.A500039)、烟酸(nicotinic acid, Cat No.A610660)、硫酸锌七水(ZnSO4·7H2O, Cat No.A602-906)、硼酸(H3BO3, Cat No.A100588)、氯化锰四水(MnCl2·4H2O, Cat No.A500331)、硫酸亚铁七水(Fe-SO4·7H2O, Cat No.A501386)、氯化钴六水(CoCl2·6H2O, Cat No.A600316)、硫酸铜五水(CuSO4·5H2O, Cat No.A100330)、钼酸钠二水(Na2MoO4·2H2O, Cat No.A610358)、琼脂粉(agar, Cat No.A100637)以及吐温20 (Tween-20, Cat No.A100- 777)。
● 麦克林试剂: 硝酸钠(NaNO3, Cat No.S817996)。
3 试剂配方
本实验所用试剂配方见表1。Table 1
表1
表1稻瘟病菌和纹枯病菌生长培养所需相关试剂配方
Table 1
| Solution | Composition | Amount |
|---|---|---|
| 20× Nitrate salts (1 L) | NaNO3 | 120 g |
| KCl | 10.4 g | |
| MgSO4.7H2O | 10.4 g | |
| KH2PO4 | 30.4 g | |
| Vitamin solution (1 L) | Biotin | 0.1 g |
| Pyridoxin | 0.1 g | |
| Thiamine | 0.1 g | |
| Riboflavin | 0.1 g | |
| p-aminobenzoic acid | 0.1 g | |
| Nicotinic acid | 0.1 g | |
| Trace elements (100 mL) | ZnSO4.7H2O | 2.2 g |
| H3BO3 | 1.1 g | |
| MnCl2.4H2O | 0.5 g | |
| FeSO4.7H2O | 0.5 g | |
| CoCl2.6H2O | 0.17 g | |
| CuSO4.5H2O | 0.16 g | |
| Na2MoO4.2H2O | 0.15 g | |
| CM agar medium (1 L, pH6.5) | Glucose | 10 g |
| Peptone | 2 g | |
| Yeast extract | 1 g | |
| Casamino acids | 1 g | |
| 20× Nitrate salts | 50 mL | |
| Vitamin solution | 1 mL | |
| Trace elements | 1 mL | |
| Agar | 15 g | |
| Oat tomato agar (1 L) | Oatmeal | 40 g, collect the liquid filter after boiling |
| Fresh tomato juice | 150 mL | |
| Agar | 15 g | |
| PDA medium (1 L) | Potato dextrose broth | 24 g |
| Agar | 20 g |
新窗口打开|下载CSV
4 仪器设备
● 常用设备及设施: 恒温光照培养箱、高温高压灭菌锅、超净工作台、显微镜、喷雾加湿器和人工气候室。● 通用耗材: 无菌培养皿、镊子、解剖刀、喷雾瓶、打孔器、湿度计、玻璃锥形瓶、移液器、血球计数板、注射器、离心管、擦镜纸、医用棉签、医用纱布、阿尤斯木制0.8 mm厚竖纹木皮和花盆(65 cm (长)× 23 cm (宽)×18 cm (高))。
● 离体茎秆纹枯病菌接种鉴定室的搭建: 在离体茎秆纹枯病抗性鉴定过程中, 需搭建1个接种鉴定室, 该室由铝合金型材框架、保湿托盘和聚酯薄膜组成。框架的长、宽、高为800 mm×400 mm×800 mm, 由横截面20 mm×20 mm的铝合金柱拼接而成。框架的侧面及顶面覆以聚酯薄膜(可用胶带固定, 但不能完全密封); 将搭建好的框架置于水深约7 cm的托盘内, 托盘的长、宽、高为925 mm×625 mm×140 mm。茎秆培养架包括长、宽、高为340 mm×270 mm× 130 mm的塑料盒、孔径为15 mm的试管架、花泥和营养液; 花泥使用前需用清水浸泡24小时, 营养液配制参照文献(Yoshida et al., 1976)所述配方。
5 实验方法
5.1 水稻幼苗期喷雾接种的稻瘟病抗性鉴定
幼苗期喷雾接种法是目前鉴定稻瘟病抗性最为常用的方法, 其优点是通过培养稻瘟病菌进行接种, 可最大限度地避免田间自发病害的不可控性, 而且通过使用不同的水稻品种及稻瘟病菌生理小种, 可快速且准确地鉴定不同水稻品种的抗谱。5.1.1 实验流程
(1) 准备水稻幼苗期材料: 在平整的田间育秧土地上, 划分长、宽为50 cm×5 cm的种植小区, 每个小区播种30-50粒催芽处理的水稻种子(图1A), 用透明薄膜覆盖保温。生长14天至四叶期用于接种稻瘟病菌(图1B)。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1水稻幼苗期接种稻瘟病菌进行抗性鉴定及典型病斑
(A) 苗床上分小区播种水稻种子; (B) 生长2周的幼苗期水稻; (C) CM平板上的稻瘟病菌菌落; (D) 番茄燕麦产孢平板上生长的稻瘟病菌; (E) 对水稻小区喷雾接种孢悬液; (F) 接种6天后稻瘟病的发病情况; (G) 水稻叶片上产生的典型纺锤形病斑(Bar=1 cm)。
Figure 1Spraying inoculation at rice seedling stage for evaluation of blast disease resistance and typical rice blast symptom
(A) Sowing rice seeds on seedbeds; (B) Rice seedlings grown for two weeks; (C)Magnaporthe oryzae colony grown on CM agar medium; (D)M. oryzae sporulation on oat tomato agar medium; (E) Inoculation of rice seedlings by spraying spore suspension; (F) Development of blast lesions six-day post inoculation; (G) Typical blast lesions formed on rice leaves (Bar=1 cm).
(2) 活化菌株: 将保存的滤纸片平铺于CM培养基中央, 25°C光照培养5-7天后, 从菌落边缘切取直径0.5 cm的菌丝块, 接种于新的CM培养基上, 25°C培养(图1C)。
(3) 准备产孢平板: 待CM培养基上的稻瘟病菌菌落生长至接近满皿时(约7天), 加入3-5 mL无菌水, 用涂布棒将菌丝打断成细小碎段, 吸取菌液, 转移至直径9 cm的番茄燕麦产孢平板, 涂布均匀晾干, 25°C光照培养2天。
(4) 产孢: 用棉签擦除培养基表面的气生菌丝, 然后用无菌水冲洗晾干, 最后用双层纱布封盖培养皿, 25°C光照培养2-3天(图1D)。
(5) 制备孢悬液: 每皿加入5 mL灭菌水, 洗下培养基表面的分生孢子, 过滤收集孢悬液。混匀后测定孢子浓度, 并将孢悬液浓度调至105个·mL?1。
(6) 田间喷雾接种: 将孢悬液转移至喷雾瓶中, 加入Tween-20至终浓度0.01%, 然后喷雾接种于田间生长约14天的水稻幼苗(图1E)。
(7) 抗感性鉴别: 接种后5-7天开始发病(图1F), 参照“水稻品种试验稻瘟病抗性鉴定与评价技术规程”(中华人民共和国农业行业标准NY/T2646-2014)中所述的苗瘟调查分级标准(表2), 评价水稻的抗感性。感病水稻材料被稻瘟病菌侵染后, 产生典型的纺锤形病斑(图1G), 病斑中央呈灰色, 生长有菌丝和分生孢子, 中央外围有褐色坏死, 病斑最外层为淡黄色的中毒部位; 抗病材料在侵染后, 免疫系统被激活而产生超敏反应, 诱发自发性细胞死亡, 无病斑产生或仅产生针头状褐点。
Table 2
表2
表2水稻幼苗期叶瘟调查的分级标准
Table 2
| Disease score | Resistance level | State of disease |
|---|---|---|
| 0 | High resistance (HR) | No blast lesion |
| 1 | Resistance (R) | Only needle-shaped brown lesion s- pots |
| 2 | R | Slightly large brown spots with diameter less than 1 mm |
| 3 | Medium re- sistance (MR) | Round or oval gray lesion which shows brown edge and appear diameter between 1-2 mm |
| 4 | Medium su- sceptibility (MS) | Typical spindle lesion which has leng- th between 1-2 cm. The lesion is us- ually confined between two veins of a leaf and the lesion area occupies less than 2.0% of a leaf |
| 5 | MS | Typical spindle lesion whose area occupies the leaf area between 2.1%- 10.0% |
| 6 | Susceptibility (S) | Typical spindle lesion whose area occupies the leaf area between 10.1%- 25.0% |
| 7 | S | Typical spindle lesion whose area occupies the leaf area between 25.1%- 50.0% |
| 8 | High sus- ceptibility (HS) | Typical spindle lesion whose area occupies the leaf area between 50.1%- 75.0% |
| 9 | HS | Typical spindle lesion whose area oc- cupies more than 75.1% of the leaf area |
新窗口打开|下载CSV
5.1.2 注意事项
(1) 控制好稻瘟病菌的生长和产孢条件。在直径9 cm 的CM培养基平皿中, 稻瘟病菌最适生长天数约为7天, 时间过长容易老化失活。使用番茄燕麦培养基产孢时, 需用纱布盖住平皿, 以利于通气和光照进而促进产孢。
(2) 根据接种水稻材料的数量确定番茄燕麦产孢平板的使用量。通常每个直径9 cm的产孢培养基产生的孢子量, 可制备约50-100 mL的105个·mL?1孢悬液, 供约10-20个水稻种植小区喷雾接种。
(3) 稻瘟病菌孢悬液需现配现用。稻瘟病菌孢悬液配制好后, 需在2小时内使用, 以避免放置时间过长而失活。
(4) 稻瘟病田间接种时需避免日照和注意保温。接种常在下午日落时或之后进行, 以避免阳光紫外线对稻瘟病菌造成伤害, 接种完成后用薄膜覆盖苗床过夜。
5.2 水稻分蘖期和孕穗期注射接种的稻瘟病抗性鉴定
水稻分蘖成熟阶段的叶片发病称为叶瘟, 一般在水稻分蘖盛期后产生, 严重时病斑密布且叶片枯焦, 甚至出现植株枯死。穗颈瘟发生在抽穗破口前, 水稻穗轴与稻穗的连接处, 常使穗颈节坏死, 形成瘪粒或白穗。育种实践中常通过聚合抗病基因来改良叶瘟和穗颈瘟抗性, 而采用有效的分蘖期和孕穗期抗性鉴定方法, 是实现抗病基因有效聚合和增强抗性的关键。5.2.1 实验流程
(1) 种植水稻材料: 按照5.1.1节所述方法准备水稻幼苗期材料。将苗床上生长1个月的秧苗移栽, 按每小区2行、每行12株移栽大田, 常规水肥管理。待水稻生长至分蘖盛期时进行注射接种, 以鉴定叶瘟; 待水稻生长至孕穗期时接种, 以鉴定穗颈瘟。
(2) 准备稻瘟病菌接种物: 按照5.1.1节所述方法培养稻瘟病菌, 并制备浓度为105个·mL?1的稻瘟病菌孢悬液。
(3) 注射接种: 用注射器将孢悬液缓慢注入分蘖盛期水稻植株茎秆的叶鞘(图2A), 每小区接种单行12株, 每株接种3个分蘖的茎秆, 每茎秆注射约1 mL孢悬液; 处于孕穗期的水稻植株, 注射方法为在距离水稻茎秆顶端约5-10 cm处, 将孢悬液注入稻茎中央部位(图3A), 直至心叶渗出孢悬液。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2水稻分蘖盛期注射接种稻瘟病菌及叶瘟病状
(A) 分蘖盛期注射接种叶鞘; (B) 叶瘟病斑。
Figure 2Evaluation of leaf blast disease resistance by injection inoculation at rice tillering stage
(A) Inoculation of rice sheath by injection of Magnaporthe oryzae spore suspension at the stage of tillering; (B) Blast disease symptoms in the rice leaf.
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3水稻孕穗期注射接种稻瘟病菌及穗颈瘟病状
(A) 水稻孕穗期注射接种; (B) 穗颈瘟病状。
Figure 3Evaluation of neck blast disease resistance by injection inoculation at rice booting stage
(A) Inoculation by injection of Magnaporthe oryzae spore suspension at the stage of booting; (B) Blast disease symptoms in the rice spike.
(4) 观察病情: 感病品种在分蘖盛期注射接种后约7天出现叶瘟(图2B), 而孕穗期注射接种后, 在稻穗灌浆成熟时产生穗颈瘟(图3B)。参照“水稻品种试验稻瘟病抗性鉴定与评价技术规程”的九级标准(表2)鉴定叶瘟发病程度, 根据穗颈瘟单穗损失率分级标准(表3)鉴定穗颈瘟的发病程度。
Table 3
表3
表3水稻穗颈瘟单穗损失率分级标准
Table 3
| Disease score | State of disease |
|---|---|
| 0 | No disease symptom |
| 1 | Blast disease symptom appears in primary or secondary branch of panicle and leads to less than 5.0% yield loss in each spike |
| 3 | Blast disease symptom appears in rice rachis or spike neck which leads to 5.1%-20.0% yield loss in each spike |
| 5 | Blast disease symptom appears in rice rachis or spike neck which leads to half-shriveled grain and 20.0%-50.0% yield loss in each spike |
| 7 | Blast disease symptom appears in rice spike neck which leads to shriveled kernel and 50.0%-70.0% yield loss in each spike |
| 9 | Blast disease symptom appears in rice spike neck which leads to more than 70.0% yield loss in each spike |
新窗口打开|下载CSV
5.2.2 注意事项
(1) 把握准确的接种时期。由于水稻稻瘟病注射接种通常在分蘖盛期或孕穗期进行, 因此需根据水稻生育期, 计划好接种时间。
(2) 水稻田间管理避免使用稻瘟病农药。为防止因使用杀真菌农药干扰抗性鉴定结果, 水稻种植期间应避免喷施稻瘟病防治农药。
5.3 水稻离体叶片戳伤接种的稻瘟病抗性鉴定
稻瘟病菌侵染水稻时, 需突破水稻的表皮物理屏障才能顺利进入寄主组织定殖。由于不同水稻品种表皮的机械强度各异, 故在抵御稻瘟病菌刺破表皮的能力方面存在差异, 导致抗性基因所介导的抗病表型鉴定不准确。水稻叶片戳伤接种法中, 稻瘟病菌不必刺破表皮即可进入水稻组织, 可规避水稻表皮物理屏障对侵染的阻碍作用, 适于鉴定水稻抗病基因所介导的抗性。5.3.1 实验流程
(1) 配置6-苄氨基嘌呤水溶液: 配置pH7.0的10 μg· mL-1 6-苄氨基嘌呤溶液, 分装至直径9 cm无菌培养皿, 每皿约30 mL。
(2) 准备水稻离体叶片: 选取生长至四叶期的水稻幼苗, 从幼苗同一部位剪取长6 cm的叶段, 使用10 μL的枪头轻轻戳点叶片, 每隔1.5 cm戳点1次, 每片叶上形成3个表皮伤口(图4A)。然后将叶片放入平皿, 使其漂浮于6-苄氨基嘌呤水溶液的表面, 每皿放置6-8片戳伤叶片(图4B)。
图4
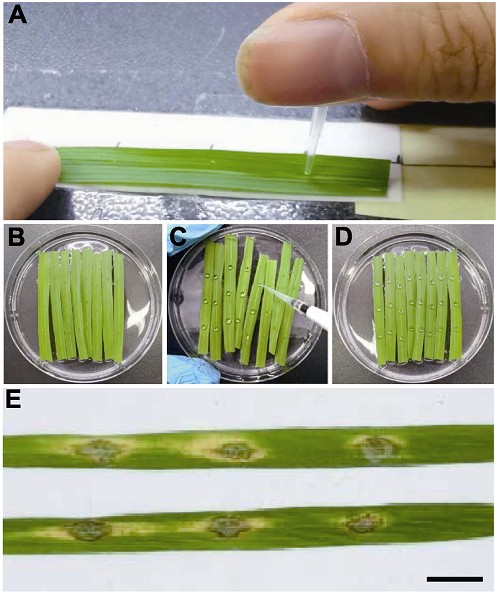 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4水稻离体叶片的点滴接种及稻瘟病病斑
(A) 采用10 μL移液器枪头对标1.5 cm的刻度戳伤水稻叶片; (B) 戳伤之后漂浮于平皿6-BA溶液中的水稻叶片; (C) 对戳伤叶片进行点滴接种; (D) 点滴接种之后的水稻叶片; (E) 水稻叶片上的病斑(Bar=1 cm)。
Figure 4Evaluation of blast disease resistance by inoculation of detached rice leaves
(A) Punching detached rice leaves using 10 μL pipette tips with 1.5 cm scale; (B) Rice leaves put on the surface of 6-BA solution after punching; (C) Inoculation of punched leaves by spotting spore suspension; (D) Rice leaves inoculated with spore suspension of Magnaporthe oryzae; (E) Blast lesions formed on detached rice leaves (Bar=1 cm).
(3) 制备孢悬液: 参照5.1.1节所述流程制备稻瘟病菌孢悬液, 调整孢悬液浓度至105个·mL?1, 备用。
(4) 孢悬液点滴接种叶片: 用10 μL的移液器取5 μL配制好的孢悬液, 滴至叶片的戳伤处(图4C, D)。接种完毕后盖上平皿盖, 置于25°C恒温光照培养箱。
(5) 观察发病情况: 接种当天用黑布遮盖平皿, 第2天移去黑布, 在25°C下14小时光照/10小时黑暗放置4-5天。
(6) 抗感性鉴别: 详见5.1.1节所述, 典型稻瘟病病斑呈纺锤形, 病斑中央呈灰色, 中央外围有褐色坏死, 最外层为淡黄色(图4E)。以褐色坏死为边界, 测量病斑长度, 统计20个以上病斑长度的平均值, 作为水稻抗感性指标。
5.3.2 注意事项
(1) 待测水稻叶片的来源部位需保持一致。为保证水稻叶片幼嫩程度一致和稻瘟病发病程度均一, 应剪取水稻植株同一部位的叶片(倒二叶较为合适)。
(2) 戳伤时避免刺穿水稻叶片。由于水稻四叶期的叶片较为幼嫩, 需控制戳伤力度, 防止水稻叶片被刺穿进而导致孢悬液在伤口处滴漏。
5.4 水稻分蘖期纹枯病田间接种鉴定
田间自然条件下, 水稻纹枯病的第一危害高峰通常发生在分蘖末期, 以侵染基部叶鞘为主。为避免病害自然发生的不均衡性影响抗性鉴定结果, 在田间进行纹枯病菌人工接种鉴定时, 需在分蘖末期前完成接种。此外, 考虑到田间鉴定主要是面向实际应用, 病害调查一般在抽穗后约30天病情稳定时进行。该方法主要适用于生育期相对集中、株高差异不太大, 且对育种应用价值评价要求高的水稻材料。5.4.1 实验流程
(1) 种植水稻材料: 每份水稻材料设置不低于3次重复, 每个重复种植3行, 每行不低于12株, 中间行的中间10株或以上用于接种; 常规病虫害管理, 但不施用广谱抗真菌药剂; 分蘖期至孕穗期的氮肥施用量可比正常水稻田多20%。
(2) 培养纹枯病菌: 将纹枯病菌菌块接种于PDA培养基, 28°C黑暗下培养2-3天后, 将1块活化的菌块传代至新的PDA培养基, 28°C黑暗下培养2天。
(3) 制备纹枯病菌木皮接种物: 将0.8 mm厚的木皮(图5A)剪为长1 cm、宽2 mm的木片, 放入直径为9 cm的玻璃培养皿中(图5B)。在灭菌后的培养皿内加入6 mL PDB培养液浸没木片; 挑取直径为8 mm的菌块, 置于皿中央; 用灭菌湿纱布盖好培养皿, 28°C黑暗下培养3天, 待木片表面布满菌丝, 即可用作接种物(图5C)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5分蘖期水稻纹枯病的田间木皮物接种鉴定
(A) 0.8 mm厚竖纹木皮; (B) 布满纹枯菌菌丝的木皮接种物(以下简称木皮接种物); (C) 木皮接种物表面菌丝的显微观测; (D) 用镊子将接种物嵌入自上而下第3叶鞘内侧; (E) 水稻分蘖期田间人工接种; (F) 高感水稻品种Lemont接种后11天的病情扩展情况; (G) 高感水稻品种Lemont抽穗后30天的病情扩展情况。
Figure 5Evaluation of sheath blight disease resistance in field by using wood veneer inoculation method at rice tillering stage
(A) Wood veneer with a thickness of 0.8 mm; (B) Wood veneer colonized with mycelia of Rhizoctonia solani (hereafter named wood inoculum); (C) Mycelia of R. solani on wood inoculum observed by micrograph; (D) Wood inoculum was put into inner side of the third leaf sheath from up to down by tweezer; (E) Rice plants in the field at tillering stage used for inoculation; (F) Sheath blight development in the highly susceptible rice variety Lemont at 11 days after inoculation in the field; (G) Disease symptoms of Lemont at 30 days after heading in the field.
(4) 纹枯菌接种及接种后的田间管理: 采用嵌入法接种, 于水稻分蘖末期前接种纹枯菌木片。用镊子将木皮接种物嵌入水稻主茎秆自上而下第3叶叶枕下1 cm处的叶鞘(倒3叶鞘)内侧(图5D)。此时, 倒2叶叶鞘不再伸长, 木片接种物可固定于此。每株水稻接种3个主分蘖, 接种后田间保持2-5 cm浅水层(图5E)。
(5) 纹枯病抗性评价: 于抽穗后约30天病情稳定时, 调查纹枯病的发病情况(图5F, G)。采用表4所述病情评价指标, 对所有有效分蘖的茎秆病级, 以病级和病情指数来评价抗感差异。使用病级作为评价指标时, 以每株中发病最重的3个茎秆病级的平均数表示相应植株的病级, 并进一步计算获得3个重复中累计30个植株的平均病级, 来表示相应品种/系的病级。以病情指数作为评价指标时, 每株的病情指数按照公式(病情指数=(9n9+8n8+7n7+6n6+5n5+4n4+3n3+2n2+ 1n1+0n0)/9N×100)计算获得。式中, n0-9是每种病级(1-9)的分蘖数, N是每个植株调查的总分蘖数; 进而可计算获得3个重复中累计30个植株的平均病情指数, 以此表示相应品种/系的病情指数。
Table 4
表4
表4田间纹枯病病级的评价标准
Table 4
| Disease sore | Sheath blight severity |
|---|---|
| 0 | Plant healthy, no symptoms |
| 1 | Lesions mainly restricted to the emerged portion of sixth sheath from top on the culm |
| 1.5 | Lesions extending to lower 1/2 of the emerged portion of fifth sheath from top on the culm |
| 2 | Lesions extending to upper 1/2 of the emerged portion of fifth sheath from top on the culm |
| 2.5 | Lesions extending to lower 1/2 of the emerged portion of fourth sheath from top on the culm |
| 3 | Lesions extending to upper 1/2 of the emerged portion of fourth sheath from top on the culm |
| 3.5 | Lesions extending to lower 1/2 of the emerged portion of third sheath from top on the culm |
| 4 | Lesions extending to upper 1/2 of the emerged portion of third sheath from top on the culm |
| 4.5 | Lesions extending to lower 1/2 of the emerged portion of second sheath from top on the culm |
| 5 | Lesions extending to upper 1/2 of the emerged portion of second sheath from top on the culm |
| 5.5 | Lesions extending to lower 1/4 of the emerged portion of flag leaf sheath from top on the culm |
| 6 | Lesions usually coalescing and reaching to lower 1/4 to 1/2 of the emerged portion of flag leaf sheath on the culm |
| 6.5 | Lesions usually coalescing and reaching to lower 1/2 to 3/4 of the emerged portion of flag leaf sheath on the culm |
| 7 | Lesions usually coalescing and reaching to upper 1/4 of the emerged portion of flag leaf sheath on the culm |
| 7.5 | Lesions usually coalescing and reaching to lower 1/2 of flag leaf on the culm, the flag leaf presenting semi-rolling or <50% flag leaf tissues affected |
| 8 | Lesions usually coalescing and reaching to upper 1/2 of flag leaf on the culm, more than 50% flag leaf tissues affected |
| 8.5 | Panicle rachis and culm with brown streak and becoming light brown, all sheath and leaf tissues dead and drying on the culms, florets in lower 1/3 of panicle often not filling on the culm |
| 9 | Panicle rachis and culm dead and becoming dry, severely affected culms lodging, florets in lower 1/3 to 1/2 or more of panicle not filling on the culm |
新窗口打开|下载CSV
5.4.2 注意事项
(1) 准备纹枯病菌时, PDB培养液不宜漫过木片太多, 否则菌丝不易附着于木片表面。夹取木片进行接种时, 应注意不要黏带过多木片四周的菌丝或培养基。
(2) 注意合适的水稻田间管理。考虑到田间影响发病程度的因素复杂, 田间鉴定时的生物学重复一般不低于3次; 种植管理过程中建议适当密植, 在分蘖至孕穗期适当增施氮肥, 接种前2天可以施1次氮肥, 促进水稻营养生长以利于发病; 病虫害防治中需尽量避免使用广谱抗真菌农药。
(3) 把握准确的接种时期和接种后管理。务必在分蘖末期前完成病原菌接种, 避免分蘖末期后田间的纹枯病自发量增加而影响人工接种效果。接种后田间应长期保持2 cm以上水层, 有利于保持田间高湿小气候。
(4) 本鉴定方法的优势是完全在自然条件下进行, 鉴定结果贴近育种实际。缺点是须有足够的试验田, 工作量大、周期长, 且难以排除生育期和株型对纹枯病抗性的影响。
5.5 水稻孕穗期温室接种的纹枯病抗性鉴定
孕穗至灌浆中期通常是水稻纹枯病严重发生的第二个关键时期, 也是对产量和品质影响最重要的生育阶段。因此, 对这一生育期的水稻材料进行温室抗性鉴定具有极其重要的意义。在温室进行接种鉴定, 有利于排除环境因素的干扰, 较精准地鉴别各材料的抗性差异。该方法鉴定结果重复性好且可靠性高, 适于对表型鉴定精度要求高的各类试验。5.5.1 实验流程
(1) 水稻材料的准备: 将水稻种子播种在装有营养土的长条形花盆(土面距盆顶约2-3 cm)中, 每盆4株, 在自然光照下培养至孕穗初期, 期间常规水肥管理, 确保每株均能产生足够的分蘖(一般要求每株不低于4个主分蘖) (图6A)。每份材料接种鉴定株数不低于6株, 可分设3个重复进行; 每株接种不低于3个茎秆。接种前10天不施真菌杀菌剂, 接种前2天增施适量氮肥并转移至温室进行适应性培养。接种前适当剪除植株基部的枯烂叶, 如小分蘖过多, 可用剪刀从基部剪除。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6水稻孕穗期温室木皮物接种的纹枯病抗性鉴定
(A) 生长于花盆中的孕穗期水稻植株; (B) 对孕穗期水稻的叶鞘接种纹枯病菌木皮; (C) 接种后置于温室中的水稻植株; (D) 感病品种接种21天后的纹枯病病状。
Figure 6Evaluation of sheath blight disease resistance in greenhouse by using wood veneer inoculation method at rice booting stage
(A) Rice plants at booting stage growing in flowerpots; (B) Inoculation of rice sheath with Rhizoctonia solani wood inoculum at booting stage; (C) Rice plants growth in greenhouse after inoculation; (D) Disease symptoms of susceptible rice variety at 21 days after inoculation.
(2) 纹枯菌接种物的准备: 参照5.4.1节所述方法准备纹枯病菌木皮接种物。
(3) 接种及接种后管理: 采用嵌入法接种, 用镊子将培养好的纹枯病菌木皮接种物放入自上而下第3叶叶枕下1 cm的叶鞘内侧(图6B), 确保接种后叶鞘的抱茎状态不变。接种后保证花盆中有不低于1 cm的水层, 将温室内温光条件设置为30°C下14小时光照/10小时黑暗(24°C), 利用喷雾加湿装置将温室湿度控制在75%-90% (图6C)。
(4) 纹枯病病情调查: 接种后14或21天出现明显的纹枯病病斑(图6D), 此时测量水稻剑叶叶枕至植株基部间的叶鞘长度(叶鞘总长度), 以及叶鞘上病斑最高点至最低点的长度(病斑长度), 用于计算平均相对病斑长度=(病斑长度×100%)/叶鞘总长度。按照表5所示的相对病斑长度标准(或通过估算病斑面积占叶鞘总面积的比例), 判断材料间的纹枯病抗性差异。
5.5.2 注意事项
(1) 培养壮苗是开展纹枯病温室精准鉴定的前提。选择种植培养水稻材料的花盆时, 尽可能选择深度不低于18 cm且宽度不低于23 cm的长条形花盆。培养盆中装入足够的土壤, 表面用无菌土覆盖。
(2) 选择恰当的病情调查时间。可根据鉴定材料的具体抗性情况, 选择感病材料病斑最先扩展至剑叶枕时为病情调查的时间点。
5.6 水稻离体茎秆纹枯病的抗性鉴定
相比于水稻分蘖期田间接种和孕穗期温室接种的抗病性鉴定方法, 离体茎秆接种鉴定法具有通量高和周期短的优势, 能有效避免生育期和株型这两个显著影响纹枯病抗性的干扰, 可用于大量水稻自然种质资源的纹枯病抗性初步评价。5.6.1 实验流程
(1) 纹枯病菌木皮接种物的准备: 参照5.4.1节所述方法准备纹枯病菌接种物。
(2) 搭建接种室: 在温光可控的人工气候室内, 搭建能保湿的接种室(图7A)。
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7水稻离体茎秆纹枯病接种鉴定方法
(A) 接种框架; (B) 使用嵌入法进行木皮接种物接种; (C) 接种后的培养室; (D) 高感品种Lemont接种后3天病斑的扩展情况; (E) Lemont接种7天后病斑的扩展情况。
Figure 7Methods for evaluation of sheath blight disease resistance by using detached stems of rice
(A) Inoculation shelves; (B) Inoculation of detached rice stem by using wood inoculum; (C) Growth chamber containing inoculated plants; (D) Sheath blight disease symptoms of the highly susceptible cultivar Lemont at three days after inoculation; (E) Sheath blight disease symptoms of the highly susceptible cultivar Lemont at seven days after inoculation.
(3) 种植水稻材料: 在大田正常温光条件下培育水稻, 确保植株健康。孕穗期选取长短一致且具有完全倒二叶叶鞘的主分蘖茎秆, 从倒二叶叶鞘基部茎节下方1 cm处剪断茎秆, 去除叶片, 保留倒一、倒二叶叶鞘和茎节。将茎秆浸水并放置于接种室中预培养24小时, 然后插入装有花泥的茎秆培养架。
(4) 接种及接种后管理: 采用嵌入法接种, 将培养好的木皮接种物放入叶枕下0.5 cm处的叶鞘内侧, 接种后将茎秆培养架置于接种室的框架内, 使整个接种培养装置位于盛水托盘内(图7B)。人工气候室的温光条件为30°C下14小时光照/10小时黑暗, 并通过加湿器和覆盖聚酯薄膜, 保证接种室内的湿度维持在75%-95% (图7C)。
Table 5
表5
表5离体茎秆接种鉴定法的纹枯病抗感分类标准
Table 5
| Relative lesion length (%) | 0-0.15 | 0.16-0.3 | 0.31-0.45 | 0.46-0.6 | 0.61-0.75 | 0.76-1.0 |
|---|---|---|---|---|---|---|
| Resistant level | HR | R | MR | MS | S | HS |
新窗口打开|下载CSV
(5) 病情调查: 密切观察病斑的发展情况(图7D)。当感病材料的病斑距试管架上表面约1 cm时(图7E), 测量各材料的叶鞘长度及其上的病斑长度。按照5.5.1节所述方法, 计算相对病斑长度, 并基于相对病斑长度划分水稻材料的纹枯病抗感强弱和类别(表5)。
5.6.2 注意事项
(1) 为确保茎秆的植株健康, 建议在大田自然条件下培育水稻, 并注意病虫害防治。为防止取样后的离体茎秆失水萎蔫, 最好在傍晚剪取茎秆, 并将叶片修剪至约2 cm长, 处理好的茎秆应立即放入水杯中, 创口不宜连续暴露空气中超过10分钟; 固定茎秆的花泥须提前用清水浸泡24小时, 期间换水3-4次。
(2) 做好接种和接种后管理。确保接种叶鞘的抱茎状态不变, 利用叶鞘自身的紧密包裹, 保证接种物上的菌丝不至于失水枯死。接种室覆盖的聚酯薄膜不能完全封闭, 要适当保持空气流通, 使接种室温度与人工气候室相当。
(3) 计划好鉴定水稻材料的数量。评定1份材料的抗性应接种不低于10个茎秆, 并设置3个重复。在1个12 m2的人工气候室内可以布置8个接种室, 每个接种室可放置4个塑料培养架, 每个培养架内可放置5个单排10孔的试管架, 1个鉴定周期为8-10天, 以每个材料10个茎秆计算, 1个月内可完成约500份水稻材料的抗性鉴定。
(4) 本鉴定方法适于在孕穗期接种, 孕穗期是纹枯病纵向传播和造成水稻损失的关键阶段。因此, 评价此时期离体茎秆的纹枯病抗性具有实际应用价值。但该法鉴定结果的分辨率低于水稻孕穗期温室接种鉴定法, 不太适于鉴别微弱抗性差异的材料。
(责任编辑: 孙冬花)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/mpp.2012.13.issue-7URL [本文引用: 1]
DOI:10.1016/j.pbi.2019.03.015URLPMID:31163394 [本文引用: 1]

Blast is arguably the most devastating fungal disease of rice. Systematic studies of this disease have made significant progress and identified many genes. Broad-spectrum resistance is highly preferred in agricultural practice. Here, we focus our discussion on resistance (R) and defense-regulator (DR) genes that confer broad-spectrum resistance to Magnaporthe oryzae, in particular those potentially causing no significant yield penalties. Recent advances show that broad-spectrum resistance can be achieved without significant yield penalties, or even with yield benefits. Cross talks of defense signaling mediated by these genes are present that may allow the host to integrate different anti-fungal factors against M. oryzae infection. We also summarize possible mechanisms underlying broad-spectrum resistance to rice blast.
DOI:10.1111/ppa.2015.64.issue-3URL [本文引用: 1]
DOI:10.1038/nrmicro2032URLPMID:19219052 [本文引用: 1]

The filamentous fungus Magnaporthe oryzae causes rice blast, the most serious disease of cultivated rice. Cellular differentiation of M. oryzae forms an infection structure called the appressorium, which generates enormous cellular turgor that is sufficient to rupture the plant cuticle. Here, we show how functional genomics approaches are providing new insight into the genetic control of plant infection by M. oryzae. We also look ahead to the key questions that need to be addressed to provide a better understanding of the molecular processes that lead to plant disease and the prospects for sustainable control of rice blast.
[本文引用: 1]
DOI:10.1038/ncomms2427URLPMID:23361014 [本文引用: 1]

Rhizoctonia solani is a major fungal pathogen of rice (Oryza sativa L.) that causes great yield losses in all rice-growing regions of the world. Here we report the draft genome sequence of the rice sheath blight disease pathogen, R. solani AG1 IA, assembled using next-generation Illumina Genome Analyser sequencing technologies. The genome encodes a large and diverse set of secreted proteins, enzymes of primary and secondary metabolism, carbohydrate-active enzymes, and transporters, which probably reflect an exclusive necrotrophic lifestyle. We find few repetitive elements, a closer relationship to Agaricomycotina among Basidiomycetes, and expand protein domains and families. Among the 25 candidate pathogen effectors identified according to their functionality and evolution, we validate 3 that trigger crop defence responses; hence we reveal the exclusive expression patterns of the pathogenic determinants during host infection.
水稻抗稻瘟病分子机制研究进展
1
2019
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
人工注射接种及田间病圃鉴定水稻对稻瘟病的抗病性
1
2015
... 实践证明, 挖掘水稻抗病资源并在育种中加以利用, 是控制病害流行和危害最经济有效的措施.长期以来, 育种家们投入了大量时间和精力, 从自然宝库中挖掘优异的抗病资源, 并将其应用于生产实践.抗病性鉴定上, 传统策略主要是在病害高发区进行自然鉴定.然而, 由于病害的自发程度受地理环境和气候条件限制, 加之病原菌高度变异, 流行的优势生理小种频繁更迭, 导致病害高发区的抗病性鉴定具有不可控性.此外, 育种基地一般远离病害高发区, 致使抗病性鉴定往往耗时费力, 因而抗病育种在实际操作中难以有效开展(
水稻主要病害生物防治的研究进展
1
2019
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
利用绿色荧光蛋白GFP研究稻瘟病菌与水稻的互作
1
2017
... 稻瘟病和纹枯病均属于真菌病害.稻瘟病由子囊菌稻瘟病菌(Magnaporthe oryzae)引起, 在水稻各生育期和不同部位均可发生, 其中以叶瘟和穗颈瘟最为常见.稻瘟病菌以菌丝体或分生孢子形式在病谷或病稻草上越冬, 作为下一年的侵染源.其侵染过程包括分生孢子黏附寄主表皮、萌发产生芽管、芽管末端分化形成附着胞、侵染钉刺穿寄主表皮、侵染菌丝增殖并杀伤植物组织和产孢及释放侵染单元等(
水稻稻瘟病抗性基因的克隆、育种利用及稻瘟菌无毒基因研究进展
1
2019
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
水稻抗纹枯病遗传育种研究进展
1
2010
... 稻瘟病和纹枯病均属于真菌病害.稻瘟病由子囊菌稻瘟病菌(Magnaporthe oryzae)引起, 在水稻各生育期和不同部位均可发生, 其中以叶瘟和穗颈瘟最为常见.稻瘟病菌以菌丝体或分生孢子形式在病谷或病稻草上越冬, 作为下一年的侵染源.其侵染过程包括分生孢子黏附寄主表皮、萌发产生芽管、芽管末端分化形成附着胞、侵染钉刺穿寄主表皮、侵染菌丝增殖并杀伤植物组织和产孢及释放侵染单元等(
The top 10 fungal pathogens in molecular plant pathology
1
2012
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
Recent advances in broad-spectrum resistance to the rice blast disease
1
2019
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
Pathotypic and genetic diversity in the population of Rhizoctonia solani AG1-IA causing rice sheath blight in China
1
2015
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
Under pressure: investigating the biology of plant infection by Magnaporthe oryzae
1
2009
... 稻瘟病和纹枯病均属于真菌病害.稻瘟病由子囊菌稻瘟病菌(Magnaporthe oryzae)引起, 在水稻各生育期和不同部位均可发生, 其中以叶瘟和穗颈瘟最为常见.稻瘟病菌以菌丝体或分生孢子形式在病谷或病稻草上越冬, 作为下一年的侵染源.其侵染过程包括分生孢子黏附寄主表皮、萌发产生芽管、芽管末端分化形成附着胞、侵染钉刺穿寄主表皮、侵染菌丝增殖并杀伤植物组织和产孢及释放侵染单元等(
Laboratory manual for physiological studies of rice
1
1976
... ● 离体茎秆纹枯病菌接种鉴定室的搭建: 在离体茎秆纹枯病抗性鉴定过程中, 需搭建1个接种鉴定室, 该室由铝合金型材框架、保湿托盘和聚酯薄膜组成.框架的长、宽、高为800 mm×400 mm×800 mm, 由横截面20 mm×20 mm的铝合金柱拼接而成.框架的侧面及顶面覆以聚酯薄膜(可用胶带固定, 但不能完全密封); 将搭建好的框架置于水深约7 cm的托盘内, 托盘的长、宽、高为925 mm×625 mm×140 mm.茎秆培养架包括长、宽、高为340 mm×270 mm× 130 mm的塑料盒、孔径为15 mm的试管架、花泥和营养液; 花泥使用前需用清水浸泡24小时, 营养液配制参照文献(
The evolution and pathogenic mechanisms of the rice sheath blight pathogen
1
2013
... 粮食是人类赖以生存和发展的物质基础, 其安全生产关乎社会的稳定及世界和平与发展.水稻(Oryza sativa)作为主要的粮食作物, 为世界约一半人口提供主食, 但病害(稻瘟病和纹枯病)等因素长期威胁着水稻的产量和品质, 给粮食生产带来巨大损失, 严重制约了水稻生产(
