 ,*山东农业大学园艺科学与工程学院, 作物生物学国家重点实验室, 泰安 271018
,*山东农业大学园艺科学与工程学院, 作物生物学国家重点实验室, 泰安 271018Effects of Sucrose on Seedling Growth and Development and SnRK1 Activity in Prunus persica
Shuhui Zhang, Hong Wang, Wenru Wang, Xuelian Wu, Yuansong Xiao, Futian Peng ,*State Key Laboratory of Crop Biology, College of Horticulture Science and Engineering, Shandong Agricultural University, Tai’an 271018, China
,*State Key Laboratory of Crop Biology, College of Horticulture Science and Engineering, Shandong Agricultural University, Tai’an 271018, China通讯作者:
责任编辑: 白羽红
收稿日期:2019-02-22接受日期:2019-05-17网络出版日期:2019-11-01
| 基金资助: |
Corresponding authors:
Received:2019-02-22Accepted:2019-05-17Online:2019-11-01

摘要
关键词:
Abstract
Keywords:
PDF (1162KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
张淑辉, 王红, 王文茹, 吴雪莲, 肖元松, 彭福田. 蔗糖对桃幼苗生长发育及其SnRK1酶活性的影响. 植物学报, 2019, 54(6): 744-752 doi:10.11983/CBB19032
Zhang Shuhui, Wang Hong, Wang Wenru, Wu Xuelian, Xiao Yuansong, Peng Futian.
SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(Smeekens et al., 2010; Yu et al., 2015)。Wurzinger等(2018)研究表明, SnRK1可以调节蔗糖和淀粉合成及相关酶基因的表达, 进而调控碳水化合物代谢, 影响植株生长发育。SnRK1蛋白激酶可以磷酸化调控硝酸还原酶(NR)、3-磷酸甘油醛脱氢酶(np-Ga3PDHase)、蔗糖磷酸合酶(SPS)和海藻糖磷酸合酶(TPS)等代谢酶活性, 进而调控代谢水平和维持能量平衡(Piattoni et al., 2011; Nukarinen et al., 2016)。Fujita等(2006)发现在低能条件下, SnRK1可以抑制氨基酸、蔗糖和脂质等物质合成过程中300多个基因的表达; 同时, 还可以促进蛋白质、纤维素和多糖等多元分解代谢过程中近300个基因的表达。植物可以感知能量信号, 通过SnRK1中心枢纽调控植物体复杂的代谢过程, 在一定程度上弥补能量缺失, 调节植物正常的生命活动。
糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(Ho et al., 2001; Rolland et al., 2006; Boriboonkaset et al., 2013)。研究表明, 外源蔗糖可以提供碳源, 维持青花菜(Brassica oleracea var. italica)采后高呼吸速率, 延缓其叶绿素降解(董栓泉等, 2016)。在培养基中加入50 mmol∙L-1蔗糖, 可解除microRNA156 (开花抑制因子)对成花的抑制作用(Yu et al., 2013)。蔗糖还可以减缓盐胁迫对植株的毒害。例如, 外源蔗糖可有效缓解盐、热及盐热共同胁迫对菠菜(Spinacia oleracea) PSII的伤害, 缓解其对光合作用的影响(邱念伟和邓樱, 2007); 外源蔗糖还可以缓解盐胁迫对荞麦(Fagopyrum esculentum)根系生长的抑制(刘丽萍等, 2006)。但是蔗糖作为外源物质对桃(Prunus persica)幼苗生长发育的影响尚未见报道。
研究表明, 马铃薯(Solanum tuberosum) SnRK1蛋白激酶可以响应高浓度蔗糖, 提高淀粉合成关键酶AGPase活性, 进而促进淀粉合成(Geigenberger et al., 2004)。而Jossier等(2009)发现生长在葡萄糖介质中的超表达KIN10 (SnRK1蛋白激酶的催化亚基)拟南芥(Arabidopsis thaliana)叶片淀粉含量低于野生型, 表明不同植株体内SnRK1蛋白激酶对外源糖类物质的响应不同。本研究通过外源施加蔗糖, 探讨其对桃幼苗SnRK1蛋白激酶活性及对植株生长发育的影响, 旨在为果树生产提供理论依据。
1 材料与方法
1.1 实验材料及处理
试材为桃(Prunus persica L. Batsch)实生苗。实生苗种子于2017年12月层积, 2018年4月选取芽饱满裂口的种子播种于50孔育苗盘中。1个月后, 取长势一致的桃幼苗定植于32 cm×25 cm的花盆中, 盆中土为园土:基质:蛭石=2:1:1 (v/v/v)。培养30天后, 选取长势一致的植株进行处理。实验设置2个处理。处理1: 施加不同浓度蔗糖考察其对桃幼苗SnRK1酶活的影响。设置的蔗糖溶液浓度为0%、1%、3%、5%和7%, 一次性浇透, 使溶液从盆底流出(1 000 mL)。处理7天后取样, 测定SnRK1酶活性。每处理设置3个重复, 每个重复6株桃幼苗。处理2: 以上述蔗糖溶液最适浓度(5%)进行处理, 以清水和5%甘露醇(与蔗糖具有相似的渗透性, 但不作为能量为植物提供营养)作为对照, 处理溶液体积为 1 000 mL。于0、3、6、9和12天取样, 进行相关指标的测定, 观察其对桃幼苗生长发育的影响。设置3个重复, 每个重复20株。
1.2 SnRK1酶活性测定
称取1 g鲜叶, 加入1 mL预冷的提取缓冲液(100 mmol∙L-1 N-三甲基甘氨酸氢氧化钠缓冲液(pH8)、25 mmol∙L-1氟化钠、5 mmol∙L-1二硫苏糖醇、2 mmol∙L-1焦磷酸钠、0.5 mmol∙L-1乙二胺四乙酸、0.5 mmol∙L-1 2-氨基乙醚四乙酸、1 mmol∙L-1苯乙醚、1 mmol∙L-1苯甲基磺酰氟、1 mmol∙L-1蛋白酶抑制剂Sigma P9599、磷酸酶抑制剂PhosStop、Roche及不溶性聚乙烯吡咯烷酮至终浓度为0.02 g∙L-1)。其中二硫苏糖醇在提取当天加入, 蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟用前加入, 于研钵中充分研磨, 其它步骤参照罗静静等(2017)的方法。以AMARA多肽为底物(Zhang et al., 2009; Debast et al., 2011), SnRK1酶活性用Universal Kinase Activity Kit (R&D Systems, USA)试剂盒测定。1.3 总RNA提取及qPCR分析
采用康为世纪科技有限公司的RNA提取试剂盒提取叶片总RNA, 利用Perfect Real Time (TaKaRa)反转录试剂盒合成cDNA第1链, 具体操作参照试剂盒说明书进行。通过Primer 5.0软件设计荧光定量所需引物(表1)。以Actin为内参, 用Ultra SYBR Mixture (with ROX)试剂盒(康为世纪)进行实时荧光定量PCR分析。所有反应均设3个重复, 采用2-ΔΔCT法进行数据分析。Table 1
表1
表1所用引物
Table 1
| Gene | Primer name | Primer sequence (5′-3′) |
|---|---|---|
| PpPIN1 (Ppa002944m) | P-PIN1-F | TAACAATACGACAGCGCATTACC |
| P-PIN1-R | TGAAGATCCTTACCACCATCCTC | |
| PpPIN2 (Ppa024134m) | P-PIN2-F | TTCGAATCTCACGGGAGTGG |
| P-PIN2-R | GAATCCACCTTGGAAACTGTTTG | |
| PpPIN3 (Ppa002528m) | P-PIN3-F | ATCTAACCTTACAGGCGCAGAGA |
| P-PIN3-R | GAGTCTCTTCGAAATTTGACGGT | |
| PpYUC2 (Ppa022204m) | P-YUC2-F | GACCCAGCAGTGTTCGATCA |
| P-YUC2-R | CTGCCTCCTCCAATTCTGGCT | |
| PpYUC6 (Ppa005244m) | P-YUC6-F | TCCTCCTCATCACCATCACA |
| P-YUC6-R | CCACAAGAGGCTATGCAATT | |
| PpActin | P-Actin-F | GTTATTCTTCATCGGCGTCTTCG |
| P-Actin-R | CTTCACCATTCCAGTTCCATTGTC |
新窗口打开|下载CSV
1.4 生理指标测定
于处理后0、3、6、9和12天, 参照赵世杰等(2002)的方法测定桃幼苗叶片和根系的可溶性糖和淀粉含量。采用CIRAS-3便携式光合仪(PPSystems, 英国)测定各处理功能叶片的净光合速率(Pn)。用叶绿素仪(SPAD502)测定功能叶片的叶绿素相对含量(SPAD)。于处理后13天采用整株破坏性取样, 根系用超纯水洗净后, 使用WinRHIZO根系分析系统(专业版)测定根系构型参数。用天平称量地上部和地下部鲜重, 统计植株生物量。采用高效液相色谱法测定植株根系的生长素含量。每处理随机选取3株进行取样, 数据取平均值, 重复3次。
1.5 统计分析
实验数据均为基于3次重复的平均值。利用Microsoft Excel 2007软件处理数据并作图。用SPSS 20.0软件的LSD法进行差异显著性检验。2 结果与讨论
2.1 外源蔗糖对桃幼苗SnRK1酶活性的影响
随着外源蔗糖浓度的增加, 桃叶片中SnRK1酶活性呈现先上升后下降趋势(图1)。当施加5%蔗糖时, SnRK1酶活性达到最高, 相比清水处理高27.47%; 施加7%蔗糖, SnRK1酶活性反而下降, 可能是过高浓度的蔗糖使根系细胞发生质壁分离, 从而影响植株的生长发育, 进而造成酶活性降低。图1
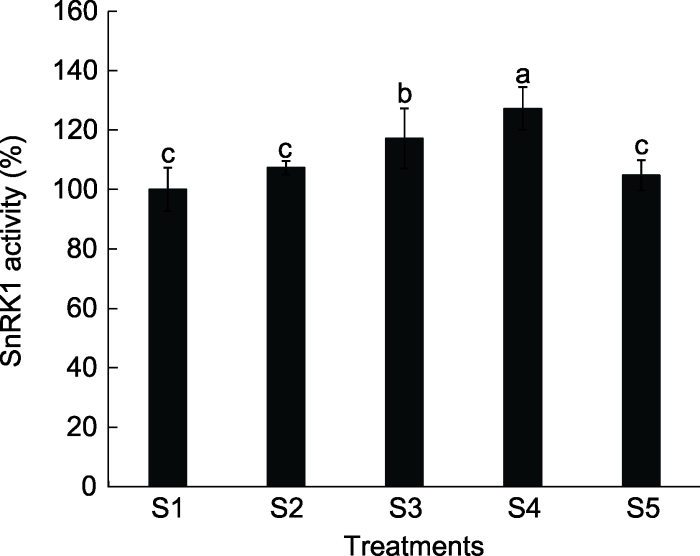 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同浓度蔗糖对桃幼苗SnRK1酶活性的影响
S1: 清水; S2: 1%蔗糖溶液; S3: 3%蔗糖溶液; S4: 5%蔗糖溶液; S5: 7%蔗糖溶液。不同小写字母表示处理间差异显著(P<0.05)。
Figure 1Effects of different sucrose concentrations on SnRK1 activity in peach seedlings
S1: Water; S2: 1% sucrose solution; S3: 3% sucrose solution; S4: 5% sucrose solution; S5: 7% sucrose solution. Different lowercase letters above the bars indicate significant differences among different treatmens (P<0.05).
以清水和5%甘露醇为对照, 用最适浓度5%蔗糖溶液处理, 观察不同处理时间桃幼苗叶片SnRK1酶活性(图2)。清水和甘露醇处理的桃幼苗叶片SnRK1酶活性呈先上升后下降趋势, 这可能与植株体内能量变化有关, 而蔗糖处理的桃幼苗叶片SnRK1酶活性处于持续增加的趋势; 处理后3、6、9和12天, 蔗糖比清水处理的叶片SnRK1酶活性分别提高了21.18 %、16.56%、55.41%和104.61%, 比甘露醇处理分别提高了29.45%、19.31%、84.16%和156.88%。
图2
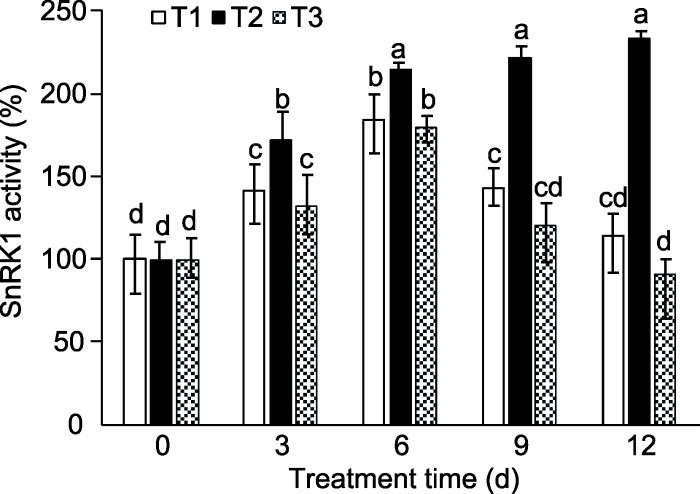 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同蔗糖处理时间对桃幼苗SnRK1酶活性的影响
T1: 清水; T2: 5%蔗糖溶液; T3: 5%甘露醇溶液。不同小写字母表示处理间差异显著(P<0.05)。
Figure 2Effects of sucrose treatment on SnRK1 activity in peach seedlings
T1: Water; T2: 5% sucrose solution; T3: 5% mannitol solution. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
2.2 外源蔗糖对桃可溶性糖和淀粉含量的影响
外源蔗糖的加入使桃幼苗叶片(图3A)和根系(图3B)中可溶性糖含量相比对照都显著提高。处理后3、6、9和12天, 相比清水处理, 处理组叶片可溶性糖含量分别提高了12.27%、14.68%、24.38%和29.92%, 根系中分别提高了77.84%、59.90%、73.03%和78.34 %; 甘露醇处理组随着时间的延长, 植株叶片和根系中可溶性糖含量有所下降, 这充分说明外源施加蔗糖可提高植株体内可溶性糖含量, 且根系效果更明显。图3
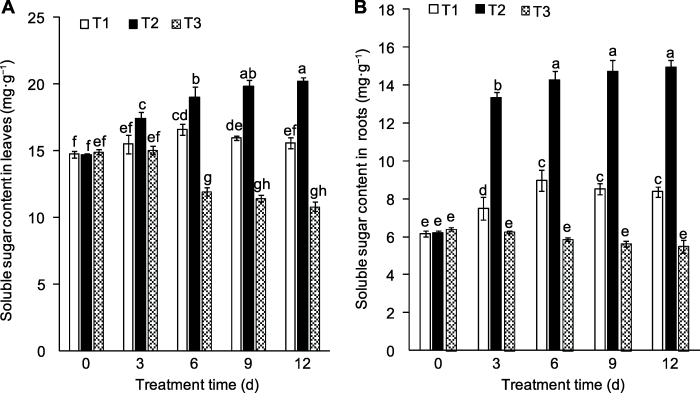 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3外源蔗糖对桃幼苗叶片(A)和根系(B)可溶性糖含量的影响
T1-T3同
Figure 3Effects of exogenous sucrose on soluble sugar contents in leaves (A) and roots (B) of peach seedlings
T1-T3 see Ffddigure 2. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
外源蔗糖对桃幼苗叶片淀粉含量的影响(图4A) 与可溶性糖(图3A)相似。相比其对可溶性糖的影响, 外源蔗糖对植株叶片和根系中淀粉积累的促进效果更显著(图4B)。
图4
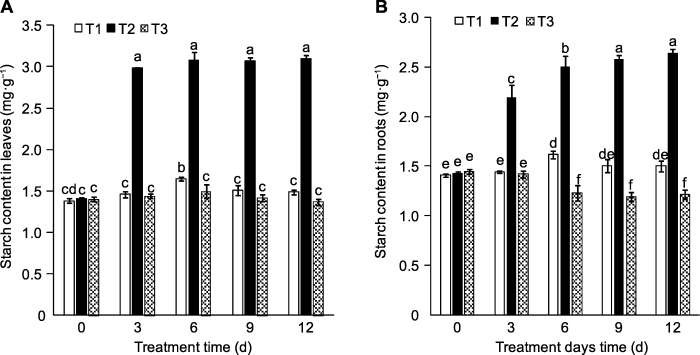 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4外源蔗糖对桃幼苗叶片(A)和根系(B)淀粉含量的影响
T1-T3同
Figure 4Effects of exogenous sucrose on starch contents in leaves (A) and roots (B) of peach seedlings
T1-T3 see Ffddigure 2. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
2.3 外源蔗糖对桃叶绿素含量及净光合速率的影响
不同时间内, 施加外源蔗糖后, 植株叶绿素含量明显高于对照(图5A), 且随时间的延长, 差异越显著。处理3、6、9和12天, 相比清水对照处理, 叶绿素含量分别提高15.59%、27.96%、34.98%和47.49%; 而甘露醇处理后, 功能叶片叶绿素含量相比清水处理明显下降, 表明适当浓度的外源蔗糖有利于植株生长发育。图5
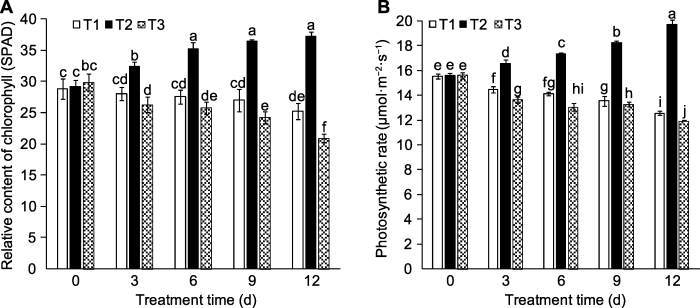 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5外源蔗糖对桃功能叶片叶绿素相对含量(A)和净光合速率(B)的影响
T1-T3同
Figure 5Effects of exogenous sucrose on relative content of chlorophyll (A) and photosynthetic rate (B) of peach leaves
T1-T3 see Ffddigure 2. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
为进一步探明蔗糖对光合能力的影响, 我们于处理3、6、9和12天的上午10:00测定不同处理桃幼苗功能叶片的净光合速率(图5B)。结果表明, 外源蔗糖的施加明显提高植株净光合速率。
2.4 外源蔗糖对桃生物量的影响
5%外源蔗糖可显著提高植株地上部和地下部鲜重(图6)。相比清水处理, 蔗糖处理后地上部和地下部鲜重分别增长了110.76%和80.21%; 相比甘露醇处理, 分别增长了141.81%和133.44%。图6
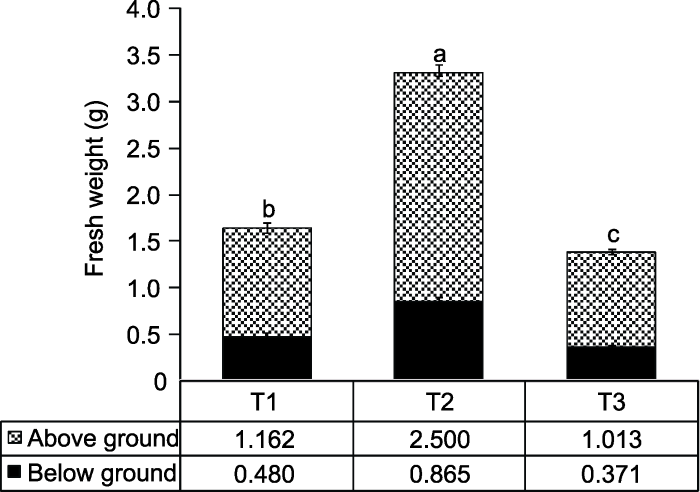 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6外源蔗糖对桃幼苗鲜重的影响
T1-T3同
Figure 6Effects of exogenous sucrose on fresh weight of peach seedlings
T1-T3 see Ffddigure 2. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
2.5 外源蔗糖对桃根系构型的影响
外源蔗糖促进根系生长, 5%蔗糖处理显著增加植株的一级和二级侧根数量, 同时促进根系加长加粗生长, 根系总长度和总表面积显著高于对照(表2; 图7)。与清水处理相比, 蔗糖处理后根系的一级侧根数、二级侧根数、根系总长度及根系总表面积分别提高77.58%、173.31%、70.45%和81.46%, 表明适当浓度的蔗糖可以正向调控根系生长, 尤其有利于侧根的发生。Table 2
表2
表2外源蔗糖对桃幼苗根系构型的影响
Table 2
| Experimental treatments | Number of primary lateral roots | Number of secondary lateral roots | Total root length (cm) | Total root surface area (cm2) |
|---|---|---|---|---|
| T1 | 235.00±14.42 b | 123.67±7.02 b | 86.63±6.01 b | 9.82±1.00 b |
| T2 | 417.33±14.47 a | 338.00±12.77 a | 147.66±14.99 a | 17.82±1.49 a |
| T3 | 107.67±8.96 c | 62.67±7.64 c | 67.67±3.71 c | 6.75±0.54 c |
新窗口打开|下载CSV
图7
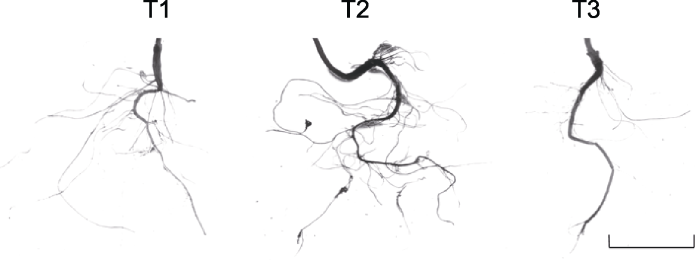 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7外源蔗糖对桃幼苗根系表型的影响
T1-T3同
Figure 7Effects of exogenous sucrose on roots phenotype of peach seedlings
T1-T3 see Ffddigure 2. Bar=3 cm
2.6 外源蔗糖对桃根系生长素含量及基因表达的影响
为进一步探究外源蔗糖对根系构型的影响, 我们测定了桃根系中生长素含量, 结果表明, 与清水处理相比, 外源蔗糖处理后, 根系中生长素含量显著增加(34.04%), 相比甘露醇处理提高近2倍(图8A)。通过qRT-PCR检测根系中与生长素相关基因的表达情况, 结果(图8B-F)表明, 蔗糖处理后, 无论是生长素转运相关基因(PpPIN1、PpPIN2和PpPIN3), 还是生长素合成相关基因(PpYUC2和PpYUC6)的表达量较清水处理均明显上调; 而甘露醇处理后基因表达量明显下调。这说明外源蔗糖对根系构型的影响可能是由于其正向调控生长素相关基因的表达所致。图8
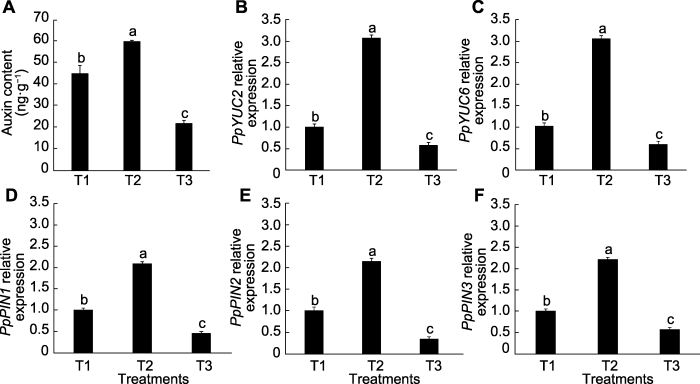 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8外源蔗糖对桃幼苗根系生长素含量(A)和基因表达量(B-F)的影响
T1-T3同
Figure 8Effects of exogenous sucrose on auxin content (A) and gene expression (B-F) in peach seedling roots
T1-T3 see Ffddigure 2. Different lowercase letters above the bars indicate significant differences among different treatments (P<0.05).
2.7 讨论
糖是反映植物能量水平的关键物质, 植物对糖水平持续感知和能量供给的控制是其存活的重要条件。而SnRK1蛋白激酶作为能量感受器, 在植株代谢、生长发育及胁迫响应过程中起非常重要的调节作用, 其活性受糖代谢的影响, 且不同植株体内SnRK1酶活性对糖浓度响应不同(Geigenberger et al., 2004; Jossier et al., 2009; Emanuelle et al., 2016)。本研究表明, 对于桃幼苗来说, 5%蔗糖浓度是调控SnRK1的最适浓度, 且在一定时间范围内, 随着作用时间的延长, SnRK1酶活性不断增加。植株生长发育进程是一个高度需求能量的过程, 呼吸作用、蛋白质的生物合成和对环境刺激的应答均需要糖物质提供能量和碳骨架。而蔗糖是植物体内糖类物质的主要形式之一, 其在植株生长发育和逆境响应过程中起重要作用(Lastdrager et al., 2014)。本研究表明, 外源蔗糖可显著增加桃幼苗叶片和根系中可溶性糖和淀粉含量, 及叶片叶绿素含量, 提高净光合速率, 最终使植物地上部和地下部的生物量增加。其原因可能是外源蔗糖促进SnRK1酶活性, 进而调控植株能量代谢, 最终影响植株生长发育。
根系是植物根本, 尤其对于多年生果树来说, 根系是其生长发育的基础。根系除了固定、吸收、合成、分泌、输导和贮藏等基本功能外, 还可以感知土壤微环境的变化, 使植物更好地适应环境。提高根系生长状况是果树适应逆境、提高果实产量及改善果实品质的关键所在。在栽培方面也可采取一定措施促进植株根系生长, 进而提高果实产量和品质(杨凯等, 2015; 郭承彬等, 2018)。本研究显示, 外源蔗糖可显著增加植株的一级和二级侧根数量, 同时促进根系加长加粗生长, 使根系总长度和总表面积显著高于对照。我们通过测定根系中生长素含量及检测相关基因表达量可知, 外源蔗糖显著增加桃幼苗根系中生长素含量, 且上调生长素合成和转运基因的表达, 而甘露醇并不能诱导生长素的合成和转运。这可能是由于蔗糖可作为信号物质, 通过调控生长素的合成和转运促进根系生长。
3 结论
一定浓度的蔗糖可以促进桃幼苗叶片SnRK1酶活性增加, 提高叶片和根系可溶性糖、淀粉和叶片叶绿素含量, 增加植株地上部和地下部的生物量, 显著提高植株净光合速率; 同时外源蔗糖可以显著增加根系总表面积和总体积, 增加侧根数量, 促进根系加粗加长生长, 且能促进根系中生长素的合成和转运。但是蔗糖对SnRK1酶活性的具体调控机制及SnRK1调控的糖信号与生长素信号是否共同调控植株生长发育还需深入研究。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
蔗糖在延缓青花菜黄化过程中维持其能量和抗氧化力
1
2016
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
果树根系生长发育的研究进展及调控应用
1
2018
... 根系是植物根本, 尤其对于多年生果树来说, 根系是其生长发育的基础.根系除了固定、吸收、合成、分泌、输导和贮藏等基本功能外, 还可以感知土壤微环境的变化, 使植物更好地适应环境.提高根系生长状况是果树适应逆境、提高果实产量及改善果实品质的关键所在.在栽培方面也可采取一定措施促进植株根系生长, 进而提高果实产量和品质(
外源蔗糖对盐胁迫荞麦幼苗根系生长的缓解效应
1
2006
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
桃PpSnRK1α在番茄中过表达对营养胁迫下植株生长的影响
1
2017
... 称取1 g鲜叶, 加入1 mL预冷的提取缓冲液(100 mmol∙L-1 N-三甲基甘氨酸氢氧化钠缓冲液(pH8)、25 mmol∙L-1氟化钠、5 mmol∙L-1二硫苏糖醇、2 mmol∙L-1焦磷酸钠、0.5 mmol∙L-1乙二胺四乙酸、0.5 mmol∙L-1 2-氨基乙醚四乙酸、1 mmol∙L-1苯乙醚、1 mmol∙L-1苯甲基磺酰氟、1 mmol∙L-1蛋白酶抑制剂Sigma P9599、磷酸酶抑制剂PhosStop、Roche及不溶性聚乙烯吡咯烷酮至终浓度为0.02 g∙L-1).其中二硫苏糖醇在提取当天加入, 蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟用前加入, 于研钵中充分研磨, 其它步骤参照
外源蔗糖显著缓解盐和热胁迫对菠菜PSII颗粒的伤害
1
2007
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
果树根系分布研究进展
1
2015
... 根系是植物根本, 尤其对于多年生果树来说, 根系是其生长发育的基础.根系除了固定、吸收、合成、分泌、输导和贮藏等基本功能外, 还可以感知土壤微环境的变化, 使植物更好地适应环境.提高根系生长状况是果树适应逆境、提高果实产量及改善果实品质的关键所在.在栽培方面也可采取一定措施促进植株根系生长, 进而提高果实产量和品质(
1
2002
... 于处理后0、3、6、9和12天, 参照
Regulation of some carbohydrate metabolism-related genes, starch and soluble sugar contents, photosynthetic activities and yield attributes of two contrasting rice genotypes subjected to salt stress
1
2013
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
Altering trehalose-6-phosphate content in transgenic potato tubers growth and alters responsiveness to hormones during sprouting
1
2011
... 称取1 g鲜叶, 加入1 mL预冷的提取缓冲液(100 mmol∙L-1 N-三甲基甘氨酸氢氧化钠缓冲液(pH8)、25 mmol∙L-1氟化钠、5 mmol∙L-1二硫苏糖醇、2 mmol∙L-1焦磷酸钠、0.5 mmol∙L-1乙二胺四乙酸、0.5 mmol∙L-1 2-氨基乙醚四乙酸、1 mmol∙L-1苯乙醚、1 mmol∙L-1苯甲基磺酰氟、1 mmol∙L-1蛋白酶抑制剂Sigma P9599、磷酸酶抑制剂PhosStop、Roche及不溶性聚乙烯吡咯烷酮至终浓度为0.02 g∙L-1).其中二硫苏糖醇在提取当天加入, 蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟用前加入, 于研钵中充分研磨, 其它步骤参照
Molecular insights into the enigmatic metabolic regulator, SnRK1
1
2016
... 糖是反映植物能量水平的关键物质, 植物对糖水平持续感知和能量供给的控制是其存活的重要条件.而SnRK1蛋白激酶作为能量感受器, 在植株代谢、生长发育及胁迫响应过程中起非常重要的调节作用, 其活性受糖代谢的影响, 且不同植株体内SnRK1酶活性对糖浓度响应不同(
Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks
1
2006
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
Metabolic control analysis and regulation of the conversion of sucrose to starch in growing potato tubers
2
2004
... 研究表明, 马铃薯(Solanum tuberosum) SnRK1蛋白激酶可以响应高浓度蔗糖, 提高淀粉合成关键酶AGPase活性, 进而促进淀粉合成(
... 糖是反映植物能量水平的关键物质, 植物对糖水平持续感知和能量供给的控制是其存活的重要条件.而SnRK1蛋白激酶作为能量感受器, 在植株代谢、生长发育及胁迫响应过程中起非常重要的调节作用, 其活性受糖代谢的影响, 且不同植株体内SnRK1酶活性对糖浓度响应不同(
Sugar coordinately and differentially regulates growth and stress- related gene expression via a complex signal transduction network and multiple control mechanisms
1
2001
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
SnRK1 (SNF1related kinase 1) has a central role in sugar and ABA signaling in Arabidopsis thaliana
2
2009
... 研究表明, 马铃薯(Solanum tuberosum) SnRK1蛋白激酶可以响应高浓度蔗糖, 提高淀粉合成关键酶AGPase活性, 进而促进淀粉合成(
... 糖是反映植物能量水平的关键物质, 植物对糖水平持续感知和能量供给的控制是其存活的重要条件.而SnRK1蛋白激酶作为能量感受器, 在植株代谢、生长发育及胁迫响应过程中起非常重要的调节作用, 其活性受糖代谢的影响, 且不同植株体内SnRK1酶活性对糖浓度响应不同(
Sugar signals and the control of plant growth and development
1
2014
... 植株生长发育进程是一个高度需求能量的过程, 呼吸作用、蛋白质的生物合成和对环境刺激的应答均需要糖物质提供能量和碳骨架.而蔗糖是植物体内糖类物质的主要形式之一, 其在植株生长发育和逆境响应过程中起重要作用(
Quantitative phosphoproteomics reveals the role of the AMPK plant ortholog SnRK1 as a metabolic master regulator under energy deprivation
1
2016
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
Nonphosphorylating glyceraldehyde-3-phosphate dehydrogenase is phosphorylated in wheat endosperm at serine-404 by an SNF1-related protein kinase allosterically inhibited by ribose-5-phosphate
1
2011
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
Sugar sensing and signaling in plants: conserved and novel mechanisms
1
2006
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
Sugar signals and molecular networks controlling plant growth
1
2010
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
The SnRK1 kinase as central mediator of energy signaling between different organelles
1
2018
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
Sugar is an endogenous cue for juvenile-to-adult phase transition in plants
1
2013
... 糖是光合作用的主要产物, 是植物体内重要的有机物, 可为植物提供生长发育所需能量, 也可以通过代谢途径合成细胞结构、氨基酸以及蛋白质的碳骨架, 同时糖还可以作为信号分子, 调节相关基因或酶的活性, 从而调控植物生长发育和逆境响应(
Source-sink communication: regulated by hormone, nutrient, and stress cross-signaling
1
2015
... SnRK1蛋白激酶(蔗糖非发酵-1-蛋白激酶-1)作为能量感受器, 在植物生长发育、代谢及胁迫应答等多种过程中发挥重要作用(
Inhibition of SNF1-related protein kinase 1 activity and regulation of metabolic pathways by trehalose-6-phosphate
1
2009
... 称取1 g鲜叶, 加入1 mL预冷的提取缓冲液(100 mmol∙L-1 N-三甲基甘氨酸氢氧化钠缓冲液(pH8)、25 mmol∙L-1氟化钠、5 mmol∙L-1二硫苏糖醇、2 mmol∙L-1焦磷酸钠、0.5 mmol∙L-1乙二胺四乙酸、0.5 mmol∙L-1 2-氨基乙醚四乙酸、1 mmol∙L-1苯乙醚、1 mmol∙L-1苯甲基磺酰氟、1 mmol∙L-1蛋白酶抑制剂Sigma P9599、磷酸酶抑制剂PhosStop、Roche及不溶性聚乙烯吡咯烷酮至终浓度为0.02 g∙L-1).其中二硫苏糖醇在提取当天加入, 蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟用前加入, 于研钵中充分研磨, 其它步骤参照
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
