 ,*复旦大学生命科学学院, 上海 200438
,*复旦大学生命科学学院, 上海 200438Chromosome Behaviors of Male Meiocytes by Chromosome Spread in Arabidopsis thaliana
Wanyue Xu, Yingxiang Wang ,*School of Life Sciences, Fudan University, Shanghai 200438, China
,*School of Life Sciences, Fudan University, Shanghai 200438, China通讯作者:
责任编辑: 孙冬花
收稿日期:2019-07-10接受日期:2019-07-31网络出版日期:2019-09-01
| 基金资助: |
Corresponding authors:
Editor:
Received:2019-07-10Accepted:2019-07-31Online:2019-09-01

摘要
关键词:
Abstract
Keywords:
PDF (1610KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
徐婉约, 王应祥. 染色体展片法观察拟南芥雄性减数分裂过程中的染色体形态. 植物学报, 2019, 54(5): 620-624 doi:10.11983/CBB19127
Xu Wanyue, Wang Yingxiang.
减数分裂是真核生物进行有性生殖的必需过程。不同于有丝分裂过程中DNA复制1次, 细胞核分裂1次; 减数分裂过程中DNA复制1次, 细胞核分裂2次, 最终使染色体数目减半, 产生单倍体配子。减数分裂I包括前期I、中期I、后期I和末期I, 其中前期I又细分为细线期、偶线期、粗线期、双线期和终变期。减数分裂II类似于有丝分裂, 包括前期II、中期II、后期II和末期II (Ma, 2006)。
减数分裂I是减数分裂特异的核心过程, 涉及同源染色体配对、联会、重组和分离(Wang and Copenhaver, 2018)。下面对显微镜下观察到的各个时期染色体形态做一个简单描述。当加倍复制后的染色单体进入减数分裂后, 染色体开始逐步浓缩使得在光学显微镜下可见细线状的染色体, 该时期称为细线期; 随后同源染色体开始配对, 部分区域启动联会, 空间上1对同源染色体靠的较近, 显微镜下观察类似平行线, 称为偶线期; 当同源染色体完全联会(伴随着染色体进一步浓缩), 在光学显微镜下呈现较粗的线状结构, 即为粗线期; 然后同源染色体间的联会解除, 仅在交叉结位置仍连接在一起, 其它部位均已分开, 称为双线期; 终变期时染色体浓缩至短棒状的二价体。中期I时同源二价体在纺锤体的牵拉下, 整齐排列在细胞中部的赤道板上; 至后期I均匀地分离到细胞两极; 末期I染色体开始去浓缩, 在细胞两极形成簇状结构。前期II, 染色体开始再次浓缩, 在两极形成圆球状结构; 至中期II, 姐妹染色体在纺锤体的牵拉下分别排列在赤道板上; 到后期II, 每组姐妹染色单体对等地分离到细胞两极; 至末期II, 染色体去浓缩, 形成4个单倍体的核, 并经过胞质分裂形成4个单倍体小孢子(图1)。
模式植物拟南芥具有基因组小(The Arabidopsis Genome Initiative, 2000)、生长周期短、生殖器官多、突变体资源丰富、易于遗传分析及转基因相对容易等特点(Sanchez-Moran and Armstrong, 2014), 被认为是研究减数分裂的传统优势材料。植物雄性和雌性减数分裂分别发生在生殖器官花药和胚珠中, 模式植物拟南芥的花药发育分为14个时期, 而减数分裂发生在第4-7期(Sanders et al., 1999)。由于雄性器官不仅花药数目多而且取材方便, 相比于雌性减数分裂研究更加容易。我们对拟南芥雄性减数分裂过程中染色体形态观察的染色体展片法作一描述。该方法同时也适用于非模式植物, 如水稻(Oryza sativa)、大豆(Glycine max)和黄瓜(Cucumis sativus)。
1 材料和试剂
植物材料: 拟南芥(Arabidopsis thaliana L.)。试剂和其它材料: 抗体酶、60%冰乙酸、4', 6-二脒基-2-苯基吲哚(DAPI)、卡诺试剂、即用型山羊血清、去离子甲酰胺、Wash buffer II、载玻片和盖玻片。
2 试剂配方
l 抗体酶: 3%纤维素酶、3%果胶酶和5%蜗牛酶, 4°C过夜, 溶解于0.01 mol.L-1 pH=4.5的柠檬酸缓冲液中, 分装于2 mL离心管中, -20°C保存l DAPI: VECTASHIELD公司, X0204l 卡诺试剂: 乙醇:乙酸=3:1 (v/v), -20°C保存
l 即用型山羊血清: 博士德生物公司, AR0009
l 去离子甲酰胺: Roche公司, 039K1407
l Wash buffer II: 1×PBS溶液, 0.1% Tween20
l 着丝粒探针: 通过公司合成3段带有CY5标记的着丝粒探针, 等量混合使用。
Cen180_oligo1: CY5-GGTGTAGCCAAAGTCCRTATGAGTCTTTGK; Cen180_oligo2: CY5-TCTTATACTCAATCATACACATGACATCW; Cen180_ oligo3: CY5-AGTCATATTYGACTCCAAAACACTAACC。
3 设备与软件
实验设备包括电热恒温水浴锅(DK-S22型, 上海一恒科技有限公司)、电热板(金坛市科博实验设备研究所)、体式解剖镜(SMZ-161-BLED, Motic)和荧光显微镜(ScopA1/A2, Zeiss)。4 实验程序
4.1 拟南芥的种植
(1) 温室条件 温度22°C, 相对湿度约为75%, 16小时光照/ 8小时黑暗;(2) 培养土壤 蛭石:黑土:珍珠岩=9:3:1 (v/v/v)混匀, 灭菌后使用;
(3) 种植方法 将烘干后的拟南芥种子置于滤纸上, 用牙签逐粒播种于浸湿的土壤表面, 并在培养盆上覆盖保鲜膜保湿。5-7天后揭膜, 每个培养盆保留4-6株小苗, 用镊子拔去多余小苗。4-5周抽薹, 6-8周的花序可用于染色体展片。
4.2 染色体展片
(1) 取材时间 温室中开始, 照明2-5小时取拟南芥花序(见注意事项1), 室温下在卡诺试剂中固定2小时以上(见注意事项2);(2) 取出花序, 用灭菌水漂洗3次;
(3) 在体视镜下去除黄色的花苞(见注意事项3), 将白色的花序置于稀释1倍的抗体酶中, 37°C酶解18-20分钟(见注意事项4);
(4) 用移液枪吸出酶解液, 用灭菌水将花序漂洗3次;
(5) 用镊子将花序移至载玻片上, 在体视镜下用1 mL注射器的针头分离出处于减数分裂期的花苞, 除去萼片及花瓣, 只留下4-7期花药;
(6) 用针头及镊子将花药转移到新的载玻片上, 每张载玻片上放20-30个花药, 在体视镜下将花药夹碎至没有大的碎块, 在此过程中滴加灭菌水以保持花药湿润;
(7) 将玻片转移至45°C热台上, 待玻片上的液体加热至只剩1层水膜时, 用移液枪在样品中央逐滴滴加20-40 μL 60%冰乙酸, 并用移液枪吹打3-4次使之混匀, 静置1分钟;
(8) 在冰乙酸液滴中央逐滴滴加-20°C预冷的卡诺试剂20-40 μL, 液滴呈波纹状向四周扩散, 形成圆形的碎片带;
(9) 玻片在热台上烘干后, 在避光处向样品处滴加7-10 μL DAPI, 并覆盖盖玻片, 避光静置5-10分钟后可镜检及拍照(图1)。
4.3 荧光原位杂交(FISH)
(1) 在湿盒中垫入1张纸巾并加入适量水保湿, 将展片法(4.2节(8))制好的片子在热台上烘干后放入湿盒, 每张片子滴加100 μL 70%甲酰胺, 并覆盖24 mm×50 mm盖玻片;(2) 将片盒放入85°C烘箱, 加热变性5分钟, 取出玻片, 揭掉盖玻片, 将载玻片迅速放入装有-20°C预冷的70%乙醇的洗缸中, 置于水平摇床低速震荡5分钟;
(3) 取出载玻片, 用无水乙醇缓慢滴在玻片上冲洗3次(见注意事项5), 自然风干;
(4) 用即用型山羊血清按照1:200稀释着丝粒探针, 吸取20 μL稀释过的着丝粒探针杂交液滴加至载玻片上, 并覆盖24 mm×50 mm盖玻片(见注意事项6);
(5) 将玻片置于湿盒中, 并将湿盒放入37°C烘箱2小时以上;
(6) 取出玻片, 放入装有Wash buffer II的洗缸中清洗, 水平摇床低速震荡5分钟, 重复3次;
(7) 取出玻片, 避光自然风干后向样品处滴加7-10 μL DAPI, 并覆盖盖玻片, 避光静置5-10分钟后可镜检及拍照(图2) (Wang et al., 2014)。
图1
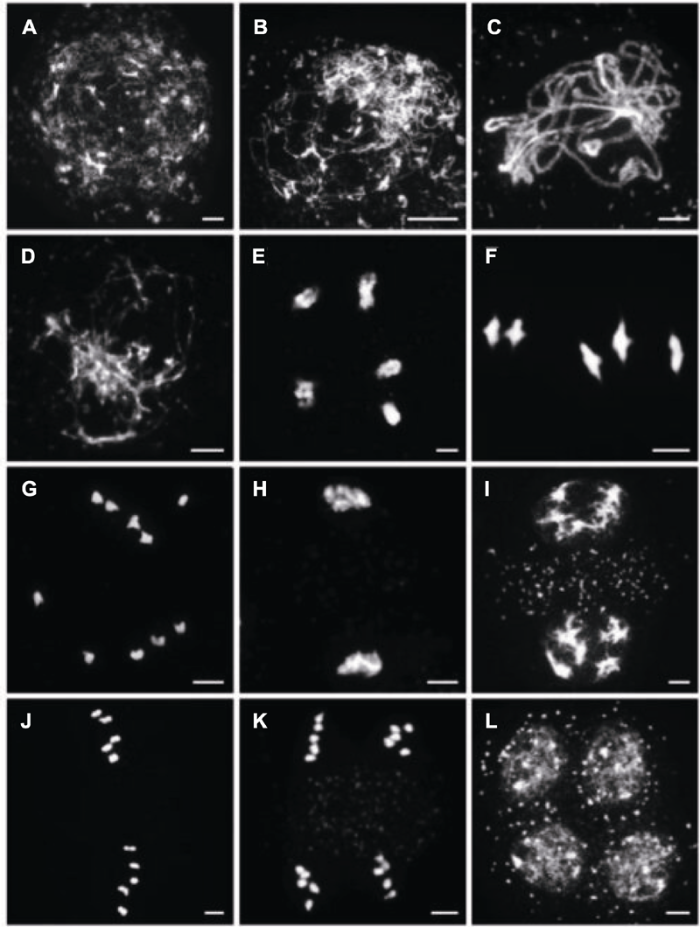 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1拟南芥Col-0生态型雄性减数分裂细胞的染色体形态(DAPI染色)
(A) 细线期; (B) 偶线期; (C) 粗线期; (D) 双线期; (E) 终变期; (F) 中期I; (G) 后期I; (H) 末期I; (I) 前期II; (J) 中期II; (K) 后期II; (L) 四分体。Bars=5 μm
Figure 1Chromosome morphology of the male meiocytes of Arabidopsis thaliana Col-0 ecotype (DAPI staining)
(A) Leptotene; (B) Zygotene; (C) Pachytene; (D) Diplotene; (E) Diakinesis; (F) Metaphase I; (G) Anaphase I; (H) Telophase I; (I) Prophase II; (J) Metaphase II; (K) Anaphase II; (L) Tetrads. Bars=5 μm
图2
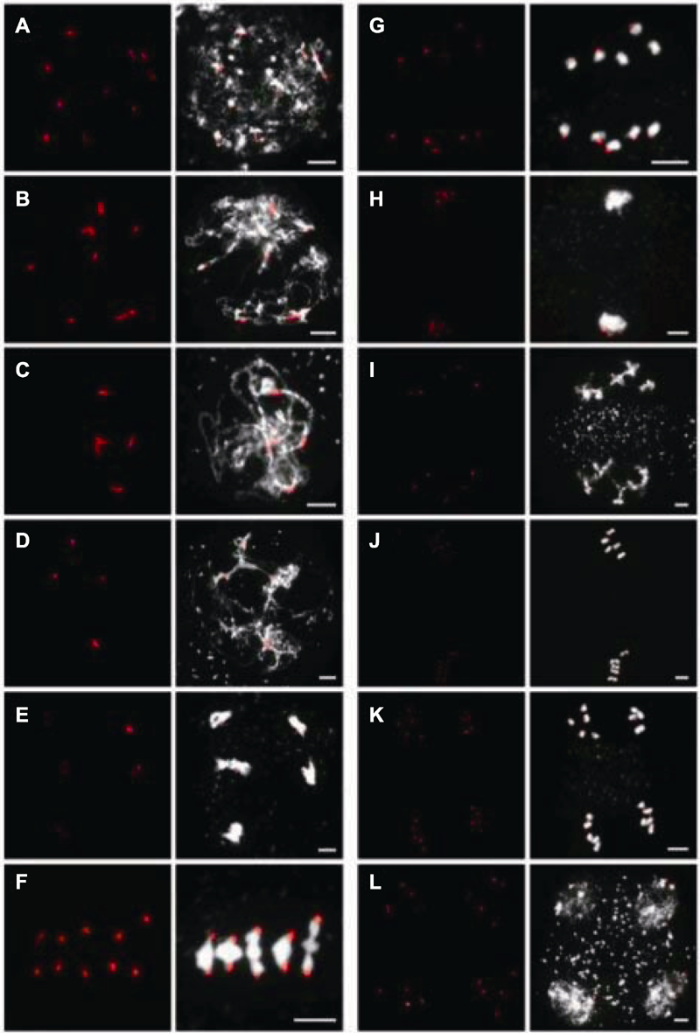 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2拟南芥Col-0生态型雄性减数分裂细胞的染色体形态及着丝粒信号(FISH)
(A)-(L) 同
Figure 2Chromosome morphology and centromere signals of male meiocytes of the Arabidopsis thaliana Col-0 ecotype (FISH)
(A)-(L) see
5 注意事项
(1) 若早上8:00开灯, 一般上午取材观察到的减数分裂I时期细胞较多, 下午取材能够观察到较多的减数分裂II时期细胞; 取花序时可将花序最外层较大的花序去除;(2) 固定于卡诺试剂中的花序可长期保存于-20°C冰箱;
(3) 体视镜下可见的黄色花苞, 其花药中的雄性生殖细胞已完成减数分裂;
(4) 酶解时间过短, 花药难以夹碎, 无法释放出减数分裂细胞; 酶解时间过长, 则难以将花药分离出来;
(5) 用无水乙醇冲洗玻片时, 应缓慢逐滴添加, 防止冲洗速度过快导致细胞脱落;
(6) 着丝粒探针的稀释及滴加应在暗室中避光操作。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
A molecular portrait of Arabidopsis meiosis
1
2006
... 减数分裂是真核生物进行有性生殖的必需过程.不同于有丝分裂过程中DNA复制1次, 细胞核分裂1次; 减数分裂过程中DNA复制1次, 细胞核分裂2次, 最终使染色体数目减半, 产生单倍体配子.减数分裂I包括前期I、中期I、后期I和末期I, 其中前期I又细分为细线期、偶线期、粗线期、双线期和终变期.减数分裂II类似于有丝分裂, 包括前期II、中期II、后期II和末期II (
Meiotic chromosome synapsis and recombination in Arabidopsis thaliana: new ways of integrating cytological and mo-lecular approaches
1
2014
... 模式植物拟南芥具有基因组小(
Anther developmental defects in Arabidopsis thaliana male-sterile mutants
1
1999
... 模式植物拟南芥具有基因组小(
Analysis of the genome sequence of the flowering plant Arabidopsis thaliana
1
2000
... 模式植物拟南芥具有基因组小(
0
2014
Meiotic recombination: mixing it up in plants
1
2018
... 减数分裂I是减数分裂特异的核心过程, 涉及同源染色体配对、联会、重组和分离(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
