 ,2,*, 戴绍军
,2,*, 戴绍军 ,1,3,*
,1,3,*Agrobacterium rhizogenes-mediated Transformation System of Spinacia oleracea
Yue Xu1, Yingping Cao2, Yu Wang2, Chunxiang Fu ,2,*, Shaojun Dai
,2,*, Shaojun Dai ,1,3,*
,1,3,*通讯作者:
责任编辑: 白羽红
收稿日期:2018-11-30接受日期:2019-04-8网络出版日期:2019-07-10
| 基金资助: |
Corresponding authors:
Received:2018-11-30Accepted:2019-04-8Online:2019-07-10

摘要
关键词:
Abstract
Keywords:
PDF (1654KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
徐悦, 曹英萍, 王玉, 付春祥, 戴绍军. 发根农杆菌介导的菠菜毛状根遗传转化体系的建立. 植物学报, 2019, 54(4): 515-521 doi:10.11983/CBB18257
Xu Yue, Cao Yingping, Wang Yu, Fu Chunxiang, Dai Shaojun.
菠菜(Spinacia oleracea)是苋科(Amaranthaceae)菠菜属(Spinacia) 1年或2年生草本植物。菠菜是主要的绿叶蔬菜之一, 具有较高的营养价值, 其耐低温但不耐高温, 目前尚缺乏适合南方栽培的品种(钱伟等, 2014)。因此, 利用分子辅助育种技术培育优质抗逆菠菜新品种具有重要意义(王晓武和杜永臣, 2007)。
在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(Ron et al., 2014)。很多植物的毛状根可以再生为具有正常育性的完整植株。目前, 苜蓿(Medicago sativa)、雪莲(Saussurea involucrata)、五寸石竹(Dianthus chinensis)和北玄参(Scrophularia buergeriana)等植物的毛状根遗传转化体系已经建立(付春祥等, 2004; Akhgari et al., 2015; 施和平等, 2016; 任如意等, 2017)。通过毛状根建立的遗传转化体系为研究植物基因功能提供了重要平台。近年来, 菠菜全基因组测序已经完成, 并已开展菠菜高温等逆境应答的研究, 但是菠菜遗传转化体系报道较少(Zhang and Zeevaart, 1999; Xu et al., 2017; Zhao et al., 2018)。
本研究建立了菠菜的毛状根遗传转化体系, 旨在为菠菜基因功能研究和品质改良奠定基础。
1 材料与方法
1.1 材料
取菠菜(Spinacia oleracea L.) SP75种子, 置于4°C春化。1周后取出种子, 去种皮。用75%乙醇浸泡2-3分钟, 无菌水冲洗2次, 75%乙醇消毒1次。然后, 经30%次氯酸钠浸泡10-15分钟, 无菌水冲洗4-6次。吸干种子表面水分, 接种于MS0培养基(1/2MS基本培养基, 15 g·L-1蔗糖, 7.8 g·L-1琼脂, pH 6)。培养条件: 温度27°C, 光周期为8小时光照/16小时黑暗。2-3天后, 种子开始萌发, 20-35天获得无菌苗。1.2 方法
1.2.1 活化发根农杆菌发根农杆菌菌株分别为LBA9402 (Rif抗性)、Arqual (Rif抗性)、R1601 (Kan抗性)和K599 (Car抗性)。从-80°C冰箱中取出LBA9402、K599、R1601和Arqual, 在含有利福平、抗卡那霉素或抗羧苄青霉素的YEP培养基平板上分别划线。发根农杆菌LBA9402含有Ti质粒pCAMBIA139IZ-eGFP (华中农业大学王学路馈赠) (图1A)和Ri质粒(图1B)。28°C下培养得到单克隆。然后将其接种到分别添加利福平、卡那霉素或羧苄青霉素的50 mL YEP液体培养基中培养8-12小时, 离心收集菌体。用50 mL毛状根侵染液(SH基础培养基, 15 g·L-1蔗糖, 100 μmol·L-1乙酰丁香酮, pH6)重悬菌液至OD600值为0.3。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1pCAMBIA139IZ-eGFP (A)和Ri质粒(B)的T-DNA区示意图
Figure 1Schematic map of T-DNAs of pCAMBIA139IZ-eGFP (A) and Ri plasmid (B)
1.2.2 侵染外植体产生毛状根并培养
取培养20-35天的菠菜无菌苗, 将叶片剪成约5 mm× 5 mm的小片, 将叶柄和茎剪成长约5 mm小段, 置于侵染液中, 振荡孵育5分钟, 之后用无菌滤纸吸干。取外植体接种在共培养培养基SHAS (SH基础培养基, 15 g·L-1蔗糖, 7.8 g·L-1琼脂, 100 μmol·L-1乙酰丁香酮, pH6)上培养2天, 然后转移到毛状根培养基SHT (SH基础培养基, 15 g·L-1蔗糖, 7.8 g·L-1琼脂, 300 mg·L-1特美汀, pH6)上培养。待外植体产生毛状根后进行继代培养, 20-40天后毛状根可以稳定生长。
1.2.3 毛状根固体和液体生长培养基筛选
选取生长状态稳定的同根系菠菜毛状根, 称取(0.5±0.05) g, 在SHT固体和SHT液体培养基中继代。拍照记录毛状根生长状态并对毛状根进行称重。计算公式如下:
毛状根诱导率=(生根外植体个数/侵染外植体个数)×100%;
增长倍数=(毛状根培养后的质量-毛状根培养前的质量)/毛状根培养前的质量。
1.2.4 毛状根的愈伤组织诱导及植株再生
取稳定生长的毛状根, 置于愈伤诱导培养基SH3a (SH基础培养基, 30 g·L-1蔗糖, 7.8 g·L-1琼脂, 4 mg·L-1 2,4-D, 1 mg·L-1 6-BA, 300 mg·L-1特美汀, pH6)。将毛状根与培养基充分接触, 每隔20天继代1次。剥下愈伤组织转接于分化培养基SH6BA (SH基础培养基, 30 g·L-1蔗糖, 7.8 g·L-1琼脂, 2 mg·L-1 6-BA, 300 mg∙L-1特美汀, pH6)中培养30-40天。最后将再生芽接种于MS0培养基上, 在27°C、光周期为8小时光照/16小时黑暗条件下培养10-20天后, 菠菜生根。
1.2.5 毛状根DNA制备
将新鲜的菠菜毛状根剪碎, 置于1.5 mL离心管中, 加入1 mL 2×CTAB提取液, 捣碎后充分混匀, 65°C水浴60分钟, 在水浴期间轻轻颠倒离心管几次。水浴结束后, 待液体冷却至室温, 加入等体积的氯仿, 剧烈振荡15秒, 室温离心10分钟, 取上清液转移到新的1.5 mL离心管中, 加入等体积的异丙醇振荡混匀, 于-20°C冰箱中沉淀30分钟, 室温离心10分钟。然后用1 mL 70%乙醇洗涤沉淀, 离心5分钟, 弃上清液。重复洗涤1次, 自然干燥。加入去离子水溶解DNA, 测定DNA浓度和比值。
1.2.6 毛状根rolB基因和GFP基因的PCR检测
在青岛擎科梓熙生物技术有限公司合成rolB基因(AM422760.1)、virG基因和GFP基因的PCR引物。rolB-F: 5'- AAGTGCTGAAGGAACAATC-3', rolB-R: 5'-CAAGTGAATGAACAAGGAAC-3'; virG-F: 5'-CCTTGGGCGTCGTCATAC-3', virG-R: 5'-TCGTCCTCGGTCGTTTCC-3'; GFP-F: 5'-TGATGCCGTTCTTCTGCTTGTC-3', GFP-R: 5'-CAGTGCTTCAGCCGCTACCC-3'。PCR反应条件: 95°C预变性5分钟; 95°C变性30秒, 54°C退火30秒, 72°C延伸45秒, 28个循环; 72°C延伸10分钟。rolB基因、virG基因和GFP基因的预期PCR产物大小分别为194、529和280 bp。
2 结果与讨论
2.1 发根农杆菌诱导外植体产生毛状根的效率
不同发根菌对外植体的侵染效率差异较大(Porter and Flores, 1991; Sharafi et al., 2013)。为了获得菠菜毛状根, 选取4种发根菌(LBA9402、K599、R1601和Arqual)分别侵染菠菜外植体。其中, LBA9402、Arqual和R1601为农杆碱型, K599为黄瓜碱型。LBA9402和K599的诱导率明显优于其它2种, 其中LBA9402在茎中的诱导率最高, 可达16%; 而Arqual的诱导率极低, 仅为3.2%; R1601没有诱导出菠菜毛状根(图2)。同时, 无论用何种发根菌侵染菠菜, 相比叶和叶柄, 茎对发根菌更为敏感, 其毛状根诱导率最高(图2)。
图2
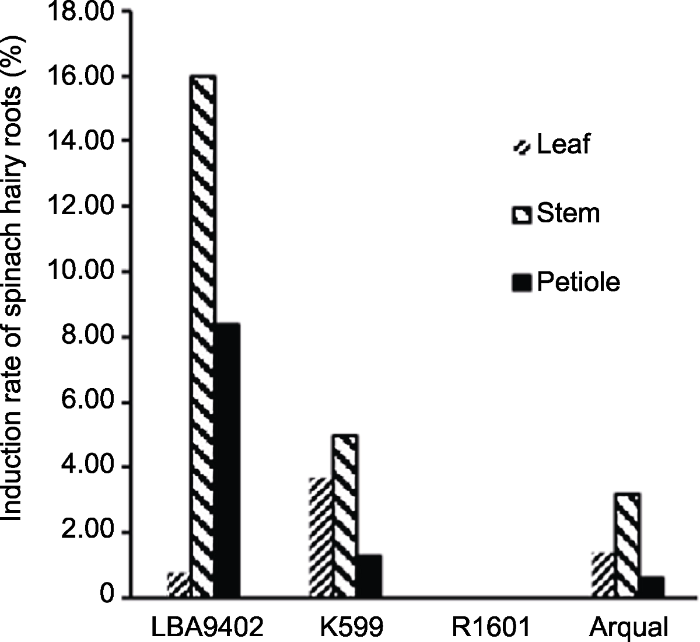 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同外植体和发根农杆菌菌种对菠菜毛状根诱导率的影响
Figure 2Effects of different explants and Agrobacterium rhizogenes strains on the induction rate of spinach hairy roots
2.2 毛状根的生长特征与鉴定
菠菜毛状根约在LBA9402侵染后8-15天出现, 且大多出现在维管束发达部位, 如叶脉、茎或叶柄的维管束位置(图3B-D), 1个侵染位点可以产生多个毛状根(图3A)。虽然菠菜毛状根外形和普通根的差异不大, 均为白色, 且长满根毛(图3F, G), 但是菠菜毛状根比普通根产生更多分叉, 并在无激素的培养基上生长更快(图4B), 这与其它植物的毛状根特点一致(Hu and Du, 2006; Veena and Taylor, 2007)。选取10个毛状根系进行PCR鉴定, 结果显示, 10个毛状根系均包含rolB基因(图3E), 说明毛状根的产生是由rolB基因引起。图3
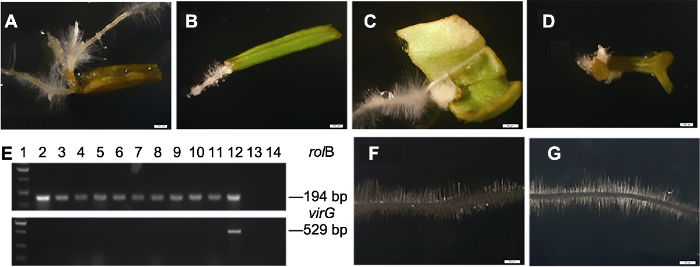 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3菠菜毛状根诱导及其形态特点
(A) 发根农杆菌(LBA9402)侵染之后在1个位点产生多条毛状根; (B) 叶柄维管束部位产生的毛状根; (C) 菠菜叶脉部位产生的毛状根; (D) 茎的维管束部位产生的毛状根; (E) PCR分析毛状根中rolB (上)和VirG (下)基因(1: 2 kb DNA marker; 2-11: 不同毛状根再生植株; 12: LBA9402; 13: 非转化对照根; 14: 去离子水); (F) LBA9402诱导产生的毛状根; (G) 野生型根。(A)-(D), (F), (G) Bars=20 μm
Figure 3The induction and morphological characteristics of spinach hairy roots
(A) After Agrobacterium rhizogenes LBA9402 infection, multiple hairy roots were produced at one site; (B) The induction of hairy roots around the vascular bundle of the petiole; (C) The induction of hairy roots in veins; (D) The induction of hairy roots around the vascular bundle of stem; (E) Genomic PCR analysis of rolB (up) and virG (down) genes in hairy roots (Lane 1: 2 kb DNA marker; Lane 2-11: Different hairy roots plantlets; Lane 12: LBA9402; Lane 13: Untransformed roots; Lane 14: Mili Q water); (F) The hairy root induced by LBA9402; (G) The wild type root. (A)-(D), (F), (G) Bars=20 μm
图4
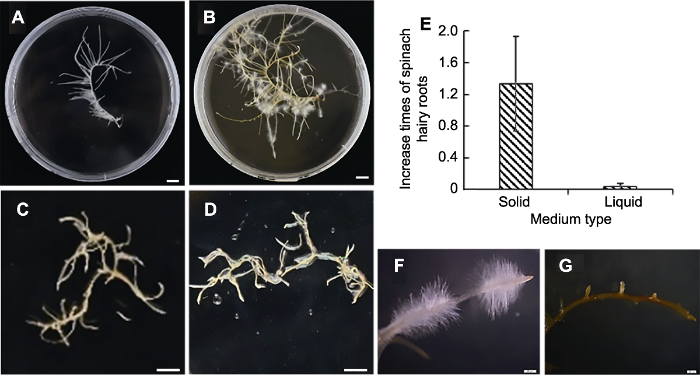 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4在液体和固体培养基上培养的菠菜毛状根的形态特征
(A) 接种于固体培养基0天的毛状根; (B), (F) 接种于固体培养基14天的毛状根; (C) 接种于液体培养基0天的毛状根; (D), (G) 接种于液体培养基14天的毛状根; (E) 毛状根鲜重在2种培养基中的增长倍数。(A)-(D) Bars=8 cm; (F), (G) Bars=20 μm
Figure 4The morphological characterization of spinach hairy roots grown on solid medium and in liquid medium
(A) Hairy roots grown on solid medium in 0 day after inoculation; (B), (F) Hairy roots grown on solid medium in 14 days after inoculation; (C) Hairy roots grown in liquid medium in 0 day after inoculation; (D), (G) Hairy roots grown in liquid medium in 14 days after inoculation; (E) Increase times of spinach hairy roots fresh weight on solid medium and in liquid medium, respectively. (A)-(D) Bars=8 cm; (F), (G) Bars=20 μm
2.3 液体和固体培养对毛状根增殖的影响
不同类型的培养基可以影响毛状根的生长(孙敏等, 2002)。将LBA9402诱导的菠菜毛状根分别置于固体和液体培养基上进行继代培养(图4)。菠菜毛状根在液体培养基中生长缓慢(图4C, D), 甚至出现褐化现象(图4G), 而固体培养基上继代的毛状根生长旺盛(图4A, B, F)。培养21天后, 固体培养基上的毛状根比液体培养基上的毛状根鲜重的增长倍数高44倍(图4E)。2.4 毛状根愈伤组织诱导培养基及再生体系
许多植物(如雪莲和北柴胡(Bupleurum chinense))的毛状根在不添加任何激素的液体培养基中生长就能够产生芽点(付春祥, 2006; 孙晶等, 2013), 但菠菜毛状根继代过程中未见此种情况发生。在分化培养基中生长的愈伤组织(图5A), 培养2.5-3个月后, 愈伤组织继续增殖, 有些愈伤组织变红变绿, 并相继产生芽点(图5B)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5菠菜毛状根再生体系
(A) 毛状根在愈伤诱导培养基上产生愈伤组织; (B) 毛状根诱导的愈伤组织在分化培养基中生长并产生不定芽; (C) 毛状根经由愈伤组织诱导分化产生再生植株; (D) 野生型种子萌发的植株; (E) PCR检测rolB (上)和VirG (下)基因(1: 2 kb DNA marker; 2-4: 不同毛状根再生株系; 5: LBA9402; 6: 野生型; 7: 去离子水)。(A)-(D) Bars=4 cm
Figure 5Regeneration system of spinach hairy roots
(A) Calli produced from hairy roots on callus induction medium; (B) Calli induced from hairy roots and produced adventitious buds on the regeneration medium; (C) The plantlets regenerated from the calli produced from hairy roots; (D) The wild type plantlets; (E) Genomic PCR analysis of rolB (up) and virG (down) genes in the plantlets regenerated from the calli produced from hairy roots (Lane 1: 2 kb DNA marker; Lane 2-4: Different hairy roots plantlets regenerated from the calli produced; Lane 5: LBA9402; Lane 6: The wild type plantlets; Lane 7: Mili Q water). (A)-(D) Bars=4 cm
由LBA9402诱导得到的13个菠菜毛状根株系中有3个根系获得再生芽。将再生芽接种到生根培养基进行生根培养, 10-20天后可以生根(图5C)。但与野生型种子萌发的植株相比, 菠菜毛状根再生植株有更多的丛生芽且根系极其发达, 生根率为90% (图5C, D)。54%的毛状根再生植株在组培瓶里可以开花, 有1株毛状根再生植株可以在组培瓶里结籽, 但是种子没有种皮。将获得的种子取出, 在生根培养基中进行培养, 种子不能发芽。从3个根系的再生植株中随机选取3株, PCR分析结果表明rolB基因已成功整合到再生植株的基因组中(图5E)。
2.5 Ri质粒与Ti质粒共转化毛状根的获得与鉴定
为了开发菠菜毛状根的外源基因转化系统, 将携带GFP的Ti质粒导入发根菌LBA9402中。对产生10个不同根系的毛状根株系进行鉴定, PCR结果显示, 10个毛状根根系中均含有rolB, 其中有6个毛状根根系含有rolB和GFP基因(图6C)。荧光显微镜下观察显示, GFP基因可在毛状根中稳定表达, 发出绿色荧光(图6A, B), 共转化率为50%。图6
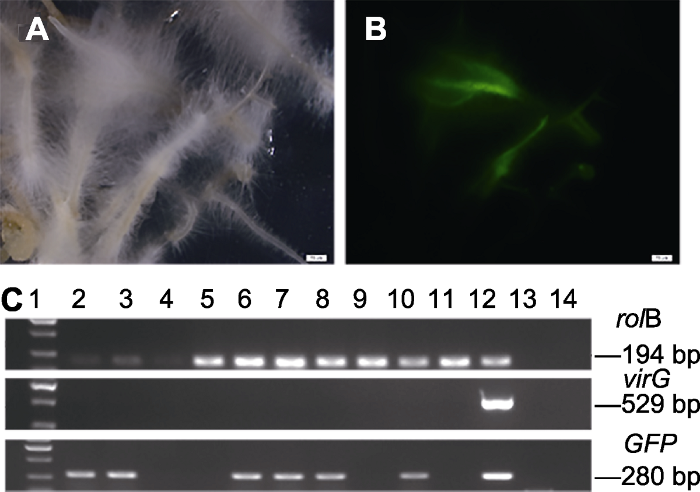 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6菠菜毛状根rolB基因和GFP基因的PCR检测和荧光观察
(A) 在自然光下的转基因毛状根; (B) 在蓝色激发光下观察的转基因毛状根; (C) PCR检测转rolB (上)、VirG (中)和GFP (下)基因(1: 2 kb DNA marker; 2-11: 不同转基因毛状根株系; 12: LBA9402; 13: 野生型根; 14: 去离子水)。(A), (B) Bars=20 μm
Figure 6PCR analysis and GFP green fluorescence assay of the rolB gene and GFP gene in spinach transgenic hairy roots
(A) Transgenic hairy root under the natural light; (B) Transgenic hairy root under the blue exciting light; (C) Genomic PCR analysis of rolB (up) and virG (middle) and GFP (down) genes in transgenic hairy roots (Lane 1: 2 kb DNA marker; Lane 2-11: Different of transgenic hairy roots lines; Lane 12: LBA9402 (GFP); Lane 13: The wild type root; Lane 14: Milli Q water). (A), (B) Bars=20 μm
2.6 讨论
菠菜的农杆菌转化体系是由Zhang和Zeevaar (1999)建立的, 但仅限于Longstanding Bloomsdale Dark Green和Melody两个菠菜品种。有报道用基因枪法转化菠菜其它品种, 如日本春秋大叶菠菜、大叶菠菜和春秋菠菜, 由于再生效率和转化效率极低, 均未获得转基因植株(耿晓霞, 2009)。本研究采用菠菜材料SP75, 其全基因组测序已经完成, 所有基因组序列均可通过spinach base (http://www.spinachbase. org/)在线获得(Xu et al., 2017)。因此, 研发该菠菜品种的高效转基因体系对于利用基因组数据库进行基因功能分析具有重要意义。我们通过前期研究发现, 菠菜材料SP75在常见的培养基及激素配比下, 其再生效率约为5%, 根癌农杆菌对该品种组培苗的侵染效率也较低, 仅为10%。因此, 本研究通过发根菌介导诱导产生毛状根, 进而产生愈伤组织(愈伤诱导率为90%), 并诱导愈伤组织分化产生植株, 进一步导入外源基因获得转基因植株, 成功建立了基于毛状根的菠菜材料SP75遗传转化体系。在菠菜毛状根培养时, 我们发现其在SHT液体培养基中生长极其缓慢, 而在含有相同营养元素的固体培养基上却生长旺盛。这说明菠菜毛状根更适合在较干燥的、添加固体支持剂的培养基上生长。早期的研究表明, 添加固体支持剂对植物根的生长状况影响很大。在组培苗生根的研究中发现, 大豆(Glycine max)再生枝在液体培养条件和固体培养基中的生根能力有很大差异, 液体培养条件下生根时间短, 且根的生长速度远高于固体培养基(胡凤和杨万年, 2013)。这表明, 不同植物根的生长对是否有支持剂有一定的偏好性。此外, 菠菜毛状根在水培液中生长较慢的原因也有可能是培养液的营养元素配比不合适。罗勒(Ocimum basilicum)的毛状根在MS、MS0和N6这几种液体培养基上生长速度有一定的差异(闻玉莉和杨世海, 2010)。因此, 通过液体培养基中营养元素的优化改善菠菜毛状根的生长状况, 还需要进一步验证。
菠菜毛状根再生植株比正常种子萌发的植株根系更加发达(图5C, D), 植株矮小。其它植物的毛状根再生植株也有类似的形态特点, 如雪莲的毛状根再生植株比正常植株矮小, 丛生芽增多, 根系发达(付春祥等, 2004)。在本研究的培养条件下, 54%的菠菜毛状根再生植株培养2-3个月之后, 可以在瓶里开花, 但无法结实。这可能是由于菠菜主要为雌雄异株, 培养瓶中的营养条件也不利于结实所致(晋四清, 2013)。后续我们将进一步优化培养条件, 解决毛状根再生植株的育性问题。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
雪莲细胞培养物中黄酮类物质代谢调控及其生物活性成分分析
1
2006
... 许多植物(如雪莲和北柴胡(Bupleurum chinense))的毛状根在不添加任何激素的液体培养基中生长就能够产生芽点(
新疆雪莲毛状根的诱导及其植株再生体系的建立
2
2004
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
... 菠菜毛状根再生植株比正常种子萌发的植株根系更加发达(
菠菜叶绿体表达载体构建及遗传转化
1
2009
... 菠菜的农杆菌转化体系是由
大豆组培苗水培生根与培养基生根比较研究
1
2013
... 在菠菜毛状根培养时, 我们发现其在SHT液体培养基中生长极其缓慢, 而在含有相同营养元素的固体培养基上却生长旺盛.这说明菠菜毛状根更适合在较干燥的、添加固体支持剂的培养基上生长.早期的研究表明, 添加固体支持剂对植物根的生长状况影响很大.在组培苗生根的研究中发现, 大豆(Glycine max)再生枝在液体培养条件和固体培养基中的生根能力有很大差异, 液体培养条件下生根时间短, 且根的生长速度远高于固体培养基(
菠菜露地越冬杂交制种技术
1
2013
... 菠菜毛状根再生植株比正常种子萌发的植株根系更加发达(
菠菜遗传育种研究进展
1
2014
... 菠菜(Spinacia oleracea)是苋科(Amaranthaceae)菠菜属(Spinacia) 1年或2年生草本植物.菠菜是主要的绿叶蔬菜之一, 具有较高的营养价值, 其耐低温但不耐高温, 目前尚缺乏适合南方栽培的品种(
北玄参毛状根诱导及其植株再生
1
2017
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
五寸石竹毛状根诱导及其植株再生
1
2016
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
北柴胡毛状根诱导及其植株再生体系的建立
1
2013
... 许多植物(如雪莲和北柴胡(Bupleurum chinense))的毛状根在不添加任何激素的液体培养基中生长就能够产生芽点(
长春花转化毛状根诱导及培养条件的优化
1
2002
... 不同类型的培养基可以影响毛状根的生长(
蔬菜作物分子育种研究现状与趋势
1
2007
... 菠菜(Spinacia oleracea)是苋科(Amaranthaceae)菠菜属(Spinacia) 1年或2年生草本植物.菠菜是主要的绿叶蔬菜之一, 具有较高的营养价值, 其耐低温但不耐高温, 目前尚缺乏适合南方栽培的品种(
罗勒毛状根的诱导及培养
1
2010
... 在菠菜毛状根培养时, 我们发现其在SHT液体培养基中生长极其缓慢, 而在含有相同营养元素的固体培养基上却生长旺盛.这说明菠菜毛状根更适合在较干燥的、添加固体支持剂的培养基上生长.早期的研究表明, 添加固体支持剂对植物根的生长状况影响很大.在组培苗生根的研究中发现, 大豆(Glycine max)再生枝在液体培养条件和固体培养基中的生根能力有很大差异, 液体培养条件下生根时间短, 且根的生长速度远高于固体培养基(
Establishment of transgenic Rhazya stricta hairy roots to modulate terpenoid indole alkaloid production
1
2015
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
Hairy root and its application in plant genetic engineering
1
2006
... 菠菜毛状根约在LBA9402侵染后8-15天出现, 且大多出现在维管束发达部位, 如叶脉、茎或叶柄的维管束位置(
Host range and implication of plant infection by Agrobacterium rhizogenes
1
1991
... 不同发根菌对外植体的侵染效率差异较大(
Hairy root transformation using Agrobacterium rhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model
1
2014
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
A reliable and efficient protocol for inducing hairy roots in Papaver bracteatum
1
2013
... 不同发根菌对外植体的侵染效率差异较大(
Agrobacterium rhizogenes: recent developments and promising applications
1
2007
... 菠菜毛状根约在LBA9402侵染后8-15天出现, 且大多出现在维管束发达部位, 如叶脉、茎或叶柄的维管束位置(
Draft genome of spinach and transcriptome diversity of 120 Spinacia accessions
2
2017
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
... 菠菜的农杆菌转化体系是由
An efficient Agrobacterium tumefaciens-mediated transformation and regeneration system for cotyledons of spinach( Spinacia oleracea L.)
2
1999
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
... 菠菜的农杆菌转化体系是由
Proteomics and phosphoproteomics of heat stress-responsive mechanisms in spinach
1
2018
... 在自然界中, 发根农杆菌(Agrobacterium rhizogenes)可通过Ri质粒的T-DNA将诱导发根的rol基因(rolA、rolB和rolC)稳定整合到宿主植物基因组中产生毛状根, 并可以同时将Ti质粒中携带的外源基因共同整合到植物基因组中, 从而实现共转化(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
