Improvement in Extraction Methods of Genomic DNA from Pitaya Stems
Quandong Nong1,2,3, Mingyong Zhang1,2, Mei Zhang2, Shuguang Jian2, Hongfang Lu2, Kuaifei Xia1,2,*, Heming Wen3,*通讯作者:
收稿日期:2018-06-11接受日期:2018-10-14网络出版日期:2019-07-01
| 基金资助: |
Received:2018-06-11Accepted:2018-10-14Online:2019-07-01

摘要
关键词:
Abstract
Keywords:
PDF (1174KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
农全东, 张明永, 张美, 简曙光, 陆宏芳, 夏快飞, 文和明. 火龙果茎基因组DNA提取方法改良. 植物学报, 2019, 54(3): 371-377 doi:10.11983/CBB18134
Nong Quandong, Zhang Mingyong, Zhang Mei, Jian Shuguang, Lu Hongfang, Xia Kuaifei, Wen Heming.
火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(邓仁菊等, 2011); 其风味独特, 营养丰富, 含有一般植物少有的植物性白蛋白、花青素, 丰富的维生素和水溶性膳食纤维, 以及黄酮类、植物甾醇类化合物和多糖等活性物质, 对人体健康非常有益(申世辉等, 2015; 张桂春等, 2017)。火龙果花、茎、果实皆可食用和观赏, 是集果树、花卉和蔬菜于一体的特色植物。火龙果原产于墨西哥及美洲大陆等地, 是当地传统的食物来源和经济作物。我国于20世纪90年代开始引种火龙果, 现已在海南、广东、福建、广西、云南及贵州等省自治区广泛种植(罗小艳和郭璇华, 2007; 田新民等, 2015)。然而, 目前我国火龙果种质资源鉴定和评价工作较为落后, 在育种上还是以传统育种技术为主, 一定程度地影响了火龙果的育种研究进程(董美超等, 2013)。现代生物技术的高速发展有效提高了育种效率并缩短了育种周期, 故在植物育种中的应用越来越广泛(冯建成, 2006; 李建生, 2007; 邱丽娟等,2007; 程文等, 2016; 马小军和莫长明, 2017)。DNA是现代分子生物学研究的主要对象之一, DNA质量的优劣直接影响以其为基础的各项分子生物学实验(詹少华和尹艺林, 2008; 罗焜等, 2012; 吴敏娜等, 2015; 傅建敏等, 2015)。因此, 能否提取到高质量的DNA对分子生物学研究极为重要。
植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(Murray and Thompson, 1980)、SDS法(梁雪莲等, 2007; 韩静丹等, 2012)、高盐沉淀法(吴丽圆, 2004)和试剂盒提取方法(李会等, 2013)等。对不同植物, 由于其所含成分不同, DNA提取方法也不尽一致。火龙果组织富含多糖、植醇、维生素E、白蛋白及其它次生代谢物质等黏性成分, 显著增加了其DNA提取难度。目前, 火龙果DNA主要通过微量CTAB法(余志雄等, 2010)和试剂盒提取方法(陈明贤, 2012; 张冰雪等, 2013)从其嫩茎中提取。而相关研究表明, 微量CTAB法并不能够从抽生3个月以上的嫩茎中提取质量较好的DNA (陈明贤, 2012; 吴琳, 2016)。试剂盒提取方法虽然可从火龙果茎中提取到质量较好的DNA, 但提取的DNA量少, 且成本高。此外, 我们的研究发现, 使用普通植物基因组DNA提取试剂盒提取一年生以上火龙果茎DNA需严格控制样品量, 否则容易造成柱子堵塞。火龙果主要以枝条(茎)扦插方式繁殖, 鉴于其花和果具有季节性, 导致野外取样不方便。因此, 探索一种不受取样时间和部位限制、成本低且容易操作的火龙果DNA提取方法势在必行。
CTAB+Tris-HCl洗涤法(张芬等, 2011)是针对兰花植物中多糖等黏性物质建立的一种DNA提取方法。该方法先对样品黏性物质进行洗涤, 然后再进行DNA萃取, 有可能适用于火龙果茎DNA的提取。然而经尝试, 发现该方法尚不能从火龙果老茎中提取质量较好的基因组DNA。因此本研究基于此方法, 对样品的预处理、洗涤和萃取过程进行改良, 同时简化了DNA提取过程, 建立了一种较好的适用于火龙果茎DNA提取的方法。
1 材料与方法
1.1 植物材料
以一年生以上的火龙果(Hylocereus undulatus Britt.)茎为材料, 按照颜色和大小分为绿色宽大型、绿色窄小型和紫红窄小型。实验用火龙果种植于中国科学院华南植物园火龙果种质资源圃中(经度113°21°, 纬度 23°10°12?)。1.2 DNA提取
参考张芬等(2011)的CTAB+Tris-HCl洗涤法, 并进行以下3种不同的改进:改进一: (1) 取0.2-0.3 g去除中间髓部分的火龙果茎, 液氮研磨成粉末, 移入2 mL离心管中, 加入1.5 mL Tris洗涤液(200 mmol?L-1 Tris-HCl; 40 mmol?L-1 EDTA; 5 mol?L-1 NaCl), 摇匀, 静置10分钟, 室温下12 000 ×g离心10分钟, 弃上液; 重复洗涤3-4次。(2) 加入1.3 mL CTAB裂解液(2% CTAB; 100 mmol?L-1 Tris-HCl; 20 mmol?L-1 EDTA; 1.4 mol?L-1 NaCl), 振荡混匀, 65°C水浴45分钟, 每10分钟轻摇1次; (3) 室温下12 000 ×g离心10分钟, 将上清液转入另一个1.5 mL离心管中, 加入等体积的氯仿:异戊醇(24:1, v/v)混合液抽提, 室温下12 000 ×g离心10分钟; (4) 将上清液转移至新的离心管中, 加入等体积的氯仿:异戊醇(24:1, v/v)混合液再次抽提, 室温下12 000 ×g离心10分钟; (5) 将上清液转移至新的离心管中, 加入2/3体积的异丙醇, 轻摇, 使其充分混匀, 置于-20°C下30分钟; (6) 室温下12 000 ×g离心15分钟, 弃上清液, 可见絮状沉淀, 即为DNA沉淀, 用75%乙醇洗涤2遍, 置于室温风干; (7) 加入50 μL 50 μg?L-1 RNase水溶解沉淀, 放置-20°C冰箱中保存。
改进二: 对“改进一”中的步骤1和3同时优化, 步骤1优化后变为: 取0.5-1.0 g去除中间髓部分的火龙果茎, 液氮研磨成粉末, 移入50 mL离心管中, 加入45 mL Tris洗涤液(200 mmol?L-1 Tris-HCl; 40 mmol?L-1 EDTA; 5 mol?L-1 NaCl), 摇匀, 静置10分钟, 室温下8 000 ×g离心10分钟, 弃上液。将沉淀转移至2 mL离心管中继续用Tris洗涤3-4次。步骤3的优化为将氯仿:异戊醇(24:1, v/v)混合液改为酚:氯仿:异戊醇(25:24:1, v/v/v), 其余步骤同“改进一”。
改进三: 在“改进二”的基础上将步骤1改为: 取0.5-1.0 g去除中间髓部分及含90%以上肉质部分的火龙果茎, 液氮研磨成粉末, 移入50 mL离心管中, 加入45 mL灭菌蒸馏水, 摇匀, 静置10分钟, 室温下8 000× g离心10分钟, 弃上液。将沉淀转移至2 mL离心管中继续用Tris洗涤3-4次。其余步骤同“改进二”。
1.3 DNA质量检测
1.3.1 紫外分光光度计检测取1 μL DNA于Thermo Scientific Nano Drop 2000c检测仪上进行DNA质量检测。
1.3.2 琼脂糖凝胶电泳检测
取3 μL DNA和5 μL DL5000 DNA Marker点样于含有溴化乙锭的1%琼脂糖凝胶中进行电泳, 在电压176 V、电流300 A条件下电泳25分钟, 然后经紫外凝胶成像扫描结果。
1.3.3 酶切反应检测
分别对通过3种新方法提取的基因组DNA进行单酶切和双酶切反应。10 μL单酶切反应体系为: 200 ng DNA模板, 1 μL 10× FastDiest green Buffer, 0.5 μL HindIII, 加ddH2O至10 μL。10 μL双酶切反应体系为: 250 ng DNA模板, 1 μL 10× FastDiest green Buffer, 0.5 μL HindIII, 0.5 μL EcoRI, 加ddH2O至10 μL。反应条件: 37°C酶切30分钟。最后, 使用琼脂糖凝胶电泳检测反应结果。
1.3.4 ISSR扩增反应检测
以3种新方法提取的火龙果基因组DNA为模板, UB- C808为引物进行ISSR扩增。10 μL PCR反应体系为: 5 μL 2× Ex Taq, 1 μL 10 μmol?L-1 UBC808, 50 ng DNA模板, 加ddH2O至10 μL。反应程序为: 94°C预变性5分钟; 94°C变性30秒, 54°C退火30秒, 72°C延伸5分钟, 35个循环; 72°C延伸5分钟。最后, 通过琼脂糖凝胶电泳检测PCR扩增结果。
2 结果与讨论
2.1 DNA提取
在用3种改进的CTAB+Tris-HCl洗涤法提取火龙果成熟茎DNA的过程中发现, 经过第1步的洗涤后, “改进二”与“改进三”的沉淀很容易与CTAB裂解液混匀, “改进一”的沉淀则很黏稠, 无法与CTAB裂解液混匀(图1)。而与“改进二”相比, “改进三”更容易洗掉黏液; 故从洗涤效果上看, 3种方法中“改进三”最佳。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1洗涤后的火龙果样品加入CTAB裂解液混匀图
1-3: 样品与CTAB难以均匀混合; 4-9: 样品与CTAB容易混合
Figure 1The washed samples of pitaya mixed with CTAB lysate
1-3: Represented the precipitation can not be mixed with CTAB lysate; 4-9: Represented the precipitation can be mixed with CTAB lysate
另外, 3种改进方法提取的DNA经紫外分光光度计检测, 结果(表1)显示DNA的OD260与OD280比值均介于1.90-3.83之间, 说明DNA中蛋白质去除地比较干净, 而大部分比值高于2.0, 说明DNA有所降解或有RNA污染; OD260与OD230比值为0.48-1.79, 说明DNA中有糖类或盐类的污染, 但“改进三”的污染程度最低。由于在溶解DNA的过程中“改进二”与“改进三”均未发现有黏性物质, 而“改进一”有黏性物质, 但“改进一”提取DNA的OD260/OD280和OD260/ OD230值均优于“改进二”, 说明紫外分光光度计检测结果不很准确, 3种改进方法的优劣需进一步通过琼脂糖凝胶电泳检测加以判断。
Table 1
表1
表13种改进CTAB+Tris-HCl洗涤法提取的火龙果DNA的OD260/OD280和OD260/OD230值
Table 1
| No. | Improved 1 | Improved 2 | Improved 3 | |||
|---|---|---|---|---|---|---|
| OD260/OD280 | OD260/OD230 | OD260/OD280 | OD260/OD230 | OD260/OD280 | OD260/OD230 | |
| 1 | 1.99 | 1.38 | 3.83 | 0.48 | 2.06 | 1.51 |
| 2 | 1.90 | 1.16 | 2.12 | 0.92 | 2.04 | 1.79 |
| 3 | 2.03 | 1.30 | 2.69 | 0.63 | 2.05 | 1.65 |
1, 2 and 3 represent the stems of three different pitayas, respectively. High quality DNA was generally with a high OD260/OD230 value and the OD260/OD280 value between 1.8 and 2.0.
新窗口打开|下载CSV
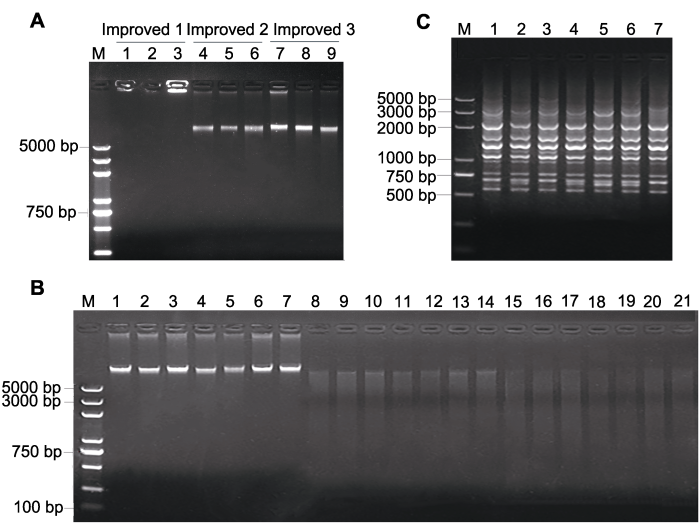
将3种方法提取的DNA进行琼脂糖凝胶电泳检测, 结果(图2A)发现“改进一”的1号和3号点样孔亮,
且没有DNA条带, 说明DNA中含有黏性物质, 这与溶解DNA沉淀时观察到的结果一致; 2号点样孔不亮且没有DNA条带, 说明该样品未提出DNA。而“改进二”和“改进三”的点样孔清晰且几乎不亮, 并有明显的DNA主带, 说明这两种方法均提取出了不含黏性物质的火龙果DNA; 同时, “改进二”和“改进三”的DNA主带有轻微的拖尾现象, 说明DNA有所降解。但“改进二”的DNA主带比较暗淡(相比“改进三”), 说明“改进二”提取的DNA浓度较低。基于此可以得出“改进三”方法提取的DNA质量和浓度均最优。
本研究表明, “改进二”与“改进三”方法均可从火龙果茎中提取不含黏性物质的DNA, 但“改进三”的提取效果优于“改进二”, 且“改进三”在大离心管中用水作为洗涤液, 大大降低了成本。因此, 我们初步认为, “改进三”为火龙果茎的最佳DNA提取方法。为了进一步检测“改进三”方法提取DNA的质量, 后续进行了生化与分子生物学实验。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2火龙果DNA、酶切及ISSR扩增电泳图
(A) 3种改进方法提取的DNA电泳图(M: DNA marker; 1-3: 用“改进一”方法提取的DNA; 4-6: 用“改进二”方法提取的DNA; 7-9: 用“改进三”方法提取的DNA); (B) 用“改进三”方法提取的火龙果DNA及酶切产物电泳图(M: DNA marker; 1-7: DNA; 8-14: HindIII酶切产物; 15-21: HindIII和EcoRI酶切产物; 8-14及15-21所用模板DNA分别对应于1-7泳道中的DNA); (C) ISSR扩增电泳图(M: DNA marker; 1-7: 以“改进三”方法提取的7个DNA为模板进行ISSR扩增的产物)。
Figure 2Electrophoretograms of pitaya DNA, enzyme digestion and ISSR amplification
(A) Electrophoretogram of DNA extracted by 3 different improved methods (M: DNA marker; Lane 1-3: DNA extracted by improved 1 method; Lane 4-6: DNA extracted by improved 2 method; Lane 7-9: DNA extracted by improved 3 method). (B) Electrophoretogram of pitaya DNA extracted by improved 3 method and enzyme digestion (M: DNA marker; Lane 1-7: DNA; Lane 8-14: DNA digested by HindIII; Lane 15-21: DNA digested by HindIII and EcoRI; The DNA template of 8-14 and 15-21 is corresponding to the DNA in 1-7 lanes, respectively). (C) Electrophoretogram of ISSR amplification (M: DNA marker; Lane 1-7: Products of 7 different DNA templates ISSR amplification).
2.2 酶切反应检测
用“改进三”方法重新提取7个不同火龙果材料DNA, 并以提取的DNA为模板进行单酶切和双酶切反应。DNA、单酶切及双酶切产物经琼脂糖凝胶电泳检测, 结果(图2B)显示, DNA泳道有明显的DNA主带, 几乎无拖尾或拖带现象, 且DNA能够完全酶切, 说明提取的DNA质量能够满足酶切反应的要求。2.3 ISSR扩增反应检测
以酶切反应实验中提取的7个DNA为模板进行ISSR扩增(图2C), 发现7个泳道中均有很多清晰的条带, 说明这7个DNA能够较好地进行ISSR扩增, 从而说明“改进三”提取的DNA可满足ISSR多态性扩增的基本要求。2.4 讨论
DNA作为分子生物学主要的研究对象之一, 其质量的好坏关乎下游实验的成败。不同实验目的对DNA质量的要求不同, 对于普通PCR检测, 含有杂质较多的DNA也能达到实验目的。然而, 高灵敏度的分子生物学实验(如分子标记分析实验及以酶切为基础的实验等)对DNA的质量要求比较高(郑育声等, 2007)。不同植物种类由于其组织成分、含量差异较大, 致使DNA提取难易不尽相同。例如, 用普通CTAB法即可提出水稻(Oryza sativa)质量较好的DNA, 而春兰(Cym- bidium goeringii)和珙桐(Davidia involucrate)等植物的叶片由于富含多酚和多糖等物质, 用普通CTAB法很难提取到高纯度的DNA, 需要在CTAB法的基础上进行改良(张芬等, 2011; 张玉晶等, 2011; 李金璐等, 2013)。本研究基于前人和笔者以前的工作, 选择CTAB+Tris-HCl洗涤法并加以改进, 探索火龙果茎的DNA提取方法。其中, “改进一”的沉淀经洗涤后黏性依然很大, 很难与CTAB抽提液混匀, 这是由于加样量偏多, 造成第1次洗涤时混合液过于黏稠, 之后再多洗涤几次也无法将黏液清洗掉, 结果造成“改进一”方法无法从火龙果茎中提取质量较好的DNA。可见, 欲通过该方法提取火龙果茎DNA, 首先必须控制好加样量。紫外分光光度计检测是DNA质量检测的方法之一。然而, 本研究中该方法并不能很好地判断DNA质量的优劣, 这可能是由于“改进一”中DNA含有黏性物质, 致使DNA中杂有的各成分不能完全混匀, 从而造成吸取1 μL DNA进行检测的不准确性;“改进二”的DNA OD260/OD280值偏高, OD260/OD230值偏低, 而DNA又不含黏性物质, 推测可能是由于“改进二”的DNA盐类污染严重, 及DNA浓度过低所致。
“改进二”和“改进三”都能提取不含黏性物质的火龙果DNA, 但“改进三”方法效果更佳, 主要原因如下。(1) Tris缓冲液为有机溶剂, 水为无机溶剂, “改进三”将有机溶剂与无机溶剂结合使用, 洗涤效果更好, 这可能也是“改进三”提取DNA的OD260/ OD230值最高的原因之一; 此外, 实验结果证明, 先用水洗涤1次并不会造成DNA的严重降解, 这可能是由于在洗涤过程中已将研磨时细胞破裂产生的DNA连同黏性物质一起洗掉, 提取的DNA可能大部分为CTAB裂解液重新抽提出来的, 因此洗涤过程对DNA的降解影响极小。再有, 在大离心管中用水洗涤, 大大降低了成本。(2) 火龙果茎肉质部分含有的物质成分不仅多且黏性大, “改进三”方法在样品研磨前已将这部分去除, 故大大降低了样品的黏性。而“改进二”研磨时将肉质部分一起研磨, 不仅使样品的黏性更大, 导致难以除尽黏性物质, 而且还造成了洗涤后沉淀含量少, 进而影响DNA的提取量。
虽然“改进三”方法提取的DNA质量最好, 且基本满足酶切反应及ISSR分子标记实验等要求。但是, 其DNA OD260/OD230的最高值为1.79, 而高纯度DNA该比值为2.0-2.2 (Kaczyńska et al., 2013)。同时, DNA有轻微降解, 说明“改进三”方法可进一步优化以提取更高质量的DNA。通过分析本研究结果不难发现, 3种方法提取的DNA都不同程度地受到盐类污染, 可能是由于洗涤液中使用了5 mol·L-1 NaCl的缘故。因此, 降低洗涤液中的NaCl浓度或许可达到降低盐类污染的目的。此外, 本研究离心均是在室温条件下进行, 将室温下离心改为4°C下离心可在一定程度上避免DNA的降解。
我们对CTAB+Tris-HCl洗涤法进行了3种不同方式的改进, 结果表明“改进三”方法提取的DNA质量最好, 可直接用于下游的生化实验, 满足酶切及分子标记等高灵敏度实验的基本要求, 且不受取样时期和部位的限制。“改进三”的基本步骤如下: (1) 取0.5-1.0 g去除中间髓部分及含90%以上肉质部分的火龙果茎, 液氮研磨成粉末, 移入50 mL离心管中, 加入45 mL灭菌蒸馏水, 摇匀, 静置10分钟, 室温下8 000 ×g离心10分钟, 弃上液。将沉淀转移至2 mL离心管中继续用Tris-HCl (200 mmol·L-1 Tris-HCl; 40 mmol·L-1 EDTA; 5 mol·L-1 NaCl)洗涤3-4次, 室温下12 000 ×g离心3-10分钟, 弃上液; (2) 加入1.3 mL CTAB裂解液(2% CTAB; 100 mmol·L-1 Tris-HCl; 20 mmol·L-1 EDTA; 1.4 mol·L-1 NaCl), 振荡混匀, 65°C水浴30-60分钟, 每10分钟轻摇1次; (3) 室温下 12 000 ×g离心10分钟, 将上清液转入新的2 mL离心管中, 加入等体积的酚:氯仿:异戊醇(25:24:1, v/v/v)混合液抽提, 室温下12 000 ×g离心10分钟; (4) 将上清液转移至新的2 mL离心管中, 加入等体积的氯仿:异戊醇(24:1, v/v)混合液再次抽提, 室温下12 000 ×g离心10分钟; (5) 将上清液转移至新的1.5 mL离心管中, 加入2/3体积的异丙醇, 轻摇, 使其充分混匀, 置于-20°C下30分钟; (6) 室温下12 000 ×g离心15分钟, 弃上清液, 可见絮状沉淀, 即为DNA沉淀, 用75%乙醇洗涤2遍, 置于室温风干; (7) 加入30-50 μL含50 μg·mL-1 RNase水溶解沉淀, 于-20°C冰箱中保存。
(责任编辑: 孙冬花)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 2]

本文以搜集到的福建省20份火龙果样品为试验材料,利用ISSR标记技术,对火龙果的种质资源进行聚类分析,研究其遗传多样性。依据聚类结果结合生物学特性筛选了5个火龙果品种(株系),用NaCl溶液对筛选到的品种进行胁迫,研究火龙果的耐盐生理,探索不同类型、品种的耐盐程度。主要研究结果如下: 1.以火龙果嫩茎为材料,建立了适合火龙果ISSR-PCR扩增的反应体系,最佳反应体系:20μL ISSR反应体系中各主要成份的最适浓度分别为10×Buffer(含Mg~(2+))2μL,模板DNA为20ng、dNTP为0.30mmol·L~(-1)、引物浓度为0.35μmol·L~(-1)、Taq DNA聚合酶为1.5U,其余成分为ddH_2O。 2.从96条ISSR随机引物中筛选出11条,对20份火龙果资源进行ISSR-PCR扩增,利用SPSS18.0软件对ISSR-PCR扩增位点的数据矩阵进行统计分析。结果表明:20个火龙果品种(株系)进行ISSR-PCR扩增后共获得142个扩增位点,其中多态性位点有106个,多态性比率达到74.65%。20个火龙果品种(株系)的遗传相似系数在0.487~0.937之间,平均值为0.646,Jaccard聚类可以把不同品种(株系)和不同来源的火龙果进行区分。从聚类结果中选出了5个品种(株系)用于耐盐生理研究,在一定程度上缩短了良种选育的过程。 3.以‘海白1号’火龙果扦插盆栽幼苗为试材,以浇灌NaCl的方式,研究了质量分数为0.4%、0.8%和1.2%的NaCl胁迫对海白1号火龙果茎若干生理指标的影响。结果表明,在0.4%的NaCl胁迫下,火龙果茎的各项生理指标无明显变化,到后期才开始受影响;0.8%的NaCl胁迫下,到胁迫的中后期,火龙果茎相对电导率、MDA含量开始显著升高,可溶性糖、抗氧化酶SOD、POD、CAT的活性均升高,Pro含量变化无规律;在1.2%的NaCl胁迫下,火龙果茎的相对电导率、MDA、Pro含量从胁迫的初期开始便显著升高,可溶性糖先是降低后升高再降低,抗氧化酶SOD、POD、CAT的活性在胁迫的前期都显著上升,到中后期后开始下降。 4.以‘海白1号’、‘白巨龙’、‘赤龙’、‘巨龙’和‘红仙蜜’火龙果扦插盆栽幼苗为试材,研究了1.2%的NaCl溶液胁迫下的生理变化,探索不同品种火龙果的耐盐性。结果表明,不同品种在盐胁迫下表现各异,白肉品种海白1号的耐盐性要强于白巨龙;红肉品种赤龙的耐盐性比巨龙和红仙蜜强,但巨龙和红仙蜜没有明显差异。从单一的生理指标尚无法区分不同品种火龙果的耐盐性。 5.通过主成分分析法,提取了3个主成分,能解释原始变量信息的97.34%,建立了不同火龙果耐盐性的评价体系,对5个火龙果品种(株系)的耐盐性强弱进行了排序:赤龙海白1号巨龙白巨龙红仙蜜。
DOI:10.11983/CBB15057URL [本文引用: 1]

基因分型是进行植物基因功能的遗传分析和分子标记辅助育种的重要环节.该研究以大豆(Glycine max)成熟种子为材料,建立了通过钻孔采集样品、快速提取DNA进行基因型鉴定的方法.用此方法,一个熟练的工作人员可以在1个小时内完成120个样品的采集和DNA提取;同时种子钻孔取样后,不会对大豆种子的萌发造成影响.利用该方法获得的DNA可满足PCR扩增的要求.实验重复性好,成功率在98%以上.这种快速且无损的大豆种子基因型鉴定方法可以用于鉴定杂交种子、品种纯度以及遗传分析等研究工作.
DOI:10.3969/j.issn.1001-3601.2011.06.052URL [本文引用: 1]

为给我国火龙果的生产和科研提供参考和依据,综述了国内外火龙果研究进展及产业的概况,阐明了火龙果的应用及发展前景,并对火龙果研究和产业发展中存在的问题和未来研究方向提出了建议。
DOI:10.3969/j.issn.1009-2196.2013.05.014URL [本文引用: 1]

对目前国内外火龙果的分类、主要推广品种、育种目标和育种技术等研究进行综述,旨在为火龙果育种工作的开展提供参考。
DOI:10.3969/j.issn.1000-6850.2006.03.011URL [本文引用: 1]

分子标记辅助选择技术给水稻育种提供了新的途径,与传统育种技术相结合,可大大提高育种效率,缩短育种周期。因此,加强分子标记辅助选择技术在水稻育种上的应用研究具有重要的实践意义。在此,综述了分子标记的特点与类型及分子标记辅助选择原理,着重介绍了分子标记辅助选择在水稻育种上的利用现状,主要包括在回交育种、基因聚合、数量性状改良等方面的应用进展。同时讨论了该技术存在的问题,并展望了其应用前景。
DOI:10.14067/j.cnki.1673-923x.2015.12.004URL [本文引用: 1]

利用 Percoll 密度梯度离心法,对4种柿属植物君迁子 D. lotus L.、油柿 D. oleifera Cheng、浙江柿 D. glaucifolia Metc.、金枣柿 D. kaki spp.进行叶绿体 DNA(cpDNA)提取方法的优化,结果显示优化后的柿属植物cpDNA 提取方法具有高效、简便、重复性好、稳定性高的特点;经检验,利用此方法提取的 cpDNA 质量好,浓度与纯度均较高,能够满足后续叶绿体 PCR 扩增、基因组测序等分子生物学试验。
DOI:10.3969/j.issn.1000-2340.2012.02.015URL [本文引用: 1]

以铁线蕨(Adiantum capillus-veneris L.)不同世代植株为材料,对铁线蕨总DNA不同提取方法进行比较,并通过检测体系进行分析.结果表明:结构简单的配子体为材料的DNA的纯度明显高于孢 子体,但是产量也明显低于孢子体;对于配子体而言,CTAB法、SDS法、高盐低pH法、尿素提取法、试剂盒法都能提取较为纯净的总DNA,但经过DNA 完整性检测体系筛选后,改良CTAB法结果最优;对于含大量次生代谢产物的孢子体植株而言,改良CTAB法得到的总DNA纯度明显高于其它,通过后续的 DNA完整性检测得到与配子体相同结论.
DOI:10.3969/j.issn.0439-8114.2013.08.059URL [本文引用: 1]

比较3种不同DNA提取试剂盒(宝生物、天根、LGC)在转基因产品检测中的应用效果,分别提取玉米、水稻和大豆种子的基因组DNA.结果表明,天根DNA提取试剂盒DP305更为适合从作物种子中提取基因组DNA进行转基因成分检测.
DOI:10.3969/j.issn.1008-0864.2007.02.002URL [本文引用: 1]

玉米我国最重要的禾谷类作物之一。尽管传统育种技术在作物遗传改良方面取得了显著成就,但已不能满足当前玉米生产对优良品种的需求。随着生物技术的发展,分子育种已经成为玉米育种的重要研究方向。本文扼要总结了分子育种学形成的背景;分子育种的主要研究内容;转基因玉米的主要种类;分子标记的主要类型。综述了国内外玉米产量、农艺、品质、生物和非生物抗性等性状QTL定位的有关结果,及其在育种中的应用;简介了关联分析和功能分子标记的概念,基于比较基因组学和生物信息开发分子标记的策略。
DOI:10.3724/SP.J.1259.2013.00072URL [本文引用: 1]

It is very important but usually difficult to extract high quality DNA from plants for molecular work since there exist a great deal of polysaccharides, hydroxybenzenes, esters and other secondary metabolities. In this paper we provide a simple modified CTAB (mCTAB) protocol for extracting plant DNA. The mCTAB method protocol includes 18 steps. (1) Weigh ca. 20 mg of dry plant tissue and ground into powder with sand using a mortar or a pestle. Remove the powder into a 2.0 mL microcentrifuge tube. (2) Add 1.0 mL pre-cooled buffer A (Table 2) to the tube, mix well and incubate the tube on ice for 15 min. Mix sample 2–3 times during incubation by inverting the tube. (3) Centrifuge the tube at 7 000 for 10 min. Discard the supernatant liquid by pouring it out of the tube. (4) Repeat step 2 and 3 until the supernatant is not viscous. (5) Add 0.7 mL buffer B (Table 3), mix well and incubate at 65°C for 90–120 min. Mix the sample several times during incubation by inverting the tube. (6) Centrifuge at 10 000 for 10 min, remove the supernatant to a new microcentrifuge tube. The precipitate is reusable from step 5 if necessary. (7) Add 0.7 mL CI (chloroform: isoamyl alcohol=24:1, v/v), mix it well for 10 min by inverting tube gently. (8) Centrifuge at 10 000 ×g, for 10 min, carefully remove the supernatant to a new 1.5 mL microcentrifuge tube. (9) Repeat step 7 and 8 until no precipitate appearing between the two layers of liquid after centrifuging. (10) Add 0.5 mL pre-cooled isopropanol, carefully mix well . Incubate at –20°C for 20 min. (11) Centrifuge at 10 000 for 10 min, discard the supernatant, centrifuge the tube briefly to collect the remaining liquid and remove it by pipetting. (12) Add 0.1 mL RNase (100 mg·L) and incubate at 37°C for 30–60 min. (13) Add 0.1 mL ddHO, 0.1 mL 5 mol·LNaCl and 0.8 mL pre-cooled ethanol (95%), carefully mix well. (14) Centrifuge at 10 000 for 10 min, discard the supernatant. (15) Add 0.5 mL 75% ethanol, re-suspend the pellet, centrifuge at 10 000 for 2 min, discard the supernatant. (16) Repeat step 15. (17) Add 0.1 mL TE to dissolve DNA after ethanol has evaporated. (18) Estimate the concentration and the purity of the DNA solution. Store it at 4°C for immediate use, at –20°C for short time storage and –80°C for long time storage. We compared our protocol with four frequently used and commercially available kits. The result showed that our mCTAB method yielded much more DNA of high quality that is suitable for PCR amplification but with much lower cost.
DOI:10.3969/j.issn.1004-311X.2007.01.014URL [本文引用: 1]

目的:旨在筛选优化花生DNA提取方法.方法:采用SDS法、改 进SDS法;CTAB法、改进CTAB法四种方法对花生叶DNA进行提取,并从电泳结果、纯度、得率、等方面对其进行比较研究,从而确定花生DNA提取适 用流程;结果:CTAB法DNA平均得率为55.0 μg/g·Fw,略小于SDS的60.3,但其A260/A280平均值为1.81,比SDS的1.55更接近标准要求.结论:综合考虑CTAB法是提取 花生DNA的最佳方法,可提取到较高质量的DNA,符合分子检测要求;虽然改良CTAB法也相对好于SDS法,但由于步骤增加反而加剧DNA降解.
DOI:10.11842/wst.2012.2.[sequence]URL [本文引用: 1]

This study was aimed to establish a universal DNA extraction method for future research on authentication of Chinese herbal medicine by DNA barcoding. Ten representative specimens belonging to five different medicinal parts were used to evaluate five different DNA extraction methods. The universal DNA extraction method was further modified and evaluated by agarose gel electrophoresis and PCR amplification. Modified CTAB method was a common extraction method for almost all kinds of herbs. The amplification success rate for ITS2 was 90% though DNA degradation occurred in all specimens. The study showed that modified CTAB method was suitable for nine herbs by improving methods on herbal pretreatment, buffer for DNA separation, and concentration of CTAB. The simple and feasible CTAB approach provided a reference method for DNA extraction of herbal medicines.
URL [本文引用: 1]

介绍了国内外对火龙果植物的栽培技术及营养成分、化学成分的研究概况,阐明了火龙果的应用及开发前景。
URL [本文引用: 1]

分子辅助育种、转基因育种和分子设计育种是植物分子育种学三大发展方向。该文就此3个育种方向的遗传连锁作图、QTL定位作图、关联分析作图、分子辅助选择、花粉管通道介导转化、农杆菌介导转化、基因枪介导转化、基因编辑技术、全基因组测序、转录组测序、蛋白组测序和品种分子设计等研究领域的发展现状和新趋势进行概述,并结合药用植物分子育种目标和存在问题的探讨,展望了此3种分子育种技术在药用植物分子育种中的应用前景。
DOI:10.3321/j.issn:0578-1752.2007.11.005URL [本文引用: 1]

大豆分子育种代表了大豆育种的发展方向,主要包括分子标记育种、转基因育种和品种分子设计育种三个方面.通过综合利用基因组学、生物信息学、计算机模拟与遗传育种学等多个学科的理论和方法,大豆分子育种可对大豆从表型到分子等多个层次进行遗传操作,有助于大幅度提高育种效率,最终实现大豆品种的定向遗传改良.本文介绍了中国大豆分子标记育种、转基因育种和品种分子设计育种三个方面的开创者,将国内的主要研究进展与国外相关的最新研究成果进行了综述和比较,由于知识所限对未提及的做出重要贡献的科学家在此致歉.通过比较发现,中国大豆分子育种与国外相关研究的差距普遍存在,然而,有些分子育种相关研究如基因克隆及功能研究等方面则与国外的差距正在逐渐缩小.笔者认为,大豆分子育种正朝着遗传图谱信息多元化、基因发掘规模化、分子育种技术高效化、分子育种理论系统化的方向发展.
[本文引用: 1]
[本文引用: 1]
DOI:10.3969/j.issn.1001-389X.2004.03.011URL [本文引用: 1]

以思茅松(Pinus kesiya var langbianensis)针叶为材料,分别采取了简易提取法、高盐沉淀法、CTAB沉淀法和高盐低pH法提取基因组DNA , 并通过琼脂糖凝胶电泳、限制性内切酶处理和RAPD 3种方法对所提取的DNA样品进行检测,将它们在DNA产量、质量等方面的优缺点进行总结,并根据群体分子遗传学研究工作的实际特点确定了高盐沉淀法为最佳方法.
URL [本文引用: 1]

为了更好的评价和创新利用火龙果种质资源,本研究采用SCoT和ISSR两种分子标记对36份火龙果种质资源进行了遗传多样性分析并对其中的红肉、白肉和粉红肉三种火龙果种质资源进行了形态学鉴定评价;并进行了扦插繁育和种子发芽方面的试验研究。主要研究结果如下:1.采用改良的微量CTAB法,建立适合火龙果种质资源的基因组DNA提取方法。2.采用单因素和正交试验,分别建立了适用于火龙果种质资源的ISSR和SCoT分子标记的两套反应体系。①SCoT-PCR扩增反应体系,单因素试验初步筛选出来的结果:模板DNA 30ng、引物浓度0.60 μmol·L-1、dNTP 0.20 mmol·L-1、TaqDNA聚合酶1.50 U。正交试验筛选出的最佳体系:DNA 30ng、引物浓度0.55 μmol·L-1、dNTP 0.2 mmol·L-1、TaqDNA聚合酶2.0 U。②ISSR-PCR扩增反应体系,单因素试验初步筛选出来的结果:模板DNA 40ng、引物浓度0.60 μmol·L-1、dNTP浓度0.55 μmol·L-1、TaqDNA聚合酶2.50U,正交试验筛选出的最佳体系:DNA 50ng、引物浓度0.55 μmol·L-1、dNTP 0.6 mmol·L-1、TaqDNA聚合酶2.5 U。3.建立了适用火龙果SCoT-PCR扩增反应的反应程序:95℃预变性5 min;95℃变性40s,50℃退火40s,72℃延伸1 min:共38个循环;最后72℃再延伸10 min。4.两种分子标记分别筛选出12条引物对36份火龙果进行扩增,SCoT-PCR扩增后共获得扩增位点,156个;123个多态性位点,多态性百分率达到78.85%,平均每个引物能产生13个扩增位点,平均多态位点有10.25个,遗传相似系数位于0.50-0.91之间。ISSR-PCR扩增后共获得扩增位点,174个;141个多态性位点,多态性百分率达到81.03%,平均每个引物能产生14.5个扩增位点,平均多态位点有11.75个。36个火龙果品种的遗传相似系数在0.44-0.95之间。综合两个标记的扩增结果混合聚类得出,供试材料之间的遗传相似系数值在0.47-0.92之间。在遗传系数为0.47水平处,可以将仙人掌和35个中越火龙果品种区分开。在遗传系数为0.665处,36份资源除了仙人掌外,被分成了两大类,21份广西境内火龙果品种和14份越南境内火龙果品种。5.对三种不同肉色火龙果种质资源进行形态学鉴定评价和描述。①越南种质资源的茎色均为墨绿色,枝条边缘为浅黄色,茎刺颜色大多都是综色和深棕色;广西境内的种质资源,除了白肉品种黑金刚枝条边缘为浅黄色,其他样品基本没有边缘线,茎刺颜色主要为浅棕色和浅黄色。②3种不同肉色火龙果的花粉均为近球形的三沟单粒花粉,花粉沟长未达两端,表面纹饰为瘤状雕纹,雕纹为明显的圈状颗粒和圆锥形颗粒不均匀分布组成。③红肉火龙果、白肉火龙果和粉肉火龙果花被片边缘分别为全缘红色、无色和尖端部分红色。④红肉火龙果果实近球形,果皮为深紫红色,鳞片大部分为深紫红色,鳞片边缘略为褐色;白肉火龙果果实卵圆形,果皮为淡紫红色,鳞片大部分为淡紫红色,鳞片最尖端和边缘均为绿色;粉肉火龙果果实卵形,果皮为紫红色,鳞片大部分为绿色,鳞片边缘为褐色,苞片靠尖端部分为褐色。6.对不同营养土配方的火龙果扦插繁殖试验表明:综合分析初期插条的生根、根系的生长情况、扦插的成活率、生根率、插条抽梢的总数和平均抽梢长度等指标,筛选出基质D处理(田园土:椰糠:草木灰=4.5:4.5:1)的配制为火龙果扦插的最佳基质。7.以玫红肉火龙果、粉红肉火龙果、紫红肉火龙果、白肉火龙果4种火龙果种子为试验材料,进行火龙果种子萌发特性比较试验研究,试验结果表明,不同果肉颜色火龙果的种子萌发率不同。不同浸种时间,萌发率也不同。紫红肉火龙果种子的发芽率、发芽势和活力指数最大,粉红肉火龙果种子的发芽率、发芽势和活力指数最小。四种不同果肉颜色火龙果种子的最佳浸种时间分别是:玫红肉火龙果种子,24 h;粉肉火龙果种子,36h;紫红肉火龙果种子,为36 h;白肉火龙果种子,36 h。
URL [本文引用: 1]

采用异硫氰酸胍(guandine thiocyanate,GITC)法、Tiangen DNA提取试剂盒、Omega DNA提取试剂盒和广泛应用的十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法提取小鼠粪便微生物总DNA,通过比较所提取DNA的浓度和纯度,发现粪便DNA提取试剂盒提取的DNA纯度最高但浓度最 低;CTAB法所得的DNA浓度最高但纯度最低;GITC法所得DNA的浓度高于粪便DNA提取试剂盒,纯度高于CTAB法.通过变性梯度凝胶电泳 (16S rDNA-PCR-DGGE)指纹图谱分析技术进一步比较了各种提取方法所代表微生物群落的丰富度和多样性.结果表明,GITC法提取得到的DNA所代表 细菌的丰富度和多样性显著高于其他3种方法.本实验所建立的GITC法可更全面地反映肠道微生物的多样性和群落结构,是一种较为理想的粪便微生物DNA提 取方法.
URL [本文引用: 1]

Abstract: The tissues of Pitaya richly contain polysaccharide and other subsequent metabolizing substance, so it is difficult to extract DNA effectively. The study compares different methods for Pitaya DNA extraction on tender stem of Pitaya.. Then the purified DNA was detected through Eppendorf Biophotomete. The researches indicated that modified CTAB and micro-CTAB extraction methods were both suitable for extracting DNA of Pitaya, especially the latter. DNA purity gained by those two methods was available to the further molecular biology study.
DOI:10.3969/j.issn.0517-6611.2008.23.029URL [本文引用: 1]

[目的]通过逐步富集的方法,提高大豆DNA的纯度和质量,为其他动植物基因组DNA的提取纯化提供参考。[方法]以梅桥大豆为试验材料,在CTAB法提取大豆基因组DNA的基础上,对大豆基因组DNA进行了纯化,对纯化后的DNA进行了光密度、紫外光谱、琼脂糖电泳和RAPD-PCR等的检测。[结果]光密度和紫外光谱检测表明A260/A230介于1.678~1.722,平均为1.697,A260/A280介于1.733~2.022,平均为1.844;琼脂糖电泳检测证实DNA分子量较大、完整性好、RNA残留少;RAPD-PCR检测得到了谱带清晰、多态性丰富的电泳谱带。DNA的得率为66.969μg/g。该试验的研究方法具有DNA质量高、操作简便、试验条件要求不高的特点。[结论]该方法可以应用于其它动植物的DNA提取纯化。
URL [本文引用: 1]

【目的】为了构建火龙果芽变种质的DNA指纹图谱,并揭示种质间的遗传关系,【方法】以贵州近几年选育的一些优良火龙果种质为试材,采用ISSR标记技术和NTSYS 2.01软件对这些新种质及其原始品种进行分析。【结果】利用筛选出的52条引物进行PCR扩增,共扩增出364个清晰、重复性好的标记,其中215个(60%)为多态性标记。M08、845和881等3个引物扩增出的标记能将22份种质区分开来。采用NTSYS 2.01软件计算,供试种质间的相似性系数为0.70~0.96,平均0.81,其中红肉种质间平均值为0.82,白肉为0.89。UPGMA聚类分析显示,在相似系数0.9处可将供试材料分为11类,其中7份分别各自聚类(红肉占86%)。【结论】火龙果体细胞变异率较高,且红肉品种高于白肉品种,通过芽变选种能有效地实现遗传改良。
DOI:10.3969/j.issn.1006-060X.2011.03.039URL [本文引用: 3]

以兰花的叶片、花瓣、根系为材料,用改进后的CTAB+Tris-HCl洗涤法、CTAB法、SDS+Tris-HCl洗涤法、SDS法均获得HMW基因组DNA。其中,CTAB+Tris-HCl洗涤法提取的DNA纯度较高,其操作简单,并能有效地将兰花叶中富含的酚类、多糖类物质去除,使得提取出DNA的纯度、浓度都符合SRAP分析要求,取材也最方便。研究获得了兰花的清晰SRAP指纹图谱,为SRAP的相关研究提供参考。
DOI:10.11983/CBB16116URL [本文引用: 1]

火龙果(Hylocereus undulatus)果皮可以作为一种优良的膳食纤维来源,且其膳食纤维具有良好的理化性能.为提高火龙果果皮的综合利用水平,该研究以火龙果果皮为原料,首先采用纤维素酶水解法对火龙果果皮中的可溶性膳食纤维进行提取,然后采用单因素试验和响应面法优化酶提取工艺.结果表明,纤维素酶法提取火龙果果皮中可溶性膳食纤维的优化工艺条件为:纤维素酶浓度0.54%,酶解温度50℃,pH5.2.在此条件下,可溶性膳食纤维的提取率可达19.81%;膳食纤维的持水力为31.25 9.g-1,溶胀性为29.11 mL·g-1.
DOI:10.3969/j.issn.1008-0457.2011.03.005URL [本文引用: 1]

采用改良的CTAB法提取珙桐基因组DNA,并采用正交试验设计 方法优化其ISSR-PCR反应体系.结果表明:改良CTAB法提取基因组DNA的质量符合ISSR-PCR扩增反应的要求.最佳反应体系为:20μL反 应液中含有2.0μL10×buffer、2.75 mmol/L Mg2+、0.125 mmol/L dNTPs、0.7μmol/L引物、0.75 U Taq酶和40 ng模板;PCR反应参数为:94℃5 main;94℃30 s,53.2℃45 s,72℃1min,共40个循环;72℃7min.
DOI:10.3969/j.issn.1004-1729.2007.01.013URL [本文引用: 1]

以椰子植物的叶片和花序组织为材料,探索了应用CTAB微量法分离高质量椰子基因组DNA的方法.结果表明,采用CTAB的缓冲液裂解材料,以及在提取过程中用φ=4%的β-巯基乙醇的改良CTAB法,可有效地控制椰子这种高纤维、易褐变材料和多糖在DNA提取过程中的污染和影响.应用本研究建立的分离方法,可从椰子的叶片和花序2种不同材料中分离得到高质量的基因组DNA,产量分别达0.75 g.L-1和0.65 g.L-1.通过Hind III酶切实验证明,分离出的基因组DNA适用于限制性酶切反应的分析和操作;该方法的建立可有效地应用于椰子和其他棕榈科植物基于DNA的分子生物学研究.
DOI:10.2478/s13545-013-0058-yURL [本文引用: 1]

The aim of this work was to develop an improved method for isolation and purification of genomic DNA from filamentous cyanobacteria. The method described here employs a modified phenol extraction-based procedure. It allowed us to obtain a high yield (60–620 μg/g wet weight, depending on the cyanobacterial strain) of pure and undegraded genomic DNA (A260/A280 ratio of about 1.8 and A260/A230 ratio of about 2.0). Genomic DNA, isolated from cyanobacteria belonging to the genera Anabaena, Nodularia and Nostoc has been successfully used for construction of gene libraries. Thus, this method can be used in procedures requiring highly purified cyanobacterial DNA.
.
DOI:10.1093/nar/8.19.4321URL [本文引用: 1]
福建省火龙果种质资源ISSR分析及耐盐生理研究
2
2012
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
... )从其嫩茎中提取.而相关研究表明, 微量CTAB法并不能够从抽生3个月以上的嫩茎中提取质量较好的DNA (
一种快速、无损大豆种子DNA提取方法的建立和应用
1
2016
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
国内外火龙果研究进展及产业发展现状
1
2011
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
火龙果育种研究进展
1
2013
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
分子标记辅助选择技术在水稻育种上的应用
1
2006
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
柿属植物叶绿体DNA提取方法优化
1
2015
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
铁线蕨总DNA提取方法比较分析
1
2012
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
不同DNA提取试剂盒提取作物种子基因组DNA效果的比较
1
2013
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
玉米分子育种研究进展
1
2007
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
一种改良的植物DNA提取方法
1
2013
... DNA作为分子生物学主要的研究对象之一, 其质量的好坏关乎下游实验的成败.不同实验目的对DNA质量的要求不同, 对于普通PCR检测, 含有杂质较多的DNA也能达到实验目的.然而, 高灵敏度的分子生物学实验(如分子标记分析实验及以酶切为基础的实验等)对DNA的质量要求比较高(
花生DNA提取方法比较
1
2007
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
中药DNA条形码鉴定中的DNA提取方法研究
1
2012
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
火龙果的研究现状及发展前景
1
2007
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
药用植物分子育种展望
1
2017
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
大豆分子育种研究进展
1
2007
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
火龙果研究进展
1
2015
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
火龙果研究现状
1
2015
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
4种思茅松总DNA提取方法的比较
1
2004
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
火龙果种质资源评价及繁育研究
1
2016
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
四种小鼠肠道微生物DNA提取方法比较
1
2015
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
火龙果总DNA提取方法比较研究
1
2010
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
大豆基因组DNA提取纯化方法研究
1
2008
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
贵州地方火龙果芽变种质DNA指纹图谱及遗传多样性的ISSR分析
1
2013
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
兰花SRAP指纹图谱的构建
3
2011
... CTAB+Tris-HCl洗涤法(
...
... DNA作为分子生物学主要的研究对象之一, 其质量的好坏关乎下游实验的成败.不同实验目的对DNA质量的要求不同, 对于普通PCR检测, 含有杂质较多的DNA也能达到实验目的.然而, 高灵敏度的分子生物学实验(如分子标记分析实验及以酶切为基础的实验等)对DNA的质量要求比较高(
火龙果果皮中可溶性膳食纤维的提取方法
1
2017
... 火龙果(Hylocereus undulatus)又称红龙果、青龙果和仙蜜果等, 为蔓藤类仙人掌科(Cactaceae)量天尺属(Hylocereus)(或蛇鞭柱属(Selenicereus))植物, 是近年发展起来的一种新兴热带亚热带果树(
珙桐基因组DNA的提取及ISSR-PCR体系的优化
1
2011
... DNA作为分子生物学主要的研究对象之一, 其质量的好坏关乎下游实验的成败.不同实验目的对DNA质量的要求不同, 对于普通PCR检测, 含有杂质较多的DNA也能达到实验目的.然而, 高灵敏度的分子生物学实验(如分子标记分析实验及以酶切为基础的实验等)对DNA的质量要求比较高(
椰子不同组织基因组DNA的提取及质量分析
1
2007
... DNA作为分子生物学主要的研究对象之一, 其质量的好坏关乎下游实验的成败.不同实验目的对DNA质量的要求不同, 对于普通PCR检测, 含有杂质较多的DNA也能达到实验目的.然而, 高灵敏度的分子生物学实验(如分子标记分析实验及以酶切为基础的实验等)对DNA的质量要求比较高(
An improved method for efficient isolation and purification of genomic DNA from filamentous cyanobacteria belonging to genera
1
2013
... 虽然“改进三”方法提取的DNA质量最好, 且基本满足酶切反应及ISSR分子标记实验等要求.但是, 其DNA OD260/OD230的最高值为1.79, 而高纯度DNA该比值为2.0-2.2 (
Rapid isolation of high molecular weight plant DNA
1
1980
... 植物基因组DNA的提取方法有很多, 常用的有普通CTAB法(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
