 ,1,*
,1,*Effects of drought stress on photosynthesis, growth and root structure of transgenic PtPIP2;8 poplar 84K (Populus alba × P. glandulosa)
Li-Yan LIU1,2, Jin-Xia FENG1, Wen-Xin LIU3, Xian-Chong WAN ,1,*
,1,*通讯作者: *wxc@caf.ac.cn
编委: 杜盛
责任编辑: 李敏
收稿日期:2020-03-6接受日期:2020-04-23网络出版日期:2020-06-20
| 基金资助: |
Corresponding authors: *wxc@caf.ac.cn
Received:2020-03-6Accepted:2020-04-23Online:2020-06-20
| Fund supported: |

摘要
为研究水通道蛋白PtPIP2;8基因功能, 了解其不同表达水平的转基因84K杨(Populus alba × P. glandulossa)应对干旱胁迫的响应, 该文以转PtPIP2;8 84K杨抑制表达株系(抑制表达)、野生型(WT)和转PtPIP2;8 84K杨超表达株系(超表达)为试验材料, 测定PtPIP2;8表达水平、根系导度、光响应曲线、气体交换参数、生长及根系形态指标。结果显示: (1) WT植株PtPIP2;8仅在根系表达; 超表达植株PtPIP2;8除在根部显著表达外, 在茎和叶片中也显著表达; 抑制表达植株PtPIP2;8仅在根部有微量表达, 表达量分别是WT和超表达植株的1/20和1/80。(2)根系结构分析发现, 超表达植株总根长、总根表面积、总根体积、总根尖数显著低于WT和抑制表达植株, 根系导水率显著高于WT和抑制表达植株, 表明PtPIP2;8参与了植物根系水分运输, 提高了水分运输效率。(3)正常水分条件下, 抑制表达植株苗高、叶面积显著低于WT和超表达植株, 根冠比显著高于WT和超表达植株。干旱胁迫后, 抑制表达植株净光合速率(Pn)、气孔导度(Gs)下降幅度小, 仍能维持较高的Pn。气体交换参数显示抑制表达植株Pn、Gs日变化为“单峰”型, 属气孔因素引起的净光合速率下降;WT和超表达植株Pn、Gs日变化为“双峰”型, 干旱胁迫后, 抑制表达植株Pn略微下降, WT和超表达植株Pn均下降, 尤其是13:00、15:00下降显著, 表明WT和超表达植株对干旱胁迫更加敏感, 干旱对其影响更大。(4)干旱胁迫后, 抑制表达植株相对生长速率、总生物量降低的最少, 根冠比最高; 总根表面积、总根体积、总根尖数显著高于WT植株。表明PtPIP2;8直接参与水分运输并提高水分运输效率, 其转化影响了植株根系发育和生长。超表达植株根系发育的下降和叶面积的增大减弱了它的抗旱性, 而抑制表达植株矮小, 降低的叶面积, 增加的根系生长和根冠比提高了它的抗旱能力。从研究结果来看, 水通道蛋白提高了水分跨膜运输效率, 而非水通道蛋白导水机制对干旱有较强的耐受性。
关键词:
Abstract
Aims In this study, changes in growth, photosynthesis and root structure in response to drought were tested in transgenic poplar 84K (Populus alba × P. glandulosa) seedlings with different expression levels of aquaporin gene (PtPIP2;8). The function of aquaporin gene PtPIP2;8 and its response to drought stress were analyzed.
Methods We selected PtPIP2;8 silencing line of poplar 84K, PtPIP2;8 overexpressing line of poplar 84K and wildtype (WT) as the experimental materials. The Real-time fluorescence quantitative PCR technique was used to detect the PtPIP2;8 expression in roots, stems and leaves. Root hydraulic conductance was measured by high pressure liquid flow meter. The photosynthetic light-response curve, and gas exchange parameters were measured by a LI-6400 photosynthetic system. Growth indexes were determined, and the root length, root surface area, root volume and total root tips were scanned and then analyzed with the root analysis software.
Important findings The results showed that: (1) The gene PtPIP2;8 was mainly expressed in the root system in WT, while its significant expression occurs not only in roots, but also in stems and leaves in PtPIP2;8 overexpressing poplar lines. The PtPIP2;8 RNAi-silence poplar lines only showed weak expression of PtPIP2;8 in the root, and the expression level were 1/20 and 1/80 of WT and overexpression line, respectively. (2) The root structure analysis showed that overexpression lines had significantly lower total root length, total root surface area, total root volume and total root tips than RNAi-silence line and WT, but higher root hydraulic conductance compared with RNAi-silence line and WT. These results showed that the aquaporin gene PtPIP2;8 participated in plant water transport and improved water transport efficiency. (3) Under normal water conditions, RNAi-silence lines showed lower plant height and leaf area but higher root-shoot ratio compared with overexpression line and WT. After drought stress, RNAi-silence lines only slightly decreased the net photosynthetic rate (Pn) and stomatal conductance (Gs), and maintained a relatively high Pn. Diurnal changes of Pn and Gs in RNAi-silence lines showed a single-peak pattern, in which the decrease of photosynthesis was caused by stomatal limitation. Diurnal changes of Pn in both overexpression lines and WT had a two-peak pattern, indicating the non-stomatal limitation of photosynthesis. Drought stress slightly decreased Pn of RNAi-silence lines, while largely decreased Pn of overexpression line and WT decreased, especially at 13:00 and 15:00, indicating that overexpression line and WT were more sensitive to drought stress compared with the RNAi-silence lines. (4) Under drought stress, RNAi-silence line showed the least decline in relative growth rate and total biomass, and the highest root-shoot ratio among the three poplar lines. The total root surface area, total root volume and total root tips of RNAi-silence line were significantly higher than those of WT. The results suggest that aquaporin gene PtPIP2;8 directly participates in the water transport and helps to improve the water transport efficiency, thus the transformation of aquaporin PtPIP2;8 gene may affect root development and growth of plants. Overexpression lines weaken their drought resistance with decreased root development and increased leaf area, while RNAi-silence line increases its drought resistance with reduced leaf area, increased root growth and root-shoot ratio. The results of this study indicate that aquaporin improves the efficiency of water transport across membranes, while the non-aquaporin water-conducting mechanism has greater tolerance to drought.
Keywords:
PDF (1220KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
刘丽燕, 冯锦霞, 刘文鑫, 万贤崇. 干旱胁迫对转PtPIP2;8基因84K杨苗木光合、生长和根系结构的影响. 植物生态学报, 2020, 44(6): 677-686. DOI: 10.17521/cjpe.2020.0058
LIU Li-Yan, FENG Jin-Xia, LIU Wen-Xin, WAN Xian-Chong.
植物的生长发育依赖于水分运输和平衡, 水分吸收、运输和蒸腾是维持水分平衡的基本元素。植物根系的水分吸收有三条途径: 质外体途径、共质体途径和跨膜运输途径。由于根系凯氏带的存在, 水通道蛋白介导的水分跨膜运输途径在根系吸水过程中起着重要作用(Steudle & Peterson, 1998)。转基因是重要的生物学技术, 其广泛用于生物性状改良以及作为生理机制研究的工具。杨树是用于遗传转化的一种木本模式植物(周熙莹, 2013)。由此, 利用转基因杨树揭示其水通道蛋白家族成员具体功能, 分析其在植物水分调控中的作用, 是最直接、有效的方法。
在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(Fotiadis et al., 2001; Chaumont & Tyerman, 2014)。PIPs分布在细胞膜上, 每个单体蛋白会在中心形成具有高度选择性的通道, 水分、甘油等小分子溶质能够透过细胞膜, 它们存在于根系(Kammerloher et al., 1994)、叶片(Martre et al., 2002; Lopez et al., 2003)、生殖器官(Bots et al., 2005a, 2005b)、果实(O’Brien et al., 2002)和种子(Schuurmans et al., 2003)等部位, 参与各种生理过程及应对非生物胁迫(包珠拉太等, 2017)。它们或通过表达量上调(Lovisolo et al., 2007; 蔡琼等, 2016), 或通过表达量的下调来应对各种胁迫(Martre et al., 2001; Alexandersson et al., 2005)。这些研究均表明水通道蛋白对非生物胁迫有着不同的响应方式, 而干旱是限制植物生长的一个普遍因素, 植物在干旱条件下, 形态结构、光合性能、生物量、根系构型等都会发生变化(Knapp & Smith, 2001), 保持植物体内水分的平衡是保证植物生存的基本要素, 水通道蛋白的种类、表达和活性的调节可能是植物调控水分的方式之一(Johansson et al., 2000; Suga et al., 2001)。因此, 本研究以转PtPIP2;8基因不同表达水平的84K杨为切入点, 分析基因转化对其形态、根系结构的影响和转基因植物对干旱胁迫的响应, 验证该基因的功能。
1 材料和方法
1.1 试验材料
本课题组于2012年采用同源克隆的方法构建毛白杨质膜内在PtPIP2;8的表达载体(MN795099), 通过农杆菌介导转化, 获得转PtPIP2;8超表达84K杨植株。同时运用RNAi技术将84K杨中的PtPIP2;8进行了沉默处理而获得了抑制表达84K杨植株。之后, 这些转基因材料通过试管苗, 以及移栽后扦插繁殖方式进行保存。本试验选取PtPIP2;8超表达转基因株系中的116株系(超表达)、PtPIP2;8抑制表达转基因株系中的521株系(抑制表达)和野生型84K杨(WT)为试验材料。我们将实验室保存的抑制表达、超表达和WT植株试管苗切取茎段接种至培养基, 苗长至3 cm左右转至生根培养基, 再生长一个月左右, 当瓶苗长至瓶口, 高约10 cm, 用于PtPIP2;8转录水平相对表达量的检测。2015年3月初, 选取超表达、抑制表达和WT的一年生枝条进行扦插, 试验植株生长在温室内, 试验期间温室内温度范围约19-28 ℃, 相对湿度35%-55%。以草炭土:珍珠岩:砂子体积比3:1:1的比例, 将植株定植于高13 cm、直径15 cm的塑料花盆中。9月初, 选取健康、长势基本一致的超表达、抑制表达及WT植株各12株, 随机分为2组, 1组正常浇水, 1组干旱处理。1.2 试验方法
1.2.1 实时荧光定量PCR检测PtPIP2;8转录水平表达量变化取培养至10 cm左右的超表达、抑制表达和WT植株, 剪取其根、茎、叶片, 按照CTAB法提取总RNA, 反转录合成cDNA第一链。内参基因及引物参照冷华妮(2012)文献设计(表1), 实时定量PCR反应按照QIAGEN试剂盒提取步骤提取总RNA。通过各组织部位样品中内参基因和PtPIP2;8扩增曲线和溶解曲线考证定量结果的可信度。每株系3个重复。
Table 1
表1
表1实时荧光定量PCR引物序列
Table 1
| 基因名称 Gene name | 上游引物 Forward primer | 下游引物 Reverse primer |
|---|---|---|
| PtACTINrt | 5′-AAACTGTAATGGTCCTCCCTCCG-3′ | 5′-GCATCATCACAATCACTCTCCGA-3′ |
| PtPIP2;8 | 5′-GAGACTGTGAGGGACTACCAGGA-3′ | 5′-AATACCAAGAATGCCAACACCAC-3′ |
新窗口打开|下载CSV
1.2.2 干旱处理方法
采用TRME-T3 TDR便携式土壤水分测定仪(IMKO, Ettlingen, Germany)测定土壤体积含水量, 测定部位为各植株主干与花盆边缘中间部分, 深度为6 cm。预实验发现, 干旱处理开始时土壤体积含水量为30% ± 3%, 干旱至土壤体积含水量低于10%以后, 野生型、超表达植株开始萎蔫并很快顶端叶片枯死, 土壤体积含水量达到6%左右, 抑制表达植株开始萎蔫。因此, 本试验的干旱胁迫程度选择土壤体积含水量达到6%-8%时, 进行光合、生长及根系结构的测定, 测定时采用称质量法保持各植株土壤体积含水量维持在6%-8%之间。正常浇水作为对照。
1.2.3 光响应曲线的测定
晴天, 温室内, 选取超表达、抑制表达和野生型扦插苗顶端叶往下第6片的健康叶, 用LI-6400便携式光合仪(LI-COR, Lincoln, USA)测定光响应曲线。测量时, 使用红蓝光源叶室, 设定CO2浓度为400 μmol, 光强为2 000、1 800、1 500、1 200、1 000、800、500、200、100、50、20、0 μmol·m2·s-1, 测定前1 200 μmol·m2·s-1光诱导30 min, 每个光强值设定120 s等待时间。3个重复, 取平均值进行拟合。
1.2.4 气体交换参数的测定
晴天, 温室内, 选取超表达、抑制表达和野生型扦插苗顶端叶往下第6片健康叶用LI-6400便携式光合仪测定净光合速率、气孔导度、胞间CO2浓度、蒸腾速率等, 测定时间为7:00-17:00, 每隔2 h测定一次。LI-6400便携式光合仪设定为红蓝光源叶室, 光合有效辐射强度为1 500 μmol·m2·s-1, 测定时, 叶片诱导10 min。6个重复。
1.2.5 根系导水率测定
采用高压液流仪(HPFM, Dynamax, Houston, USA)测定根系水力导度(单位时间, 单位压力条件下单株根系的水流量)。取各株系植株, 在水下在距离土痕以上6 cm处截去主干, 在剩余的根茎处迅速套上注满水的硅胶管, 平衡一段时间后测定根系水力导度。测完根系水力导度的植株根系用水洗净之后, 用Win-Rhizo根系分析仪(Regent Instruments, Quebec, Canada)测定根系表面积。根系导水率为根系水力导度除以根系表面积。6个重复。
1.2.6 植株生物量测定
植株苗高为土痕处到苗最高点, 使用直尺测量; 基径为扦插后长出茎的基部直径, 使用游标卡尺测量。用叶面积仪(LI-3100, Konica Minolta, Tokyo, Japan)测定叶面积。叶片装信封后放置75 ℃烘箱烘干至恒质量。比叶面积(SLA)为总叶面积与叶片干质量的比值。地上生物量的测定是将茎和叶片采集后105 ℃杀青30 min, 75 ℃烘干至恒质量后称量; 地下生物量测定同此方法。6个重复。
1.2.7 植株根系结构分析
植株根系在水中浸润, 小刷轻刷洗干净后, 采用Win-Rhizo根系分析仪, 对根系总长、根系表面积等进行定量分析。分析完后的根系用于测定植株地下生物量, 其方法同上。
1.3 数据处理
采用Excel进行数据整理, SPSS 20.0软件进行单、双因素方差分析, Duncan多重比较(p < 0.05), Sigmaplot 12.5作图。2 结果和分析
2.1 PtPIP2;8基因转化对植株表达量的影响
本实验检测了PtPIP2;8转化后84K杨根部、茎部和叶片该基因的表达情况(图1), WT主要在根部表达, 茎部和叶片表达量可忽略不计; 超表达植株在根部、茎部和叶片的基因转录水平的表达量均上调, 分别是WT表达量的4倍、1.7倍和2.1倍, 显著高于WT的表达量; 抑制表达植株的PtPIP2;8在根部表达量最高, 但仅为WT植株表达量的1/20, 茎部和叶片的表达量很低, 可忽略不计。图1
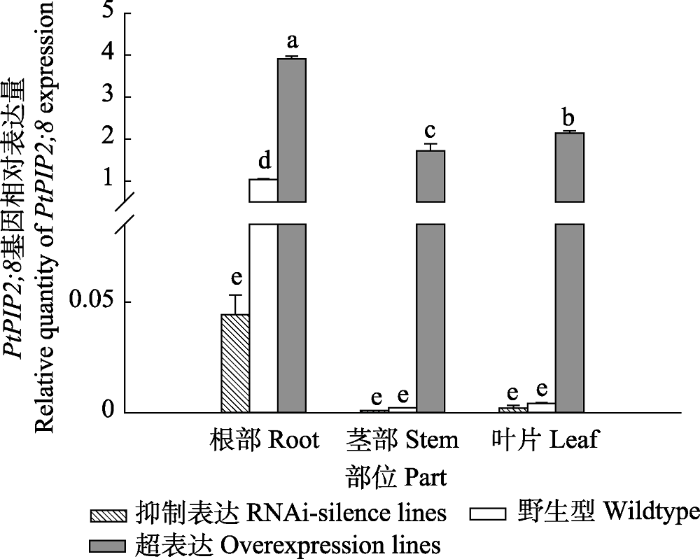 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图184K杨转基因和野生型植株PtPIP2;8基因的相对表达量(平均值+标准偏差)。
不同小写字母表示转基因和野生型植株不同部位之间相对表达量差异显著(p < 0.05)。
Fig. 1Relative quantity of PtPIP2;8 gene expression in transgenic and wildtype poplar 84K (mean + SD).
Different lowercase letters indicate significant differences in relative expression levels between different parts of transgenic and wildtype plants (p < 0.05).
2.2 PtPIP2;8基因转化对植株根系导水率的影响
除超表达植株的PtPIP2;8基因在茎和叶部有所表达之外, 抑制表达和WT植株主要在根系表达, 可见该基因能调节根系水分的跨膜运输。根系导水率测定结果显示, 在正常供水条件下, 超表达植株根系导水率显著高于WT和抑制表达植株(p < 0.05)(图2), 抑制表达植株根系导水率最低, WT植株居中, 表明PtPIP2;8基因参与了根系导水率的调节。图2
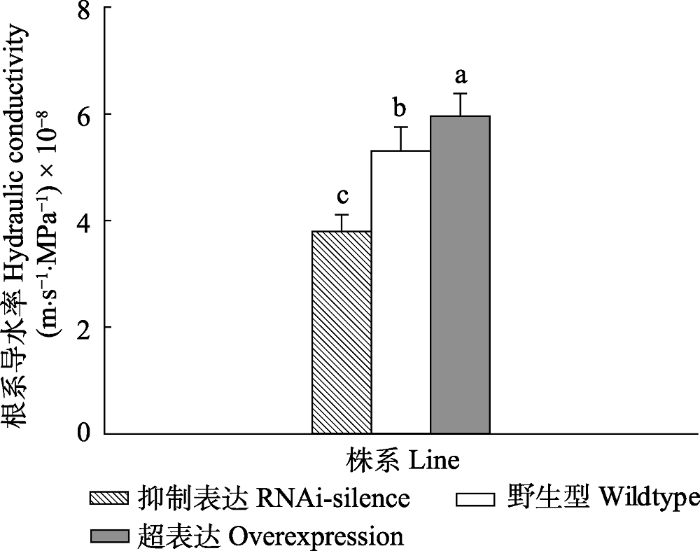 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2正常水分条件下84K杨转基因和野生型植株根系导水率变化(平均值+标准偏差)。
不同小写字母表示转基因和野生型植株之间根系导水率存在显著差异(p < 0.05)。
Fig. 2Changes of root hydraulic conductivity of transgenic and wildtype poplar 84K under normal watering condition (mean + SD).
Different lowercase letters indicate significant differences in transgenic and wildtype plants (p < 0.05).
2.3 PtPIP2;8基因转化对植物生长和根系形态的影响
正常水分条件下, 抑制表达苗高显著低于超表达和WT (p < 0.05), 超表达和WT苗高无显著差异 (p > 0.05)(表2), 表明PtPIP2;8基因沉默抑制了苗高。WT植株基径大于(p < 0.05)抑制表达和超表达植株, 后两者之间没有显著差别。抑制表达植株根冠比显著高于超表达和WT植株(p < 0.05), 超表达植株根冠比最低, 显著低于WT和抑制表达植株(p < 0.05)。抑制表达叶面积显著低于超表达和WT植株(p < 0.05)。抑制表达、WT和超表达植株比叶面积无显著差异(p > 0.05)。Table 2
表2
表2正常水分条件下84K杨转基因和野生型植株生物量变化(平均值±标准偏差)
Table 2
| 株系 Line | 基径 Basal diameter (mm) | 苗高 Height (cm) | 根冠比 Root-shoot ratio | 叶面积 Leaf area (cm2) | 比叶面积 Specific leaf area (cm2·g-1) |
|---|---|---|---|---|---|
| 抑制表达 RNAi-silence | 4.93 ± 0.26c | 71.60 ± 4.57b | 0.54 ± 0.05a | 534.35 ± 32.47b | 254.33 ± 14.32a |
| 野生型 Wildtype | 5.62 ± 0.43a | 82.55 ± 4.70a | 0.50 ± 0.03b | 565.23 ± 25.05a | 262.57 ± 20.49a |
| 超表达 Overexpression | 5.02 ± 0.46bc | 83.85 ± 4.99a | 0.32 ± 0.02c | 576.75 ± 13.31a | 240.61 ± 11.19a |
新窗口打开|下载CSV
正常水分条件下, 抑制表达植株总根表面积和总根体积显著大于WT和超表达植株(p < 0.05)(图3)。抑制表达总根长和总根尖数略大于WT, 但不显著(p > 0.05), 但显著高于超表达植株(p < 0.05)。超表达植株总根长、总根表面积、总根体积和总根尖数显著低于WT和抑制表达植株(p < 0.05), 与WT相比, 超表达植株总根长、总根表面积、总根体积和总根尖数比WT低29.5%、30.6%、34.2%和35.8%, 超表达植株根系显著小于WT。
图3
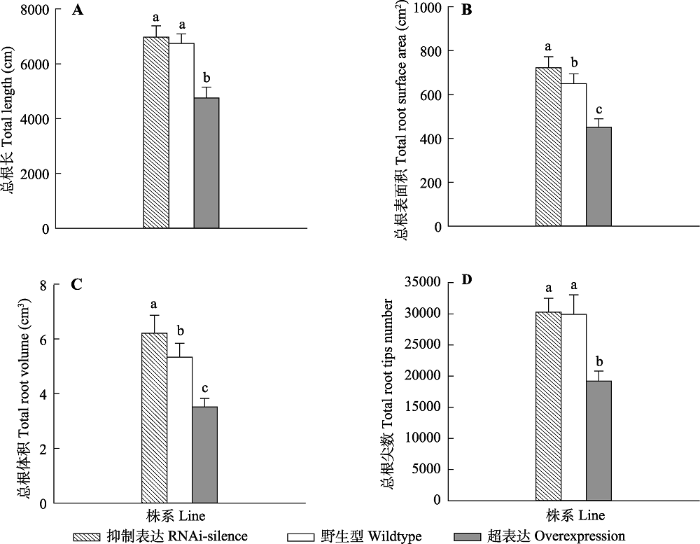 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3正常水分条件下84K杨转基因和野生型植株根系形态变化(平均值+标准偏差)。
写字母表示转基因和野生型植株之间存在显著差异(p < 0.05)。
Fig. 3Changes in root morphological traits of transgenic and wildtype poplar 84K under normal water condition (mean + SD).
ferent lowercase letters indicate significant differences between transgenic and wildtype plants (p < 0.05).
2.4 干旱胁迫后, 转基因和WT植株光合反应变化
2.4.1 转基因和WT植株光响应曲线比较转基因和WT植株光响应曲线用直角双曲线修正模型拟合后绘制(图4)。正常水分条件下, 转基因和WT植株表现相同趋势, 净光合速率(Pn)随着光照强度的增加而增大, 上升到最大值后, Pn随着光照强度增加仅略微增加, 属饱和趋近型光响应曲线, 曲线从上往下依次为WT >超表达>抑制表达; 干旱胁迫后, WT、超表达植株净光合速率下降幅度较大, 而抑制表达植株仍能保持较高的净光合速率, 光抑制现象不明显, 曲线从上往下变化为抑制表达> WT >超表达, 干旱胁迫后, 抑制表达植株对光强的利用能力强于WT和超表达植株。
图4
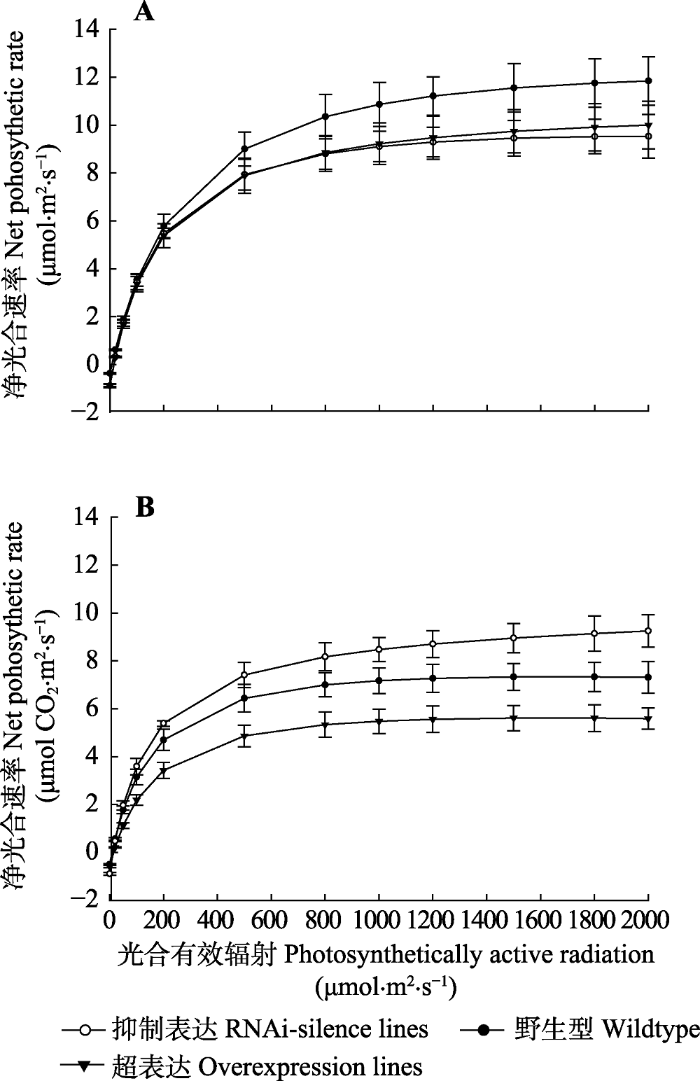 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图484K杨转基因和野生型植株净光合速率的光响应曲线(平均值±标准偏差)。
正常水分条件下净光合速率的光响应曲线。B, 干旱胁迫后净光合速率的光响应曲线。
Fig. 4Light response curve of net photosynthetic rate in transgenic and wildtype poplar 84K (mean ± SD).
Light response of net photosynthetic rate under normal watering conditions. B, Light response of net photosynthetic rate after drought stress.
2.4.2 转基因和WT植株气体交换参数变化
各基因型和WT净光合速率(Pn)和气孔导度(Gs) 的日变化规律趋势相同。超表达和WT植株Pn日变化呈“双峰”型, 中午均有明显的下降; 抑制表达植株Pn日变化呈“单峰”型(图5)。干旱胁迫后, WT和超表达植株在13:00、15:00, Pn明显下降(p < 0.05); 抑制表达Pn变化不显著, 仅在11:00略微下降, 且下降不显著(p > 0.05)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图584K杨转基因和野生型植株净光合速率日变化(平均值±标准偏差)。
A, 正常水分条件下净光合速率日变化。B, 干旱胁迫后净光合速率日变化。
Fig. 5Diurnal variations of net photosynthetic rate in transgenic and wildtype poplar 84K (mean ± SD).
A, Diurnal variations of net photosynthetic rate under normal watering conditions. B, Diurnal variations of net photosynthetic rate after drought stress.
2.5 干旱胁迫后, 转基因和WT植株生长和根系形态的变化
2.5.1 干旱胁迫后, 转基因和WT植株生物量变化干旱胁迫后, 转基因和WT植株生长速率均下降, 超表达和WT植株基茎、苗高下降的程度显著(p < 0.05), 抑制表达植株下降最少, 相对生长速率显著高于WT和超表达植株(表3)。抑制表达植株地上生物量、叶面积和根冠比下降最少, 叶面积、根冠比显著高于WT和超表达植株(p < 0.05)。超表达植株地上生物量、叶面积、根冠比下降最显著(p < 0.05)。
Table 3
表3
表3干旱胁迫后84K杨转基因和野生型植株相对生长速率及生物量变化(平均值±标准偏差)
Table 3
| 株系 Line | 基径 Basal diameter (%) | 苗高 Height (%) | 地上生物量 Aboveground biomass (%) | 地下生物量 Belowground biomass (%) | 根冠比 Root shoot ratio | 叶面积 Leaf area (%) |
|---|---|---|---|---|---|---|
| 抑制表达 RNAi-silence | 97 ± 3a | 94 ± 3a | 93 ± 2a | 84 ± 5a | 0.5 ± 0.02a | 68 ± 4a |
| 野生型 Wildtype | 92 ± 3b | 88 ± 4b | 86 ± 7b | 77 ± 4b | 0.4 ± 0.03b | 44 ± 2b |
| 超表达 Overexpression | 92 ± 2b | 87 ± 4b | 77 ± 3c | 76 ± 5b | 0.3 ± 0.02c | 43 ± 2b |
新窗口打开|下载CSV
2.5.2 干旱胁迫后, 转基因和WT植株根系形态变化
干旱胁迫后, 抑制表达植株总根表面积、总根体积和总根尖数显著高于超表达和WT植株(p < 0.05)(图6)。抑制表达植株总根长显著高于超表达植株(p < 0.05), 略高于WT, 但没有显著区别(p > 0.05)。
图6
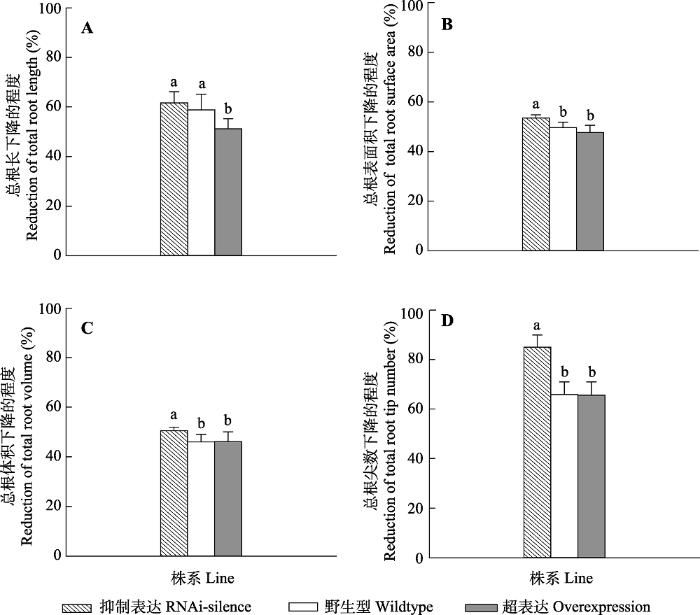 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6干旱胁迫后转基因和野生型84K杨根系形态变化(平均值+标准偏差)。
不同小写字母表示转基因和野生型植株之间存在显著差异(p < 0.05)。
Fig. 6Changes of root morphological traits of transgenic and wildtype poplar 84K after drought dress (mean + SD).
Different lowercase letters indicate significant differences between transgenic and wildtype plants (p < 0.05).
3 讨论
在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(Weig et al., 1997; Knipfer et al., 2011; 江林娟等, 2018)。在根系水通道蛋白研究中发现, 根尖和侧根包含大量水通道蛋白PIPs, 其表达位点与其功能有着直接关系(Javot & Maurel, 2002), 而PtPIP2;8基因在WT植株根部表达。PtPIP2;8基因超表达的植株表现出高单位面积根系导水率, 总根长、总根表面积、总根体积和总根尖数却显著低于WT和抑制表达的植株。这意味着PtPIP2;8基因超表达的植株仅需要少量的根系就可以维持植株的水分吸收。与此相反, PtPIP2;8基因沉默的抑制表达植株则表现为低单位面积根系导水率, 高总根表面积和总根体积。这表明PtPIP2;8基因参与了根系水分运输, 有提高水分运输效率的功能, 在跨膜运输中起了重要的作用。同时, 转基因植物中水通道蛋白的减少, 明显影响了抑制表达植株的生长和根系的发育, 其通过低的生长速率、小的叶面积, 大的根系表面积和根体积来弥补水通道的不足, 进而维持植株根系对水分的持续吸收。正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(Boughalleb & Hajlaoui, 2011)。光合作用变化是鉴定植物抗旱性的一个重要指标(赵通等, 2018)。光响应曲线则最能反映植物对光强和环境的适应能力, 本研究中, 正常水分下的WT植株净光合速率高于转基因植株, 但干旱胁迫后, 抑制表达植株净光合速率、气孔导度下降幅度最少, 在干旱条件下仍表现出较高的光合作用能力。通常, 干旱胁迫后, 气孔导度和光合速率都下降, 随着干旱胁迫的加深, 叶肉细胞光合作用受到限制, 气孔限制向非气孔限制转变。大量研究认为光合作用“午休”是非气孔因素引起的(姚庆群和谢贵水, 2005), 而本研究抑制表达植株净光合速率日变化为“单峰”型, 属气孔因素引起的净光合速率下降, 气孔限制降低了蒸腾速率, 提高了水分利用效率; 野生型和超表达植株净光合速率日变化则为“双峰”型, 表明光合速率下降是由非气孔因素引起的, 表明其对干旱更加敏感, 干旱对其影响更大。
本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关。关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(Zelazny et al., 2007)。干旱胁迫后, 转基因和WT植株生长均受到影响, 超表达植株增高、增粗生长和总生物量分别降低了12.5%、8.2%和47.0%, 下降程度最高, 对干旱胁迫更为敏感, 这与Katsuhara等(2003)研究超表达HvPIP2;1基因的大麦(Hordeum vulgare)盐胁迫结果相同, 超表达植株根系明显变小, 根系导水率显著高于WT, 对盐胁迫更敏感(Katsuhara et al., 2003)。本研究结果与水通道蛋白响应干旱胁迫的第二种观点一致, 干旱条件下, 超表达植株水通道蛋白的过量表达形成高效的水分供应导致植株水分损失过多, 对干旱更加敏感, 抗旱能力最差, 这说明在干旱条件下, 植物组织中水分运输的增加不利于植物的抗旱(Aharon et al., 2003)。抑制表达植株苗高、基径、叶面积则显著小于WT, 这与Siefritz等(2002)研究转PIP1抑制表达的烟草中抑制表达与WT植株表型无差异的结果是不同的。本研究中, 水通道蛋白PtPIP2;8基因沉默影响了抑制表达植株的生长, 其生长速率显著低于WT, 但干旱胁迫后, 抑制表达、超表达和WT植株总生物量分别减少了23.3%、47.0%和37.4%, 叶面积分别减少了32.0%、57.0%和56.0%, 抑制表达植株受干旱胁迫的影响更小, 其具有更强抗旱能力(黄娟等, 2017)。
根系结构研究发现, 正常水分条件下, 抑制表达植株总根表面积、总根体积显著高于WT, 根系的生长竞争抑制了地上部分生长, 抑制表达显著低于WT和超表达植株, 根冠比增加, 这与转PIP1的拟南芥(Arabidopsis thaliana)通过增加根系质量来弥补水通道蛋白的减少的研究结果(Kaldenhoff et al., 1998)相同。根系在抵抗干旱和维持植株水分平衡中, 具有重要的作用(Prieto et al., 2012), 正常水分条件下, 抑制表达植株具有大的根系表面积、高的根冠比; 干旱胁迫后, 其总表面积、总体积、总根尖数显著高于WT植株, 其根系的发育有利于土壤的水分吸收(Matsunami et al., 2016)。因此, 维持较大的根冠比、总根表面积、总根尖数应该是抑制表达植株抵抗干旱的一种策略。总之, PtPIP2;8基因通过表达量的变化影响了超表达和抑制表达植株的生长和根系的发育, 水通道蛋白的过多表达, 增加了植物快速运输水分的能力, 降低了植株抵抗干旱的能力; 抑制表达非水通道蛋白的导水机制增强了其对干旱的耐受能力, 这可以为新的耐旱转基因杨树的研究提供参考。

参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1105/tpc.150110URLPMID:12509517 [本文引用: 1]
DOI:10.1007/s11103-005-0352-1URLPMID:16235111 [本文引用: 1]

Since many aquaporins (AQPs) act as water channels, they are thought to play an important role in plant water relations. It is therefore of interest to study the expression patterns of AQP isoforms in order to further elucidate their involvement in plant water transport. We have monitored the expression patterns of all 35 Arabidopsis AQPs in leaves, roots and flowers by cDNA microarrays, specially designed for AQPs, and by quantitative real-time reverse transcriptase PCR (Q-RT-PCR). This showed that many AQPs are pre-dominantly expressed in either root or flower organs, whereas no AQP isoform seem to be leaf specific. Looking at the AQP subfamilies, most plasma membrane intrinsic proteins (PIPs) and some tonoplast intrinsic proteins (TIPs) have a high level of expression, while NOD26-like proteins (NIPs) are present at a much lower level. In addition, we show that PIP transcripts are generally down-regulated upon gradual drought stress in leaves, with the exception of AtPIP1;4 and AtPIP2;5, which are up-regulated. AtPIP2;6 and AtSIP1;1 are constitutively expressed and not significantly affected by the drought stress. The transcriptional down-regulation of PIP genes upon drought stress could also be observed on the protein level.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11738-010-0516-8URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.113.233791URLPMID:24449709 [本文引用: 1]

Plant growth and development are dependent on tight regulation of water movement. Water diffusion across cell membranes is facilitated by aquaporins that provide plants with the means to rapidly and reversibly modify water permeability. This is done by changing aquaporin density and activity in the membrane, including posttranslational modifications and protein interaction that act on their trafficking and gating. At the whole organ level aquaporins modify water conductance and gradients at key
DOI:10.1074/jbc.M009383200URLPMID:11050104 [本文引用: 1]

Two members of the aquaporin family, PM28A and a new one, PM28C, were isolated and shown to be the major constituents of spinach leaf plasma membranes. These two isoforms were identified and characterized by matrix-assisted laser desorption ionization-mass spectrometry. Edman degradation yielded the amino acid sequence of two domains belonging to the new isoform. PM28B, a previously described isoform, was not found in our preparations. Scanning transmission electron microscopy mass analysis revealed both PM28 isoforms to be tetrameric. Two types of particles, a larger and a smaller one, were found by transmission electron microscopy of negatively stained solubilized proteins and by atomic force microscopy of PM28 two-dimensional crystals. The ratio of larger to smaller particles observed by transmission electron microscopy and single particle analysis correlated with the ratio of PM28A to PM28C determined by matrix-assisted laser desorption ionization-mass spectrometry. The absence of PM28B and the ratio of PM28A to PM28C indicate that these plasma membrane intrinsic proteins are differentially expressed in spinach leaves. These findings suggest that differential expression of the various aquaporin isoforms may regulate the water flux across the plasma membrane, in addition to the known mechanism of regulation by phosphorylation.
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/aob/mcf199URLPMID:12234142 [本文引用: 1]

The capacity of roots to take up water is determined in part by the resistance of living tissues to radial water flow. Both the apoplastic and cell-to-cell paths mediate water transport in these tissues but the contribution of cell membranes to the latter path has long been difficult to estimate. Aquaporins are water channel proteins that are expressed in various membrane compartments of plant cells, including the plasma and vacuolar membranes. Plant aquaporins are encoded by a large multigene family, with 35 members in Arabidopsis thaliana, and many of these aquaporins show a cell-specific expression pattern in the root. Mercury acts as an efficient blocker of most aquaporins and has been used to demonstrate the significant contribution of water channels to overall root water transport. Aquaporin-rich membranes may be needed to facilitate intense water flow across root tissues and may represent critical points where an efficient and spatially restricted control of water uptake can be exerted. Roots, in particular, show a remarkable capacity to alter their water permeability over the short term (i.e. in a few hours to less than 2-3 d) in response to many stimuli, such as day/night cycles, nutrient deficiency or stress. Recent data suggest that these rapid changes can be mostly accounted for by changes in cell membrane permeability and are mediated by aquaporins. Although the processes that allow perception of environmental changes by root cells and subsequent aquaporin regulation are nearly unknown, the study of root aquaporins provides an interesting model to understand the regulation of water transport in plants and sheds light on the basic mechanisms of water uptake by roots.
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/s0005-2736(00)00147-4URLPMID:10748263 [本文引用: 1]

Aquaporins are water channel proteins belonging to the major intrinsic protein (MIP) superfamily of membrane proteins. More than 150 MIPs have been identified in organisms ranging from bacteria to animals and plants. In plants, aquaporins are present in the plasma membrane and in the vacuolar membrane where they are abundant constituents. Functional studies of aquaporins have hitherto mainly been performed by heterologous expression in Xenopus oocytes. A main issue is now to understand their role in the plant, where they are likely to be important both at the cellular and at the whole plant level. Plants contain a large number of aquaporin isoforms with distinct cell type- and tissue-specific expression patterns. Some of these are constitutively expressed, whereas the expression of others is regulated in response to environmental factors, such as drought and salinity. At the protein level, regulation of water transport activity by phosphorylation has been reported for some aquaporins.
[本文引用: 1]
DOI:10.1046/j.1365-313x.1994.6020187.xURLPMID:7920711 [本文引用: 1]

Expression in mammalian COS cells and an efficient microtiter-based strategy for immunoselection was used in a novel approach to identify genes encoding plant membrane proteins. COS cells were transfected with an Arabidopsis thaliana root cDNA library constructed in a bacterial mammalian shuttle vector and screened with an antiserum raised against purified deglycosylated integral plasma membrane proteins from A. thaliana roots. Antibodies directed against a prominent 27 kDa antigen led to the identification of five different genes. They comprised two subfamilies related to the major intrinsic protein (MIP) superfamily and were named plasma membrane intrinsic proteins, PIP1 and PIP2, since the cellular localization of PIP1 and most probably PIP2 proteins in the plasma membrane was independently confirmed by their cosegregation with marker enzymes during aqueous two-phase partitioning. Surprisingly, expression in Xenopus laevis oocytes revealed that all five PIP mRNAs coded for Hg(2+)-sensitive water transport facilitating activities. There had been no previous evidence of the existence of water channels in the plasma membrane of plant cells and the high diffusional water permeability of the lipid bilayer was considered to be sufficient for water exchange. Nevertheless, Northern and Western analyses showed that the PIP genes are constitutively and possibly even redundantly expressed from the small A. thaliana genome.
DOI:10.1093/pcp/pcg167URLPMID:14701933 [本文引用: 2]

Barley HvPIP2;1 is a plasma membrane aquaporin and its expression was down-regulated after salt stress in barley [Katsuhara et al. (2002) Plant Cell Physiol. 43: 885]. We produced and analyzed transgenic rice plants over-expressing barley HvPIP2;1 in the present study. Over-expression of HvPIP2;1 increased (1) radial hydraulic conductivity of roots (Lp(r)) to 140%, and (2) the mass ratio of shoot to root up to 150%. In these transgenic rice plants under salt stress of 100 mM NaCl, growth reduction was greater than in non-transgenic plants. A decrease in shoot water content (from 79% to 61%) and reduction of root mass or shoot mass (both less than 40% of non-stressed plants) were observed in transgenic plants under salt stress for 2 weeks. These results indicated that over-expression of HvPIP2;1 makes rice plants sensitive to 100 mM NaCl. The possible involvement of aquaporins in salt tolerance is discussed.
DOI:10.1126/science.291.5503.481URLPMID:11161201 [本文引用: 1]

Interannual variability in aboveground net primary production (ANPP) was assessed with long-term (mean = 12 years) data from 11 Long Term Ecological Research sites across North America. The greatest interannual variability in ANPP occurred in grasslands and old fields, with forests the least variable. At a continental scale, ANPP was strongly correlated with annual precipitation. However, interannual variability in ANPP was not related to variability in precipitation. Instead, maximum variability in ANPP occurred in biomes where high potential growth rates of herbaceous vegetation were combined with moderate variability in precipitation. In the most dynamic biomes, ANPP responded more strongly to wet than to dry years. Recognition of the fourfold range in ANPP dynamics across biomes and of the factors that constrain this variability is critical for detecting the biotic impacts of global change phenomena.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/j.1469-8137.2011.04039.xURLPMID:22250761 [本文引用: 1]

Hydraulic redistribution (HR) is the passive movement of water between different soil parts via plant root systems, driven by water potential gradients in the soil-plant interface. New data suggest that HR is a heterogeneous and patchy process. In this review we examine the main biophysical and environmental factors controlling HR and its main implications at the plant, community and ecosystem levels. Experimental evidence and the use of novel modelling approaches suggest that HR may have important implications at the community scale, affecting net primary productivity as well as water and vegetation dynamics. Globally, HR may influence hydrological and biogeochemical cycles and, ultimately, climate.
[本文引用: 1]
DOI:10.1105/tpc.000901URLPMID:11971141 [本文引用: 1]

The molecular functions of several aquaporins are well characterized (e.g., by analysis of aquaporin-expressing Xenopus oocytes). However, their significance in the physiology of water transport in multicellular organisms remains uncertain. The tobacco plasma membrane aquaporin NtAQP1 was used to elucidate this issue. By comparing antisense plants that were inhibited in NtAQP1 expression with control plants, we found evidence for NtAQP1 function in cellular and whole-plant water relations. The consequences of a decrease in cellular water permeability were determined by measurement of transpiration rate and stem and leaf water potential as well as growth experiments under extreme soil water depletion. Plants impaired in NtAQP1 expression showed reduced root hydraulic conductivity and lower water stress resistance. In conclusion, our results emphasize the importance of symplastic aquaporin-mediated water transport in whole-plant water relations.
[本文引用: 1]
DOI:10.1007/s004250000396URLPMID:11216851 [本文引用: 1]

Plant aquaporins occur in multiple isoforms and are distributed in both plasma membrane and tonoplast. We cloned cDNAs for plasma-membrane aquaporins (PAQ1, 1b, 1c, 2, 2b, and 2c) of radish (Raphanus sativus L.). The amino acid sequences of the PAQs showed on average 63% sequence identity. Their sequences were 23% identical to those of tonoplast aquaporins (gamma- and delta-VM23). A comprehensive investigation of the aquaporin mRNAs, including VM23, in seedlings, plants, flowers and seeds of radish showed a marked accumulation of all the mRNAs in hypocotyls and growing taproots. In other organs, the mRNA level of each isoform varied according to the organ. In petals, stamens, pistils and sepals of flowers, the levels of PAQ1, 1b, 1c and gamma-VM23 mRNAs were high, and mRNAs of all aquaporins except for delta-VM23 were detected at high levels in pericarps. The protein levels of aquaporins on the basis of the membrane protein were determined by immunoblotting. Proteins PAQ1 and VM23 were detected in every organ except for the mature petiole. The PAQ2 protein level was especially high in green cotyledons and leaves, but was extremely low in seedling cotyledons and hypocotyls. Proteins PAQ1, PAQ2 and VM23 were highly accumulated in growing pericarps, but not in the immature seeds. These results indicate that the gene expression of the aquaporin isoforms was individually regulated in an organ- and tissue-specific manner, and that the amounts of aquaporin protein, especially PAQ2, are regulated in certain tissues at the translational level and by the rate of protein turnover.
DOI:10.1104/pp.114.4.1347URLPMID:9276952 [本文引用: 1]

Aquaporins, proteins that enhance the permeability of biological membranes to water, are widely distributed in living organisms. They are 26- to 29-kD proteins that belong to the major intrinsic protein (MIP) family of channels. By searching the Arabidopsis thaliana expressed sequence tag database and by using the polymerase chain reaction with oligonucleotides to conserved plant aquaporin domains, we identified 23 expressed Arabidopsis MIP genes. Eight of these had been previously identified as active aquaporins, and two additional ones are now reported to have water-transport activity in Xenopus laevis oocytes. One of these is highly expressed in suspension-cultured cells. On a dendrogram these 23 MIP sequences cluster into three groups: the first group has 11 members and contains the plasma membrane aquaporins, the second group also has 11 members and contains the tonoplast aquaporins, and the third group has only a single member. This MIP protein, provisionally called At-NLM1, is most closely related to the Gm-NOD26 protein that is found in the bacteroid membranes of soybean (Glycine max L.) nodules; At-NLM1 is an active aquaporin when expressed in oocytes. With a semiquantitative slot-blot analysis technique, we determined the expression levels of 22 MIP genes in the various organs. The quantitative polymerase chain reaction was used to determine the effects of various stress treatments on the expression of NLM1.
[本文引用: 1]
[本文引用: 1]
DOI:10.1073/pnas.0701180104URLPMID:17636130 [本文引用: 1]

Zea mays plasma membrane intrinsic proteins (ZmPIPs) fall into two groups, ZmPIP1s and ZmPIP2s, that exhibit different water channel activities when expressed in Xenopus oocytes. ZmPIP1s are inactive, whereas ZmPIP2s induce a marked increase in the membrane osmotic water permeability coefficient, P(f). We previously showed that, in Xenopus oocytes, ZmPIP1;2 and ZmPIP2;1 interact to increase the cell P(f). Here, we report the localization and interaction of ZmPIP1s and ZmPIP2s in living maize cells. ZmPIPs were fused to monomeric yellow fluorescent protein and/or monomeric cyan fluorescent protein and expressed transiently in maize mesophyll protoplasts. When expressed alone, ZmPIP1 fusion proteins were retained in the endoplasmic reticulum, whereas ZmPIP2s were found in the plasma membrane. Interestingly, when coexpressed with ZmPIP2s, ZmPIP1s were relocalized to the plasma membrane. Using FRET/fluorescence lifetime imaging microscopy, we demonstrated that this relocalization results from interaction between ZmPIP1s and ZmPIP2s. Immunoprecipitation experiments provided additional evidence for the association of ZmPIP1;2 and ZmPIP2;1 in maize roots and suspension cells. These data suggest that PIP1-PIP2 interaction is required for in planta PIP1 trafficking to the plasma membrane to modulate plasma membrane permeability.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress
1
2003
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
Whole gene family expression and drought stress regulation of aquaporins
1
2005
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
植物水通道蛋白及其生理功能
1
2017
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
植物水通道蛋白及其生理功能
1
2017
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
PIP1 and PIP2 aquaporins are differentially expressed during tobacco anther and stigma development
1
2005a
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Aquaporins of the PIP2 class are required for efficient anther dehiscence in tobacco
1
2005b
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Physiological and anatomical changes induced by drought in two olive cultivars (cv Zalmati and Chemlali)
1
2011
... 正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(
马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析
1
2016
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析
1
2016
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Aquaporins: highly regulated channels controlling plant water relations
1
2014
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Structural characterization of two aquaporins isolated from native spinach leaf plasma membranes
1
2001
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
干旱胁迫对转JERF36银中杨苗木叶片解剖结构及光合特性的影响
1
2017
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
干旱胁迫对转JERF36银中杨苗木叶片解剖结构及光合特性的影响
1
2017
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
The role of aquaporins in root water uptake
1
2002
... 在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(
植物水通道蛋白的干旱应答机制研究进展
1
2018
... 在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(
植物水通道蛋白的干旱应答机制研究进展
1
2018
... 在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(
The role of aquaporins in cellular and whole plant water balance
1
2000
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Significance of plasmalemma aquaporins for water-transport in Arabidopsis thaliana
1
1998
... 根系结构研究发现, 正常水分条件下, 抑制表达植株总根表面积、总根体积显著高于WT, 根系的生长竞争抑制了地上部分生长, 抑制表达显著低于WT和超表达植株, 根冠比增加, 这与转PIP1的拟南芥(Arabidopsis thaliana)通过增加根系质量来弥补水通道蛋白的减少的研究结果(
Water channels in the plant plasma membrane cloned by immunoselection from a mammalian expression
1
1994
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Over-expression of a barley aquaporin increased the shoot/root ratio and raised salt sensitivity in transgenic rice plants
2
2003
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
... )盐胁迫结果相同, 超表达植株根系明显变小, 根系导水率显著高于WT, 对盐胁迫更敏感(
Variation among biomes in temporal dynamics of aboveground primary production
1
2001
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Aquaporin- facilitated water uptake in barley (Hordeum vulgare L.) roots
1
2011
... 在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(
植物栓塞修复机制与质膜内在水通道蛋白基因的克隆、表达和转基因研究
1
2012
... 取培养至10 cm左右的超表达、抑制表达和WT植株, 剪取其根、茎、叶片, 按照CTAB法提取总RNA, 反转录合成cDNA第一链.内参基因及引物参照
植物栓塞修复机制与质膜内在水通道蛋白基因的克隆、表达和转基因研究
1
2012
... 取培养至10 cm左右的超表达、抑制表达和WT植株, 剪取其根、茎、叶片, 按照CTAB法提取总RNA, 反转录合成cDNA第一链.内参基因及引物参照
Diurnal regulation of water transport and aquaporin gene expression in maize roots: contribution of PIP2 proteins
1
2003
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Expression of PIP1 and PIP2 aquaporins is enhanced in olive dwarf genotypes and is related to root and leaf hydraulic conductance
1
2007
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Plasma membrane aquaporins play a significant role during recovery from water deficit
1
2002
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Hydraulic conductance and mercury-sensitive water transport for roots of Opuntia acanthocarpa in relation to soil drying and rewetting
1
2001
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Root development and the expression of aquaporin genes in rice seedlings under osmotic stress
1
2016
... 根系结构研究发现, 正常水分条件下, 抑制表达植株总根表面积、总根体积显著高于WT, 根系的生长竞争抑制了地上部分生长, 抑制表达显著低于WT和超表达植株, 根冠比增加, 这与转PIP1的拟南芥(Arabidopsis thaliana)通过增加根系质量来弥补水通道蛋白的减少的研究结果(
Characterization of a fertilization-induced and developmentally regulated plasma-membrane aquaporin expressed in reproductive tissues, in the wild potato Solanum chacoense Bitt
1
2002
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
Water release through plant roots: new insights into its consequences at the plant and ecosystem level
1
2012
... 根系结构研究发现, 正常水分条件下, 抑制表达植株总根表面积、总根体积显著高于WT, 根系的生长竞争抑制了地上部分生长, 抑制表达显著低于WT和超表达植株, 根冠比增加, 这与转PIP1的拟南芥(Arabidopsis thaliana)通过增加根系质量来弥补水通道蛋白的减少的研究结果(
Members of the aquaporin family in the developing pea seed coat include representatives of the PIP, TIP, and NIP subfamilies
1
2003
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
PIP1 plasma membrane aquaporins in tobacco: from cellular effects to function in plants
1
2002
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
How does water get through roots?
1
1998
... 植物的生长发育依赖于水分运输和平衡, 水分吸收、运输和蒸腾是维持水分平衡的基本元素.植物根系的水分吸收有三条途径: 质外体途径、共质体途径和跨膜运输途径.由于根系凯氏带的存在, 水通道蛋白介导的水分跨膜运输途径在根系吸水过程中起着重要作用(
Specificity of the accumulation of mRNAs and proteins of the plasma membrane and tonoplast aquaporins in radish organs
1
2001
... 在植物的水通道蛋白中, 质膜水通道蛋白(PIPs)和液泡膜水通道蛋白(TIPs)最为重要, PIPs主要负责水分的吸收与外排, TIPs维持细胞膨压, 它们主要参与了水分在根部、叶部的运输, 维持植物体内水分的平衡(
The major intrinsic protein family of Arabidopsis has 23 members that form three distinct groups with functional aquaporins in each group
1
1997
... 在水通道蛋白研究中, PIP2s多表现为更强的水通道活性, 具有提高水分运输效率的功能(
干旱胁迫下光合作用的气孔与非气孔限制
1
2005
... 正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(
干旱胁迫下光合作用的气孔与非气孔限制
1
2005
... 正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(
FRET imaging in living maize cells reveals that plasma membrane aquaporins interact to regulate their subcellular localization
1
2007
... 本研究中超表达植株对干旱胁迫更敏感, 究其原因应与水通道蛋白的表达有关.关于水通道蛋白对干旱胁迫的响应有2种观点: 一种认为增加水通道蛋白的表达可以增强植物对水分的调控; 另一种观点则相反, 认为水通道蛋白过量表达会加剧水分的运输和流失, 加剧了水分缺乏对植物的影响(
不同苹果砧穗组合的生长及光合特性
1
2018
... 正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(
不同苹果砧穗组合的生长及光合特性
1
2018
... 正常水分条件下, 植物会尽最大可能截获光能积累能量, 促进植物的生长; 干旱胁迫则会降低植物的生长活力, 导致光合作用能力下降, 进而影响植物的生长(
84K杨再生和遗传转化体系的研究
1
2013
... 植物的生长发育依赖于水分运输和平衡, 水分吸收、运输和蒸腾是维持水分平衡的基本元素.植物根系的水分吸收有三条途径: 质外体途径、共质体途径和跨膜运输途径.由于根系凯氏带的存在, 水通道蛋白介导的水分跨膜运输途径在根系吸水过程中起着重要作用(
84K杨再生和遗传转化体系的研究
1
2013
... 植物的生长发育依赖于水分运输和平衡, 水分吸收、运输和蒸腾是维持水分平衡的基本元素.植物根系的水分吸收有三条途径: 质外体途径、共质体途径和跨膜运输途径.由于根系凯氏带的存在, 水通道蛋白介导的水分跨膜运输途径在根系吸水过程中起着重要作用(
