0 引言
【研究意义】飞蝗(Locusta migratoria)是重要的世界性农业害虫,其表皮周期性的生成与降解是重要的生物学现象,研究表皮发育对害虫防治具有重要意义。【前人研究进展】飞蝗表皮富含几丁质,其周期性的降解由几丁质酶等催化完成。几丁质酶5(chitinase5,Cht5)属于Group I,是第一个被鉴定的昆虫几丁质酶基因(MsCht5),由KRAMER等[1]于1993年从烟草天蛾(Manduca sexta)的蜕皮液中分离得到,之后该基因的直系同源基因在至少15个昆虫物种中被陆续分离鉴定[2-5],被认为参与昆虫表皮几丁质的降解[6-7]。Cht5在飞蝗中具有基因复制现象[8],飞蝗Cht5包含LmCht5-1和LmCht5-2两个基因,其中LmCht5-1含有信号肽、几丁质结合域和催化域,与已报道的昆虫Cht5基因直系同源,通过向5龄若虫注射dsCht5-1,发现LmCht5-1影响飞蝗5龄若虫到成虫期的蜕皮发育,造成飞蝗蜕皮困难而死亡;而抑制LmCht5-2无可见异常表型。通过几丁质结合蛋白Knickkopf(Knk)和Cht5蛋白在赤拟谷盗(Tribolium castaneum)表皮的定位分析,发现Knk蛋白和Cht5蛋白共定位于新合成的表皮,提出Knk蛋白的新功能,即保护新合成几丁质不被几丁质酶降解[9]。YU等[10]通过几丁质脱乙酰基酶2(CDA2)在飞蝗表皮的蛋白定位,发现该蛋白主要定位在外表皮(exocuticle)与上表皮(epicuticle)之间,结合生化和电镜结果,发现了昆虫CDA2的新功能,即连接外表皮和上表皮,具有支架作用,启动几丁质螺旋结构的形成和有序紧密排列。【本研究切入点】LmCht5-1的抗体缺乏,影响对其表达特性及功能的分析。制备高特异性LmCht5-1抗体,有利于解析其功能及与LmCht5-2的功能分化。【拟解决的关键问题】通过序列比对和抗原表位预测分析,获得LmCht5-1抗原结构区域,通过与高免疫原性鸡卵清白蛋白偶联制备高效多克隆抗体,检测抗体效价与特异性,分析LmCht5-1在飞蝗不同发育日龄的表达特性及组织定位;解析LmCht5-1蛋白缺失对表皮几丁质降解的影响。为后续深入解析LmCht5-1功能及其与LmCht5-2的功能分化研究提供试验材料和平台条件。1 材料与方法
试验于2016—2017年在山西大学应用生物学研究所完成。1.1 材料
试虫:试验用飞蝗饲养于山西大学应用生物学研究所昆虫培养室。饲养条件:室温28—30℃,光照14L﹕10D,相对湿度15%—25%。挑选大量3龄飞蝗若虫进行同步化培养。取4龄各日龄飞蝗的表皮进行分析。主要试剂:载体pET32a和JMB88-OVA为实验室保存。IPTG、X-Gal购于索莱宝公司。蛋白纯化Ni-NTA柱和RiboMAXTM Expression RNAi System购于Promega公司。Trizol、HiFi cDNA-script、SYBR Green、2×Tag Mix购自康为世纪,其他试剂均为分析纯。
1.2 飞蝗LmCht5-1高免疫活性载体构建
1.2.1 特异性LmCht5-1序列选取及分析 利用MEGA软件对LmCht5-1和LmCht5-2的氨基酸全长序列进行比对,分析其中差异序列。选取LmCht5-1的差异片段,在Expression网站分析抗原表位,选取抗原表位中含有大量抗原决定簇的片段作为LmCht5-1的抗原制备区域。利用软件ClonemanageV7将LmCht5-1抗原片段与OVA进行拼接,获得融合OVA-LmCht5-1抗原序列,运用TMHMM软件预测融合蛋白的跨膜结构域和可溶性。1.2.2 pET32a-OVA-LmCht5-1构建 利用双酶切方法从JMB88-OVA中酶切获得OVA片段并插入至pET32a的对应酶切位点处,获得pET32a-OVA载体。设计LmCht5-1抗原序列的扩增引物(表1),酶切位点选用Hind III和Xho I。以飞蝗表皮cDNA为模板,通过PCR方法,扩增LmCht5-1抗原序列。利用Hind III和Xho I同时双酶切LmCht5-1和pET32a-OVA,连接获得pET32a-OVA-LmCht5-1。引物序列为LmCht5-1-Hind IIIF:gggAAGCTTATGGATGTCGAC TGCAGCGACG和Lm Cht5-1-Xho I R:ccgCTCGAGG AGGCTGTGCTTGGCCATGGAGC。
1.3 pET32a-OVA-LmCht5-1蛋白表达及纯化
1.3.1 pET32a-OVA-LmCht5-1蛋白诱导表达 将载体pET32a-OVA-LmCht5-1通过42℃热激的方法转化至BL21(DE3)感受态中,在LB+Amp平板中进行筛选。挑取单克隆摇菌至OD600为0.6,加0.5 mmol·L-1 IPTG于37℃诱导培养4 h。12 000 r/min离心1 min收集细菌沉淀,超声波破碎后离心,分离上清与沉淀,通过12% SDS-PAGE电泳确定目的蛋白的表达部位。1.3.2 蛋白OVA-LmCht5-1和OVA的Ni-NTA纯化 将OVA-LmCht5-1菌液接种至400 mL LB培养基中,16℃过夜诱导。12 000 r/min离心1 min收集细菌沉淀,超声波破碎后,12 000 r/min离心1 min收集包涵体。利用50 mmol·L-1 Tris-HCl+200 mmol·L-1 NaCl+8 mol·L-1尿素溶解包涵体后,使用Ni-NTA系统对溶解的包涵体蛋白进行纯化。采用不同浓度咪唑进行逐级洗脱,并收集洗脱液馏分。利用12% SDS-PAGE蛋白胶检测蛋白浓度和纯度。收集蛋白纯度较高的洗脱馏分,采用分子量为30 kD的超滤离心管(Millipore)对其进行超滤浓缩,12 000 r/min离心获得超滤液。利用BCA试剂盒测定蛋白浓度。采用同样条件对OVA蛋白进行表达与纯化。
1.4 OVA-LmCht5-1抗体制备及效价检测
1.4.1 OVA-LmCht5-1抗体制备方法 委托华大公司通过以下程序免疫新西兰白兔以制备多克隆抗体,具体方法:取纯化后的OVA-LmCht5-1蛋白400 μg,生理盐水稀释至500 μL,与等体积的弗氏完全佐剂混合,充分混匀,制备油包水结构,对2.0 kg左右的新西兰白兔的背部进行皮下注射,完成初次免疫。14 d与21 d分别进行一次加强免疫。在免疫之前通过耳静脉取阴性血清用做后期蛋白特异性的检测。28 d时,颈动脉取血收集全血,5 000 r/min离心10 min,2次离心后收取血清作为多克隆抗体血清[11]。1.4.2 OVA-LmCht5-1效价检测 采用ELISA方法测定所制备抗体的效价[12]。抗原包被为OVA-LmCht5-1抗原蛋白,终浓度为2 μg·mL-1,一抗为多抗血清,从200倍开始用PBS梯度稀释,设置PBS为空白对照(Blank),以PBS稀释的200倍阴性血清作为阴性对照(negative);二抗为稀释20 000倍的羊抗兔HRG,显色后加50 μL终止液终止反应;双波长(450/630 nm)测吸光值。抗体效价为1/2最大OD值所对应的稀释倍数[13]。
1.5 OVA-LmCht5-1抗体特异性检测
1.5.1 蛋白水平检测OVA-LmCht5-1抗体特异性 取原核表达蛋白OVA-LmCht5-1和OVA检测OVA-LmCht5-1抗体是否识别OVA;取笔者课题组利用昆虫病毒表达系统获得的真核蛋白[14]β-N-acetylglucosaminidase(eLmNAG)、eukaryotic expression LmCht5-1(eLmCht5-1)和eukaryotic expression Cht5-2(eLmCht5-2),通过Western blot鉴定OVA-LmCht5-1抗体是否准确区分eLmCht5-1和eLmCht5-2;取飞蝗中肠与表皮蛋白样品用于检测OVA-LmCht5-1对组织样品检测的灵敏度和特异性。以上蛋白样品浓度调整为500 ng·μL-1,上样量均为30 μL,用于后续Western blot检测。1.5.2 Western blot检测LmCht5-1 采用12% SDS-PAGE分离胶蛋白样品,电泳条件为80 V 30 min,120 V 40 min。电泳结束后,采用湿转方法将蛋白转印至PVDF膜,湿转条件为150 V,45 min。利用含10% BSA的TBS溶液在常温下封闭1 h。TBST清洗3次,每次5 min。将OVA-LmCht5-1抗体稀释2 000倍后进行孵育,时间为1 h,TBST洗涤3次,每次10 min。二抗孵育羊抗兔IgG,时间为1 h,TBST洗涤5次,每次10 min。利用奥德赛双红外荧光捕捉信号并采集图像。设置免疫前阴性血清为阴性对照,检测抗体的特异性。
1.6 LmCht5-1在飞蝗不同发育日龄表皮中的表达特性
选择4龄第1天(N4D1)至N4D5和N5D1的若虫表皮,检测不同发育日龄飞蝗表皮中LmCht5-1蛋白的表达特性。以上所有样品均取3个生物学重复,每个生物学重复3头若虫。分离飞蝗背部表皮,加入RIPA+PMSF+DTT混合液后子冰上进行匀浆,放置30 min后,离心取上清。采用BCA方法测定蛋白浓度,调整蛋白浓度为300 ng·μL-1。蛋白检测参照1.5.2。利用灰度分析计算不同日龄表皮中LmCht5-1相对于β-actin的表达量,观察LmCht5-1表达量的变化以及对表皮发育的影响。1.7 dsLmCht5-1的合成、注射与蛋白样品制备
dsLmCht5-1的合成与注射参照实验室标准步骤进行[15-16]。选取4龄第2天飞蝗若虫进行LmCht5-1 dsRNA注射,同时注射dsGFP作为对照组。将dsRNA从飞蝗第2和3腹节连接处注入体腔,注射量为10 μg/头,设置3个生物学重复,每个重复5头若虫。在注射后第5天取样,分离飞蝗腹部背面表皮,方法参照1.6。1.8 LmCht5-1在表皮中的组织定位及功能
取1.7中N4D4的表皮进行固定。按照标准石蜡切片制备方法制备飞蝗表皮切片[17]。利用OVA- LmCht5-1抗体染色确定LmCht5-1的表达定位。切片厚度为5 μm,每张载玻片上保留3—5张切片。将表皮石蜡切片进行抗原修复,双氧水处理后,滴加1滴1﹕1 000稀释的OVA-LmCht5-1抗体,室温孵育2 h。洗涤后滴加1滴聚合物增强剂,室温孵育20 min。再次洗涤滴加1滴羊抗兔HRP,室温孵育30 min。PBS(pH 7.4)冲洗3次,每次5 min。利用Fluorescent Brightener 28(FB28)染色确定dsLmCht5-1干扰对表皮几丁质的影响。在上述石蜡切片中滴加1滴FB28,室温孵育10 min,中性树胶封固,晾干后荧光显微镜下观察,以确定样品中几丁质的变化。
2 结果
2.1 飞蝗LmCht5-1高免疫活性载体构建
利用MEGA软件将LmCht5-1和LmCht5-2氨基酸序列进行比对,发现LmCht5-1的前445AA与LmCht5-2序列一致度极高,此区域无法作为抗原制备抗体而区分LmCht5-1和LmCht5-2。LmCht5-1在446AA后,与LmCht5-2氨基酸序列一致度上较低(图1-A),此区域与其他LmChts比对的相似度较低。利用软件BepiPred Server 2.0分析发现,LmCht5-1的471—533AA氨基酸序列富含抗原表位,可以作为制备LmCht5-1的抗原序列。利用ClonemanageV7软件将OVA与LmCht5-1抗原序列进行虚拟偶联后,通过TMHMM预测,发现该融合蛋白可溶性差。随后通过酶切连接将JMB88- OVA中的OVA片段连接至原核表达载体pET32a中,构建pET32a-OVA骨架载体(图1-B);然后通过PCR扩增获得LmCht5-1抗原片段,通过酶切连接后插入至pET32a-OVA中,获得可表达LmCht5-1的高特异性抗原表达载体pET32a-OVA- LmCht5-1(图1-C)。
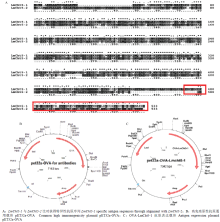 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1LmCht5-1抗原序列选择与表达
-->Fig. 1The antigen selection and expression for LmCht5-1
-->
2.2 OVA-LmCht5-1蛋白表达与纯化
将构建好的pET32a-OVA和pET32a-OVA- LmCht5-1分别转化BL21(DE3)感受态,挑取阳性克隆在LB+Amp培养基中过夜培养。隔日1﹕100接种,37℃培养4 h后,加0.5 mmol·L-1 IPTG在16℃过夜诱导。收集菌液,超声波破碎后,分别收集上清和沉淀,利用12% SDS-PAGE进行检测。发现OVA蛋白在沉淀中表达,分子量为64.37 kD,OVA-LmCht5-1重组蛋白也在沉淀中表达,分子量为71.34 kD(图2-A)。按照上述培养条件将pET32a-OVA-LmCht5-1扩大培养至400 mL,破碎收集沉淀,用含8 mol·L-1尿素的缓冲液溶解包涵体后,利用Ni-NTA纯化进行。蛋白上柱前PB中大量OVA-LmCht5-1,而结合缓冲液BB中蛋白量明显减少,说明Ni柱对OVA-LmCht5-1有较强的结合能力。咪唑梯度洗脱后,在50—500 mmol·L-1的馏分中OVA-LmCht5-1量大,且条带单一,杂蛋白含量少。收集50—500 mmol·L-1咪唑下的馏分,利用30 kD超滤离心管进行超滤浓缩。利用BCA测定总蛋白浓度为400 μg·mL-1,可用于制备多克隆抗体(图2-B),同时纯化OVA蛋白,通过Ni-NTA纯化发现,OVA蛋白在100和200 mmol·L-1咪唑浓度下的馏分中条带单一,收集在100和200 mmol·L-1咪唑浓度下的馏分,利用30 kD超滤离心管进行超滤浓缩,用于后续抗体特异性检测与分析(图2-C)。
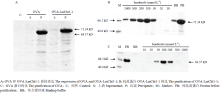 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2OVA和OVA-LmCht5-1的表达与纯化
-->Fig. 2The expression and purification of protein OVA and OVA-LmCht5-1
-->
2.3 OVA-LmCht5-1 抗体制备及效价检测
委托华大公司将OVA-LmCht5-1抗原与弗氏完全佐剂混合后注射新西兰白兔,并进行两次加强免疫。28 d后从颈动脉收集兔血液,通过离心收集到50 mL兔抗OVA-LmCht5-1血清抗体。在96孔酶标板中包被抗原蛋白OVA-LmCht5-1,利用ELISA方法检测发现兔抗OVA-LmCht5-1抗体效价可达到1﹕102 400(表1),抗体产生效果良好,可用于后续Western blot和免疫组化检测。Table 1
表1
表1抗体效价检测
Table 1Detection of antibody titer
| OVA-LmCht5-1兔抗血清效价检测 Detection of rabbit antiserum OVA-LmCht5-1 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 稀释倍数 Dilution ratio | 400 | 800 | 1600 | 3200 | 6400 | 12800 | 25600 | 51200 | 102400 | 空白 Blank | 阴性 Negative |
| OD | 1.587 | 1.470 | 1.417 | 1.389 | 1.355 | 1.301 | 1.235 | 1.193 | 0.923 | 0.034 | 0.065 |
新窗口打开
2.4 OVA-LmCht5-1 抗体特异性检测
采用Western blot方法检测OVA-LmCht5-1抗体的特异性。所选抗原蛋白为原核表达蛋白OVA- LmCht5-1和OVA、真核表达蛋白NAG、eCht5-1和eCht5-2[14]。抗体OVA-LmCht5-1与抗原蛋白OVA- LmCht5-1杂交产生条带为71.34 kD,与OVA杂交显示条带为64.37 kD,说明抗体OVA-LmCht5-1能有效识别OVA-LmCht5-1和OVA的原核蛋白。抗体OVA-LmCht5-1与eLmNAG、eLmCht5-2杂交不显示任何条带,而可以在eLmCht5-1中识别分子量为57.0 kD的蛋白,说明该抗体有效识别LmCht5-1抗原,而不识别LmCht5-2抗原,实现对LmCht5-1和LmCht5-2的区分。提取飞蝗肠道MT和表皮CT的蛋白进行检测,发现OVA-LmCht5-1可识别样品中分子量为56.0 kD的蛋白,与预样本中LmCht5-1蛋白大小一致,表明OVA-LmCht5-1抗体可用于检测飞蝗表皮中LmCht5-1的表达(图3-A)。同时将免疫前阴性血清识别上述抗原,未有任何条带产生,说明新西兰白兔自身血清中未含有识别LmCht5-1和OVA的抗体成分(图3-B)。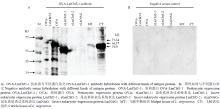 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3OVA-LmCht5-1兔抗血清特异性检测
-->Fig. 3The specific detection on rabbit antiserum of OVA-LmCht5-1
-->
2.5 飞蝗不同发育日龄表皮中LmCht5-1蛋白表达
提取飞蝗N4D1—N5D1中发育每天的飞蝗表皮蛋白,利用Western blot检测发现,LmCht5-1随着飞蝗日龄增加而表达量逐渐升高,在飞蝗蜕皮当天表达量达到最高。而在飞蝗蜕皮后的N5D1表达量快速降低,恢复到N4D1的起始水平(图4)。2.6 注射dsLmCht5-1对飞蝗LmCht5-1转录和蛋白水平表达的影响
在飞蝗N4D2注射dsGFP和dsLmCht5-1,在N4D5时提取飞蝗总RNA和表皮蛋白。RT-qPCR检测显示LmCht5-1的转录本表达降低70%(图5-A),蛋白水平检测发现蛋白表达量减少73.6%,说明dsLmCht5-1有效抑制LmCht5-1在mRNA和蛋白水平的表达;同时说明OVA-LmCht5-1可特异性地识别飞蝗体内的LmCht5-1(图5-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4飞蝗不同发育日龄表皮中LmCht5-1蛋白表达
-->Fig. 4The protein expression of LmCht5-1 in the cuticle of different developmental days in L. migratoria
-->
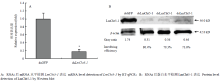 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5dsLmCht5-1抑制对4龄飞蝗LmCht5-1转录和蛋白水平表达的影响
-->Fig. 5Effect of dsLmCht5-1 interfere on the expression of LmCht5-1 in cuticle of the 4th instar L. migratoria nymph
-->
2.7 OVA-LmCht5-1检测表皮中LmCht5-1定位及功能
取注射后发育至N4D4的飞蝗dsGFP和dsLmCht5-1的表皮样品,制备石蜡切片,利用OVA-LmCht5-1抗体对其进行免疫组化检测。OVA-LmCht5-1在注射dsLmCht5-1的表皮样本中无可见的信号,但OVA- LmCht5-1在注射dsGFP的飞蝗表皮样本中,可检测到LmCht5-1表达的强烈信号(图6)。LmCht5-1蛋白在表皮细胞质和旧表皮中表达。dsGFP组在N4D4时,旧表皮结构破坏,而同时期的dsLmCht5-1组中表皮结构完整,表明LmCht5-1蛋白的作用方式为降解表皮中的几丁质。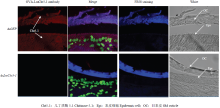 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6OVA-LmCht5-1抗体免疫组化检测LmCht5-1的定位与表达量
-->Fig. 6The cellular localization and expression of LmCht5-1 in cuticle detected by immunohistochemistry
-->
3 讨论
抗体制备是昆虫基因功能研究的重要手段,然因昆虫蛋白序列未知、功能域结构复杂、家族基因数量庞大而造成抗体制备困难[18]。笔者课题组曾通过多肽免疫制备几丁质合成酶和几丁质酶抗体,但均未获得高效价的抗体,分析其原因为几丁质酶蛋白免疫原性差。一般来说,提高抗原的免疫原性,是抗体制备成功的关键。鸡卵清白蛋白OVA由386个氨基酸而组成,常作为蛋白添加剂用于提高生物药或疫苗等的稳定性,同时OVA也可以通过半抗原偶联而作为载体蛋白用于抗体制备[19-20]。在本研究中首先通过序列比对和抗原决定簇分析,获取LmCht5-1特异性的抗原序列。将OVA与LmCht5-1特异性抗原序列进行偶联,通过原核表达与纯化获得大量的OVA-LmCht5-1抗原蛋白,用于制备多克隆抗体。本研究中制备的OVA-LmCht5-1多克隆抗体利用ELISA进行效价检测可达到1﹕102 400,足以满足抗体使用需求。在抗体特异性方面,抗体OVA-LmCht5-1能有效识别体外真核表达的eLmCht5-1,识别分子量为57.0 kD的蛋白,而在eLmNAG和eLmCht5-2蛋白泳道中不产生杂交条带,充分说明所制备抗体识别的特异性。此外,抗体OVA-LmCht5-1可以有效识别飞蝗表皮与中肠中的LmCht5-1蛋白。免疫前血清不能与蛋白OVA-LmCht5-1、OVA、NAG、eLmCht5-1、eLmCht5-2、飞蝗表皮和飞蝗中肠蛋白产生可见的杂交条带,进一步表明,兔血清OVA-LmCht5-1是针对LmCht5-1的特异性抗体。OVA-LmCht5-1在dsLmCht5-1注射组检测到表达量极低的杂交条带,而在对照组dsGFP得到表达量较高的杂交条带,不仅说明dsLmCht5-1直接影响LmCht5-1在蛋白水平的表达,而且进一步证实抗体OVA-LmCht5-1特异性结合飞蝗表皮LmCht5-1蛋白。
4龄不同日龄的Western blot结果表明,LmCht5-1主要在第4和第5天表达,笔者课题组在mRNA水平研究LmCht5-1表达时发现其在蜕皮前一天高表达[2],而蛋白检测则发现LmCht5-1在蜕皮当天高表达,推测与mRNA和蛋白在表达上的时间差异有关。LmCht5-1在蜕皮当天高表达,与其行使几丁质降解、协助表皮蜕去的生理学功能相符合。进一步采用免疫组化技术鉴定LmCht5-1在飞蝗表皮组织中的表达位置和相对表达量,发现OVA- LmCht5-1抗体可特异性识别组织切片中LmCht5-1,主要在表皮细胞和旧表皮中表达,这与桑卷叶蛾和赤拟谷盗的研究结果一致[9,21]。而利用免疫前阴性血清对上述切片进行染色,未发现任何可见的信号,说明免疫前血清中不含有对表皮组织切片进行非特异结合的成分,进一步鉴定了OVA-LmCht5-1抗体的特异性。
飞蝗的表皮富含几丁质,因此针对几丁质的代谢途径进行调控是防治害虫的重要手段。昆虫表皮发育关键基因功能的解析,有助于寻找新的靶标基因作为害虫防治的靶点。笔者课题组已经利用RNAi技术发现几丁质合成酶[16,22-27]和几丁质酶[8,15,28]的缺失会引起飞蝗表皮形成与降解发生障碍而导致飞蝗死亡。飞蝗几丁质酶5是催化飞蝗表皮降解的关键酶,且存在基因扩增现象,有2个亚型(LmCht5-1和LmCht5-2)[2],与已报道的昆虫Cht5基因直系同源,通过向5龄若虫注射dsCht5-1发现LmCht5-1影响飞蝗5龄若虫到成虫期的蜕皮发育,造成飞蝗蜕皮困难而死亡;而LmCht5-2是仅在飞蝗中发现的亚型,其若虫期干扰后未发现明显的表型变化。利用昆虫杆状病毒表达LmCht5-1和LmCht5-2进行体外酶活性测定时发现,LmCht5-1主要降解寡聚几丁质,而LmCht5-2主要负责降解多聚几丁质,二者的功能存在分化[29]。在飞蝗的胚胎发育过程中,LmCht5-1和LmCht5-2具有明显的表达差异[8],推测可能在飞蝗浆膜表皮降解和预若虫表皮降解中发挥不同功能。进一步利用OVA-LmCht5-1抗体对蛋白进行时空表达定位,将有助于解析LmCht5-1和LmCht5-2在飞蝗胚胎发育及其他发育阶段的功能分化。
4 结论
偶联OVA与LmCht5-1抗原序列可获得高免疫原性的原核蛋白OVA-LmCht5-1;通过该抗原所制备的LmCht5-1多克隆抗体可特异性识别飞蝗体内LmCht5-1,可用于Western blot和免疫组化检测。蛋白LmCht5-1在飞蝗4龄蜕皮当天表达量最高,定位于表皮细胞和旧表皮中。dsLmCht5-1可抑制LmCht5-1蛋白表达,减少表皮细胞和旧表皮中LmCht5-1的表达,阻碍旧表皮中几丁质的降解。The authors have declared that no competing interests exist.
