0 引言
【研究意义】胚胎发生和胚乳发育对于种子形成是必不可少的,并且对水稻品质和产量至关重要。因此,研究这些过程的分子机制具有相当重要的意义。水稻胚乳在发育过程中积累大量的淀粉,约占籽粒干重的90%,其主要功能是为种子萌发及后期幼苗的生长发育提供营养物质,并作为人类重要的食物来源,为人类的生理活动提供主要的能量[1]。水稻胚乳中淀粉含量直接决定水稻的产量,同时其中的直链和支链淀粉的比例和结构影响着稻米的品质[2]。在籽粒的形成过程中,光合产物蔗糖在胚乳细胞中经造粉体内一系列的淀粉合成酶的催化加工形成可见的淀粉颗粒,同时整个胚乳细胞内造粉体和淀粉粒也在不断增殖和发育。随着籽粒的成熟,整个胚乳内充满了排列整齐的淀粉颗粒[3]。贮藏淀粉的合成是一个非常复杂而精细的生物过程,但目前人们对这个过程的了解尚不充分。因此,克隆和鉴定水稻淀粉合成相关基因并对其功能进行研究,不仅对阐释水稻淀粉合成的分子机理具有生物学意义,同时将为稻米品质改良提供理论指导。【前人研究进展】胚乳淀粉分为直链淀粉和支链淀粉两类,直链淀粉是由1 000—5 000个葡萄糖单体经α-1,4糖苷键连接而成的线性分子,而支链淀粉则是葡萄糖经α-1,6糖苷键聚合而成的多分支分子。淀粉合成首先是植物叶片通过光合作用合成葡萄糖,随后转化为蔗糖,蔗糖再通过维管束被运输到籽粒造粉体中,接着在尿苷二磷酸葡萄糖焦磷酸化酶(UDP glucose pyrophosphorylase,UGPase1)的作用下水解为UDP-葡萄糖和果糖,然后转化为1-磷酸葡萄糖,接着在腺苷二磷酸葡萄糖焦磷酸化酶(ADP glucose pyrophosphorylase,AGPase)的催化下合成腺苷二磷酸葡萄糖(ADP-glucose,ADPG),最后ADPG经过一系列酶促反应转变为淀粉,这些酶包括淀粉合成酶(starch synthase,SS)、颗粒淀粉合成酶(granule-bound starch synthase,GBSS)淀粉分支酶(starch branching enzyme,SBE)和淀粉去分支酶(debranching enzyme,DBE)[4,5,6]。其中颗粒淀粉合成酶(GBSS)主要负责直链淀粉的合成[7,8,9],淀粉合成酶(SS)、淀粉分支酶(SBE)[10,11]和淀粉去分支酶(DBE)则负责支链淀粉的合成。淀粉分支酶(SBE)的缺失会导致支链淀粉短链合成发生障碍,胚乳粉质,同时伴有籽粒变小,千粒重下降的表型[12]。此外,水稻淀粉的合成还会受到一些转录因子的调控。之前报道转录因子RSR1会负向调控淀粉合成基因的表达,rsr1突变体胚乳中的所有淀粉合成基因表达量均上调,直链淀粉含量增加,籽粒变大,粒重增加[13]。碱性亮氨酸拉链转录因子OsbZIP58可以直接调控OsAGPL3、OsSSIIa、SBE1、Wx、OsBEIIb和ISA2的表达,osbzip58突变体总淀粉和直链淀粉含量显著下降,同时千粒重降低[14]。在对淀粉合成相关基因的研究中,人们通过寻找胚乳突变体来揭示更多的调控机制。水稻胚乳突变体表型主要分为六类:糯性(waxy)、粉质(floury)、皱缩(shrunken)、暗色(dull)、糖质(sugary)和心白(white-core)。水稻中研究最早的粉质突变体是糯性wx,其胚乳中几乎不含直链淀粉,绝大多数是支链淀粉,Wx编码GBSSI蛋白,主要集中在胚乳早期表达[15,16]。近年来,报道了一系列粉质突变体flo1—flo8,它们籽粒表型各异,包括粉质、皱缩、心白等等。其中flo2、flo4、flo5、flo6、flo7和flo8已经克隆,但flo1、flo3目前尚未被克隆。flo1突变体胚乳中直链淀粉比例上升,突变基因定位于第5染色体[17]。flo2籽粒呈现完全粉质表型,籽粒变小,胚乳中淀粉粒变小并且排列疏松,FLO2为一个包含三角形四肽重复基序的蛋白,具体功能未知[18]。FLO3突变基因定位于第4染色体,突变体籽粒中16 kD醇溶蛋白含量减少[19]。flo4和flo5籽粒均呈现心白状胚乳,其中FLO4编码一个丙酮酸磷酸双激酶,主要在发育的胚乳中表达,通过调控胚乳中碳代谢来影响淀粉合成[20];FLO5定位于第5染色体上,其编码的蛋白为淀粉合酶亚家族SSIIIa[21]。FLO6编码一个包含CBM48结构域的未知功能蛋白,调控胚乳中造粉体的发育和淀粉的合成[22]。FLO7定位于第12染色体,编码一个未知功能蛋白[23]。FLO8定位于第9染色体上,其编码的蛋白为UDP-葡萄糖焦磷酸化酶1(Ugp1)[24]。此外,日本科学家利用化学诱变方式,获得6份胚乳中淀粉颗粒异常的粉质突变体ssg1—ssg6。其中ssg1—ssg3胚乳中淀粉颗粒都变小,而ssg4和ssg6胚乳中淀粉颗粒变大,ssg5胚乳中没有正常的淀粉颗粒。通过克隆和表型分析,发现ssg1—ssg3都是ae的等位突变体。目前SSG5还未被克隆,而SSG4编码一个功能未知的蛋白,定位于造粉体;而SSG6则编码一个转氨酶的同源蛋白,定位于造粉体膜上[25]。以上突变体的发现和相关基因的克隆,为更全面地阐释淀粉生物合成途径奠定了基础。【本研究切入点】目前,水稻胚致死及胚乳中淀粉合成和调控的分子机理尚未完全阐明,挖掘更多的粉质突变体,有助于进一步解析胚致死及胚乳淀粉形成的机制,为提高稻米品质奠定基础。【拟解决的关键问题】本研究以从化学诱变剂N-甲基-N-亚硝基脲(MNU)处理的粳稻品种宁粳3号突变体库中筛选到的一个稳定遗传的胚乳粉质致死fse3突变体为材料,对该突变体的形态学特征及各种理化性质进行详细的分析与描述,同时对突变基因进行精细定位,并检测突变基因对淀粉合成相关基因表达的影响,为胚致死及淀粉合成机制的进一步研究奠定基础。1 材料与方法
1.1 材料种植
fse3是粳稻品种宁粳3号2015年7月经1 mmol·L-1 N-甲基-N-亚硝基脲(MNU)诱变后从中筛选得到的粉质皱缩突变体材料,其胚乳突变性状稳定遗传。2016年3月在海南陵水实验基地将其与9311配制杂交组合,5月份收获F1。5月底将F1播种于南京农业大学水稻研究所土桥实验基地,9月份得到F2群体,挑选F2群体中隐性极端个体用于精细定位。所有材料种植管理方式同大田生产。1.2 成熟种子理化性质测定
从突变体杂合植株上分离粉质成熟种子,去粰壳后磨成糙米粉进行测定。按照农业部标准NY147-88进行表观直链淀粉含量测定;总淀粉含量使用Megazyme总淀粉测定试剂盒测定;使用FOSS公司Kjeltec2300型全自动凯氏定氮仪测定总蛋白含量;参照NISHI等[26]方法测定尿素膨胀;按照HAN等[27]的方法测定支链淀粉链长分布(聚合度);采用瑞典波通公司(Perten)的快速黏度分析仪(RVA)测定米粉的黏度特性[28]。每个样品重复3次,取平均值。1.3 TTC染色
2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC)和活细胞线粒体内的琥珀酸脱氢酶反应,生成红色的甲臜,用来表征种子呼吸相关脱氢酶活性。取种子20粒,去粰壳,在30℃条件下清水浸种24 h,设置3次重复。浸种完毕后,用滤纸吸干种子表面水分,放入10 mL试管,加入8 mL事先用磷酸缓冲液配置好的0.5%TTC染液,在35℃黑暗条件下染色2 h。最后用蒸馏水冲洗3次,吸干水分,进行拍照。1.4 成熟种子横切面的扫描电镜观察
扫描电镜观察参照前人方法进行[29]。将成熟籽粒横断后置于3%戊二醛溶液中室温浸泡3 h,用0.1 mol·L-1的磷酸钠溶液(pH 6.8)冲洗,每次15 min;冲洗3—5次,然后用2%四氧化锇溶液4℃固定过夜,固定后的样品用磷酸钠溶液冲洗2—3次,每次15 min;再用70%、80%、95%和100%乙醇溶液进行梯度脱水,每个梯度5 min,然后在乙醇:异戊基醋酸(v/v= 1﹕3)混合液中浸泡1 h,取出干燥,用金粉包裹,用日立S-3000N型扫描电子显微镜观察(加速电压为10—20 kV)。1.5 胚乳半薄切片观察
分别从野生型和突变体杂合植株上取花后12 d的发育胚乳,切成厚度~1 mm薄片,置于固定液(多聚甲醛2%(W/V),戊二醛2%(V/V),蔗糖250 mmol·L-1,PIPES-KOH 50 mmol·L-1,pH7.2)中,固定12 h后PBS漂洗3次,在4℃依次用30%、50%乙醇对样品进行脱水处理,每次15 min。然后在-20℃中用70%乙醇对样品脱水处理2次,每次30 min。接着在-20℃中,依次用LR White树脂﹕70%乙醇溶液(2﹕1)、100% LR White树脂对样品进行渗透,每次2 h,最后用纯树脂渗透12 h后,将样品放入60℃烘箱中聚合48 h。采用Leica RM2265切片机上切成1 μm厚的薄片,最后用1% I2-KI溶液染色后在显微镜下观察并拍照。1.6 基因的图位克隆
配制fse3与9311的杂交组合,在F1植株上收取F2种子,挑选其中与fse3突变体一样表现为粉质不透明的F2种子用于基因定位,采用CTAB法提取种子DNA。筛选9311和fse3之间的多态性标记,并用10个极端个体进行连锁分析。确定连锁标记后,在定位区间开发新标记,并扩大群体进行精细定位。利用Gramene网站(www.gramene.org)预测精细定位区间内的开放阅读框(open reading frame,ORF),用Primer Premier5.0软件设计引物(表1),扩增ORF的编码区并测序,测序由南京金斯瑞公司完成。Table 1
表1
表1突变体基因FSE3的精细定位所用分子标记
Table 1Markers for fine mapping of FSE3
| 引物名称 Primer name | 正向引物序列 Forward (5′-3′) | 反向引物序列 Reverse (5′-3′) | 产物大小 Product size (bp) |
|---|---|---|---|
| 09-019 | GCCTCATCCCTCTAACCCTC | CAAGAAAGATCAGTGCGTGG | 255 |
| 66 | GGAGTGAGGTGTGTATCATC | CTGACCTGACCAACACAAT | 127 |
| 68 | TATCTCCTGTCAGAGTTGGG | TAGATTTTGTCGCACCAAGA | 173 |
| YF-1 | CAGTTGTTCATCCGCTTTTC | GTGTCGGAACTGTAATACGT | 115 |
| YF-3 | CCCCTCTTGTCTCTACGTAT | AGTTTTCATATACGTACAGTTTGT | 109 |
| YF-4 | CACTTGCTACTTCCTCCATT | GATCTACTTCCTTCGACTCG | 132 |
| YF-5 | GATGATCCCCCAAAGCAG | AGAAAAAGGCGACAAGGAA | 110 |
| 10711 | GGTCAATGCATCTTACACTG | TAAATGAATTGAAGTTAGTAGC | 122 |
| 21653 | GGTAGGGTAATAAATTGGTACC | TAAAACATAGCCTGTGCAGT | 104 |
| 72 | AATTTGGAGGTGGTAGTCAC | ATGAGAACAAGTGATTGCGA | 111 |
| N9-21 | CAGTTCCGAGCAAGAGTACTC | GGATCGGACGTGGCATATG | 171 |
新窗口打开
1.7 淀粉合成相关基因的表达分析
分别从野生型和突变体杂合植株上取花后12 d的胚乳,使用TIANGEN公司的植物总RNA提取试剂盒提取RNA,反转录得到cDNA后使用SYBR®Green Master Mix(Applied Biosystems, Foster, CA, USA)进行实时荧光定量PCR,仪器为Applied Biosystems 7500 Real-Time PCR System,以水稻Actin作为内参(表2)。反应体系为cDNA模板2.0 μL、2×SYBR Premix Ex TaqⅡ 10 μL、前后引物(10 µmol·L-1)各0.8 μL、50×ROX Reference Dye 0.4 μL和ddH2O 6.0 μL。反应程序采用两步法:95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。采用2-ΔΔCT计算方法处理数据。Table 2
表2
表2实时荧光定量PCR分析所用的引物
Table 2Primers used in real-time PCR analysis
| 引物名称 Primer name | 正向引物序列 Forward (5′-3′) | 反向引物序列 Reverse (5′-3′) |
|---|---|---|
| Actin | CATGCTATCCCTCGTCTCGACCT | CGCACTTCATGATGGAGTTGTAT |
| OsAGPS1 | AGAATGCTCGTATTGGAGAAAATG | GGCAGCATGGAATAAACCAC |
| OsAGPS2a | ACTCCAAGAGCTCGCAGACC | GCCTGTAGTTGGCACCCAGA |
| OsAGPS2b | AACAATCGAAGCGCGAGAAA | GCCTGTAGTTGGCACCCAGA |
| OsAGPL1 | GGAAGACGGATGATCGAGAAAG | CACATGAGATGCACCAACGA |
| OsAGPL2 | AGTTCGATTCAAGACGGATAGC | CGACTTCCACAGGCAGCTTATT |
| OsAGPL3 | AAGCCAGCCATGACCATTTG | CACACGGTAGATTCACGAGACAA |
| OsAGPL4 | TCAACGTCGATGCAGCAAAT | ATCCCTCAGTTCCTAGCCTCATT |
| OsSSⅠ | GGGCCTTCATGGATCAACC | CCGCTTCAAGCATCCTCATC |
| OsSSⅡa | GCTTCCGGTTTGTGTGTTCA | CTTAATACTCCCTCAACTCCACCAT |
| OsSSⅢa | GCCTGCCCTGGACTACATTG | GCAAACATATGTACACGGTTCTGG |
| OsBEⅡb | ATGCTAGAGTTTGACCGC | GCAAACATATGTACACGGTTCTGG |
| GBSSⅠ | TCCGAGAGGTTCAGGTCATC | ATGAGCTCCTCGGCGTAGTA |
| OsISA1 | TGCTCAGCTACTCCTCCATCATC | AGGACCGCACAACTTCAACATA |
| OsISA2 | TAGAGGTCCTCTTGGAGG | AATCAGCTTCTGAGTCACCG |
| OsISA3 | ACAGCTTGAGACACTGGGTTGAG | GCATCAAGAGGACAACCATCTG |
| OsPUL | ACCTTTCTTCCATGCTGG | CAAAGGTCTGAAAGATGGG |
| OsPHOL | TTGGCAGGAAGGTTTCGCT | CGAAGCCTGAAGTGAACTTGCT |
新窗口打开
1.8 蛋白Western-blot分析
提取野生型以及从突变体杂合植株上摘取的花后12 d胚乳总蛋白进行SDS-PAGE。浓缩胶浓度为6%,分离胶使用8%—18%的梯度胶。采用Bio-Rad公司的湿转系统转膜。将转印后的PVDF膜(Minipore,0.45 μm)放入封闭液中孵育1 h,然后转移至一抗溶液中(1﹕1000),室温孵育2 h;接着用PBST溶液漂洗3次,每次15 min;再将PVDF膜转移至二抗溶液中(1﹕5000),室温孵育1 h后,重复上述漂洗过程;最后用ECL化学发光液检测杂交信号。抗体由ABclonal公司制备,内参抗体为Sigma公司的Anti-actin单克隆抗体。2 结果
2.1 fse3突变体表型及农艺性状分析
fse3突变体,是粳稻品种宁粳3号经化学诱变(1 mmol·L-1 MNU处理)后筛选得到的能稳定遗传的胚乳突变体,其成熟籽粒去壳后呈现粉质皱缩不透明状,而宁粳3号成熟籽粒胚乳为透明状(图1-A和图1-B)。利用扫描电镜观察fse3突变体和野生型成熟籽粒的横截面,发现野生型种子淀粉颗粒排列紧密,大小均匀,且淀粉颗粒呈现规则多面体结构。而fse3突变体种子横断面淀粉颗粒排列疏松,大小不均匀,颗粒间存在较大间隙,且单粒型淀粉颗粒较多,呈椭圆形(图1-C和图1-D),这些表型说明fse3突变体的淀粉合成过程出现异常,导致淀粉的结构发生了改变。与野生型相比,fse3突变体成熟籽粒的粒厚显著降低,而粒长和粒宽没有显著变化。成熟后突变体籽粒千粒重显著降低,仅为野生型千粒重的64%(图1-E和图1-F)。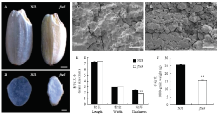 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1野生型与fse3突变体表型比较
A:野生型与fse3突变体种子表型比较,标尺为1 mm;B:野生型与fse3突变体种子横切面比较,标尺为1 mm;C—D:野生型与fse3突变体成熟籽粒的扫描电镜观察为野生型,标尺为50 μm;E:野生型与fse3 突变体的籽粒大小比较;F:野生型与fse3突变体的千粒重比较;千粒重n=3,其余n=20,取平均值;采用t测验,**表示P<0.01
-->Fig. 1Phenotypic characterization of the wild type and fse3 mutant
A: Comparison of wild-type and fse3 mutant seeds, Bar = 1 mm. B: Cross-sections of wild-type and fse3 mutant seeds, Bar = 1 mm. C-D: Scanning electron microscopic observation of mature seeds of wild type and fse3 mutant, Bar = 50 μm. E: Comparison of grain size between wild type and fse3 mutant. F: The 1000-grain weight of the wild-type and fse3 mutant seeds. n = 3 for the 1000-grain weight and n = 20 for the remaining assays, values are means ± SD, using the students t-test, ** indicated P<0.01
-->
2.2 fse3突变体种子的胚致死观察
fse3突变体与野生型相比,fse3突变体不能萌发,TTC染色表明突变体胚没有活力(图2-A和图2-B)。因此,该突变体为纯合致死,只能以杂合体保存。对放置在30℃培养箱9 h后的野生型和突变体种子胚的纵切片进行观察,发现野生型已有正常完整的心型胚的分化,而在突变体中未见有胚胎分化的痕迹,说明该突变造成了胚发育缺陷。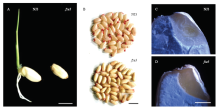 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2野生型与fse3突变体种子的胚致死观察
A:野生型与fse3突变体种子萌发5 d后的表型,标尺为5 mm;B:野生型与fse3突变体种子的TTC染色;标尺为1 cm;C—D:野生型和突变体种子在30℃培养箱放置9 h后胚的纵切片观察,标尺为1 mm
-->Fig. 2Embryo lethality observation of wild type and fse3 mutant seeds
A: Phenotypic Comparison of wild-type and fse3 mutant seeds after 5 days of germination, Bar = 5 mm; B: TTC staining of the wild-type and mutant seeds after imbibition for 9 h at 30℃, Bar = 1 cm; C-D: The longitudinal sections of embryos of wild-type and mutant seeds after being placed in a 30℃ incubator for 9 h were observed. Bar = 1 mm
-->
2.3 fse3突变体成熟籽粒的理化性质分析
与野生型宁粳3号成熟种子相比,fse3突变体总淀粉含量、表观直链淀粉含量显著降低,分别为野生型的90%和85%,而总蛋白含量无明显差异(图3-A—图3-C)。为进一步分析突变体中支链淀粉结构,对fse3突变体和野生型的支链淀粉的链长分布进行测定,结果表明,fse3突变体与野生型相比,fse3突变体聚合度(degree of polymerization,DP)为7—12的支链分支比例增加,同时,DP 13—15支链比例减少,说明fse3突变体中支链淀粉的精细结构发生了变化。(图3-D)。尿素的溶解性分析发现fse3突变体的米粉较野生型米粉更难溶解于尿素当中,且在尿素浓度为4 mol·L-1时开始表现出显著差异(图3-E和图3-F)。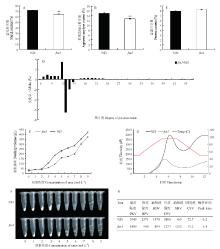 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3野生型与fse3突变体成熟籽粒的理化性质分析
A—C:野生型与fse3突变体籽粒的总淀粉(A)、表观直链淀粉(B)和总蛋白(C)含量的测定,n = 3,取平均值;采用t测验,**表示P<0.01;D:fse3突变体和野生型支链淀粉链长分布;E:不同尿素浓度下野生型和fse3突变体米粉的膨胀体积比较(n = 3);F:野生型与fse3突变体的尿素膨胀试验;G—H:野生型和fse3突变体胚乳淀粉的RVA谱分析
-->Fig. 3Physicochemical characteristics of wild-type and fse3 mature seeds
A-C: Comparison of the contents of total starch (A), amylose (B), and total protein (C) of wild-type and fse3 seeds. Values are means ± SD (n =3); t-test, **P<0.01. D: The chain length distribution profiles of amylopectin in fse3 and wild-type endosperm. E: Gelatinization properties of wild-type and fse3 mutant seeds. F: The swollen volume of wild-type and fse3 starch in urea solutions of various concentrations (n = 3). G-H: RVA profiles of endosperm starch of wild type and fse3 mutant
-->
另外,利用黏度分析仪测定fse3突变体和野生型的胚乳淀粉黏度曲线,结果显示,fse3突变体淀粉的黏度曲线与野生型差异显著。fse3突变体的最高黏度(peak paste viscosity,PKV)、热浆黏度(hot paste viscosity,HPV)、冷浆黏度(cool paste viscosity,CPV)以及崩解值(break down viscosity,BDV=PKV-HPV)都显著高于野生型(图3-G和图3-H)。说明FSE3的突变影响了淀粉的理化性质。
2.4 fse3胚乳发育过程中淀粉结构的半薄切片观察
制备了fse3突变体及野生型宁粳3号开花后12 d发育胚乳的半薄切片,并用0.1% I2-KI染色观察。结果发现,在野生型宁粳3号发育胚乳细胞中,淀粉颗粒均为典型的复合淀粉颗粒(compound starch grains),其由多个单粒淀粉颗粒(starch granules),且排列规整,几乎观察不到间隙(图4-A—图4-C)。而在fse3突变体的发育胚乳细胞中,复合淀粉颗粒较少,单粒型淀粉颗粒较多,排列疏松,淀粉颗粒间隙较野生型更大(图4-D—图4-F)。综上所述,fse3突变体胚乳发育过程中淀粉颗粒的形成出现异常。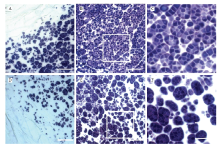 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4野生型与fse3突变体胚乳的半薄切片观察结果
A—C:开花后12 d野生型胚乳细胞外围(A)、里层(B)及里层放大图(C);D—F:开花后12 dfse3突变体胚乳细胞外围(D)、里层(E)及里层放大图(F);A、B、D、E标尺为50 μm,C和F标尺为125 μm
-->Fig. 4Semi-thin sections of developing endosperm of wild type and fse3
A-C: Peripheral region (A) , central region (B) and enlarged central region (C) of 12 DAF endosperm of wild type. D-F: Peripheral region (D), central region (E) and enlarged central region (F) of 12 DAF endosperm of fse3. Bars = 50 μm in A, B, D and E, 125 μm in C and F; DAF, days after flowering
-->
2.5 FSE3的遗传分析和精细定位
考察杂合植株成熟种子表型分离比(表3),结果显示,正常透明种子和粉质皱缩两种类型种子的性状分离比符合3﹕1的比例,说明突变性状受1对隐性主基因控制,该基因暂命名为FSE3(Floury and Shrunken Endosperm 3)。Table 3
表3
表3杂合植株种子不同性状分离比
Table 3Segregation of heterozygous plants seeds of different phenotypes
| 收获年份 Year | 总种子数 Total No. of seeds | 正常透明种子数 No. of wild type seeds | 粉质皱缩种子数 No. of mutant seeds | χ2 (3﹕1) |
|---|---|---|---|---|
| 2016 | 446 | 345 | 101 | 1.585<3.84(χ20.05) |
| 2017 | 421 | 328 | 93 | 2.498<3.84(χ20.05) |
新窗口打开
由于fse3纯合致死,故挑选杂合单株(FSE3fse3)与籼稻品种9311配制杂交组合,F1自交后获得F2种子,从中挑选粉质不透明极端个体,用于FSE3基因的定位。筛选出9311与fse3之间具有多态性的SSR标记,从中挑选出均匀分布于12条染色体的标记,间距在10—15 cM。并利用22个隐性极端个体将该基因初步连锁在第9染色体长臂上,分子标记09-019和N9-21之间,遗传距离大约14 cM(图5-A),进一步利用1 400个极端个体将FSE3定位于分子标记YF-3和10711之间,物理距离约228 kb(图5-B)。通过NCBI和Gramene网站预测,该区域包含28个ORFs(表4)。
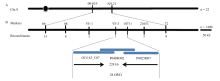 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5突变基因FSE3的精细定位
A:FSE3与标记09-019和N9-21连锁;B:利用1 422个分离单株将FSE3定位到228 kb的区间内
-->Fig. 5Fine-mapping of FSE3
A: FSE3 was linked with markers 09-019 and N9-21; B: FSE3 was located in 228 kb region based on 1 422 segregated plants
-->
Table 4
表4
表4候选区域内的28个开放阅读框
Table 4Twenty eight open reading frames in the mapping interval
| 开放阅读框ORFs | 基因号 Locus ID | 功能注释 Functional description |
|---|---|---|
| ORF1 | Os09g0451000 | 1-氨基环丙烷-1-羧酸氧化酶1ACC oxidase 1 |
| ORF2 | Os09g0451100 | 表达蛋白Expressed protein |
| ORF3 | Os09g0451400 | 1-氨基环丙烷-1-羧酸氧化酶1ACC oxidase 1 |
| ORF4 | Os09g0451500 | 硫氧还蛋白Thioredoxin domain 2 containing protein |
| ORF5 | Os09g0451700 | 未知功能的DUF573家族蛋白Protein of unknown function DUF573 family protein |
| ORF6 | Os09g0451800 | 未知功能的DUF1644家族蛋白Protein of unknown function DUF1644 family protein |
| ORF7 | Os09g0452200 | 包含LysM结构域的GPI锚定蛋白1前体LysM-domain GPI-anchored protein 1 precursor |
| ORF8 | Os09g0452300 | 己糖转运蛋白Hexose transporter |
| ORF9 | Os09g0452400 | 胃蛋白酶家族蛋白Pepsin family protein |
| ORF10 | Os09g0452700 | 泛素Ubiquitin |
| ORF11 | Os09g0452800 | 胃蛋白酶家族蛋白Pepsin family protein |
| ORF12 | Os09g0452900 | 糖基转移酶Glycosyl transferase |
| ORF13 | Os09g0453000 | 未知功能的UPF0220家族蛋白Protein of unknown function UPF0220 family protein |
| ORF14 | Os09g0453100 | 保守的假定蛋白Conserved hypothetical protein |
| ORF15 | Os09g0453200 | 内体膜蛋白Emp24 family protein |
| ORF16 | Os09g0453300 | 膜联蛋白家族蛋白Annexin family protein |
| ORF17 | Os09g0453400 | 肽酶S26A,信号肽酶I家族蛋白Peptidase S26A, signal peptidase I family protein |
| ORF18 | Os09g0453500 | 血影重复蛋白Spectrin repeat containing protein |
| ORF19 | Os09g0453700 | 肽酶S9A,脯氨酰寡肽酶家族蛋白Peptidase S9A, prolyl oligopeptidase family protein |
| ORF20 | Os09g0453800 | 天冬氨酸转氨酶Asparate aminotransferase |
| ORF21 | Os09g0453900 | 免疫球蛋白Immunoglobulin |
| ORF22 | Os09g0454100 | 菱形家族蛋白Rhomboid-like protein family protein |
| ORF23 | Os09g0454200 | 保守的假定蛋白Conserved hypothetical protein |
| ORF24 | Os09g0454300 | 包含F-box结构域的细胞周期蛋白Cyclin-like F-box domain containing protein |
| ORF25 | Os09g0454500 | 碳酸酐酶,真核生物家族蛋白Carbonic anhydrase, eukaryotic family protein |
| ORF26 | Os09g0454600 | 线粒体磷酸转运蛋白Mitochondrial phosphate transporter |
| ORF27 | Os09g0454900 | 类姜黄素(甘露糖结合)凝集素结构域蛋白Curculin-like (mannose-binding) lectin domain containing protein |
| ORF28 | Os09g0455000 | 保守的假定蛋白Conserved hypothetical protein |
新窗口打开
2.6 FSE3的突变影响了发育胚乳中淀粉合成相关基因的表达和蛋白积累
通过比较开花后12 d的野生型与突变体胚乳中编码淀粉合成相关基因的表达水平发现,与野生型相比,fse3突变体中编码淀粉合成相关基因的表达量绝大部分呈不同程度的下降,包括淀粉合成的限速酶AGPase各亚基的编码基因,只有少部分基因表达量不变或上调(图6-A—图6-B)。提取开花后12 d胚乳中的总蛋白进行免疫印迹分析,发现fse3突变体中影响淀粉合成的相关蛋白水平显著降低(图6-C)。因此,FSE3的突变严重影响了发育胚乳中淀粉合成,造成胚乳粉质皱缩。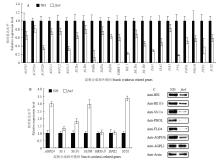 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6野生型和fse3中淀粉合成相关基因表达和蛋白积累
A—B:野生型与fse3突变体花后12 d胚乳的淀粉合成相关基因表达分析,以Actin作为内参;C:野生型与fse3突变体发育胚乳中淀粉合成相关蛋白的积累,以Actin作为上样对照
-->Fig. 6Gene expression and protein accumulation analyses of starch biosynthesis related genes in wild type and fse3
A-B: Real-time RT-PCR analysis of the expression levels of starch synthesis related genes in 12 DAF endosperm of wild type and fse3 mutant. Actin was used as an internal control; C: Immunoblot analysis of starch biosynthesis related proteins in developing endosperm of wildtype and fse3 mutant. Actin was used as a loading control
-->
3 讨论
稻米提供了人类尤其是亚洲人所需的大部分能量和较多的蛋白质营养,同时也是畜牧业和食品加工等行业的重要原料[30]。因此,稻米的产量与品质直接关系到人们的营养状况和身体健康。淀粉的含量、组成及结构是决定稻米品质的主要因素[31]。水稻粉质形成是由于籽粒胚乳灌浆时期淀粉和贮藏蛋白不充实,相互间存在空隙而形成的一种光学特性[32]。目前已经有多个粉质胚乳突变体的研究报道,如粉质flo4突变体相对于其野生型,总淀粉含量不变,蛋白质含量增加,直链淀粉含量降低[20];flo6突变体相对于其野生型,总淀粉和直链淀粉含量显著下降,而蛋白质和脂肪含量显著增加[22]。本研究发现的fse3突变体相对于野生型,粒长和粒宽不变,粒厚、千粒重、总淀粉含量和直链淀粉含量都显著降低(图1和图3)。因此,研究粉质胚乳突变体有助于进一步发现稻米品质及粒重的形成和调控的分子机制。淀粉和蛋白质是构成水稻胚乳的主要组分,因此淀粉和蛋白质的组分及结构发生改变往往会造成粉质胚乳的表型[33],同时也会影响淀粉合成相关基因的表达,如粉质flo2突变体中大部分淀粉合成相关基因的表达量都降低了[18]。在本研究中,粉质fse3突变体胚乳中的淀粉合成相关基因表达同样受到不同程度的影响,这可能是导致总淀粉含量降低的原因。其中,GBSSI的表达量下调推测是导致fse3直链淀粉含量降低的直接原因。淀粉和贮藏蛋白在籽粒灌浆过程中快速积累,如果淀粉或蛋白的合成或调控相关基因发生突变均可能导致胚乳粉质状。如AGPL2突变造成胚乳粉质和籽粒皱缩[34];谷蛋白前体增加突变体gpa1、gpa2、gpa3、gpa4胚乳均为粉质[35,36,37,38];还有一些不直接涉及淀粉和蛋白合成的基因,它们的突变同样能造成胚乳粉质。如FLO2参与调控淀粉和贮藏蛋白合成相关基因的表达,flo2突变体籽粒变小、胚乳粉质、直链淀粉含量降低[18]。ssg4和ssg6都是定位于造粉体上的基因,参与调控淀粉颗粒大小,它们的突变导致胚乳中淀粉颗粒发育异常从而形成粉质胚乳[25]。虽然,目前已经报道了较多的粉质胚乳突变体,但是粉质胚乳形成的分子机理仍然不是十分清楚,因此还需要克隆更多的相关基因并对其功能进行研究。本研究以粉质胚乳fse3突变体为材料,将基因定位在第9染色体长臂上(图4),与之前报道的粉质胚乳相关基因的位点均不相同。通过精细定位,FSE3被定位于约228 kb的区间内,该区间包含28个ORFs(表3)。其中,ORF20编码的是天冬氨酸转氨酶,是天冬氨酸代谢途径关键酶基因。天冬氨酸是组成蛋白质的重要氨基酸如赖氨酸、苏氨酸、蛋氨酸等合成的共同的前体分子[39]。转基因研究表明转化外源或自身天冬氨酸转氨酶基因可以使拟南芥、水稻种子中氨基酸和蛋白质含量都显著增加[40]。重测序发现该基因启动子区发生了单碱基替换,但是突变体候选基因是否是该基因还有待进一步转基因验证。本研究结果为FSE3的最终克隆及功能研究打下基础,后续研究将有助于更深入了解淀粉合成、代谢的调控机理。
胚致死(embryo lethality)突变表现为其突变体的胚胎会在特定时期发育失败,从而使种子丧失发芽能力。这种突变可以自发产生,也可由人工诱发获得。已知的胚致死突变多数是诱发产生的,EMS(Ethyl methane-sulfonate)、MNU(N-methyl-N- nitrosourea)及EMS配合X-射线均已用于诱发这种突变,用于诱变处理的材料有种子、花粉及受精卵细胞等[35]。由于突变的性质所致,纯合突变体胚胎不能正常发育,所以纯合胚致死突变的植株无法用常规方法获得。这种突变在玉米、拟南芥、胡萝卜及水稻中均有报道[41,42,43,44]。GAVAZZI等[42]在玉米中发现一种胚发育营养缺陷型突变,需要为其补充脯氨酸来完成正常的胚胎发育。GABOTTI等[45]和GUTIERREZ-MARCOS等[46]发现玉米突变体中编码PPR蛋白的基因EMP4(empty pericarp4)突变导致种子纯和致死,突变体的胚乳严重受损,胚乳传递细胞高度不规则分化。利用胚挽救实验也未能得到成熟的纯合突变体植株。拟南芥中发现了至少250个胚缺陷基因(embryo-defective genes,EMBs)为胚正常发育所不可或缺,其中LEC2(leafy cotyledon2)编码一个含B3结构域的转录因子,负责调控胚发育的正确启动[47],GNOM编码鸟苷酸交换因子(GEF),它通过激活G型蛋白-ADP核糖基化因子(ARF)来影响合子的第一次分裂[48]。因此,造成胚胎致死的原因多种多样。我们以化学诱变剂MNU处理粳稻品种宁粳3号开花20 h的受精卵诱发获得水稻胚致死突变fse3,TTC染色表明其胚活力下降,对发育中的胚纵切片观察发现突变体没有心型胚的分化。胚致死的分子遗传机理还有待基因克隆后进一步分析,该突变体为胚致死突变分子遗传机理的研究提供了良好的材料。
之前报道很多胚致死突变体都伴随有粉质表型,例如玉米突变体emp4、emp9和emp16。拟南芥基因AtTIM9或AtTIM10的功能障碍导致早期孢子体致死表型,在16/32细胞阶段,由于线粒体结构和活性的破坏引起细胞程序性死亡进而导致胚胎和胚乳都会停止分裂[49]。最近,也有研究发现,在水稻大多数胚致死的种子中,胚乳核分裂的次数有限。游离核仅分布在胚囊的珠孔端,并且其定向定位被阻断,此外其糊粉分化出现中断[50]。但是,在玉米胚致命突变体(lem1)中,其胚胎在转变期之前发育中止,但胚乳却正常发育[51]。FSE3突变既造成了胚乳粉质的表型又导致胚致死,但是胚致死和胚乳粉质之间有无关联还有待考证。
4 结论
胚乳粉质皱缩致死fse3突变体籽粒的千粒重、籽粒大小、总淀粉含量、直链淀粉含量等指标的降低,及淀粉在尿素溶液中的膨胀能力减弱等变化是由于fse3突变体中FSE3的突变影响了造粉体的发育,进而造成了淀粉合成积累的缺陷。利用fse3/9311 F2群体,将FSE3定位在第9染色体长臂228 kb的区间内,这与之前报道的粉质胚乳突变体基因及胚致死突变体基因的染色体位置均不相同,推测FSE3是一个新的调控胚及胚乳发育的基因。致谢:农业部长江中下游粳稻生物学与遗传育种重点实验室/江苏省现代作物生产中心/长江流域杂交水稻协同创新中心在研究中给予了帮助,在此表示感谢。
The authors have declared that no competing interests exist.
